Ano: 2002 Vol. 68 Ed. 5 - Setembro - Outubro - (21º)
Seção: Artigo de Revisão
Páginas: 736 a 742
Sinusite fúngica alérgica: atualização
Allergic fungal sinusitis: an update
Autor(es):
Carla R. Monteiro 1,
Alfeu T. França 2,
Shiro Tomita 3,
Fernando A. Rodrigues 4
Palavras-chave: rinossinusite crônica, Aspergillus, sinusite fúngica alérgica
Keywords: chronic rhinosinusitis, Aspergillus, allergic fungal sinusitis
Resumo:
Sinusite fúngica alérgica é uma modalidade de sinusite fúngica reconhecida há aproximadamente 20 anos. Os critérios diagnósticos ainda não estão bem definidos e muitas dúvidas existem com relação à sua fisiopatogenia e tratamento. Com o intuito de rever os mais modernos conceitos desta nova entidade clínica, foi realizada uma pesquisa utlilizando como fontes de referências bibliográficas o Medline e o Lilacs, abrangendo os últimos 20 anos. A sinusite fúngica alérgica vem sendo reconhecida como uma importante causa de rinossinusite crônica e a integração entre otorrinolaringologistas, imunologistas e patologistas faz-se necessária para seu manuseio adequado.
Abstract:
Allergic fungal sinusitis is a well recognized form of fungal sinusitis first described 20 years ago. This entity hasn't a well defined diagnostic criteria and many questions rise about its true fisiopathology and treatment. The authors have performed a MEDLINE and LILACS search, comprising the last 20 years, in order to review the most moderns concepts about this new clinical entity. Allergic fungal sinusitis has been considered an important cause of chronic rhinosinusitis and a good relation envolving otolaryngologists, immunologists and pathologists is essential for its correct management.
![]()
INTRODUÇÃO
Sinusite é afecção relativamente comum, afetando aproximadamente 20% da população1,2. A sinusite fúngica (SF), entretanto, deve ser considerada em todos os pacientes com rinossinusite (aguda ou crônica) que falham aos vários cursos de antibioticoterapia utilizados.
Segundo Cody et al.3, 10 a 20% dos pacientes com rinossinusite crônica (RC) que são submetidos a cirurgia têm o fungo como o principal agente causador.
Os fungos são os principais aeroalérgenos em muitas áreas. Em alguns locais, por exemplo, os esporos são centenas de vezes mais freqüentes no ar inalado do que o pólen4. Os mecanismos de defesa do hospedeiro contra os fungos ainda não estão bem elucidados, mas a fisiopatogenia da SF provavelmente envolve uma aeração comprometida do seio e/ou resposta imune alterada contra o fungo4.
A classificação mais aceita atualmente, divide as SF em: aguda/fulminante; crônica/indolente; bola fúngica e sinusite fúngica alérgica (SFA)1,2,3.
DeShazo et al.4 citaram ainda um quinto tipo, denominado sinusite fúngica invasiva crônica, que prevalece em indivíduos imunocomprometidos e com diabetes mellitus. Essa classificação baseia-se na presença ou não de invasão tecidual, assim como o estado imune do paciente. A sinusite aguda fulminante e a crônica indolente são formas invasivas, já a bola fúngica e a SFA são formas não invasivas, ou seja, não há invasão da mucosa ou do osso pelo fungo.
De todas as formas, a mais pesquisada atualmente é a sinusite fúngica alérgica. O objetivo do trabalho é alertar clínicos, otorrinolaringologistas e alergistas sobre a importância do tema.
REVISÃO DA LITERATURA
HISTÓRICO
Em 1971, McCarthy e Pepysapud5,6 observaram que 10% dos pacientes com aspergilose brocopulmonar alérgica (ABPA) eliminavam tampões mucosos nasais similares àqueles expectorados dos seus brônquios durante a tosse. Neste estudo, 41.4% dos 111 pacientes apresentavam comprometimento em um dos seios maxilares evidenciado por radiografia simples do seios paranasais. A cultura do lavado sinusal revelou crescimento de Aspergillus fumigatus (Af).
Safirstein em 1976apud5,7 descreveu o caso de uma paciente de 24 anos de idade portadora de ABPA e polipose nasossinusal (PN). A cultura do material do seio paranasal comprometido revelou crescimento de Af.
Neste mesmo ano, Young et al.apud5,8 relataram o caso de um rapaz de 15 anos, nadador, com sinusite maxilar, etmoidal, PN e proptose do olho esquerdo, que resultou da expansão do material fúngico para o interior da órbita.
Em 1981, Millar et al.apud9,10, na Grã Bretanha, publicaram cinco casos de RC que tinham características histológicas idênticas à ABPA, cuja cultura cresceu Aspergillus sp. Eles propuseram uma relação entre doença pulmonar alérgica e doença sinusal, denominando-a "aspergilose alérgica dos seios paranasais".
Logo em seguida, em 1983, Katzenstein et al.11, em um estudo retrospectivo envolvendo 119 casos de sinusite, demonstraram em nove deles características histológicas indistinguíveis da impactação mucóide existente nos brônquios de pacientes com ABPA. Em sete deles foram demonstradas hifas fúngicas que assemelhavam-se a do Aspergillus, propondo a denominação "sinusite alérgica por Aspergillus".
Robson et al., em 1989apud3,7,8, introduziram o termo "sinusite fúngica alérgica" após terem reconhecido que não só o Aspergillus sp, mas outras espécies de fungos cresciam do material removido dos seios paranasais.
Ponikau et al.12, em 1999, sugerem a substituição do termo SFA por rinossinusite fúngica eosinofílica, pois acreditam que ainda não há provas suficientes para afirmar que a etiologia deste tipo de SF é devido a uma reação de hipersensibilidade mediada por IgE.
EPIDEMIOLOGIA
SFA já é considerada para alguns a forma mais comum de SF4,13. Apesar disto, continua sendo a menos entendida e mais subdiagnosticada, pelo fato de não ser tão familiar para otorrinolaringologistas, patologistas e radiologistas.
Com a exceção das formas aguda/fulminante, todos os pacientes com os outros tipos de SF são imunocompetentes. Na SFA existe história de atopia, ocorre geralmente em adolescentes ou adultos jovens, freqüentemente apresentando asma que é exacerbada pelos episódios repetidos de sinusite9. Há geralmente relato de cirurgias múltiplas e contagem elevada de eosinófilos séricos14.
Goldstein15 registrou uma incidência de 66% de PN entre os pacientes com SFA (Figura 1).
Manning et al.13 analisaram 10 pacientes com SFA. A média de idade encontrada foi 32 anos. Sete eram do sexo masculino e três do feminino. Sete tinham história de rinite alérgica e três de asma. Todos tinham PN e eram imunocompetentes.
Morpeth et al.10 e Torres et al.8 afirmam que a real prevalência da SFA ainda permanece desconhecida, sendo maior nas regiões onde o clima é quente e úmido13,16.
Corey et al.17 acreditam que a incidência possa ter uma variação geográfica. No estudo retrospectivo inicial de Katzenstein em St. Louis11, registrou-se uma incidência de 4.5% de SFA comprovada histopatologicamente. Allphin et al.1, em outro estudo retrospectivo de pacientes com RC em Cleveland (Ohio), encontraram uma incidência de SFA de 2%, entretanto 6% dos pacientes tinham mucina alérgica sem hifas ao exame histopatológico ou cultura (SFA síndrome - símile). Cody et al.3, após revisão histopatológica de 789 conteúdos dos seios paranasais de pacientes com RC, encontraram uma prevalência de 6.5% de mucina alérgica e 4.0% de SFA.
Panda et al.18, Dahniya et al.19, Yagi et al.20 reconhecem que é alta a incidência de micose acometendo os seios paranasais em regiões que apresentam clima úmido e quente, como o norte da Índia, norte do Sudão, Arábia Saudita e no sudoeste dos Estados Unidos.
Wickern21 afirmou que aproximadamente 7% dos pacientes, com RC que requerem cirurgia, têm SFA e que a maioria dos fungos são Aspergillus e Bipolaris.
Araújo et al.2, após avaliarem prospectivamente 708 pacientes com RC submetidos à cirurgia endoscópica funcional, identificaram SFA em 11 (1,5%). Destes, seis apresentavam asma brônquica e dez PN.
Ponikau et al.12, em um estudo mais recente, encontraram um dos maiores índices de SFA entre pacientes com RC. Dos 101 submetidos à cirurgia, 94 (93%) tiveram diagnóstico de SFA, baseados em achados histopatológicos e resultados de cultura.
AGENTE ETIOLÓGICO
Os agentes etiológicos primários da SFA mais comumente descritos na literatura são das famílias Moniliaceae e Dematiaceae (fungos pigmentados). Os dematiaceous diferem dos Aspergillus por conterem melanina no interior das suas células, o que produz uma coloração escura na cultura e no tecido7. Pertencem à primeira família os fungos do gênero Aspergillus, cujas espécies mais relatadas são Af e A. flavus (Figura 2). Na segunda família estão incluídos os fungos do gênero Bipolaris, Exserohilum, Curvularia, Alternaria, Cladosporium e Scedosporium17,22. As principais espécies do Bipolaris são: B. spicifera, B. senegalensis, B. hawaiiensis.; Curvularia: C. lunata, C. senegalensis, C. australiensis; Alternaria: A. alternata17.
Além desses, vários outros fungos já foram descritos, entre eles: Nodulisporium sp16, Fusarium sp16,21, Chrysosporium sp8,16, Rhizomucor8,16, Drechslera16, Exserohilum rostratum22.
Noble et al.16 isolaram Epicoccum nigrum em 4 pacientes com SFA e relataram que o fungo mais prevalente foi o Aspergillus sp.
Allphin et al.1 afirmaram que o gênero Aspergillus é o mais encontrado no meio ambiente e o mais freqüentemente isolado nas SF. Em se tratando de SFA, os fungos mais prevalentes são da família Dematiaceae10,14,17,22.
Entretanto, Schwartz6 relatou 10 pacientes com diagnóstico confirmado de SFA, tendo sido isolado Af em 6 pacientes e um caso de Curvularia sp.
Se as espécies de fungos associadas à SFA têm uma variação geográfica, é uma dúvida que ainda precisa ser esclarecida.
Infecção concomitante com mais de uma espécie de fungo tem raras publicações na literatura5,22.
FISIOPATOGENIA
Apesar da SFA ser reconhecida como uma entidade clínica distinta há aproximadamente vinte anos, muitas controvérsias existem com relação à sua fisiopatogenia.
A maioria dos autores reconhece que a SFA é uma enfermidade mais de caráter imunológico do que infeccioso7,9,17,23,24. Atualmente é postulado que a fisiopatologia da SFA assemelha-se a da ABPA, devido à semelhança histológica entre o material encontrado no interior dos seios paranasais e aquele expectorado por pacientes com ABPA10.
Reações de hipersensibilidade dos tipos I (imediata) e III (semitardia) parecem ocorrer na SFA7,9,17.
A SFA representa uma resposta imune do tipo I devido aos altos níveis séricos de IgE total e específica para fungo. Além disso, é possível uma reação do tipo III não devido à presença de imunocomplexos circulantes, mas porque anticorpos IgG específico para fungo podem ser demonstrados. Precipitinas e IgG sérica específica também têm sido encontradas3. Os níveis séricos do complemento mantêm-se dentro da normalidade e não há atividade citotóxica, como visto nas reações imunológicas tipo II17.
Manning et al.24 afirmaram que vários fatores relacionados podem levar ao desenvolvimento da SFA. Um indivíduo atópico é exposto à inalantes fúngicos. A presença destes antígenos em indivíduos susceptíveis deflagra uma resposta inflamatória mediada por reações dos tipos I e III. A obstrução do óstio sinusal e a estase de secreção dentro do seio criam um ambiente favorável ao crescimento fúngico, aumentando ainda mais sua expressão antigênica e a reação inflamatória imunologicamente mediada. Um provável produto dessa reação é a mucina alérgica, que ao obliterar o seio, contribui para perpetuar o processo patológico.
O papel da reatividade tipo I na SFA foi enfatizado em seu trabalho24, no qual demonstraram em nove pacientes com SFA por Bipolaris, níveis séricos elevados de IgE total e IgE específico para antígenos do Bipolaris.
Mabry e Manning25 analisaram 16 pacientes com SFA. Os soros destes pacientes foram submetidos a RAST com antígenos fúngicos e outros aeroalérgenos, como também foram dosados os níveis séricos de IgE total. Quinze das 16 amostras demonstraram RAST classe II para antígenos fúngicos e outros aeroalérgenos e níveis de IgE elevados em 14 exemplares.
Cody et al.26 demonstraram uma redução na freqüência dos batimentos ciliares no epitélio respiratório nasal humano, in vitro, quando exposto à culturas de Af e Alternaria alternata. Esta inibição se mantinha mesmo após a remoção do fungo. Concluíram que existem uma ou mais substâncias produzidas por estes fungos que agem no epitélio respiratório ciliado causando inibição dos seus batimentos.
Há ainda controvérsias na literatura sobre o papel da hipersensibilidade vs infecção fúngica na patogênese da SFA. As evidências que falam a favor de uma causa alérgica baseiam-se no seu quadro clínico característico manifestado por RC em pacientes jovens, atópicos e imunocompetentes; presença de mucina alérgica e ausência de invasão tecidual ao exame histopatológico; ausência de progressão clínica da infecção e pela presença de testes cutâneos positivos para antígenos fúngicos, como também de IgE e IgG específicos para estes antígenos.
Ponikau et al.12, contrariando vários autores, afirmaram que ainda não existem evidências na literatura suficientes mostrando a participação das reações de hipersensibilidade mediadas por IgE na fisiopatogenia da SFA. Após análise de seus pacientes com RC, a SFA pode existir na presença ou ausência de atopia. Afirmaram ainda que as lesões da mucosa existentes nestes pacientes são decorrentes das reações mediadas por proteínas dos eosinófilos e não pela IgE.
DIAGNÓSTICO
Vários autores têm publicado suas experiências, ao longo desses anos, na tentativa de delinear os critérios diagnósticos para a SFA.
Katzenstein et al.11, em 1983, após revisarem 119 materiais removidos dos seios paranasais, nos quais todas as culturas foram positivas para Aspergillus sp, afirmaram que a mucina alérgica é essencial para o diagnóstico. Este material tem consistência mucinosa, é espesso, de coloração verde, amarela ou marrom, semelhante a pasta de amendoim (peanut butter) ou queijo tipo ricota (cottage cheese). Histologicamente são encontradas hifas fúngicas, sem a presença de esporos, que não invadem a mucosa; restos celulares necróticos; eosinófilos e cristais de Charcot-Leyden. Estes cristais são estruturas hexagonais bipiramidais que correspondem à lisofosfolipase da membrana celular dos eosinófilos e basófilos7. Invasão fúngica, formação de granuloma ou necrose tecidual não são características presentes no exame histopatológico da SFA27. As hifas fúngicas na SFA encontram-se dispersas na mucina, muitas vezes difíceis de serem encontradas, diferente do micetoma no qual as mesmas apresentam-se densamente agrupadas27.
Allphin et al.1, após uma análise histopatológica retrospectiva de 82 pacientes com RC, identificaram SFA em 3 deles e presença de mucina alérgica sem evidências de fungo em 11 pacientes. Em todos os três casos estava presente: PN; tomografia computadorizada (TC) sugestiva de SFA; mucina alérgica com hifas não invasivas; testes cutâneos e/ou sorológicos que confirmavam atopia.
Bent e Kuhn9, baseados na análise de 15 pacientes com diagnóstico prévio de SFA, definiram com mais ênfase alguns critérios. Cinco características foram identificadas em todos os quinze pacientes, sendo consideradas assim critérios para o seu diagnóstico. São elas: 1) reação de hipersensibilidade tipo I, confirmada pela história, testes cutâneos ou sorologia; 2) PN; 3) sinais característicos à TC; 4) muco eosinofílico sem invasão fúngica tecidual (mucina alérgica); 5) identificação de hifas fúngicas no material sinusal removido durante a cirurgia. Outras características freqüentemente associadas, mas que não foram encontradas em todos os casos foram: asma, predominância unilateral da lesão, erosão óssea, cultura positiva para fungos, cristais de Charcot-Leyden e eosinofilia.
DeShazo et al.5 utilizaram cinco critérios bem definidos, similares aos descritos por Bent, mas com algumas peculiaridades. A mucina alérgica, que pode ser identificada à rinoscopia, durante a cirurgia ou subseqüentemente pelo exame histopatológico, apresenta características clínicas e histopatológicas não encontradas em nenhum outro tipo de SF a não ser na SFA. Os elementos fúngicos podem ser demonstrados através da secreção nasal ou pelo material colhido do seio durante a cirurgia (Figura 3). Acrescentaram ainda que deve ser afastada a presença de diabetes, outras doenças que cursam com imunodeficiência e tratamento com drogas imunossupressoras. DeShazo et al. não incluíram a PN, nem os testes cutâneos e sorológicos que definem a reação de hipersensibilidade tipo I nos seus critérios, pois afirmam que os mesmos quando não encontrados, não invalidam o diagnóstico.
Ponikau et al.12, em um estudo envolvendo 210 pacientes com RC, questionaram o papel das reações de hipersensibilidade tipos I e III na gênese da SFA. Sendo assim, consideraram indispensáveis apenas três critérios: 1) RC; 2) presença de mucina alérgica e 3) de elementos fúngicos nesta mucina, confirmados por exame histopatológico, cultura ou ambos.
ACHADOS RADIOGRÁFICOS
Algumas características radiográficas, avaliadas pela TC e ressonância nuclear magnética (RNM), sugerem SF apesar de não serem patognomônicas.
Na TC sem contraste, os seguintes sinais estão presentes nestes pacientes: áreas focais de hiperatenuação, osteíte reativa, obliteração do complexo óstio-meatal, erosão óssea principalmente na parede lateral nasal e remodelação das paredes ósseas com expansão da cavidade sinusal comprometida13. É importante frisar que erosão óssea não significa invasão tecidual17. Na RNM, em T1 encontra-se massa heterogênea com áreas de baixa intensidade de sinal (hipointensas) e em T2 esses sinais podem estar ausentes13,19.
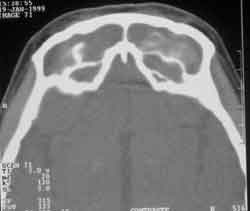
As áreas de hiperatenuação, evidenciadas pela TC, são devido à combinação dos metais pesados (ferro e manganês) e cálcio, produtos do metabolismo fúngico3,13 (Figura 4). Esta característica também é vista quando há presença de secreção purulenta espessa, trombo, hemorragia intrassinusal, corpo estranho, neoplasias benignas e malignas, as quais entram como diagnóstico diferencial6,13.
Na grande maioria dos casos os seios maxilares e etmoidais são acometidos, seguidos pelo seio esfenoidal. Envolvimento do seio frontal parece ser raro. Acometimento unilateral é mais freqüente13.
Manning et al.13 analisaram a TC e RNM de 10 pacientes com SFA. Em todos os exames evidenciavam-se áreas de hiperatenuação, que correspondiam cirurgicamente à mucina alérgica espessa. Sinais hipointensos ou a sua ausência, que correspondiam às áreas de hiperatenuação da TC, foram os achados mais comuns em T1 e T2 respectivamente. Todos os pacientes apresentaram extravasamento do material sinusal. Nove pacientes apresentaram sinais de remodelação ou erosão óssea. A atrofia conseqüente à pressão intrassinusal e a lesão tecidual secundária à degradação eosinofílica podem ser responsáveis pelo fenômeno acima.
O diagnóstico pré-operatório da SFA, sugerido por dados tomográficos e da RNM, pode ser extremamente válido, já que alerta o cirurgião e o patologista para a necessidade de confirmar o diagnóstico.
COMPLICAÇÕES
Apesar da SFA geralmente seguir um curso lento, não agressivo e não ter invasão tecidual, a pressão intrassinusal existente pode eventualmente causar expansão e erosão da parede sinusal, com conseqüente envolvimento de estruturas vizinhas como órbita e crânio19.
O sinal mais freqüentemente relatado é a proptose do globo ocular7,14. No entanto, diplopia, blefaroptose, epífora, oftalmoplegia e até mesmo perda visual total são sinais e sintomas também relatados e que podem ser a primeira manifestação da SFA14.
Carter et al.14 publicaram seis casos de SFA com sintomas orbitários. Todos apresentaram proptose. Em dois deles ocorreu alguma limitação da motilidade ocular. Um apresentou diplopia sintomática e outro estava assintomático. Um paciente sofreu perda visual severa, mas reversível.
Marple et al.7, após rever 82 pacientes com SFA, relataram perda visual em três (3,7%). Envolvimento orbitário sem perda visual foi encontrado em 14.6% dos pacientes, sendo os sinais mais encontrados a proptose (6,1%) e telecanto (7,3%). As perdas visuais foram reversíveis após a drenagem cirúrgica.
Complicações intracranianas também têm sido relatadas e são conseqüentes à erosão óssea presente nestes casos17,22.
Kinsella et al.22 relataram seis casos de SFA que tinham evidências radiográficas de erosão da base do crânio. Todos os pacientes foram submetidos a cirurgia endoscópica funcional e em apenas um foi feita ressecção da dura-máter. Com exceção de um paciente que mantinha paralisia do nervo abducente, nenhum outro apresentou complicação neurológica permanente.
TRATAMENTO
Embora o diagnóstico atualmente esteja sendo feito com maior acurácia e freqüência, o manuseio dos pacientes com SFA continua sendo motivo de grandes controvérsias.
Não há ainda um consenso em relação ao tratamento ideal, embora a maioria dos autores combinem cirurgia endoscópica funcional dos seios paranasais ao uso de corticóides local e sistêmico.
Kuhn e Bent28 afirmam: "Se os fungos são de fato antígenos e não agentes infecciosos, o sucesso do tratamento vai depender das três seguintes etapas: debridamento cirúrgico a fim de remover os antígenos fúngicos, a mucina alérgica e a mucosa polipóide doente; prevenir a recorrência do crescimento fúngico; modificar a resposta imune do indivíduo ao antígeno".
Uma vez tendo sido feito o diagnóstico, o tratamento inicia-se com o debridamento cirúrgico do material nasossinusal, de forma que se retire a maior quantidade possível de mucina alérgica e mucosa polipóide3. Este procedimento tem função diagnóstica e terapêutica. A cirurgia proporciona alívio imediato dos sintomas obstrutivos, melhorando a drenagem das secreções e reduzindo a carga fúngica local. Entretanto, mesmo utilizando a melhor das técnicas cirúrgicas, é difícil a remoção completa de todas as hifas e esporos fúngicos.
Terapêutica médica adjuvante inclui corticóides sistêmicos, antifúngicos orais, imunoterapia ou a combinação deles.
O uso de corticóides tópicos nasal e sistêmico pode ser iniciado mesmo antes da cirurgia e mantido por período variável no pós-operatório. Devido a sua potente ação antiinflamatória e aos efeitos de imunomodulação são considerados a principal arma no tratamento dos pacientes com SFA. Alguns autores notaram um significante aumento no tempo entre as revisões cirúrgicas nos pacientes que receberam corticoterapia prolongada no pós-operatório6,21,26. Irrigações nasais com solução salina no pós-operatório e remoção de debris cirúrgicos por endoscopia no ambulatório também são utilizadas.
Bent e Kuhn28, 1996, após tratarem mais de 50 pacientes com SFA afirmaram que não há taxa de cura a longo prazo com o tratamento atualmente disponível. Corticóides tópicos podem ser utilizados para imunomodulação local, sem risco de complicações sistêmicas, entretanto não causam um impacto notável no controle da doença. Corticóides sistêmicos diminuem a resposta imune anormal e constituem a principal arma terapêutica no pós-operatório. Estes mesmos autores, após análise retrospectiva de 26 pacientes com SFA, mostraram que a prednisona oral ajudou a manter o paciente livre da doença durante um período, mas os sintomas retornaram assim que a corticoterapia foi finalizada.
O uso de antifúngicos tópicos, para irrigação das fossas nasais no pós-operatório como terapia adjuvante, foi motivo de estudo pelos autores acima citados. Para isso analisaram a suscetibilidade in vitro de 22 culturas fúngicas de pacientes com SFA. O cetoconazol e anfotericina B mostraram-se os mais efetivos. Para atingir o máximo de benefício, as irrigações já deveriam começar no momento da cirurgia e continuar por vários meses no pós-operatório. Acreditaram que estas irrigações ajudariam a combater a recorrência da doença, através do bloqueio do crescimento fúngico.
Os antifúngicos sistêmicos não são indicados pela maioria dos autores15,27,29, pois não alteram a evolução natural da doença, além de aumentarem o risco de complicações inerentes à sua utilização.
Uma questão ainda mais controversa diz respeito a utilização da imunoterapia com antígenos fúngicos no controle desses pacientes. Na fisiopatologia da SFA participam reações de hipersensibilidade dos tipos I e III a antígenos fúngicos. Alguns autores acreditam que a probabilidade do processo recidivar parece ser bastante alta, se a resposta imune não for modulada24,29.
Mabry et al.29,30 têm publicado suas experiências ao longo de três anos utilizando imunoterapia com antígenos fúngicos e outros aeroalérgenos em pacientes com SFA, e chegaram às seguintes conclusões: a imunoterapia não exacerbou os sintomas nasossinusais; mostrou ter o seu maior benefício na redução das crostas, evitando o reacúmulo da mucina alérgica; a rápida recorrência, característica da doença, foi menos observada; o uso de corticóides nasais e sistêmicos foi menos necessário. Entretanto, os próprios autores recomendam a necessidade de mais estudos, de preferência randomizados, a fim de comprovar os efeitos benéficos desta terapia.
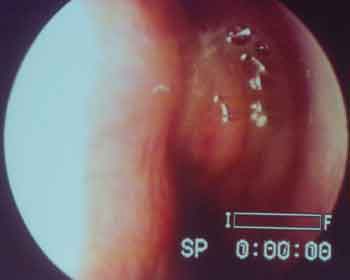
Figura 1. Pólipo e mucina alérgica preenchendo meato médio esquerdo de paciente com SFA por Candida sp.
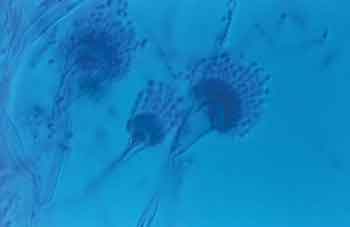
Figura 2. Aspecto microscópico do gênero Aspergillus sp
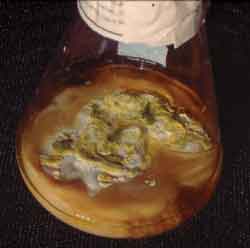
Figura 3. Crescimento fúngico em meio de cultura Sabouraud com cloranfenicol de secreção sinusal.
Figura 4. Corte axial de TC dos seios paranasais, seio frontal, de paciente com SFA por Aspergillus sp
DISCUSSÃO
A SFA é considerada uma causa de RC, cujo tratamento não padronizado, ainda não estabeleceu índices de cura a longo prazo nos diversos artigos analisados.
O diagnóstico da sinusite fúngica inicialmente requer um alto grau de suspeição por parte do médico, já que o exame clínico, por si só, raramente é conclusivo. No caso da SFA, a suspeita aumentará quando nos depararmos diante de um indivíduo jovem, imunocompetente, atópico, com sinusite crônica e PN.
A intervenção cirúrgica torna-se importante tanto para o diagnóstico como para o seu tratamento. A identificação da mucina alérgica é essencial para a caracterização deste tipo de sinusite e o isolamento do fungo pode ser realizado por intermédio da cultura do material colhido e/ou exame histopatológico. É exatamente este o ponto mais crucial do diagnóstico, corfirmar elementos fúngicos do material colhido dos seios paranasais.
Nos últimos anos, com a análise cada vez mais detalhada da mucosa nasossinusal e com a melhoria nas técnicas de cultura para fungos, tornou-se possível identificar os gêneros e espécies mais comumente encontrados em cada caso.
Mesmo assim, alguns autores ainda sugerem o termo sinusite fúngica alérgica síndrome - símile para os casos nos quais o fungo não pode ser identificado.
COMENTÁRIOS FINAIS
Não nos resta dúvida que apesar da sinusite fúngica alérgica já ser reconhecida há quase 20 anos, muitas controvérsias existem com relação à sua fisiopatogenia e conseqüentemente ao tratamento mais adequado.
Ao longo destes anos, vários autores vêm publicando suas experiências, levantando diferentes hipóteses, com mais questionamentos do que propriamente respostas.
A nossa sugestão é que mais trabalhos sejam realizados e que realmente os médicos procurem isolar o fungo das secreções nasossinusais de pacientes com rinossinusite crônica e PN, além de manterem contato com imunologistas e patologistas para que não se perca dados para o correto diagnóstico.
Observação: Apud utilizado como referência a autores não listados abaixo, mas que foram citados por outros que estão incluídos nas referências bibliográficas.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Allphin AL, Strauss M, Abdul-Karim FW. Allergic fungal sinusitis: Problems in diagnosis and treatment. Laryngoscope 1991;101:815-820.
2. Araújo E, Palombini BC, Stolz DP, Richter VT. Sinusite fúngica alérgica. F Méd 1999;118:5-11.
3. Cody DT, Neel HB, Ferreiro JA, Roberts GD. Allergic fungal sinusitis: The Mayo Clinic Experience. Laryngoscope 1994;104:1074-1079.
4. DeShazo RD, Chapin K, Swain RE. Fungal sinusitis. N Engl J Med 1997;337:254-259.
5. DeShazo RD, Swain RE. Diagnostic criteria for allergic fungal sinusitis. J Allergy Clin Immunol 1995 jul;96:24-35.
6. Schwartz HJ. Allergic fungal sinusitis: experience in an ambulatory allergy practice. Ann Allergy Asthma Immunol 1996;77:500-502.
7. Marple BF, Mabry RL. Comprehensive management of allergic fungal sinusitis. Am J Rhinol 1998;12:263-8.
8. Torres C, Ro JY, El-Naggar AK, Sim SJ, Weber RS, Ayala AG. Allergic fungal sinusitis: a clinicopathologic study of 16 cases. Hum Pathol 1996;27:793-799.
9. Bent JPIII, Kuhn FA. Diagnosis of allergic fungal sinusitis. Otolaryngol Head Neck Surg, 1994;111:580-588.
10. Morpeth JF, Rupp NT, Dolen WK, Bent JP, Kuhn FA. Fungal sinusitis: an update. Ann Allergy Asthma Immunol 1996;76:128-139.
11. Katzenstein AA, Sale SR, Greenberger PA. Allergic Aspergillus sinusitis: a newly recognized form of sinusitis. J Allergy Clin Immunol 1983;72:89-93.
12. Ponikau JU, Sherris DA, Kern EB, Homburger HA, Frigas E, Gaffey TA, Roberts GD. The diagnosis and incidence of allergic fungal sinusitis. Mayo Clin Proc 1999;74:877-884.
13. Manning SC, Merkel M, Kriesel K, Vuitch F, Marple B. Computed Tomography and Magnetic Resonance Diagnosis of Allergic Fungal Sinusitis. Laryngoscope 1997;107:170-176.
14. Carter KD, Graham SM, Carpenter KM. Ophthalmic manifestations of allergic fungal sinusitis. Am J Ophthalmol 1999;127:189-95.
15. Goldstein MF, Dunsky EH, Dvorin DJ et al. Allergic fungal sinusitis: a review with four illustrated cases. Am J Rhinol 1994;8:13-18.
16. Noble JA, Crow SA, Ahearn DG, Kuhn FA. Allergic fungal sinusitis in the southeastern USA: involvement of a new agent Epicoccum nigrum Ehrenb. ex Schlecht. 1824. J Medical Veter Micol 1997;35:405-409.
17. Corey JP, Delsupehe KG, Ferguson BJ. Allergic fungal sinusitis: Allergic, infectious, or both? Otolaryngol Head Neck Surg 1995;113:110-119.
18. Panda NK, Sharma SC, ChakrabartiA, Mann SBS. Paranasal sinus mycoses in north India. Mycoses 1998;41:281-6.
19. Dahniya MH, Makkar R, Grexa E, Cherian J, Mattar M. Appearances of paranasal fungal sinusitis on computed tomography. Br J Radiol 1998;71:340-344.
20. Yagi HI, Gumaa SA, Shumo AI, Abdalla N, Gadir AA. Nasosinus aspergillosis in sudanese patients: clinical features, pathology, diagnosis and treatment. J Otolaryngol 1999;28:90-94.
21. Wickern GM. Fusarium allergic fungal sinusitis. J Allergy Clin Immunol 1993;92:624-625.
22. Kinsella JB, Rassekh CH, Bradfield JL, Chaljub G, McNees SW, Gourley WK, Calhoun KH. Allergic fungal sinusitis with cranial base erosion. Head Neck 1996;18:211-217.
23. DeShazo RD. Fungal sinusitis. Am J Med Scienc 1998 jul;316:39-45.
24. Manning SC, Mabry RL, Schaefer SD, Close LG. Evidence of IgE-mediated hypersensitivity in allergic fungal sinusitis. Laryngoscope 1993;103:717-721.
25. Mabry RL, Manning S. Radioallergosorbent microscreen and total immunoglobulin E in allergic fungal sinusitis. Otolaryngol Head Neck Surg 1995;113:721-723.
26. Cody DT, McCaffrey TV, Roberts G, Kern EB. Effects of Aspergillus fumigatus and Alternaria alternata on human ciliated epithelium in vitro. Laryngoscope 1997;107:1511-1514.
27. Schubert MS, Goetz DW. Evaluation and treatment of allergic fungal sinusitis. I. Demographics and diagnosis. J Allergy Clin Immunol 1998;102:387-394.
28. Bent III JP, Kuhn FA. Antifungal activity against allergic fungal sinusitis organisms. Laryngoscope 1996;106:1331-1334.
29. Mabry RL, Manning SC, Mabry CS. Immunotherapy in the treatment of allergic fungal sinusitis. Otolaryngol Head Neck Surg 1997;116:31-35.
30. Mabry RL, Marple BF, Folker RJ, Mabry CS. Immunotherapy for allergic fungal sinusitis: three years' experience. Otolaryngol Head Neck Surg 1998;119:648-651.
1 Mestre em otorrinolaringologia pela Faculdade de Medicina da Universidade Federal do Rio de Janeiro-UFRJ.
2 Professor titular da cadeira de alergia e imunologia da FM da UFRJ.
3 Chefe do serviço de otorrinolaringologia do Hospital Universitário Clementino Fraga Filho (HUCFF) da UFRJ.
4 Mestrando do curso de pós-graduação em otorrinolaringologia da FM da UFRJ.
Trabalho realizado nos Serviços de Otorrinolaringologia e Imunologia do HU Clementino Fraga Filho da UFRJ.
Endereço para correspondência: Carla R. Monteiro - Rua Nilo Peçanha, n° 01/1309 Bl 4, Ingá
24210480 Niterói - RJ
Tel/Fax: (0xx21) 27194320 - e-mail: carlaandreiuolo@zipmail.com.br
Artigo recebido em 13 de setembro de 2001. Artigo aceito em 8 de outubro de 2001.