Ano: 2013 Vol. 79 Ed. 2 - Março - Abril - (11º)
Seção: Artigo Original
Páginas: 190 a 195
Correlação entre dados clínico-patológicos e margens cirúrgicas em pacientes com carcinoma epidermoide da cavidade oral
Correlation between clinical and pathological data and surgical margins in patients with squamous cell carcinoma of the oral cavity
Autor(es): Fábio Muradás Girardi1; Virgílio Gonzales Zanella1; Ricardo Galicchio Kroef2
DOI: 10.5935/1808-8694.20130034
Palavras-chave: cirurgia bucal; neoplasias; neoplasias bucais; neoplasias da língua.
Keywords: mouth neoplasms; neoplasms; surgery, oral; tongue neoplasms.
Resumo:
Há décadas se conhece a importância de se obter margens livres de neoplasia quando da ressecção de neoplasias de boca.
OBJETIVO: Correlacionar achados clínico-patológicos com status de margem cirúrgica em pacientes com carcinoma espinocelular da língua e do assoalho da boca.
MÉTODO: Forma de estudo: Estudo de coorte histórico, com corte transversal, envolvendo todos os pacientes submetidos à ressecção de carcinomas espinocelulares da língua oral e assoalho bucal entre os anos de 2007 e 2011 pelo Serviço de Cirurgia de Cabeça e Pescoço da nossa Instituição.
RESULTADOS: Foram incluídos 117 casos, sendo 68.3% dos tumores localizados na língua. A relação homem:mulher foi de 2.3:1 e a média de idade foi de 57,6 anos. Ao todo, 23,0% dos casos tiveram margens de ressecção livres e amplas, 60,6% exíguas e 16,2% comprometidas. Diâmetro tumoral e espessura apresentaram correlação com margens de ressecção, sendo os tumores de estádio T mais elevados mais propensos à ressecção com margem insatisfatória. Casos operados com mar-gens livres e amplas tiveram seus tumores ressecados mais comumente com técnicas trans-orais.
CONCLUSÕES: Evidenciamos correlação entre tumores de maior volume, tanto em diâmetro quanto em espessura, com margens de ressecção insatisfatórias. Técnicas cirúrgicas de maior complexidade não tiveram associação com melhores margens de ressecção.
Abstract:
The importance of having tumor-free margins when resecting oral neoplasms has been known for decades.
OBJECTIVE: To correlate clinical and pathology data to surgical margin status in patients with squamous cell carcinoma of the tongue and floor of the mouth.
METHOD: This historical cohort cross-sectional study included all patients submitted to squamous cell carcinoma resection for tumors of the oral tongue and floor of the mouth between 2007 and 2011 at the Head and Neck Surgery service of our institution.
RESULTS: In the 117 cases included, 68.3% had tongue tumors. The male-to-female ratio was 2.3:1 and patient mean age was 57.6 years. Broad free resection margins were seen in 23.0% of the cases; narrow margins in 60.6% of the cases; and compromised margins in 16.2%. Tumor diameter and thickness were correlated to resection margins. Tumors in more advanced T-stages presented more unsatisfactory margins. Patients operated with broad free margins had their tumors resected more commonly through transoral approaches.
CONCLUSIONS: Tumors of larger volume both in terms of diameter and thickness were more correlated to unsatisfactory resection margins. Higher complexity procedures were not associated with better resection margins.
![]()
INTRODUÇÃO
O câncer de boca é a quinta neoplasia maligna mais frequente em homens no Brasil1. Ao longo das últimas décadas, não só a incidência como também a mortalidade pela doença está em elevação no país2. O tratamento do câncer bucal é primariamente cirúrgico. A importância da obtenção de margens livres de neoplasia quando do tratamento do carcinoma espinocelular (CEC) de boca já foi reconhecida há décadas3. Há tendência de recorrência local e decréscimo na sobrevida entre pacientes operados com margens de ressecção insatisfatórias3.
Vários estudos identificaram associação entre margens envolvidas por tumor e diversos fatores de impacto na sobrevida dos pacientes com câncer oral, incluindo o estádio T3-8, o estádio N5,6, a espessura9 e o padrão de invasão tumoral5,10,11. No entanto, a maioria dos trabalhos agrupa pacientes com tumores de todas as regiões anatômicas da boca12-15, sem análises de subsítios ou subgrupos, considerando uma diversidade de critérios de definição de status de margem13,15,16. A habilidade do cirurgião em atingir margens de ressecção livres de neoplasia pode ser influenciada pela localização da lesão6. Loree & Strong3 mostraram em seu trabalho que as taxas de margens comprometidas tiveram grande variação de acordo com o subsítio da boca.
Os tumores da língua oral e do assoalho bucal correspondem de 41% a 74% dos carcinomas epidermoides da boca7,8. O comportamento dessas neoplasias costuma ser semelhante, assim como as bases do tratamento cirúrgico. Nosso objetivo é correlacionar achados histopatológicos com status de margem cirúrgica em pacientes com CEC da língua oral e do assoalho da boca.
MÉTODO
Com a aprovação do Comitê de Ética em Pesquisa da nossa Instituição (3557/11) elaboramos uma coorte histórica com corte transversal, envolvendo todos os pacientes submetidos à ressecção de neoplasias malignas da cavidade oral entre os anos de 2007 e 2011 pelo Serviço de Cirurgia de Cabeça e Pescoço desse Hospital. Foram identificados 385 casos, sendo 333 (86,4%) portadores de CEC. Ao todo, 153 casos (45,9%) correspondiam a CECs da língua oral e assoalho da boca. Dezessete casos foram excluídos por falta de informações histopatológicas de diâmetro e espessura tumoral, 17 casos por terem sido previamente submetidos à radioterapia cervicofacial ou cirurgias com envolvimento da cavidade oral e dois casos por cirurgia com caráter estritamente paliativo. Em última análise, foram incluídos no estudo 117 casos, correspondendo a todos os indivíduos portadores de CEC da língua oral e assoalho bucal, virgens de tratamento, submetidos à cirurgia em caráter curativo no período em estudo.
Foram analisadas variáveis histopatológicas, idade, gênero e modalidade cirúrgica empregada. Todos os dados foram coletados pelo mesmo pesquisador (Girardi FM). A análise estatística foi realizada com o uso do software EpiInfo, versão 3.4.3, 2007. Foi utilizada análise descritiva para sumarizar os dados. As variáveis foram expressas em frequência, média e desvio padrão conforme apropriado. As variáveis diâmetro e espessura apresentaram distribuição normal, conforme teste de Anderson-Darling. Utilizamos teste t para comparar médias de variáveis contínuas e o teste qui-quadrado para comparar frequências de variáveis qualitativas. Todos os testes consideraram valor alfa de 0,05.
O estadiamento patológico foi realizado de acordo com a sexta edição do sistema de estadiamento da American Joint Committee on Cancer pTNM17. A distância entre as células tumorais e as margens cirúrgicas foi medida com o uso de micrômetro ocular. A definição de margens cirúrgicas foi realizada conforme Batsakis18: margens livres, quando o tumor dista pelo menos 5 mm da margem cirúrgica; margens exíguas, quando o tumor se encontra a menos de 5 mm da margem cirúrgica; e margens comprometidas, quando há tumor envolvendo a margem cirúrgica. Não foram consideradas ampliações de margens no transoperatório ou posteriormente à cirurgia primária no cálculo ou na categorização de margens cirúrgicas. As margens de ressecção tumorais comprometidas ou exíguas foram consideradas insatisfatórias, enquanto as demais, satisfatórias. A técnica operatória empregada foi categorizada em cirurgia transoral (TO) e abordagens complexas, podendo envolver labiotomia com ou sem ressecção ou secção de mandíbula, assim como abordagem por acesso transcervical com retalho em viseira. Quando da análise estatística, foram comparados apenas dois grupos: pacientes com margens de ressecção cirúrgica satisfatória e insatisfatória.
RESULTADOS
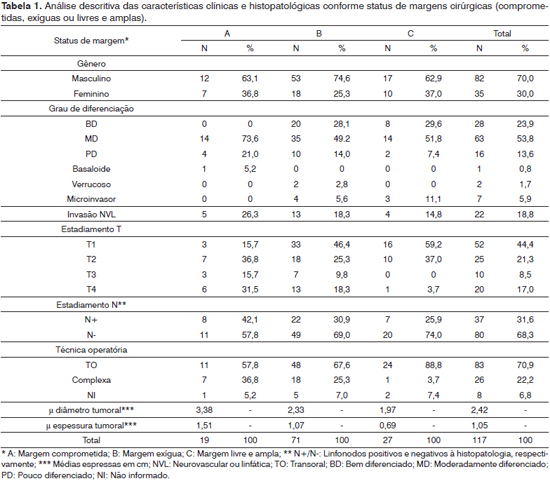
Do total de 117 casos incluídos, 80 (68,3%) estavam localizados na língua e 37 (31,6%) no assoalho da boca. A relação homem:mulher foi de 2,3:1. A média de idade foi de 57,6 ± 14,5 anos, com variação de 13 a 95 anos. Não se observou diferença na média de idade conforme o status de margem cirúrgica (p = 0,8737). A média de diâmetro máximo do tumor foi de 2,4 ± 1,3 cm, com variação de 0,3 a 7,8 cm. A média de espessura tumoral máxima foi de 1,0 ± 0,7 cm, com variação de 0,1 a 3,5 cm. Em 90 casos (76,9%), foi realizado esvaziamento cervical, sendo que 38 casos (32,4%) apresentaram linfonodos com metástases ao exame histopatológico. Ao todo, 27 casos (23,0%) tiveram margens de ressecção livres e amplas, 71 casos (60,6%) margens exíguas e 19 casos (16,2%) margens de ressecção comprometidas por neoplasia. As distribuições por grau de diferenciação tumoral, invasão neurovascular e linfática, estádios T e N, margens cirúrgicas, técnica operatória empregada, diâmetro e espessura tumoral estão demonstradas na Tabela 1.
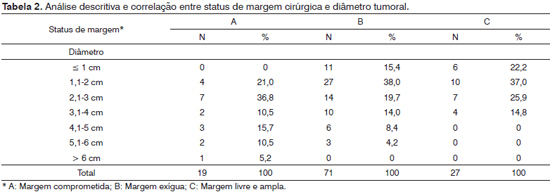
Tanto o diâmetro quanto a espessura tumoral apresentaram relação com as margens de ressecção cirúrgicas, sendo os tumores mais volumosos e de estádios T mais elevados mais propensos à ressecção com margem insatisfatória (Tabelas 1, 2 e 3). No entanto, observamos que mesmo entre tumores menores ou iguais a 2 cm de diâmetro, 72,4% (42/58 casos) apresentavam margens de ressecção insatisfatórias (Tabela 2).
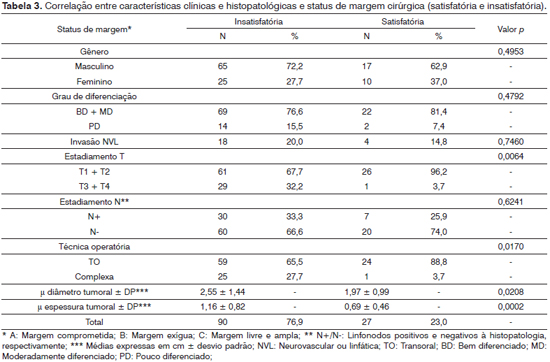
Casos operados com margens livres e amplas tiveram seus tumores ressecados mais comumente com técnicas transorais. Embora sem significância estatística, casos com margens de ressecção insatisfatórias apresentaram-se com maior frequência com tumores pouco diferenciados, invasão neurovascular e metástases cervicais. Da mesma forma, observou-se predomínio de mulheres entre aqueles com ressecções satisfatórias, embora o grupo representado pelo gênero feminino tenha se apresentado com lesões de estádio mais precoce, além de diâmetro e espessura tumorais em média menores que a população masculina.
DISCUSSÃO
Dois grandes estudos multicêntricos randomizados confirmaram que margens cirúrgicas comprometidas são fatores de mau prognóstico entre portadores de CEC da cavidade oral19-21. Esses tumores apresentam maior chance de recidiva22 e menor sobrevida a médio e longo prazo4,22. Liao et al.8 analisaram 827 pacientes submetidos à cirurgia por carcinoma epidermoide da cavidade oral, dos quais 344 correspondiam a tumores da língua e do assoalho bucal. Na análise multivariada, tanto a espessura tumoral quanto margens livres de neoplasia mostraram relação com o controle local da doença.
Larsen et al.7 observaram que a taxa de margens livres de neoplasia decrescia na medida em que aumentava o diâmetro e a espessura do tumor. Para tumores com espessura superior a 1 cm, somente 3% dos casos atingiram margens livres e amplas. Há trabalhos que mostraram que, dentre os carcinomas da cavidade oral, comparado a outros subsítios, os tumores de língua ressecados com margens exíguas ou comprometidas têm pior controle locorregional, mesmo que submetidos a tratamento adjuvante23. Ao contrário do estudo de Byers et al.24, o qual sugere que margens negativas possuem pouco impacto positivo em pacientes com tumores volumosos, o estudo de Kwok et al.25 evidenciou que a obtenção de margens cirúrgicas livres de neoplasia deve ser uma meta independente do tamanho tumoral.
Alguns autores questionaram se a técnica cirúrgica empregada poderia ter relação com a taxa de margens exíguas ou comprometidas, visto que tumores mais volumosos poderiam estar sendo submetidos a tentativas frustradas de ressecção transoral. No estudo de Binahmed et al.13 isso não se confirmou, embora tenham sido agrupados nesse estudo todos os diversos subsítios anatômicos da cavidade oral. Do mesmo modo, na nossa série houve correlação inversa entre ressecções transorais e margens insatisfatórias, o que mostra que a decisão técnica não necessariamente está envolvida nos resultados de status da margem.
Diferentemente de Nason et al.26, observamos tendência de ressecção com margens livres e amplas entre pacientes do gênero feminino, sem distinção por média etária. Aparentemente, o estádio de apresentação T deve estar influenciando nesse achado.
A taxa de ressecções com margens exíguas e comprometidas tem se mostrado muito elevada, não apenas na nossa série, mas também na experiência de diversos grupos internacionais, como mostram os estudos de Branwein-Gensler et al.27 e Iseli et al.28, os quais utilizaram os mesmos critérios de estratificação de margens. É evidente que a proximidade dos tumores da cavidade oral com inúmeras estruturas cuja ressecção acrescenta morbidade ou é incompatível com a vida faz com que sempre existam casos de cirurgias subótimas. Sabe-se que muitos dos casos de CEC de boca se apresentam em estádios avançados. No entanto, aparentemente há uma discrepância entre a intenção cirúrgica e os dados observados no anatomopatológico, visto o grande número de casos de ressecção insatisfatória mesmo em lesões de menor diâmetro e especialmente superficiais.
A definição de margens de ressecção exíguas é amplamente variável entre na literatura. No entanto, existe um consenso de que, para CECs da cavidade oral, são consideradas ressecções com margens exíguas todas aquelas com tumor há menos de 5 mm do bordo cirúrgico18,29. Para atingir uma margem histopatológica satisfatória, deve-se levar em consideração que o espécime cirúrgico fixado em formalina pode sofrer retração de margens na ordem de 40%-50%18. Normalmente, as margens mucosas recebem a maior atenção, embora a maioria das recorrências envolva a margem de ressecção profunda. A importância da ressecção tridimensional da lesão foi enfatizada no trabalho de Ravasz et al.4. Recorrências não foram registradas entre pacientes com margens mucosas comprometidas. Porém, margens positivas na profundidade, especialmente quando observados múltiplos focos de comprometimento tumoral, estiveram associadas à recidiva em 38% e 70% dos casos, respectivamente.
A elevada taxa de margens de ressecção insatisfatórias tem demonstrado que a inspeção visual e a palpação no momento da cirurgia, assim como os métodos de imagem tradicionais, possuem limitações na determinação dos limites dos tumores da cavidade oral. O exame transoperatório de congelação também apresenta problemas, visto que a margem cirúrgica não pode ser avaliada por completo e o exame é limitado na determinação da espessura da margem livre de neoplasia. A ultrassonografia de alta resolução transoral parece oferecer melhor avaliação pré e transoperatória da espessura tumoral30, comparativamente superior à tomografia computadorizada ou à ressonância magnética, especialmente entre tumores de espessura inferior a 5 mm31. Estudos em animais com marcadores fluorescentes também parecem promissores na identificação correta dos limites tumorais32.
CONCLUSÃO
Apesar de termos evidenciado correlação entre tumores de maior volume com margens de ressecção insatisfatórias, assim como observado por outros autores, as taxas de ressecção com margens exíguas e comprometidas também são elevadas entre tumores menores ou iguais a 2 cm de diâmetro. Técnicas cirúrgicas de maior complexidade não tiveram associação com melhores margens de ressecção. Aparentemente, os métodos tradicionais de avaliação dos diâmetros tridimensionais do tumor no período pré e transoperatório e a íntima relação desses com estruturas vitais ainda dificultam garantir uma cirurgia com margens oncológicas adequadas.
REFERÊNCIAS
1. Brasil. Ministério da Saúde (MS). Secretaria de Atenção à Saúde. Instituto Nacional de Câncer (INCA). Coordenação de Prevenção e Vigilância de Câncer. Estimativas 2012: incidência de câncer no Brasil. Rio de Janeiro: Instituto Nacional de Câncer (INCA); 2012. [acessado 2012 mar 15]. Disponível em: http://www1.inca.gov.br/estimativa/2012/estimativa20122111.pdf
2. Ministério da Saúde. Departamento de informática do SUS. Disponível em: http://www2.datasus.gov.br/DATASUS/index.php
3. Loree TR, Strong EW. Significance of positive margins in oral cavity squamous carcinoma. Am J Surg. 1990;160(4):410-4.
4. Ravasz LA, Slootweg PJ, Hordijk GJ, Smit F, van der Tweel I. The status of the resection margin as a prognostic factor in the treatment of head and neck carcinoma. J Craniomaxillofac Surg. 1991;19(7):314-8.
5. Sutton DN, Brown JS, Rogers SN, Vaughan ED, Woolgar JA. The prognostic implications of the surgical margin in oral squamous cell carcinoma. Int J Oral Maxillofac Surg 2003;32(1):30-4.
6. Woolgar JA, Triantafyllou A. A histopathological appraisal of surgical margins in oral and oropharyngeal cancer resection specimens. Oral Oncol. 2005;41(10):1034-43.
7. Larsen SR, Johansen J, Sørensen JA, Krogdahl A. The prognostic significance of histological features in oral squamous cell carcinoma. J Oral Pathol Med. 2009;38(8):657-62.
8. Liao CT, Chang JT, Wang HM, Ng SH, Hsueh C, Lee LY, et al. Analysis of risk factors of predictive local tumor control in oral cavity cancer. Ann Surg Oncol. 2008;15(3):915-22.
9. Yuen AP, Lam KY, Wei WI, Lam KY, Ho CM, Chow TL, et al. A comparison of the prognostic significance of tumor diameter, length, width, thickness, area, volume, and clinicopathological features of oral tongue carcinoma. Am J Surg. 2000;180(2):139-43.
10. Woolgar JA, Scott J, Vaughan ED, Brown JS, West CR, Rogers S. Survival, metastasis and recurrence of oral cancer in relation to pathological features. Ann R Coll Surg Engl. 1995;77(5):325-31.
11. Kademani D, Bell RB, Bagheri S, Holmgren E, Dierks E, Potter B, et al. Prognostic factors in intraoral squamous cell carcinoma: the influence of histologic grade. Int J Oral Maxillofac Surg. 2005;63(11):1599-605.
12. Jerjes W, Upile T, Petrie A, Riskalla A, Hamdoon Z, Vourvachis M, et al. Clinicopathological parameters, recurrence, locoregional and distant metastasis in 115 T1-T2 oral squamous cell carcinoma patients. Head Neck Oncol. 2010;2:9.
13. Binahmed A, Nason RW, Abdoh AA. The clinical significance of the positive surgical margin in oral cancer. Oral Oncol. 2007;43(8):780-4.
14. Bell RB, Kademani D, Homer L, Dierks EJ, Potter BE. Tongue cancer: Is there a difference in survival compared with other subsites in the oral cavity? J Oral Maxillofac Surg. 2007;65(2):229-36.
15. González-Garcia R, Naval-Gías L, Román-Romero L, Sastre-Pérez J, Rodríguez-Campo FJ. Local recurrences and second primary tumors from squamous cell carcinoma of the oral cavity: a retrospective analytic study of 500 patients. Head Neck. 2009;31(9):1168-80.
16. Chandu A, Adams G, Smith AC. Factors affecting survival in patients with oral cancer: an Australian perspective. Int J Oral Maxillofac Surg. 2005;34(5):514-20.
17. Greene FL, Page DI, Fleming ID, Fritz AG, Balch CM, Haller DG, et al., eds. AJCC cancer staging manual. 6th ed. New York: Springer-Verlag;2002. p.77-87.
18. Batsakis JG. Surgical excision margins: a pathologist's perspective. Adv Anat Pathol. 1999;6(3):140-8.
19. Bernier J, Domenge C, Ozsahin M, Matuszewska K, Lefèbvre JL, Greiner RH, et al.; European Organization for Research and Treatment of Cancer Trial 22931. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med. 2004;350(19):1945-52.
20. Bernier J, Cooper JS, Pajak TF, van Glabbeke M, Bourhis J, Forastiere A, et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501). Head Neck. 2005;27(10):843-50.
21. Cooper JS, Pajak TF, Forastiere AA, Jacobs J, Campbell BH, Saxman SB, et al.; Radiation Therapy Oncology Group 9501/Intergroup. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med. 2004;350(19):1937-44.
22. Spiro RH, Guillamondegui O Jr, Paulino AF, Huvos AG. Pattern of invasion and margin assessment in patients with oral tongue cancer. Head Neck. 1999;21(5):408-13.
23. Zelefsky MJ, Harrison LB, Fass DE, Armstrong JG, Shah JP, Strong EW. Postoperative radiation therapy for squamous cell carcinomas of the oral cavity and oropharynx: Impact of therapy on patients with positive surgical margins. Int J Radiat Oncol Biol Phys. 1993;25(1):17-21.
24. Byers RM, Bland KI, Borlase B, Luna M. The prognostic and therapeutic value of frozen section determinations in the surgical treatment of squamous carcinoma of the head and neck. Am J Surg. 1978;136(4):525-8.
25. Kwok P, Gleich O, Hübner G, Strutz J. Prognostic importance of "clear versus revised margins" in oral and pharyngeal cancer. Head Neck. 2010;32(11):1479-84.
26. Nason RW, Binahmed A, Pathak KA, Abdoh AA, Sándor GK. What is the adequate margin of surgical resection in oral cancer? Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009;107(5):625-9.
27. Brandwein-Gensler M, Teixeira MS, Lewis CM, Lee B, Rolnitzky L, Hille JJ, et al. Oral squamous cell carcinoma: histologic risk assessment, but not margin status, is strongly predictive of local disease-free and overall survival. Am J Surg Pathol. 2005;29(2):167-78.
28. Iseli TA, Lin MJ, Tsui A, Guiney A, Wiesenfeld D, Iseli CE. Are wider surgical margins needed for early oral tongue cancer? J Laryngol Otol. 2012;126(3):289-94.
29. Vikram B, Strong EW, Shah JP, Spiro R. Failure at the primary site following multimodality treatment in advanced head and neck cancer. Head Neck Surg. 1984;6(3):720-3.
30. Songra AK, Ng SY, Farthing P, Hutchison IL, Bradley PF. Observation of tumour thickness and resection margin at surgical excision of primary oral squamous cell carcinoma--assessment by ultrasound. Int J Oral Maxillofac Surg. 2006;35(4):324-31.
31. Tetsumura A, Yoshino N, Amagasa T, Nagumo K, Okada N, Sasaki T. High-resolution magnetic resonance imaging of squamous cell carcinoma of the tongue: an in vitro study. Dentomaxillofac Radiol. 2001;30(1):14-21.
32. Keereweer S, Kerrebijn JD, Mol IM, Mieog JS, Van Driel PB, Baatenburg de Jong RJ, et al. Optical imaging of oral squamous cell carcinoma and cervical lymph node metastasis. Head Neck. 2012;34(7):1002-8.
1. Cirurgião de Cabeça e Pescoço do Hospital Santa Rita, Complexo Hospitalar Santa Casa de Porto Alegre, RS.
2. Chefe do Serviço de Cirurgia de Cabeça e Pescoço e Diretor Médico do Hospital Santa Rita. Departamento de Cirurgia de Cabeça e Pescoço, Hospital Santa Rita, Complexo Hospitalar Santa Casa de Porto Alegre.
Endereço para correspondência:
Fábio Muradás Girardi
Av Independência, nº 354, 901. Bairro Independência
Porto Alegre - RS. Brasil. CEP: 90035-070
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 25 de julho de 2012. cod. 9490.
Artigo aceito em 29 de dezembro de 2012.