Ano: 2013 Vol. 79 Ed. 1 - Janeiro - Fevereiro - (13º)
Seção: Artigo Original
Páginas: 75 a 81
Indicações e limites da imunoistoquímica no câncer de cabeça e pescoço
Indications and pitfalls of immunohistochemistry in head and neck cancer
Autor(es): Décio de Natale Caly1; Acklei Viana2; Abrão Rapoport3; Rogério Aparecido Dedivitis4; Otávio Alberto Curioni5; Cláudio Roberto Cernea6; Lenine Garcia Brandão7
DOI: 10.5935/1808-8694.20130013
Palavras-chave: carcinoma de células escamosas; imunoistoquímica; linfoma; neoplasias de cabeça e pescoço; sarcoma.
Keywords: carcinoma, squamous cell; head and neck neoplasms; immunohistochemistry; lymphoma; sarcoma.
Resumo:
O estudo imunoistoquímico tem sido empregado para a avaliação do diagnóstico diferencial de neoplasia.
OBJETIVO: Avaliar o uso do método nos casos de câncer de cabeça e pescoço.
MÉTODO: Estudo retrospectivo de casos do Registro Hospitalar de Câncer da instituição.
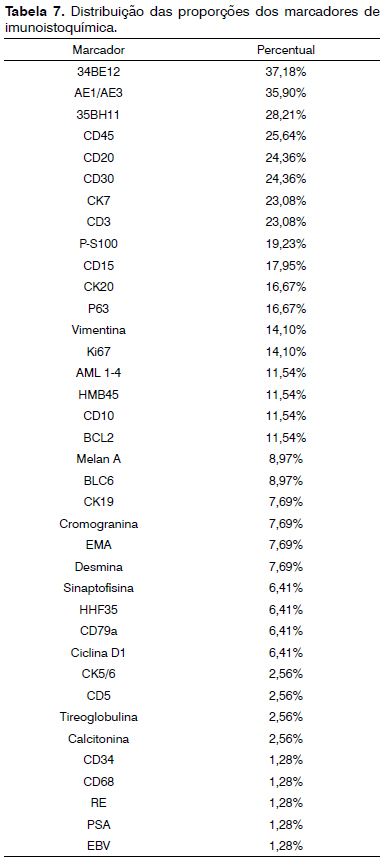
RESULTADOS: De 704 resultados anatomopatológicos, a imunoistoquímica foi realizada em 76 (11%). A maioria correspondeu a carcinomas - 85,80% e, destes, 83,66% eram epidermoides. Todos os exames foram para fins diagnósticos. Houve maior frequência para o uso de 34BE12 (37,18%), AE1/AE3 (35,90%), 35BH11 (28,21%), CD45 (25,64%), CD20 (24,36%), CD30 (24,36%), CK7 (23,08%) e CD3 (23,08%).
CONCLUSÃO: A imunoistoquímica foi usada em 10,67% dos casos de câncer de cabeça e pescoço submetidos a exame anatomopatológico, sendo maior para os carcinomas -- 5,26%. Na determinação do carcinoma epidermoide, seu uso foi de 18,42% do total de neoplasias.
Abstract:
Immunohistochemistry (IHC) has been employed in the differential diagnosis of tumors.
OBJECTIVE: To assess the use of IHC in cases of head and neck tumor.
METHOD: This is a retrospective study of the cases included in the Cancer Registry of the institution.
RESULTS: IHC was used in 76 (11%) of 704 pathology tests. Most cases were carcinomas (85.80%), and 83.66% of them were squamous cell carcinomas. All tests were done with diagnostic purposes. The most frequently used antibodies were 34BE12 (37.18%), AE1/AE3 (35.9%), 35BH11 (28.21%), CD45 (25.64%), CD20 (24.36%), CD30 (24.36%), CK7 (23.08%) and CD3 (23.08%).
CONCLUSIONS: IHC was used in 10.67% of the head and neck tumor cases submitted to pathology testing, mostly for carcinoma (5.26%). In the determination of squamous cell carcinoma, IHC accounted for 18.42% of all tumors.
![]()
INTRODUÇÃO
As alterações macro e microscópicas são a base para o diagnóstico anatomopatológico, sendo fundamental a morfologia microscópica na interpretação da histogênese, classificação e avaliação prognóstica de neoplasias. Entretanto, desde a década de 1970, ganhou importância cada vez maior o uso de técnicas mais elaboradas que colaborassem nos casos nos quais apenas a avaliação com colorações histoquímicas habituais não permitissem a elucidação diagnóstica. Nesse cenário, desenvolveu-se a imunoistoquímica, técnica na qual, por meio do uso de anticorpos marcados com substância cromógena, são identificados marcadores específicos. É uma reação antígeno-anticorpo, usando um cromógeno não fluorescente com posterior análise em microscópio óptico. A técnica baseou-se em reação no uso do material parafinado, o qual é cortado em micrótomo, submetido a tratamento para recuperação antigênica e tratado com imunoperoxidase e métodos de revelação1,2. Desse modo, ganhou grande importância nos laboratórios de anatomia patológica, uma vez que materiais emblocados em parafina podem ser utilizados com facilidade.
Apesar da grande contribuição da imunoistoquímica, a avaliação do material a ser examinado, bem como a determinação do painel a ser aplicado, vem sempre após a criteriosa análise deste material pelo médico patologista, após o exame anatomopatológico tradicional.
As principais indicações da imunoistoquímica são: definição de histogênese; diagnóstico diferencial entre estados reacionais e neoplásicos; diagnóstico etiológico em doenças infecciosas; determinação de fatores prognósticos; determinação de sítios de terapia alvo; pesquisa de sítio primário de neoplasias malignas; determinação de produtos específicos (como hormônios e proteínas) e subtipagem de neoplasias malignas.
Na definição de histogênese, entende-se a avaliação para determinar a origem tecidual e/ou celular de determinada população. No caso de neoplasias, trata-se de um ponto importante, pois colabora substancialmente ao definir se uma neoplasia é de linhagem epitelial, mesenquimal, hematopoiética ou nervosa.
Os critérios de definição entre neoplasias malignas e benignas ainda é fortemente baseado nos critérios morfológicos. Assim, macroscopicamente, alguns critérios básicos são a avaliação de crescimento do tipo infiltrativo, delimitação da lesão, ausência de cápsula, velocidade de crescimento, necrose e hemorragia. Microscopicamente, é fundamental avaliar a celularidade e os critérios de anaplasia (pleomorfismo celular e nuclear, mitoses atípicas e relação núcleo citoplasma).
Esses conceitos devem ser lembrados, pois, usando a imunoistoquímica na determinação de histogênese, ela acusará positividade para os mesmos marcadores de acordo com a origem tecidual e não pelo seu caráter benigno e maligno, ou seja, um epitélio malpighiano (escamoso) normal apresenta o mesmo caráter de marcação de um carcinoma espinocelular.
Sua classificação histológica baseia-se nos critérios estabelecidos por Broders, que avaliam a diferenciação celular e presença das pérolas córneas, obtendo quatro graus de diferenciação final3. O carcinoma espinocelular pode apresentar variantes que são, conforme a classificação da Organização Mundial da Saúde: verrucoso, basaloide, papilar, fusiforme, acantolítico, adenoescamoso, cuniculado4.
No entanto, outras lesões neoplásicas, diferentes do carcinoma espinocelular, podem acometer a topografia de cabeça e pescoço, incluindo os carcinomas indiferenciados, metástases, carcinomas neuroendócrinos, sarcomas e linfomas, entre outros.
Nesse cenário, o uso da imunoistoquímica faz-se necessário no auxílio diagnóstico, bem como na subtipagem dessas lesões. Tornou-se instrumento rotineiro na prática diária do laboratório, bem como um exame de fácil solicitação para clínicos e cirurgiões. Entretanto, cabe discutir quais seus usos e indicações precisas que ajudem no processo diagnóstico ou prognóstico e que possam ter impacto na conduta/terapêutica, bem como quais suas limitações. Assim, o objetivo desse trabalho é avaliar a utilização da imunoistoquímica nos casos de câncer de cabeça e pescoço.
MÉTODO
Estudo retrospectivo, realizado nos arquivos do Registro Hospitalar de Câncer da instituição, no período de abril de 2009 a fevereiro de 2012, baseado nos resultados anatomopatológicos referentes aos casos do Serviço de Cabeça e Pescoço e arquivados neste registro.
Os critérios de inclusão foram: casos diagnosticados e tratados na instituição e registrados no Registro Hospitalar de Câncer; e cujos resultados anatomopatológicos foram arquivados em mídia eletrônica no Registro Hospitalar de Câncer. Os critérios de exclusão foram: falta de comprovação da imunoistoquímica; neoplasias de tireoide; diagnósticos de carcinoma basocelular da pele e anexos cutâneos; e neoplasias odontogências.
Foram estudados os casos submetidos à avaliação imunoistoquímica, considerando as incidências nas diversas linhagens - carcinomas, sarcomas e linfomas e os painéis utilizados.
Foi realizada análise descritiva com o uso de frequências absolutas e relativas.
RESULTADOS
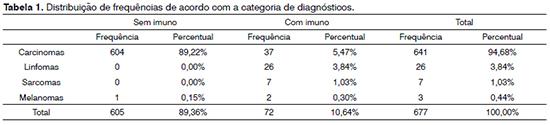
Foram selecionados 677 resultados anatomopatológicos, sendo que em 605 (89,4%) não houve imunoistoquímica e em 72 (10,6%) foi feito o estudo.
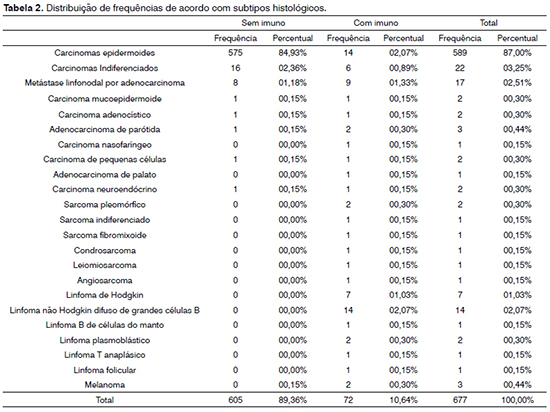
Considerando-se a divisão das neoplasias de acordo com as linhagens diagnosticadas, os carcinomas foram 94,69% dos casos e, em segundo lugar, os linfomas, com 3,84%. A participação da imunoistoquímica para o diagnóstico ocorreu em 10,64% dos casos, dos quais 5,47% corresponderam para a linhagem epitelial. No diagnóstico de linfomas e sarcomas, sua participação ocorreu em todos os casos - Tabela 1. De acordo com os subtipos histológicos, os carcinomas espinocelulares foram a maior parte da casuística, com 87% dos casos avaliados. Os demais subtipos encontrados estão descritos na Tabela 2.
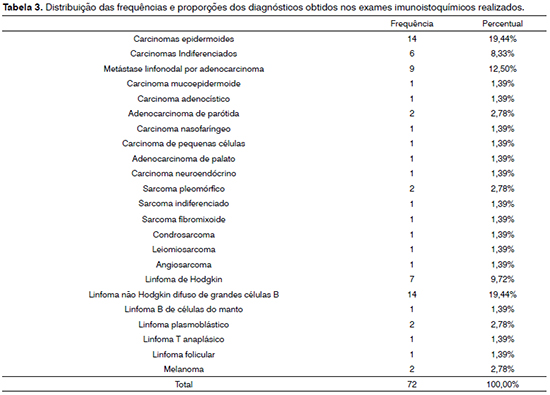
Avaliando apenas os 72 exames submetidos à imunoistoquímica, os maiores índices foram para o carcinoma epidermoide, com 19,44%; linfoma de Hodgkin difuso de grandes células com 19,44%; metástases linfonodais, com 12,50%; linfoma de Hodgkin, com 9,72%; e carcinoma indiferenciado, com 8,33% - Tabela 3.
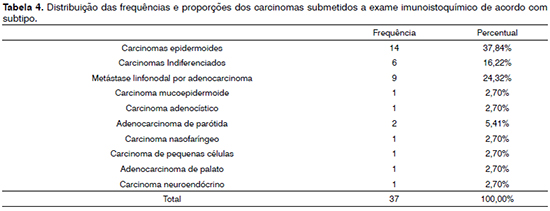
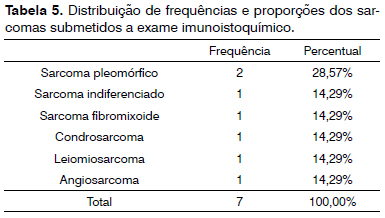
Comparando as frequências dentro dos grupos específicos (carcinoma, linfoma e sarcoma) conforme os subtipos diagnosticados nos quais foi realizado exame imunoistoquímico, no grupo carcinoma o maior percentual foi para o carcinoma espinocelular, com 37,84%; no grupo linfoma foi o linfoma difuso de grandes células B, com 53,85%; e no grupo sarcoma para o sarcoma pleomórfico, com 28,57% - Tabelas 4, 5 e 6.
Todas as 76 imunoistoquímicas realizadas foram para fins diagnósticos. Considerando os painéis imunoistoquímicos realizados e de acordo com os anticorpos utilizados, houve maior frequência para 34BE12 (37,18%), seguido de AE1/AE3 (35,90%), 35BH11 (28,21%), CD45 (25,64%), CD20 (24,36%), CD30 (24,36%), CK7 (23,08%) e CD3 (23,08%) - Tabela 7.
DISCUSSÃO
É indiscutível que o exame imunoistoquímico foi um importante avanço para a Anatomia Patológica. A possibilidade de poder elucidar as lesões neoplásicas de diagnósticos difíceis ou duvidosos tornou esse método um grande aliado às técnicas de rotina.
Os tecidos de origem epitelial apresentam imunomarcação para citoqueratinas, que são proteínas do citoesqueleto de células epiteliais. Existem mais de 25 tipos de citoqueratinas e que também são divididas em baixo e alto peso molecular. Conforme o tecido, há citoqueratinas específicas que os marcam. Epitélio do tipo escamoso possui marcação para citoqueratinas do alto peso molecular, com as principais representantes sendo: CK4, CK5, CK6, CK13, CK14, CK17 ou, então, marcado por um coquetel dessas citoqueratinas, denominado 34βE12. Epitélios glandulares apresentam marcação preferencial para citoqueratinas de baixo peso molecular (CK8, CK18, CK 19) ou pelo coquetel de baixo peso 35β11.
Em termos de diagnóstico, a imunoistoquímica no carcinoma espinocelular tem atuação reservada aos subtipos que fogem da forma tradicional e que gerem dúvidas quanto ao diagnóstico e, nos casos dos carcinomas poucos diferenciados, em que há necessidade de reconhecimento da histogênese para efetuar o diagnóstico diferencial com outras neoplasias, tais como: sarcomas, neoplasias indiferenciadas, neoplasias de células pequenas e neuroendócrinas. Os carcinomas espinocelulares marcam o coquetel de pancitoqueratina (AE1/AE3) e o complexo de citoqueratina de alto peso molecular (34βE12) e para os carcinomas espinocelulares basaloides, fusiforme e nasosinusal queratinizante marcadores adicionais podem ser usados. Mesmo na pesquisa/confirmação do carcinoma espinocelular, ressalta-se a importância de utilizar outros marcadores que auxiliam no diagnóstico diferencial com outras neoplasias (mesenquimais, hematopoiéticas, adenocarcinomas).
Se por um lado a imunoistoquímica apresenta uma indicação diagnóstica limitada aos carcinomas espinocelulares de cabeça e pescoço, alguns estudos realizados recentemente tentam avaliar sua importância prognóstica. Sabe-se que diversas vias moleculares participam da sua carcinogênese. Entre as vias mais estudadas, citam-se a do p53, p16, ciclina D1 e PTEN. Associação entre marcação do p53, ciclina e p16 e espessura tumoral, sobrevida, metástases e resposta a terapia adjuvante é estudada, sendo encontrada correlação em alguns trabalhos, porém, nenhum consenso foi estabelecido para o carcinoma espinocelular de cabeça e pescoço5-7. O valor preditivo de resposta terapêutica à radioterapia é alvo de atenção com alguns trabalhos, relacionando o grau de resposta ao grau de expressão de PTEN por imunoistoquímica8,9.
O grande foco atual volta-se para o uso de terapia alvo no controle de neoplasias. A via do receptor de fator de crescimento epidérmico (EGFR) atua como um oncogene na ativação de proliferação e divisão celular. Nos casos de mutação ou ativação desta via, os queratinócitos estão estimulados a proliferar e progredir. A via do EGFR apresenta-se mutada em cerca de 30% dos carcinomas espinocelulares de cabeça e pescoço, relacionando-se os casos de sua expressão com pior prognóstico da doença10. O uso de anticorpos monoclonais que atuam impedindo a ativação do receptor do EGF tornou-se alvo de interesse e estudo. A detecção por imunoistoquímica desse receptor auxilia na decisão terapêutica do uso da medicação específica11.
O crescimento neoplásico e propagação têm relação direta com o grau de angiogênese. O fator de crescimento vascular endotelial (VEGF), descrito desde a década de 80, é uma glicoproteína que se liga a receptores específicos, atuando no mecanismo de angiogênese. A angiogênese é essencial para o crescimento e propagação neoplásica e, consequentemente, pior prognóstico. A pesquisa por imunoistoquímica para essas vias é uma das mais novas opções de avaliar prognóstico, pois as medicações que atuam no seu bloqueio, por exemplo, o bevacizumab, têm sido utilizados na tentativa de melhor controle da doença12,13.
O uso da imunoistoquímica nos casos de pesquisa de sítio primário em doença metastática é de fundamental importância, pois, por meio de um painel que marque carcinomas espinocelulares, adenocarcinomas, carcinomas de tireoide, sarcomas, linfomas, carcinomas neuroendócrinos e melanomas, pode-se estabelecer um diagnóstico preciso e, consequentemente, um tratamento mais eficaz.
Considerando-se todos esses quesitos, a imunoistoquímica é um bom método auxiliar, porém, para que seu uso seja otimizado, são necessários critérios bem estabelecidos de indicação. O método auxilia na abordagem nas neoplasias de cabeça e pescoço, principalmente nos diagnósticos de sarcomas e linfomas, possibilitando sua adequada classificação e pode ter uso restrito aos casos de dúvida diagnóstica quando aplicado aos carcinomas.
Nessa casuística, observamos que a maioria dos diagnósticos histopatológicos referem-se ao carcinoma espinocelular forma com frequência de 87% dos casos, como relatado de acordo com a literatura mundial14,15, não apresentando dificuldades em reconhecimento e diagnóstico. A imunoistoquímica foi usada em 10,67% dos casos de carcinoma quando houve necessidade de elucidação de diagnóstico/histogênese. Esse uso é corroborado pelos dados de literatura, em que sua aplicação é resguardada para o uso de confirmação de histogênese/subtipos16,17. Considerando-se o percentual total da imunoistoquímica encontrada nessa série, falando-se exclusivamente da linhagem epitelial maligna (carcinomas), de 5,77%, podemos inferir que sua utilização como método diagnóstico é de baixa utilização e uso restrito e sem grandes impactos de mudança terapêutica.
O uso da imunoistoquímica na pesquisa de sítio primário de metástases linfonodais é uma aplicação útil e elucidativa desse método18. Nessa série, obtivemos o índice de necessidade de uso da imunoistoquímica em 11,69% dos casos. Apesar de não ser um número fortemente expressivo, apresenta uma relevância por poder indicar uma correta histogênese da lesão, nos casos de sítio primário desconhecido e, desse modo, propiciar melhor abordagem terapêutica adjuvante.
Para as neoplasias de outras linhagens (sarcomas e linfomas), é indiscutível sua aplicação, pois é usada tanto na determinação de histogênese como na subtipagem de neoplasia e, portanto, apresenta impacto determinante na conduta terapêutica.
CONCLUSÃO
A imunoistoquímica foi usada em 10,67% dos casos de câncer de cabeça e pescoço submetidos a exame anatomopatológico. A utilização foi maior para os carcinomas, com 5,26% do total de casos. Na determinação do carcinoma espinocelular, seu uso foi de 18,42% do total de neoplasias. O diagnóstico de carcinoma espinocelular ainda é feito na grande maioria das vezes sem a necessidade do seu uso. O uso para pesquisa de sítio metastático é necessário para a confirmação diagnóstica. O uso é ainda essencial para o diagnóstico e subtipagens de linfomas e para o diagnóstico e subtipagens de sarcomas.
REFERÊNCIAS
1. Heyderman E. Immunoperoxidase technique in histopathology: applications, methods, and controls. J Clin Pathol. 1979;32(10):971-8.
2. Heyderman E, Neville AM. A shorter immunoperoxidase technique for the demonstration of carcinoembryonic antigen and other cell products. J Clin Pathol. 1977;30(2):138-40.
3. Broders AC. Squamous-cell epithelioma of the lip: a study of five hundred and thirty-seven cases. JAMA. 1920;74(10):656-64.
4. Barnes L, Everson JW, Reichart P, Sidransky D, editors. World Health Organization Classification of tumours. Pathology and genetics of head and neck cancer. Lyon: IARC Press; 2005.
5. Peltonen JK, Vähäkangas KH, Helppi HM, Bloigu R, Pääkkö P, Turpeenniemi-Hujanen T. Specific TP53 mutations predict aggressive phenotype in head and neck squamous cell carcinoma: a retrospective archival study. Head Neck Oncol. 2011;3:20.
6. Fischer CA, Kampmann M, Zlobec I, Green E, Tornillo L, Lugli A, et al. p16 expression in oropharyngeal cancer: its impact on staging and prognosis compared with the conventional clinical staging parameters. Ann Oncol. 2010;21(10):1961-6.
7. Feng Z, Guo W, Zhang C, Xu Q, Zhang P, Sun J, et al. CCND1 as a predictive biomarker of neoadjuvant chemotherapy in patients with locally advanced head and neck squamous cell carcinoma. PLoS One. 2011;6(10):e26399.
8. Lee JI, Soria JC, Hassan KA, El-Naggar AK, Tang X, Liu DD, et al. Loss of PTEN expression as a prognostic marker for tongue cancer. Arch Otolaryngol Head Neck Surg. 2001;127(12):1441-5.
9. Snietura M, Jaworska M, Mlynarczyk-Liszka J, Goraj-Zajac A, Piglowski W, Lange D, et al. PTEN as a prognostic and predictive marker in postoperative radiotherapy for squamous cell cancer of the head and neck. PLoS One. 2012;7(3):e33396.
10. Elferink LA, Resto VA. Receptor-tyrosine-kinase-targeted therapies for head and neck cancer. J Signal Transduct. 2011;2011:982879.
11. Wheeler DL, Dunn EF, Harari PM. Understanding resistance to EGFR inhibitors-impact on future treatment strategies. Nat Rev Clin Oncol. 2010;7(9):493-507.
12. Tanaka T, Ishiguro H, Kuwabara Y, Kimura M, Mitsui A, Katada T, et al. Vascular endothelial growth factor C (VEGF-C) in esophageal cancer correlates with lymph node metastasis and poor patient prognosis. J Exp Clin Cancer Res. 2010;29:83.
13. Argiris A, Karamouzis MV, Gooding WE, Branstetter BF, Zhong S, Raez LE, et al. Phase II trial of pemetrexed and bevacizumab in patients with recurrent or metastatic head and neck cancer. J Clin Oncol. 2011;29(9):1140-5.
14. Stelow EB, Mills SE. Squamous cell carcinoma variants of the upper aerodigestive tract. Am J Clin Pathol. 2005;124 Suppl:S96-109.
15. Wenig BM. Squamous cell carcinoma of the upper aerodigestive tract: precursors and problematic variants. Mod Pathol. 2002;15(3):229-54.
16. Emanuel P, Wang B, Wu M, Burstein DE. p63 Immunohistochemistry in the distinction of adenoid cystic carcinoma from basaloid squamous cell carcinoma. Mod Pathol. 2005;18(5):645-50.
17. Tsubochi H, Suzuki T, Suzuki S, Ohashi Y, Ishibashi S, Moriya T, et al. Immunohistochemical study of basaloid squamous cell carcinoma, adenoid cystic and mucoepidermoid carcinoma in the upper aerodigestive tract. Anticancer Res. 2000;20(2B):1205-11.
18. Park JM, Jung CK, Choi YJ, Lee KY, Kang JH, Kim MS, et al. The use of an immunohistochemical diagnostic panel to determine the primary site of cervical lymph node metastases of occult squamous cell carcinoma. Hum Pathol. 2010;41(3):431-7.
1. Doutor em Patologia pelo Hospital A.C. Camargo, São Paulo. (Patologista do Hospital Heliópolis, São Paulo).
2. Residente do Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital Heliópolis, São Paulo.
3. Docente Livre pelo Departamento de Cirurgia da Faculdade de Medicina da Universidade de São Paulo (Diretor Técnico de Departamento de Saúde do Hospital Heliópolis, São Paulo).
4. Professor Livre-Docente. Supervisor do Grupo de Laringe do Departamento de Cirurgia de Cabeça e Pescoço do Hospital das Clínicas da Faculdade de Medicina da Universidade de
São Paulo (Médico).
5. Doutor em Patologia pela Faculdade de Medicina da Universidade de São Paulo (Chefe do Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital
Heliópolis, São Paulo).
6. Professor Associado do Departamento de Cirurgia de Cabeça e Pescoço da Faculdade de Medicina da Universidade de São Paulo, São Paulo.
7. Professor Titular do Departamento de Cirurgia de Cabeça e Pescoço da Faculdade de Medicina da Universidade de São Paulo, São Paulo.
Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital Heliópolis, São Paulo e Departamento de Cirurgia de Cabeça e Pescoço do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
Endereço para correspondência:
Rogério Aparecido Dedivitis
Rua Cônego Xavier, nº 276. Sacomã
São Paulo - SP. Brasil. CEP: 04231030
E-mail: dedivitis@usp.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 26 de julho de 2012. cod. 9522.
Artigo aceito em 15 de outubro de 2012.