Ano: 2012 Vol. 78 Ed. 5 - Setembro - Outubro - (4º)
Seção: Artigo Original
Páginas: 22 a 26
Comparação do perfil clínico de crianças não obesas com apneia do sono e ronco
Comparing the clinical profile of non obese children with sleep apnea and snoring
Autor(es): Daniele de Oliveira Soares Stefanini1; Emília Leite de Barros2; Renato Stefanini3; Márcia Lurdes de Cássia Pradella-Hallinan4; Shirley Shizue Nagata Pignatari5; Reginaldo Raimundo Fujita6
DOI: 10.5935/1808-8694.20120004
Palavras-chave: apnéia do sono tipo obstrutiva, criança, doenças metabólicas, polissonografia.
Keywords: child, metabolic diseases, polysomnography, sleep apnea, obstructive.
Resumo:
Poucos trabalhos na literatura estudam repercussões cardiovasculares e metabólicas da Síndrome da Apneia Obstrutiva do Sono (SAOS) em crianças.
OBJETIVO: Avaliar o perfil metabólico de crianças não obesas com SAOS.
MÉTODO: Foram incluídas 52 crianças (21 meninas e 31 meninos), divididas em dois grupos: SAOS (28 crianças) e Ronco (22 crianças) de acordo com a polissonografia. As crianças foram submetidas a exame otorrinolaringológico completo, medidas de peso e estatura e aferição da pressão arterial. Foram coletadas amostras de sangue para dosagem de hemoglobina, hematócrito, glicemia de jejum, insulina de jejum, triglicérides, colesterol total e frações, TSH e T4 livre. As variáveis foram comparadas entre os grupos e também dentro do grupo SAOS de acordo com o grau de gravidade da síndrome.
RESULTADOS: Todas as crianças apresentaram índices de PA e exames de sangue não alterados. Porém percebemos que existe diferença estatística entres os grupos nos resultados de: Hemoglobina, Hematócrito, HDL e VLDL. Somente o VLDL apresenta valores maiores no grupo SAOS. Não existe diferença estatística entre as variáveis de acordo com a gravidade da SAOS.
CONCLUSÃO: Não foram encontradas alterações nos exames metabólicos e nos índices de pressão arterial das crianças não obesas com SAOS.
Abstract:
Few studies in the literature have looked into the cardiovascular and metabolic effects of Obstructive Sleep Apnea Syndrome (OSAS) in children.
OBJECTIVE: This study aims to evaluate the metabolic profile of non-obese children with OSAS.
METHODS: Fifty-two children were enrolled in this study, 21 girls and 31 boys. Patients were divided into two groups: OSAS (28 children) and Snore (22 children) according to polysomnographic evaluation. All children were submitted to ENT examination, measurements of weight, height and blood pressure. Blood samples were tested for hemoglobin, hematocrit, fasting glucose, fasting insulin, triglycerides, total cholesterol, HDL, LDL, VLDL, TSH and T4. The gathered data sets were compared between groups and also within the OSAS group according to the severity of the syndrome.
RESULTS: The children from both groups had no alterations in blood pressure levels. The results of the blood tests were normal for both groups. Results of hemoglobin, hematocrit, and HDL were all significantly higher in the Snore group when compared to the OSAS group; by their turn, VLDL levels were higher in the OSAS group. There was no statistical difference between the groups based on OSAS severity.
CONCLUSION: Non-obese children with OSAS present no significant alterations in metabolic tests or blood pressure levels.
![]()
INTRODUÇÃO
A Síndrome da Apneia Obstrutiva do Sono (SAOS), caracterizada por episódios repetidos de obstrução da via aérea superior associados à hipóxia e hipercapnia intermitentes1, é um distúrbio respiratório do sono que afeta tanto adultos quanto crianças.
Sua prevalência em crianças varia de 0,7% a 3% nos diferentes estudos. Seu pico de incidência ocorre em pré-escolares, idade na qual é mais frequente a hipertrofia adenotonsilar, principal causa de SAOS na infância1. O tratamento da SAOS na criança consiste na cirurgia de adenoamigdalectomia ou, raramente, em uso de CPAP1-3.
A SAOS pode ter consequências clínicas graves, como cor pulmonale, além de outras alterações cardiovasculares e metabólicas, atraso no crescimento ponderoestatural, alterações no esqueleto facial e torácico, enurese noturna e distúrbios do comportamento, do aprendizado e de outras funções cognitivas1,4.
No adulto, já é bem documentada a associação de SAOS com hipertensão arterial sistêmica e outras doenças cardiovasculares e metabólicas1,5-8. A fragmentação e privação do sono e a hipoxemia noturna intermitente, associadas à SAOS, têm sido relacionadas à disfunção metabólica, que inclui alterações do metabolismo da glicose e dislipidemia. Evidências sugerem uma associação da SAOS com diabetes mellitus tipo II, intolerância à glicose e resistência à insulina9.
Estudos em crianças demonstram associação entre a SAOS e alterações na pressão arterial sistêmica10,11, no ecocardiograma12,13 e na resistência à insulina14,15. Estas alterações parecem estar presentes, principalmente, em crianças com SAOS moderada ou grave e nas crianças obesas16. São poucos os estudos, na literatura, que avaliam as consequências da SAOS em crianças não obesas.
Nosso objetivo foi comparar o perfil clínico entre crianças não obesas com SAOS e ronco primário.
MÉTODO
Após aprovação do estudo pelo Comitê de Ética em Pesquisa da instituição (CEP 1814/08), foram estudadas crianças do ambulatório, de março de 2009 a agosto de 2010. Essas crianças apresentavam idade entre 3 e 13 anos, respiração predominantemente oral e roncos noturnos presentes em três ou mais dias da semana, por no mínimo 6 meses, índice de massa corpórea (IMC) menor ou igual ao percentil 95, de acordo com a idade e sexo. Foram excluídos pacientes obesos, diabéticos, com doenças cardiovasculares ou metabólicas, síndromes genéticas, malformações craniofaciais ou doenças neuromusculares.
As crianças foram submetidas a exame otorrinolaringológico completo (oroscopia, rinoscopia e otoscopia), medidas de peso e estatura e aferição da pressão arterial (PA). A PA foi aferida em posição sentada, após pelo menos 20 minutos de repouso com esfigmanômetro adequado para peso e idade. A medida da PA foi classificada em "alterada" ou "não alterada" de acordo com a segunda versão da tabela publicada pela National Task Force on Hypertension of National Heart, Lung and Blood Institute e endossada pela Academia Americana de Pediatria em 1987 e revisada em 1996 17,18. Foram considerados normais os valores de PA sistólica ou diastólica menores que o percentil 90.
A hipertrofia tonsilar foi classificada em 4 graus, de acordo com a classificação de Brodsky19 e a hipertrofia da tonsila faríngea foi avaliada por meio da nasofibrolaringoscopia. Consideramos como hipertrofia obstrutiva das tonsilas palatinas os graus III e IV. A tonsila faríngea foi considerada obstrutiva quando ocupava 70% ou mais da região do cavum.
Todas as crianças realizaram o exame de polissonografia. Apneia obstrutiva foi definida como a presença de esforço inspiratório na ausência de fluxo aéreo por, no mínimo, dois eventos respiratórios. Hipopneia foi definida por redução de pelo menos 50% da amplitude do fluxo aéreo, na presença de esforço inspiratório, e dessaturação da oxihemoglobina de pelo menos 4% ou um despertar. O índice de apneia/hipopneia (IAH) foi definido como o conjunto de apneias obstrutivas, mistas (apneias com componentes centrais e obstrutivos) e hipopneias por hora de sono20. Determinamos como SAOS a presença de IAH > 1. Se IAH > 1 e < 5, consideramos SAOS de grau leve, o IAH > 5 e < 10 foi classificado como SAOS de grau moderado. A SAOS grave foi considerada quando encontrado IAH > 10.
Foram coletadas amostras de sangue do paciente em jejum para dosagem de hemoglobina (Hb), hematócrito (Ht), glicemia de jejum, insulina de jejum, triglicérides, colesterol total e frações (HDL, LDL, VLDL), TSH e T4 livre.
Neste estudo foram utilizados testes e técnicas estatísticas não paramétricos.
Para comparar se a proporção de respostas de duas determinadas variáveis e/ou seus níveis é estatisticamente significantes, foi utilizado o Teste de Igualdade de duas Proporções. O Teste de Mann-Whitney foi usado para comparar duas a duas as variáveis das amostras independentes. O Teste de Kruskal-Wallis foi utilizado para comparar os três graus de gravidade da SAOS com todas as variáveis quantitativas.
A correlação de Spearman foi utilizada para medir o grau de relação de todas as variáveis com o grau de gravidade da SAOS. Para validar as correlações, utilizou-se o Teste de Correlação.
Definiu-se para este trabalho um nível de significância de 0,05 (5%). Todos os intervalos de confiança construídos ao longo do trabalho foram construídos com 95% de confiança estatística.
RESULTADOS
Participaram do estudo 52 crianças, sendo 21 (40,38%) meninas e 31 (59,61%) meninos. Os pacientes foram divididos em dois grupos: SAOS (IAH > 1 evento/hora) e Ronco (IAH < 1 evento por hora), sendo os dois grupos homogêneos quanto ao gênero e idade. O grupo Ronco foi composto de 28 crianças, sendo 13 do sexo feminino e 15 do sexo masculino e o grupo SAOS compreendia 24 crianças, oito meninas e 16 meninos. Dentro do grupo SAOS, 11 crianças participaram do grupo de SAOS de grau leve, sete do de grau moderado e seis do de grau acentuado. A média da idade no grupo Ronco foi 8,07 e no grupo SAOS, 6,67.
Todas as crianças apresentavam SAOS de causa obstrutiva por hipertrofia de tecidos linfoides, sendo que, neste grupo SAOS, 18 (75%) crianças apresentavam hipertrofia de tonsila faríngea e 15 (62,5%) apresentavam hipertrofia amigdaliana. No grupo Ronco, 13 (46,4%) crianças apresentavam hipertrofia de tonsila faríngea e 10 (35,7%), hipertrofia amigdaliana.
Todas as crianças, tanto do grupo SAOS quanto do grupo Ronco, apresentaram índices de PA não alterados.
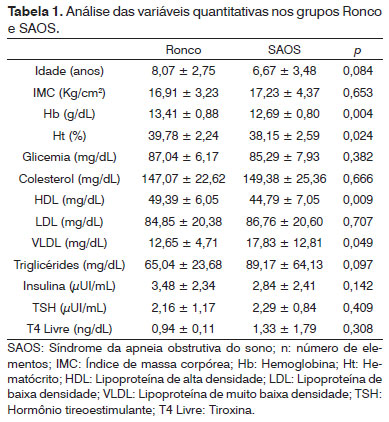
Comparamos estes mesmos grupos, mas para todas as variáveis quantitativas: idade, IMC, Hb, Ht, glicemia de jejum, colesterol total e frações, triglicérides, insulina, TSH e T4 livre, como descrito na Tabela 1.
As variáveis estudadas apresentaram valores normais nos dois grupos. Entretanto, percebemos que existe diferença estatística entres os grupos nos resultados de: Hb, Ht, HDL e VLDL. Notamos que nestas variáveis nas quais foi encontrada significância, somente o VLDL apresenta valor maior no grupo SAOS do que no grupo Ronco.
Foram analisados somente os sujeitos do grupo SAOS, comparando os três graus de gravidade da síndrome em todas as variáveis quantitativas. Embora exista diferença entre as variáveis de acordo com os graus de gravidade da SAOS, a mesma não pode ser considerada estatisticamente significante.
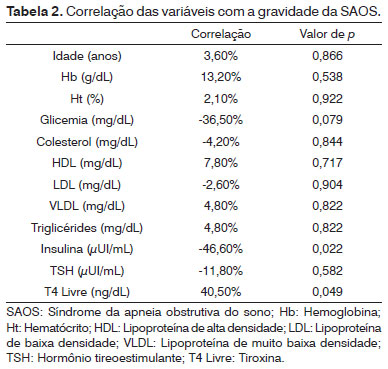
Analisando somente o grupo SAOS, mediu-se o grau de relação de todas as variáveis com o grau de gravidade da síndrome (Tabela 2).
Foi verificado que existe correlação negativa do grau da síndrome com Insulina (-46,6%) e positiva com T4 Livre (40,5%). Ambas as correlações são classificadas como sendo Regulares.
DISCUSSÃO
Vários trabalhos na literatura têm demonstrado alteração da PA em crianças com SAOS10,21,22. No presente estudo, não verificamos alteração da PA nas crianças não obesas de ambos os grupos, SAOS e Ronco. Kaditis et al.16 também não encontraram alterações nos níveis de PA de crianças não obesas com SAOS, porém, encontramos valores significantemente maiores da PA no grupo de crianças com SAOS em relação ao grupo controle. Também o trabalho realizado por Amin et al.12 em 2002 não evidenciou alteração da PA nas crianças com SAOS, nem nos roncadores primários.
Quanto aos índices metabólicos, nosso estudo não demonstrou alteração nos níveis dos mesmos em nenhum dos dois grupos. Evidenciou somente aumento do VLDL colesterol e diminuição do HDL colesterol significativos nas crianças com SAOS. A hemoglobina e o hematócrito apresentaram-se significativamente aumentados nas crianças sem a síndrome. Kaditis et al.16 avaliaram crianças não obesas e com SAOS e não encontraram diferença nos valores de colesterol total e frações, triglicérides e insulina, quando comparados com as crianças sem SAOS.
Quando avaliamos somente os pacientes com SAOS para verificar se havia variação dos índices metabólicos de acordo com a gravidade da SAOS, não encontramos diferença estatística entre os graus de gravidade da SAOS e os índices pesquisados. Verificamos que quanto maior o grau de gravidade da SAOS, menor o índice de insulina e maior o índice de T4 livre.
Esses resultados diferem dos encontrados por de la Eva et al.14, que demonstraram correlação positiva entre a gravidade da SAOS e os índices de insulina em crianças, independente do IMC. Na China, também foram estudadas crianças obesas e com SAOS, sendo encontrados valores aumentados de insulina neste grupo, com correlação positiva com a gravidade da SAOS23. Redline et al.10 estudaram um grupo de adolescentes e demonstraram que adolescentes com distúrbios respiratórios do sono têm chance sete vezes maior de ter alterações metabólicas do que o adolescente com sono normal. Após ajustar para gênero e IMC, esses adolescentes ainda apresentam níveis aumentados de PA, insulina e LDL colesterol.
Porém, no estudo realizado por Tauman et al.24 foi verificado que a obesidade, e não a SAOS, foi a maior determinante da resistência à insulina e das alterações metabólicas encontradas nas crianças estudadas. Este último estudo explicaria porque no nosso estudo, e no de Kaditis, não encontramos alterações metabólicas entre as crianças não obesas com e sem SAOS. Parece que o tecido adiposo tem um papel importante de mediador de citoquinas, fator de crescimento e esteroides sexuais, os quais modificam a ação e secreção da insulina25.
Um estudo longitudinal com crianças demonstrou que as alterações metabólicas ficam mais evidentes na faixa etária de 10 a 19 anos26. Os diferentes resultados obtidos nos diversos estudos podem estar relacionados à variação de idade entre os pacientes estudados. Os achados positivos podem prevalecer nas crianças mais velhas e nos adolescentes porque estes estão sujeitos às consequências da SAOS há mais tempo que as crianças menores, além de estarem sofrendo influência das alterações puberais.
Outro fator de confusão nos estudos de crianças com SAOS é a obesidade, que em alguns trabalhos se demonstra determinante para que haja alterações metabólicas e em outros não. Seria necessária a realização de mais trabalhos relacionando crianças com SAOS e alterações metabólicas, porém, esses devem separar as crianças obesas das não obesas e estudá-las por faixa etária.
No nosso trabalho estudamos somente crianças não obesas para evitarmos o fator de confusão da obesidade e estudarmos somente as consequências relacionadas à SAOS. Sabemos que a idade também influencia no aparecimento de alterações metabólicas e que seria importante dividir as crianças por faixa etária, porém, devido à dificuldade na realização de polissonografias, temos uma amostra com número limitado, o que não nos permitiu dividi-la em grupos menores por faixa etária.
Apesar de a literatura ser rica em estudos envolvendo SAOS em adultos, poucos são os trabalhos realizados em crianças com distúrbios respiratórios do sono. Trabalhos que envolvem crianças com SAOS e distúrbios metabólicos e inflamatórios têm resultados divergentes, principalmente pela utilização de diferentes métodos de classificação da SAOS e também pela variação dos dados obtidos em relação à idade das crianças. O adolescente parece ter características metabólicas diferentes das encontradas em crianças menores e, na maioria dos trabalhos, são estudados em conjunto, não se levando em conta esta variação.
CONCLUSÃO
Os dados do nosso estudo nos permitem concluir que crianças não obesas, portadoras de SAOS, não apresentam alterações significativas de pressão arterial ou metabólicas quando comparadas a crianças com ronco primário.
REFERÊNCIAS
1. Weber SAT. Avaliação cardíaca em crianças com distúrbios respiratórios obstrutivos, antes e após adenotonsilectomia [Tese de Doutorado] Botucatu: Faculdade de Medicina da Universidade Estadual Paulista; 2006.
2. Görür K, Döven O, Unal M, Akkus N, Ozcan C. Preoperative and postoperative cardiac and clinical findings of patients with adenotonsillar hypertrophy. Int J Pediatr Otorhinolaringol. 2001;59(1):41-6.
3. Pereira Jr JC, Pessoa JHL. Síndrome da apnéia/hipopnéia do sono: uma visão pediátrica. Rev Paul Pediatria. 2005;23(4):184-91.
4. Pac A, Karadg A, Kurtaran H, Aktas D. Comparison of cardiac function and valvular damage in children with and without adenotonsillar hypertrophy. Int J Pediatr Otorhinolaringol. 2005;69(4):527-32.
5. Quan SF, Gersh BJ; National Center on Sleep Disorders Research; National Heart, Lung, and Blood Institute. Cardiovascular consequences of sleep-disordered breathing: past, present and future: report of a Workshop from the National Center on Sleep Disorders Research and the National Heart, Lung, and Blood Institute. Circulation. 2004;109(8):951-7.
6. Caples SM, Garcia-Touchard A, Somers VK. Sleep-disordered breathing and cardiovascular risk. Sleep. 2007;30(3):291-303.
7. Kasasbeh E, Chi DS, Krishnaswamy G. Inflammatory aspects of sleep apnea and their cardiovascular consequences. South Med J. 2006;99(1):58-67.
8. Tsaoussoglou M, Bixler EO, Calhoun S, Chrousos GP, Sauder K, Vgontzas AN. Sleep-disordered breathing in obese children is associated with prevalent excessive daytime sleepiness, inflammation, and metabolic abnormalities. J Clin Endocrinol Metab. 2010;95(1):143-50.
9. Seicean S, Kirchner HL, Gottlieb DJ, Pinjabi NM, Resnick H, Sanders M, et al. Sleep disordered breathing and impaired glucose metabolism in normal-weight and overweight/obese individuals: the Sleep Heart Health Study. Diabetes Care. 2008;31(5):1001-6.
10. Redline S, Storfer-Isser A, Rosen CL, Johnson NL, Kirchner HL, Emancipator J, et al. Association between metabolic syndrome and sleep-disordered breathing in adolescents. Am J Respir Crit Care Med. 2007;176(4):401-8.
11. Amin RS, Carroll JL, Jeffries JL, Grone C, Bean JA, Chini B, et al. Twenty-four-hour ambulatory blood pressure in children with sleep-disordered breathing. Am J Resp Crit Care Med. 2004;169(8):950-6.
12. Amin RS, Kimball TR, Bean JA, Jeffries JL, Willging JP, Cotton RT, et al. Left ventricular hypertrophy and abnormal ventricular geometry in children and adolescents with obstructive sleep apnea. Am J Respir Crit Care Med. 2002;165(10):1395-9.
13. Amin RS, Kimball TR, Kalra M, Jeffries JL, Carroll JL, Bean JA, et al. Left ventricular function in children with sleep disordered breathing. Am J Cardiol. 2005;95(6):801-4.
14. de la Eva RC, Baur LA, Donaghue KC, Waters KA. Metabolic correlates with obstructive sleep apnea in obese subjects. J Pediatr. 2002;140(6):654-9.
15. Waters KA, Mast BT, Vella S, de la Eva R, O'Brien LM, Bailey S, et al. Structural equation modeling of sleep apnea, inflammation, and metabolic dysfunction in children. J Sleep Res. 2007;16(4):388-95.
16. Kaditis AG, Alexopoulos EI, Damani E, Karadonta I, Kostadima E, Tsolakidou A et al. Obstructive sleep-disordered breathing and fasting insulin levels in nonobese children. Pediatr Pulmonol. 2005;40(6):515-23.
17. Santos AAC, Zanetta DMT, Cipullo JP, Burdmann EA. O diagnóstico da hipertensão arterial na criança e no adolescente. Pediatria (São Paulo). 2003;25(4):174-83.
18. Salgado CM, Carvalhaes JTA. Hipertensão arterial na infância. J Pediatr (Rio J). 2003;79(Suppl 1):S115-24.
19. Brodsky L, Moore L, Stanievich JF. A comparison of tonsillar size and oropharyngeal dimensions in children with adenotonsillar hypertrophy. Int J Pediatr Otorhinolaryngol. 1987;13(2):149-56.
20. Standards and indications for cardiopulmonary sleep studies in children. American Thoracic Society. Am J Respir Crit Care Med. 1996;153(2):866-78.
21. Kwok KL, Ng DK, Cheung YF. BP and arterial distensibility in children with primary snoring. Chest. 2003;123(5):1561-6.
22. Marcus CL, Greene MG, Carroll JL. Blood pressure in children with obstructive sleep apnea. Am J Respir Crit Care Med. 1998;157(4 Pt 1):1098-103.
23. Li AM, Chan MH, Chan DF, Lam HS, Wong EM, So HK, et al. Insulin and obstructive sleep apnea in obese Chinese children. Pediatr Pulmonol. 2006;41(12):1175-81.
24. Tauman R, O'Brien LM, Ivanenko A, Gozal D. Obesity rather than severity of sleep-disordered breathing as the major determinant of insulin resistance and altered lipidemia in snoring children. Pediatrics. 2005;116(1):e66-73.
25. Hotamisligil GS. Inflammatory pathways and insulin action. Int J Obes Relat Disord. 2003;27(Suppl 3):S53-5.
26. Morrison JA, Friedman LA, Harlan WR, Harlan LC, Barton BA, Schreiber GB, et al. Development of the metabolic syndrome in black and white adolescent girls: a longitudinal assessment. Pediatrics. 2005;116(5):1178-82.
1. Mestrado pela UNIFESP (Médica Otorrinolaringologista).
2. Médica Otorrinolaringologista.
3. Mestrado pela UNIFESP (Médico Otorrinolaringologista).
4. Doutorado pela UNIFESP (Médica Assistente da UNIFESP).
5. Pós-doutorado pela UNIFESP (Professora Adjunta da UNIFESP).
6. Doutorado pela UNIFESP (Professor Adjunto na UNIFESP).
UNIFESP.
Endereço para correspondência:
Daniele de Oliveira Soares Stefanini
Rua Itapeva, nº 500, 10º andar, conjunto D, Bela Vista
São Paulo - SP. Brasil. CEP: 01332-000
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 7 de novembro de 2011. cod. 8889.
Artigo aceito em 1 de julho de 2012.