Ano: 2011 Vol. 77 Ed. 3 - Maio - Junho - (17º)
Seção: Artigo Original
Páginas: 373 a 379
Efeito da dexametasona sobre sangramento, vômito e náusea pós-amigdalectomia
The effect of dexamethasone on post-tonsillectomy nausea, vomiting and bleeding
Autor(es): Jochen P. Windfuhr1; Yue-Shih Chen2; Evan J. Propst3; Christian Güldner4
Palavras-chave: amigdalectomia, complicações pósoperatórias, dexametasona, hemorragia.
Keywords: dexamethasone, hemorrhage, postoperative complications, tonsillectomy.
Resumo:
É conhecido o impacto da administração de dexametasona sobre a morbidade no pós-operatório de amigdalectomia. Objetivo: Recalcular os valores séricos para dexametasona quando administrada em doses fixas e avaliar seus efeitos sobre as taxas de náusea, vômito e sangramento no pós-operatório de amigdalectomia. Materiais e Métodos: Analisamos os prontuários de 272 crianças (idades entre 2-15 anos) submetidas a amigdalectomias. As taxas de náusea, vômitos e sangramentos foram calculadas para a dexametasona em geral e em diferentes doses (0 mg/kg; <0,15 mg/kg; >0,15 mg/kg). Tipo de Estudo: Coorte retrospectivo. Resultados: A dexametasona foi administrada em 121 crianças (43,7%), baseado na preferência do anestesista (dose média: 0,2 +/- 0,12 mg/kg; variação: 0,04 - 0,62 mg/kg). Não houve diferença significativa em termos de náuseas e vômitos (p=0,953) ou sangramento (p=0,827) entre os grupos de pacientes que receberam e não receberam dexametasona. Mesmo a estratificação em três grupos de diferentes concentrações de dexametasona não identificou risco dose-dependente de náusea ou vômito pós-operatório (p=0,98) ou sangramento (p=0,71). Conclusão: Pelo menos sob condições não-controladas normais da clínica, a dexametasona parece não ter efeito sobre a incidência de náuseas, vômito ou sangramento após amigdalectomia.
Abstract:
It has been stated, that the administration of Dexamethasone has an impact on the morbidity following tonsillectomy. Objective: To re-calculate the blood values for Dexamethasone when given as fixed doses and to evaluate the effect of Dexamethasone on post-operative nausea, vomiting and bleeding rates following tonsillectomy. Materials and methods: The charts of 272 children (2-15 years) who had undergone tonsillectomy were analyzed. The rates of post-operative nausea, vomiting and bleeding in relation to Dexamethasone were calculated-in general and different doses (0 mg/kg, <0.15 mg/kg, >0.15 mg/kg). Study design: Retrospective cohort study. Results: Dexamethasone was administered in 121 children (43.7%) according to the preference of the anesthesist (mean dose: 0.2 +/- 0.12 mg/kg; range: 0.04 - 0.62 mg/kg). There was no significant difference in nausea and vomiting (p=0.953) or bleeding (p=0.827) across groups receiving or not receiving Dexamethasone. Stratification into three different groups of Dexamethasone concentration also did not identify a dose-related risk of postoperative nausea or vomiting (p=0.98) or bleeding (p=0.71). Conclusion: At least under common non-controlled conditions in the clinic, Dexamethasone does not appear to have an effect on nausea or vomiting or bleeding following tonsillectomy.
![]()
INTRODUÇÃO
Várias meta-análises que pesquisaram a morbidade pós-amigdalectomia mostraram que, sob condições controladas, uma única dose endovenosa de dexametasona (DX) representa um método eficaz, seguro e barato para se reduzir a incidência de náusea e vômitos no pós-operatório (NVPO) de amigdalectomia em crianças1-5. Infelizmente, há grande variabilidade entre esses estudos no que diz respeito ao seu tipo, técnica cirúrgica, método usado para hemostasia e idade dos pacientes. Recentemente, Czarnetky et al.6 identificaram uma elevada taxa dose-dependente de hemorragia pós-amigdalectomia após a administração de DX. Nesse estudo, 50 crianças receberam placebo ou uma das três diferentes concentrações de DX (0,05; 0,15 ou 0,5 mg/kg). Nenhum dos pacientes do grupo placebo necessitou intervenção cirúrgica para hemostasia, enquanto todas as crianças do grupo DX precisaram de intervenção cirúrgica com propósitos hemostáticos (5,7%; 2%; 8%, respectivamente). Na instituição primária da pesquisa, a decisão de se administrar dexametasona durante amigdalectomia é determinada pela preferência pessoal do anestesista. A meta do presente estudo foi determinar os efeitos da dexametasona sobre náusea e vômitos e sangramento após amigdalectomia a partir de uma situação clínica, assim melhor mimetizando quais efeitos a DX administrada rotineiramente teria na prática. Assim, calculamos os valores séricos exatos de DX em relação ao peso individual do paciente nesse estudo para esclarecer se os valores variariam significativamente nessa população de pacientes ou não. Isso limitaria o valor das conclusões tiradas a partir de estudos nos quais a dexametasona foi administrada em doses fixas. Além disso, pesquisamos se a administração de DX resultaria em menor taxa de NVPO, mas não a ponto de causar maior incidência de sangramento.
MATERIAIS E MÉTODOS
Esse estudo cumpriu as exigências da IRB. Estudamos os prontuários de 385 pacientes pediátricos consecutivos (idade < 15 anos) submetidos a amigdalectomias, com ou sem adenoidectomia, entre janeiro de 2008 e dezembro de 2009. As crianças submetidas à amigdalectomia parcial (intracapsular) (n=108) ou que receberam metilprednisolona ao invés de DX (n=5) foram excluídas do estudo. Os pacientes incluídos (n=272) não padeciam de outras comorbidades e não tinham predisposição a sangramentos, tais como imunodeficiências, diabetes, gastrite, úlcera péptica, doença cardiovascular, arterial, hipertensão, doença renal ou maligna, nem estavam sob tratamento com corticosteroides, antieméticos, anti-histamínicos ou aspirina.
Os pacientes foram pré-medicados com midazolam oral 0,5 mg/kg, 20 minutos antes de serem levados à sala de cirurgia. Todos os procedimentos foram executados sob anestesia geral com intubação orotraqueal. A anestesia foi induzida com um de três agentes voláteis: isofluorano, sevofluorano, desfluoroano. O paciente teve uma veia cateterizada e solução de Ringer-lactato foi infundida após o reflexo palpebral ter desaparecido. A intubação endotraqueal foi facilitada com o uso de 0,1 mg/kg de pancurônio. Todas as crianças receberam paracetamol: 15 mg/kg via retal. Fentanil foi administrado de acordo com a preferência do anestesista. A anestesia foi mantida por meio de agentes anestésicos voláteis ou propofol com oxigênio e N2O. Anestésicos locais com adrenalina não foram usados durante a cirurgia. Amigdalectomias foram feitas usando técnica cruenta, dissecando as amígdalas com tesoura e descoladores, e removendo o polo inferior com uma alça de serra nó. A hemostasia foi obtida por meio de ligadura por sutura e cauterização quando necessário. A dexametasona foi administra de acordo com a preferência de cada anestesista em uma base de caso a caso. Os pacientes receberam uma ampola cheia (8mg) ou meia ampola (4mg) de dexametasona. A dose de DX administrada foi retrospectivamente calculada para cada paciente (mg/kg).
As crianças foram extubadas na sala de cirurgia e levadas para a unidade de observação pós-operatória quando acordadas e respondendo a estímulos verbais. Elas foram monitoradas de perto durante 2 horas e levadas à enfermaria quando seus sinais vitais estavam estáveis, a dor controlada e não tinham mais sangramento, nem vômitos. Piritramida foi administrada em 103 crianças que necessitaram para controle adicional da dor na unidade de recuperação pós-operatória.
Os pacientes ficaram internados por 4 dias a mais. Episódios de náusea e vômitos pós-operatórios e sangramentos foram documentados. A análise estatística foi feita usando o pacote estatístico SPSS (SPSS 16.0.2 para Windows). Dados não paramétricos foram analisados usando o teste qui quadrado para dados categóricos e o teste de Mann-Whitney-U- para dados contínuos com nível de significância estabelecido em p <0,05. Além de analisar os efeitos das doses previamente mencionadas de DX sobre o vômito, náuseas e sangramento pós-amigdalectomia, tentamos determinar uma dose de DX acima da qual o risco de náusea, vômitos e sangramento pós-operatório estariam reduzidos.
RESULTADOS
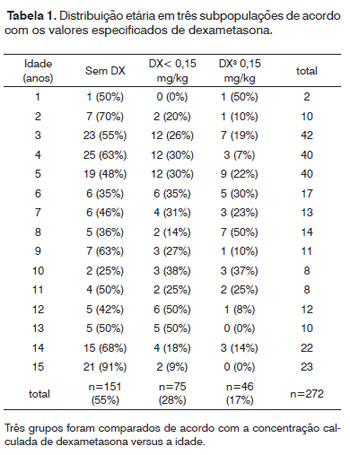
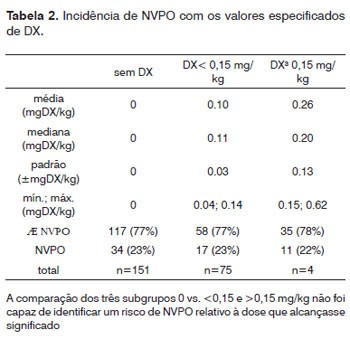
Houve 272 crianças incluídas nesse estudo (129 meninos e 143 meninas). A idade média dos pacientes foi de 7,43 +/-4,3 anos (variação 2 - 15 anos). A DX foi administrada a 121 (43,7%) crianças como dose plena ou meia-dose. A dose média de DX administrada (calculada retrospectivamente com base no peso) foi de 0,2 +/- 0,12 mg/kg (variação de 0,04 - 0,62 mg/kg). Cinco das crianças que foram excluídas desse estudo receberam altas doses de metilprednisolona (100 ou 250 mg) ao invés de DX. 62 dos 272 pacientes (22,8%) tiveram náusea ou vômito, 28 dos quais (45,2%) haviam recebido DX. Não houve diferença significativa em termos de NVPO entre os grupos que receberam e não receberam DX (p=0,953). Análises mais profundas revelaram que 6 dos 272 pacientes (2,2%) tiveram náusea sem vômito, 4 dos quais haviam recebido DX (doses de 0,05; 0,12; 0,15 e 0,17 mg/kg). Não houve diferenças em termos de náuseas entre os grupos recebendo DX (teste qui-quadrado, p=0,827). 56 de 272 pacientes (20,6%) tiveram vômito sem náusea, 24 dos quais (42,9%) receberam DX (dose média 0,16 +/-0,09 mg/kg, variação entre 0,07 - 0,44 mg/kg). Não houve diferenças em termos de vômitos entre os grupos que receberam e não receberam DX (teste qui-quadrado, p=0,953). A avaliação dos efeitos da dose de DX (0 vs. <0,15 vs. >0,15 mg/kg) sobre náusea ou vômito pós-operatório não revelou diferenças entre os grupos (teste qui-quadrado, p=0,98; Tabelas 1 e 2). 79 crianças receberam 1µg/kg de fentanil, enquanto 198 crianças não receberam. A anestesia foi mantida por meio de agentes voláteis e oxigênio como agentes únicos para manter a anestesia em 135 crianças com (n=220) ou sem (n=57) N2O. A anestesia foi mantida com propofol em 142 pacientes, com (n=118) ou sem (n=24) agentes voláteis, com (n=98) ou sem (n=44) N2O. 229 das 272 crianças receberam piritramida durante a cirurgia, das quais 104 receberam DX (45,4%). Piritramida não foi administrada em 48 dos 272 pacientes, dos quais 22 receberam dexametasona (45,8%). Os efeitos da DX na prevenção de náuseas não foram estatisticamente significativos (p=0,827; qui quadrado). Não houve associação significativa entre a náusea e/ou vômito pós-operatório e medicamentos anestésicos tais como fentanil (p=0,07), piritramida (p=0,026) ou N20 (p=0,406).
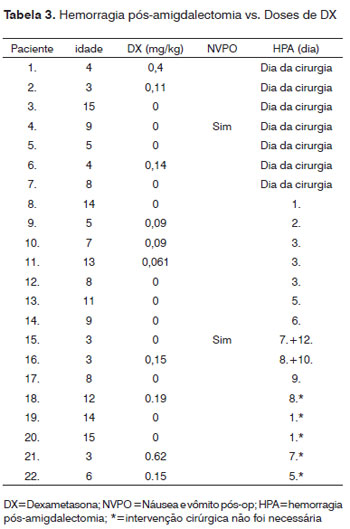
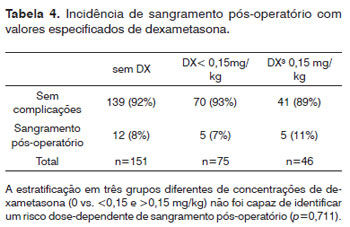
Hemorragia pós-amigdalectomia ocorreu em 22 pacientes; intervenção cirúrgica foi necessária em 17 de 272 pacientes (6,3%); 7 dos quais (41,2%) receberam DX (Tabela 3). Sangramento primário (<24 h) foi documentado em 7 casos e sangramento secundário (>24 h) em 10 crianças. Duas crianças tiveram mais de um episódio de sangramento secundário (7/12 e 8/10º dia de pós-operatório, respectivamente). Uma dessas crianças recebeu 0,15 mg de DX/kg, a segunda não recebeu DX. Não houve diferença na hemorragia pós-operatória entre os grupos que receberam e que não receberam DX (p=0,827). A avaliação dos efeitos da dose de DX sobre a hemorragia pós-amigdalectomia não identificou risco relacionado à dose de sangramento pós-operatório (p=0,711; Tabela 4). Não conseguimos determinar uma dose de corte de DX acima da qual o risco de náusea, vômitos e sangramento no pós-operatório estaria aumentado por causa de uma grande variabilidade nas doses de DX administrada.
DISCUSSÃO
Estudos anteriores que investigaram os efeitos de dexametasona endovenosa sobre náusea e vômitos pós-amigdalectomia encontraram resultados promissores2, 6-20. Nesses estudos, a DX foi comumente administrada como dose única endovenosa antes da dissecção das amígdalas, nas doses de 421; 822;1023 ou 20 mg24, ou as doses foram relacionadas ao peso corporal, variando entre 0,1525-27; 0,56; 13; 14; 18; 19; 28; 29; 0,730 a 17; 9; 10; 17; 31; 32 mg/kg. Em alguns estudos, as doses de 811; 13; 26; 29; 33; 1010; 1228; 34; 1531; 169; 19; 206; 257; 30; 2432 ou 50 mg17 foram usadas com o propósito adicional de reduzir a dor pós-operatória6; 7; 9; 10; 12; 14-17; 19; 20; 22; 24; 25, 35-38. Infelizmente, há grande variabilidade entre os estudos, tornando difícil chegar a alguma conclusão.
Czarnetzki et al. foram os primeiros a relatar um elevado risco dose-dependente de hemorragia pós-amigdalectomia após administração de DX.6 Os pacientes desse estudo receberam placebo ou três diferentes concentrações de DX (0,05; 0,15 ou 0,5 mg/kg). Devido à grande variabilidade na dose de DX administrada no presente estudo, decidimos primeiro determinar se houve qualquer efeito da dexametasona sobre o vômito ou náusea pós-operatórios ou sangramento e, em seguida, investigar a relação dose-resposta da DX usando valores de corte semelhantes àqueles usados por Czarnetzki (0 mg/kg, <0,15 mg/kg; >0,15 mg/kg). Contrariamente a condições padronizadas e, até artificiais, de estudos contemporâneos, nosso estudo caso-controle avaliou os desfechos após amigdalectomia sob condições clínicas cotidianas. Uma vez que as diretrizes relacionadas à administração de DX não estão ainda padronizadas em nossa instituição e a decisão de administrar dexametasona repousa nas mãos do anestesiologista, foi possível conduzir um estudo caso-controle retrospectivo.
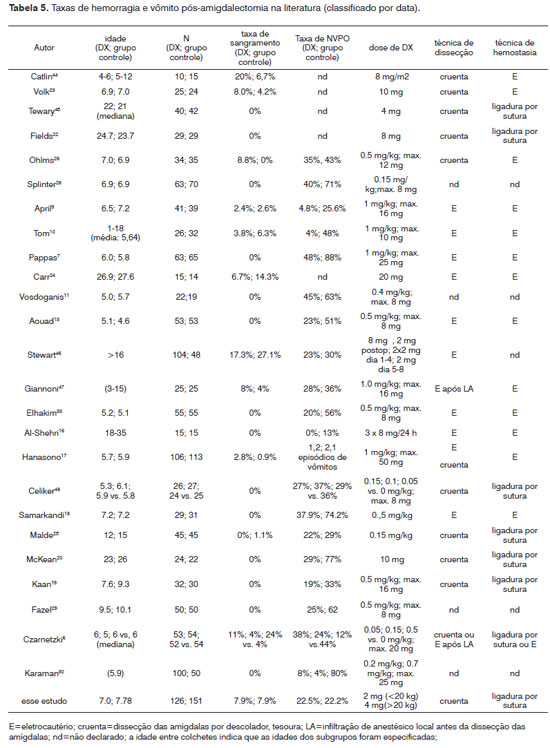
O presente estudo incluiu 272 crianças com idade média de 7,43 anos, que é comparável à maioria dos estudos publicados na literatura (Tabela 4).
Quando administrada, a dose média de DX foi de 0,2 mg/kg, com uma faixa de variação entre 0,04 e 0,62 mg/kg por dose. Aqueles autores20-24 que administraram dexametasona, não em relação ao peso, mas como dose fixa, não calcularam a dose efetiva. Os resultados do presente estudo indicam que a dose efetiva é significativamente influenciada pelo peso, mesmo em uma população pediátrica que possui comparação com estudos mais sofisticados. A dose efetiva mínima de 0,2 mg/kg pode ser mais baixa do que aquela calculada na maioria dos estudos (Tabela 4). Entretanto, há evidências de que concentrações séricas mais altas não estão associadas a maiores benefícios32.
A taxa de náusea e vômito pós-operatórios no presente estudo foi de 23% com ou sem DX. Esta taxa é menor do que aquela relatada para grupos comparáveis (Tabela 5). Não houve diferença em termos de NVPO entre os grupos que receberam e aqueles que não receberam DX no presente estudo. Esse achado é corroborado por vários estudos prospectivos bem formatados25, 28, 37, 39, 40 e refutado por outros25, 28, 37, 39, 40. Por exemplo, os resultados contrastam com aqueles de Karaman, que encontrou um decréscimo dose-dependente nas taxas de NVPO após a administração de DX30. Apesar de as doses de DX do presente estudo (0,62 mg/kg) não chegarem a concentrações altas como aquelas administradas por Karaman (0,7 mg/kg), as doses do nosso estudo foram bem próximas daquelas nas quais se esperaria ver algum efeito. Esse raciocínio é corroborado por Kim et al.31, que também relataram, em um estudo randomizado, duplo cego e prospectivo com 125 crianças, que as doses de 0,0625 mg/kg; 0,125; 0,25; 0,5 e 1 mg/kg são igualmente eficazes na redução das taxas de náusea e vômitos pós-operatórios.
A taxa de hemorragias pós-amigdalectomia que necessitou reintervenção no presente estudo foi de 6,3%. Quando os cinco pacientes que tiveram episódios mais discretos de sangramento foram incluídos, a taxa de sangramento pós-amigdalectomia aumentou para 8,1%. As taxas variam significativamente na literatura (Tabela 4), que podem também resultar de diferentes técnicas cirúrgicas, tempo de acompanhamento e diferentes definições de hemorragia pós-amigdalectomia. A taxa de hemorragia pós-amigdalectomia no presente estudo foi mais alta do que aquelas relatadas anteriormente (41, 42), que parecem relacionadas ao uso de eletrocautério para disseção ou hemostasia. Não houve diferenças nas taxas de hemorragia pós-amigdalectomia entre os grupos que receberam e aqueles que não receberam DX no presente estudo, que é apenas parcialmente corroborado por outros autores (Tabela 4).
Vômito pós-operatório foi associado a apenas 1 dos 22 casos com sangramento importante (5.4%) e em nenhum caso com sangramento discreto, sugerindo que o vômito em si não é um provável fator de risco para hemorragia pós-operatória. Isso contrasta com relatos prévios de vômito causando excessiva hemorragia43.
O atual estudo possui algumas limitações que precisam ser consideradas. Primeiro, esse é um estudo retrospectivo observacional. Apesar dos relatos virem de uma situação clínica e, portanto, melhor representa os efeitos da dexametasona rotineiramente administrada na prática, seu ponto fraco é que outros fatores que podem influenciar a náusea e vômito pós-operatórios não são controlados. Entretanto, análise multivariada ANOVA não conseguiu detectar a dexametasona ou um dos vários agentes anestésicos como fator de risco para vômito e náusea pós-operatórios na amostra de nosso estudo (dados não exibidos). Em segundo lugar, temos a grande variabilidade da dose de DX administrada. Em uma tentativa de superar essa limitação, as doses de DX foram estratificadas em três grupos, para análise. Apesar dos valores de estratificação terem sido selecionados com base em valores previamente relatados, a análise baseada em diferentes valores de corte pode gerar resultados diferentes. Não conseguimos detectar uma dose de corte de DX acima da qual o risco de náusea, vômitos ou sangramento pós-operatório estaria aumentado, devido à grande variabilidade de doses administradas de dexametasona.
CONCLUSÃO
A administração de doses fixas de dexametasona resulta em diferentes valores séricos (fator 15,5). Pelo menos sob condições não controladas na clínica, a dexametasona parece não ter efeito sobre náusea, vômitos e sangramento no pós-operatório de amigdalectomia.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Steward DL, Welge JA, Myer CM. Steroids for improving recovery following tonsillectomy in children. Cochrane Database Syst Rev.2003(1):CD003997.
2. Bolton CM, Myles PS, Nolan T, Sterne JA. Prophylaxis of postoperative vomiting in children undergoing tonsillectomy: a systematic review and meta-analysis. Br J Anaesth.2006;97(5):593-604.
3. Afman CE, Welge JA, Steward DL. Steroids for post-tonsillectomy pain reduction: meta-analysis of randomized controlled trials. Otolaryngol Head Neck Surg.2006;134(2):181-6.
4. Steward DL, Welge JA, Myer CM. Do steroids reduce morbidity of tonsillectomy? Meta-analysis of randomized trials. Laryngoscope.2001;111(10):1712-8.
5. Goldman AC, Govindaraj S, Rosenfeld RM. A meta-analysis of DXmethasone use with tonsillectomy. Otolaryngol Head Neck Surg.2000;123(6):682-6.
6. Czarnetzki C, Elia N, Lysakowski C, Dumont L, Landis BN, Giger R, et al. DXmethasone and risk of náusea and vomiting and postoperative bleeding after tonsillectomy in children: a randomized trial. Jama.2008Dec 10;300(22):2621-30.
7. Pappas AL, Sukhani R, Hotaling AJ, Mikat-Stevens M, Javorski JJ, Donzelli J, et al. The effect of preoperative DXmethasone on the immediate and delayed postoperative morbidity in children undergoing adenotonsillectomy. Anesth Analg.1998;87(1):57-61.
8. Splinter W, Roberts DJ. Prophylaxis for vomiting by children after tonsillectomy: DXmethasone versus perphenazine.Anesth Analg.1997;85(3):534-7.
9. April MM, Callan ND, Nowak DM, Hausdorff MA. The effect of intravenous DXmethasone in pediatric adenotonsillectomy. Arch Otolaryngol Head Neck Surg.1996;122(2):117-20.
10. Tom LW, Templeton JJ, Thompson ME, Marsh RR. DXmethasone in adenotonsillectomy. Int J Pediatr Otorhinolaryngol.1996;37(2):115-20.
11. Vosdoganis F, Baines DB. The effect of single dose intravenous DXmethasone in tonsillectomy in children. Anaesth Intensive Care.1999;27(5):489-92.
12. Palme CE, Tomasevic P, Pohl DV. Evaluating the effects of oral prednisolone on recovery after tonsillectomy: a prospective, double-blind, randomized trial. Laryngoscope.2000;110(12):2000-4.
13. Aouad MT, Siddik SS, Rizk LB, Zaytoun GM, Baraka AS. The effect of DXmethasone on postoperative vomiting after tonsillectomy. Anesth Analg.2001;92(3):636-40.
14. Elhakim M, Ali NM, Rashed I, Riad MK, Refat M. DXmethasone reduces postoperative vomiting and pain after pediatric tonsillectomy. Can J Anaesth.2003;50(4):392-7.
15. Kaygusuz I, Susaman N. The effects of DXmethasone, bupivacaine and topical lidocaine spray on pain after tonsillectomy. Int J Pediatr Otorhinolaryngol.2003;67(7):737-42.
16. Al-Shehri AM. Steroid therapy for post-tonsillectomy symptoms in adults: a randomized, placebo-controlled study. Ann Saudi Med.2004;24(5):365-7.
17. Hanasono MM, Lalakea ML, Mikulec AA, Shepard KG, Wellis V, Messner AH. Perioperative steroids in tonsillectomy using electrocautery and sharp dissection techniques. Arch Otolaryngol Head Neck Surg.2004;130(8):917-21.
18. Samarkandi AH, Shaikh MA, Ahmad RA, Alammar AY. Use of DXmethasone to reduce postoperative vomiting and pain after pediatric tonsillectomy procedures. Saudi Med J.2004;25(11):1636-9.
19. Kaan MN, Odabasi O, Gezer E, Daldal A. The effect of preoperative DXmethasone on early oral intake, vomiting and pain after tonsillectomy. Int J Pediatr Otorhinolaryngol.2006;70(1):73-9.
20. McKean S, Kochilas X, Kelleher R, Dockery M. Use of intravenous steroids at induction of anaesthesia for adult tonsillectomy to reduce post-operative náusea and vomiting and pain: a double-blind randomized controlled trial. Clin Otolaryngol.2006;31(1):36-40.
21. Tewary AK, Cable HR, Barr GS. Steroids and control of post-tonsillectomy pain. J Laryngol Otol.1993;107(7):605-6.
22. Fields M, Cabraal D, Dawes P. The effect of DXmethasone on post operative pain following tonsillectomy in adults. Aust J Otolaryngol.1994;1:426-9.
23. Volk M, Martin P, Brodsky L, Stanievich J, Ballou M. The effects of preoperative steroids on tonsillectomy patients. Otolaryngol Head Neck Surg.1993;109(4):726-30.
24. Carr MM, Williams JG, Carmichael L, Nasser JG. Effect of steroids on posttonsillectomy pain in adults. Arch Otolaryngol Head Neck Surg.1999;125(12):1361-4.
25. Malde AD, Sonawane VS, Jagtap SR. Effect of DXmethasone on post tonsillectomy morbidities. . Indian J Anaesth.2005;49:202-7
26. Splinter WM, Roberts DJ. DXmethasone decreases vomiting by children after tonsillectomy. Anesth Analg.1996;83(5):913-6.
27. Erdem AF, Yoruk O, Alici HA, Cesur M, Atalay C, Altas E, et al. Subhypnotic propofol infusion plus DXmethasone is more effective than DXmethasone alone for the prevention of vomiting in children after tonsillectomy. Paediatr Anaesth.2008;18(9):878-83.
28. Ohlms LA, Wilder RT, Weston B. Use of intraoperative corticosteroids in pediatric tonsillectomy. Arch Otolaryngol Head Neck Surg.1995;121(7):737-42.
29. Fazel MR, Yegane-Moghaddam A, Forghani Z, Aghadoost D, Mahdian M, Fakharian E. The effect of DXmethasone on postoperative vomiting and oral intake after adenotonsillectomy. Int J Pediatr Otorhinolaryngol.2007;71(8):1235-8.
30. Karaman M, Ilhan AE, Dereci G, Tek A. Determination of optimum dosage of intraoperative single dose DXmethasone in pediatric tonsillectomy and adenotonsillectomy. Int J Pediatr Otorhinolaryngol. 2009;73(11):1513-5.
31. Kim MW, Lee JH, Lee SC. The effect of DXmethasone in tonsillectomy. . Korean J Otolaryngol.1998;41:783-7.
32. Kim MS, Cote CJ, Cristoloveanu C, Roth AG, Vornov P, Jennings MA, et al. There is no dose-escalation response to DXmethasone (0.0625-1.0 mg/kg) in pediatric tonsillectomy or adenotonsillectomy patients for preventing vomiting, reducing pain, shortening time to first liquid intake, or the incidence of voice change. Anesth Analg.2007;104(5):1052-8, tables of contents.
33. Elhakim M, Ali N, Rashed I, Riad M, Refat M. DXmethasone reduces postoperative vomiting and pain after pediatric tonsillectomy. Can J Anaesth. 2003;50(4):392-7.
34. Egeli E, Akkaya S. The effect of peritonsillar corticosteroid infiltration in tonsillectomy. Auris Nasus Larynx. 1997;24(2):179-83.
35. Smith JP, King JT, Gershon NI, Fisher WR. Alleviation of Pain and Prevention of Infection after Tonsillectomy. a Controlled Clinical Study of a Novel Injectable Combination. Trans Am Acad Ophthalmol Otolaryngol. 1964;68:65-9.
36. Liu CM, Su CY. Post-operative pain control with topical steroid injection after hot dissection tonsillectomy. J Laryngol Otol. 1996;110(11):1038-40.
37. Stewart R, Bill R, Ullah R, McConaghy P, Hall SJ. DXmethasone reduces pain after tonsillectomy in adults. Clin Otolaryngol Allied Sci. 2002;27(5):321-6.
38. Anderson HA, Rice BJ, Cantrell RW. Effects of injected deposteroid on posttonsillectomy morbidity: a double-blind study. Arch Otolaryngol. 1975;101(2):86-8.
39. Catlin FI, Grimes WJ. The effect of steroid therapy on recovery from tonsillectomy in children. Arch Otolaryngol Head Neck Surg. 1991;117(6):649-52.
40. Kim MW, Lee JH, Lee SC. The effect of DXmethasone in tonsillectomy. Korean J Otolaryngol. 1998;41:783-7.
41. Windfuhr JP, Chen YS. Incidence of post-tonsillectomy hemorrhage in children and adults: a study of 4,848 patients. Ear Nose Throat J. 2002;81(9):626-8, 30, 32 passim.
42. Windfuhr JP, Chen YS. Hemorrhage following pediatric tonsillectomy before puberty. Int J Pediatr Otorhinolaryngol.2001 May 11;58(3):197-204.
43. Windfuhr JP, Schloendorff G, Baburi D, Kremer B. Serious post-tonsillectomy hemorrhage with and without lethal outcome in children and adolescents. Int J Pediatr Otorhinolaryngol.2008;72(7):1029-40.
44. Catlin F, Grimes W. The effect of steroid therapy on recovery from tonsillectomy in children. Arch Otolaryngol Head Neck Surg.1991;117(6):649-52.
45. Tewary A, Cable H, Barr G. Steroids and control of post-tonsillectomy pain. J Laryngol Otol.1993;107(7):605-6.
46. Stewart R, Bill R, Ullah R, McConaghy P, Hall S. DXmethasone reduces pain after tonsillectomy in adults. Clin Otolaryngol. 2002;27(5):321-6.
47. Giannoni C, White S, Enneking FK. Does DXmethasone with preemptive analgesia improve pediatric tonsillectomy pain? Otolaryngol Head Neck Surg.2002;126(3):307-15.
48. Celiker V, Celebi N, Canbay O, Basgul E, Aypar U. Minimum effective dose of DXmethasone after tonsillectomy. Paediatr Anaesth.2004;14(8):666-9.
1. Professor; M.D. Vice-Presidente.
2. Médico, Prática Particular.
3. Médico, Residente.
4. Médico, Residente.
Departamento de Otorrinolaringologia, Cirurgia Plástica e de Cabeça e Pescoço: Malteser Krankenhaus St. Anna; Albertus Magnus Str. 33; Duisburg, Alemanha.
Endereço para correspondência:
Professor Jochen P. Windfuhr, Médico
Departamento de Otorrinolaringologia, Cirurgia Plástica e de Cabeça e Pescoço; Kliniken Maria Hilf Mönchengladbach
Sandradstr. 43,
41061 Mönchengladbach; Alemanha
Tel. (+49) 2161-358-1601 - Fax: (+49) 2161-358-1603
E-mail: jochen.windfuhr@mariahilf.de
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 21 de agosto de 2010. cod. 7278
Artigo aceito em 27 de outubro de 2010.