Ano: 2011 Vol. 77 Ed. 3 - Maio - Junho - (13º)
Seção: Artigo Original
Páginas: 348 a 355
Polimorfismos no gene HTR2A relacionados à síndrome da apneia obstrutiva do sono
Polymorphisms in the 5-HTR2A gene related to obstructive sleep apnea syndrome
Autor(es): Vânia Belintani Piatto1; Thiago Bittencourt Ottoni de Carvalho2; Nely Silva Aragão De Marchi3; Fernando Drimel Molina4; José Victor Maniglia5
Palavras-chave: apneia do sono tipo obstrutiva, polimorfismo genético, receptor 5-ht1a de serotonina, serotonina.
Keywords: polymorphism genetic, receptor serotonin 5-ht2a, serotonin, sleep apnea obstructive.
Resumo:
A síndrome da apneia obstrutiva do sono (SAOS) é um dos distúrbios mais complexos do sono, envolvendo múltiplos fatores genéticos contribuintes para o fenótipo. A serotonina (5-HT) está envolvida na regulação de uma variedade de funções viscerais e fisiológicas, inclusive o sono. Polimorfismos no gene 5-HTR2A podem alterar a transcrição, afetando o número de receptores do sistema serotoninérgico, contribuindo para a SAOS. Objetivo: Investigar a prevalência dos polimorfismos T102C e -1438G/A no gene HTR2A em pacientes com e sem SAOS. Material e Método: Estudo molecular em 100 pacientes como casos-índice e em 100 como grupo controle, de ambos os gêneros. O DNA foi extraído de leucócitos de sangue periférico e realizada a amplificação das regiões que abrangem ambos os polimorfismos pelas técnicas da PCR-RFLP. Desenho do Estudo: Estudo de caso/controle em corte transversal. Resultados: Houve prevalência significativa do gênero masculino nos casos-índice em relação aos controles (p<0,0001). Para o polimorfismo T102C, não houve diferença genotípica significante entre casos e controles (p=1,000). Houve diferença significativa entre o genótipo AA do polimorfismo -1438G/A e pacientes com SAOS (OR:2,3; IC95%:1,20-4,38; p=0,01). Conclusão: Os mecanismos serotoninérgicos parecem estar relacionados a SAOS. Não há diferenças na prevalência do polimorfismo T102C entre os pacientes com SAOS e o grupo controle. Há evidências de associação entre o polimorfismo -1438G/A e a SAOS.
Abstract:
Obstructive sleep apnea syndrome (OSAS) is one of the most complex disorders of sleep; it involves several genetic factors that contribute to the phenotype. Serotonin (5-HT) regulates a variety of visceral and physiological functions, including sleep. Gene 5-HTR2A polymorphisms may change the transcription of several receptors in the serotoninergic system, thereby contributing to OSAS. Aim: To investigate the prevalence of T102C and -1438G/A polymorphisms in the 5-HTR2A gene of patients with and without OSAS. Material and Method: A molecular study of 100 indexcases and 100 controls of both genders. DNA was extracted from blood leukocytes samples and the regions that enclose both polymorphisms were amplified with PCR-RFLP. Study design: A crosssectional case study. Results: there was a significant prevalence of males in index cases compared to controls (p<0.0001). No significant genotypic differences between cases and controls were found in T102C polymorphisms (p=1.000).There were significant differences between the AA genotype of -1438G/A polymorphisms and patients with OSAS (OR:2.3; CI95%:1.20-4.38, p=0.01). Conclusion: Serotonergic mechanisms may be related to OSAS. There were no differences in the prevalence of T102C polymorphisms in patients with OSAS and the control group. There is evidence of an association between the -1438G /A polymorphism and OSAS.
![]()
INTRODUÇÃO
A síndrome da apneia obstrutiva é um distúrbio do sono muito comum, afetando cerca de 2% a 4% dos homens adultos de idade média e caracterizada pelo recorrente colapso, sono-induzido, das vias aéreas faríngeas, levando à hipoxemia e hipercapnia1. Múltiplos fatores genéticos podem, provavelmente, contribuir com a síndrome, uma vez que também são diversos os fatores componentes para o fenótipo2-5.
Alterações no controle do sistema nervoso central dos músculos das vias aéreas superiores são consideradas um importante componente da síndrome6. Dentre esses músculos, há o genioglosso, inervado por neurônios originados no núcleo hipoglosso no tronco encefálico, cujas contrações, durante a inspiração, contribuem para a efetiva ventilação pulmonar e pela manutenção da abertura das vias aéreas superiores durante a vigília e o sono7,8. Grupos de células serotoninérgicas e noradrenérgicas podem fazer padrões paralelos, estimulando diretamente as células motoras do nervo hipoglosso que regulam esses músculos dilatadores. Portanto, a ativação desses grupos celulares, aumenta a atividade do músculo genioglosso7-9.
É evidente que a serotonina (5-hidroxitriptamina, 5-HT), um neurotransmissor no sistema nervoso central, está envolvida na regulação de uma variedade de funções viscerais e fisiológicas, tais como o sono, apetite, termorregulação, percepção da dor, secreção hormonal e comportamento sexual. Anormalidades do sistema serotoninérgico têm sido implicadas em um grande número de doenças humanas, como depressão, cefaleia, epilepsia, comportamento obsessivo-compulsivo, disfunção têmporo-mandibular e distúrbios afetivos6-9.
A 5-HT também tem um importante papel na patência das vias aéreas superiores, pois excita os neurônios motores dessas vias e, também, promove uma excitação intrínseca nos neurônios motores do tronco encefálico. A atividade dos neurônios que suprem de 5-HT os neurônios motores declina com o sono, conforme a maioria dos estudos funcionais, que mostram que a 5-HT e neurônios serotoninérgicos têm um significante efeito excitatório nos neurônios motores respiratórios, ambos in vivo e in vitro e que os referidos neurônios, apresentam máxima atividade durante a vigília e mínima atividade durante o sono REM. O comportamento, relacionado ao sono, da 5-HT sobre os neurônios motores contribui para o colapso das vias aéreas superiores e consequente obstrução da respiração10,11.
A 5-HT atua por meio de uma grande família de receptores 5-HT e, dentre essa, há os receptores denominados 5-HT2 que compreendem três subtipos, 5-HT2A, 5-HT2B e 5-HT2C, os quais são semelhantes em termos de sua estrutura molecular, farmacologia e padrões dos sinais de transdução. Os subtipos 5-HT2A e 5-HT2C têm um importante papel na manutenção da estabilidade das vias aéreas superiores e da respiração normal, na obesidade12. O 5-HT2A, um dos subtipos de receptor da 5-HT, é predominantemente excitatório aos neurônios motores do hipoglosso e o subtipo 5-HT2C é excitatório para neurônios em várias áreas cerebrais. Embora poucas dessas respostas excitatórias tenham sido analisadas usando-se seletivos agentes dos subtipos de receptores, evidências sugerem que, em alguns desses casos, as respostas são mediadas pelos receptores 5-HT2A, enquanto outras envolvem os receptores 5-HT2C12.
A característica de todos os genes da família dos receptores 5-HT2 (denominados genes HTR2) é que eles têm dois introns (no caso dos genes 5-HTR2A e 5-HTR2B) ou três introns (gene 5-HTR2C) na sequência codificante, estando todos acoplados, positivamente, à fosfolipase C, além de mobilizar Ca2+ intracelular12. O gene 5-HTR2A está localizado no cromossomo 13 (13q14-q21), tendo uma sequência de aminoácidos relativamente alta, idêntica ao gene 5-HTR2C, embora seja mais baixa quando comparada ao gene 5-HTR2B. O gene 5-HTR2C está localizado no cromossomo X (Xq24)12.
Uma variante funcional promotora do gene 5-HTR2A pode, diferencialmente, alterar a transcrição afetando, desse modo, o número de receptores. Polimorfismos nos genes 5-HTR2 estão associados a várias doenças, inclusive à síndrome da apneia obstrutiva do sono, por afetarem o sistema serotoninérgico, contribuindo, portanto, ainda mais para o colapso das vias aéreas durante o sono. Os efeitos excitatórios do receptor 5-HT2C são de baixa magnitude e, embora o polimorfismo do gene 5-HTR2C seja funcional, o efeito de um alelo polimórfico ativo pode não ser suficiente para que esse polimorfismo esteja associado com o índice apneia/hipopneia, devido a menor dominância desse subtipo de receptores no núcleo do hipoglosso13,14. Em compensação, foi identificado, recentemente, um polimorfismo no gene 5-HTR2A, o qual é definido pela substituição T->C na posição nucleotídica 1028, além da identificação da substituição G->A, na posição -1438 da região promotora do gene9, em pacientes com a síndrome da apneia obstrutiva do sono.
OBJETIVO
Investigar a prevalência dos polimorfismos T102C e -1438G/A no gene 5-HTR2A, com o teste da Reação em Cadeia da Polimerase/ Polimorfismo no Comprimento de Fragmentos de Restrição (Polimerase Chain Reaction/ Restriction Fragment Lenght Polymorphism - PCR/RFLP), em amostra de pacientes com e sem a síndrome da apneia obstrutiva do sono.
MATERIAL E MÉTODO
De acordo com as Normas Regulamentadoras de Pesquisa em Seres Humanos, Resolução 196/96 do Ministério da Saúde, o presente estudo foi aprovado pelo Comitê de Ética em Pesquisa da Instituição (Parecer nº342/2006).
No período de 01/07/2008 a 30/06/20010 foi realizado um estudo de corte transversal no qual foram estudados 100 casos-índice com síndrome da apneia obstrutiva do sono (73 do gênero masculino e 27 do gênero feminino), com idade entre 23 e 70 anos e 100 pacientes do grupo-controle (40 do gênero masculino e 60 do gênero feminino), com idade entre 17 e 70 anos. Foram submetidos à completa anamnese para investigar presença de roncos, sono agitado, episódios de apneia noturna e sonolência diurna, uso de medicamentos, hipertensão arterial, estados depressivos. Os exames físicos, otorrinolaringológico e sistêmico foram realizados para se avaliar o Índice de Massa Corpórea (IMC), o diâmetro cervical, pesquisar tumores cervicais e afastar malformações craniofaciais, além dos exames das cavidades nasal e oral. Após esta avaliação clínica, os pacientes realizaram exames complementares gerais e específicos da SAOS, como a cefalometria, nasofibroscopia com manobra de Müeller e avaliação polissonográfica.
Para a seleção dos pacientes foram considerados os seguintes critérios:
Critérios de inclusão:
a) preencham os critérios A ou B, mais o C para o diagnóstico da síndrome:
A. sonolência diurna excessiva que não pode ser explicada por outros fatores.
B. dois ou mais dos seguintes critérios que não podem ser explicados por outros fatores:respiração ofegante ("gasping") durante o sono;
despertares recorrentes do sono;
sono não-reparador; fadiga diurna;
falta de concentração.
C. monitoramento durante a noite, demonstrando mais de 5 episódios de obstrução da respiração por hora, durante o sono. Esses eventos podem incluir qualquer combinação de apneia obstrutiva/hipopneia ou esforços respiratórios relacionados com despertares.
b) ausência de qualquer outra anormalidade somática e laboratorial, após realização dos exames físico geral e complementares.
c) ausência de dismorfismo craniofacial ou alterações têmporo-mandibular, investigados pelo exame físico específico.
d) ausência de dependência de drogas, alcoolismo, transtornos depressivos, demência, investigados pela anamnese e avaliações psiquiátricas.
e) ausência de síndromes genéticas aparentes, investigadas pelo exame físico genético-clínico.
f) presença ou não de outros casos na família.
g) idade máxima de 70 anos.
h) IMC < 35.
Critérios de exclusão:
a) Pacientes acima de 70 anos, pois a prevalência de apneia central do sono aumenta com o avançar da idade.
b) presença de distúrbios psiquiátricos.
c) alterações nas análises laboratoriais, nos exames físicos geral e específico.
d) não apresentarem os critérios mínimos para diagnóstico da síndrome.
e) IMC > 35.
Os pacientes do Grupo Controle foram selecionados com os mesmos critérios de inclusão e exclusão descritos para o Grupo com SAOS, exceto que o IAH (índice de apneia/hipopneia/hora) é de < 5.
Foram coletados os seguintes dados: idade à época da realização da polissonografia, Índice de Massa Corpórea (IMC) e índice de apneia/hipopneia (IAH), obtido pelos registros do aparelho de polissonografia (Stellat System QC, Harmonie TM, Canada). Os pacientes foram distribuídos nas seguintes faixas etárias: adolescência (11 a 17 anos), adulto jovem (18 a 40 anos), adulto (41 a 65 anos) e idoso (> 65 anos)15,16. Em relação ao índice da apneia/hipopneia (IAH), os pacientes foram agrupados na seguinte classificação: SAHOS leve (IAH de 5 a 15,9 eventos/hora), SAHOS moderada (IAH de 16 a 30 eventos/hora), SAHOS grave (IAH > 30 eventos/hora)17. Da mesma forma, em relação ao Índice de Massa Corpórea (IMC), os pacientes foram agrupados de acordo com a classificação da OMS: peso ideal (18,5-24,9 Kg/m2), sobrepeso (25,0-29,9 Kg/m2), obesidade Grau I (30,0-34,9 Kg/m2) e obesidade Grau II (35,0-39,9 Kg/m2)18. Foi estipulado o limite do IMC < 35, a fim de que maiores graus de obesidade não influenciassem nos níveis de IAH.
Investigação molecular
Foram coletados 4,0mL de sangue total em um tubo Vacutainer® contendo anticoagulante (EDTA), com prévia obtenção dos pacientes ou responsáveis. O DNA genômico foi extraído das amostras de sangue usando o Illustra Blood GenomicPrep Mini Spin Kit (GE Healthcare)TM , de acordo com o protocolo do fabricante.
Para se detectar ambos os polimorfismos T102C e -1438G/A, fragmentos do DNA nuclear que abrangem a região polimórfica no gene 5-HTR2A foram amplificados pela técnica da PCR, utilizando-se o Kit de PCR - FideliTaqTM PCR MasterMix (2X) (GE HEALTHCARE®). Para esta reação, foram utilizados dois pares de iniciadores ou "primers", que são oligonucleotídeos sintéticos. As sequências dos oligonucleotídeos dos "primers" e as condições para a reação da PCR foram de acordo com as descritas na literatura8,9.
Como produto da reação da PCR para o polimorfismo T102C, foi amplificado um fragmento de 342 pb, o qual, posteriormente, foi submetido à análise de restrição (RFLP), utilizando-se a enzima MspI (New England Biolabs) TM, por 2hs30min a 37ºC8. A digestão do fragmento de amostras homozigotas mutantes (CC) para o polimorfismo T102C (ambos os alelos mutantes) produz dois fragmentos de 217 pb e 125 pb, devido ao reconhecimento do sítio de restrição da enzima MspI, pela substituição das bases nitrogenadas T->C, na posição 102 do gene 5-HTR2A. As amostras heterozigotas (TC) para o polimorfismo, após a digestão enzimática, apresentam três fragmentos: de 342 pb (alelo selvagem-T), 217 e 125 pb (alelo mutante-C). As amostras sem o polimorfismo, portanto homozigotas normais (TT), têm apenas o fragmento de 342 pb, pois não há reconhecimento do sítio da enzima.
Do mesmo modo, para se detectar o polimorfismo -1438G/A, um fragmento de 469 pb obtido após a PCR foi submetido à análise de restrição (RFLP), utilizando-se a enzima MspI (New England Biolabs)Ò, por 2hs30min a 37ºC9. A digestão do fragmento de amostras homozigotas normais (GG) para o polimorfismo -1438G/A produz dois fragmentos de 243 pb e 226 pb, devido ao reconhecimento do sítio de restrição da enzima MspI. As amostras homozigotas mutantes (AA) para o polimorfismo têm apenas o fragmento de 469 pb, pois não há reconhecimento do sítio da enzima, pela substituição das bases nitrogenadas G->A na posição -1438 do gene 5-HTR2A e as amostras heterozigotas (GA) têm três fragmentos: de 469 pb (alelo mutante-A), 243 e 226 pb (alelo selvagem-G).
Os produtos de ambas as reações, PCR e RFLP, foram analisados por eletroforese em gel de agarose 2% em tampão TBE 1X, contendo brometo de etídio, na concentração de 0,5mg/mL, submetidos à iluminação ultravioleta, para confirmar o sucesso da reação e o gel, fotodocumentado.
Análises estatísticas
Os resultados foram submetidos previamente à estatística descritiva para determinação da normalidade. Foram utilizados o teste t bicaudal de Student para amostras independentes com distribuição normal e o teste de Mann-Whitney para amostras com distribuição não normal. Quando aplicáveis, foram utilizados o teste Chis-quare para comparação entre as variáveis e o odds ratio com intervalo de confiança de 95% (IC-95%). O nível de significância foi estabelecido em 5%. Foi realizada análise do Equilíbrio de Hardy-Weinberg para a distribuição genotípica.
Os testes estatísticos foram realizados usando o programa GraphPad InStat version 3.00, GraphPad Software Inc, San Diego California USA, www.graphpad.com.
RESULTADOS
Do total de 100 pacientes com apneia (casos-índice), 73 (73%) são do gênero masculino e 27 (27%) do gênero feminino. Em relação à faixa etária, a idade variou de 23 a 70 anos para o gênero masculino (Média M-50,1 anos; DP±12,5) e para o gênero feminino a idade variou de 43 a 65 anos (M-52 anos; DP±6,0). O IMC para o gênero masculino variou de 21,2 a 35 Kg/m2 (M-29,5 Kg/m2; DP±3,8) e para o gênero feminino variou de 21 a 35 Kg/m2 (M-28,6 Kg/m2; DP±3,5). Em relação ao IAH, este variou de 5,8 a 115 (M-37,5; DP±26,3) para o gênero masculino e para o feminino variou de 5,4 a 79 (M-19,6; DP±19,3).
Dos 100 pacientes do grupo controle, 40 (40%) são do gênero masculino e 60 (60%) são do gênero feminino. A faixa etária variou de 17 a 66 anos (M-46,1 anos; DP±12,3) para o gênero masculino e de 21 a 70 anos (M-43,6 anos; DP±11,7) para o feminino. O IMC para o gênero masculino variou de 20 a 34,6 Kg/m2 (M-26,8 Kg/ m2; DP±3,9) e de 20 a 35 Kg/m2 (M-27,1 Kg/m2; DP±4,0) para o feminino. O IAH variou de 0 a 4,9 (M-2,3; DP±1,5) para o gênero masculino e de 0 a 4,9 (M-1,6; DP±1,4) para o gênero feminino.
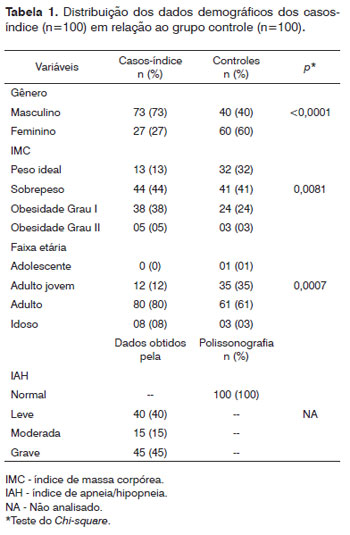
A Tabela 1 apresenta os dados demográficos dos 100 casos-índice e 100 controles e a Tabela 2 apresenta estes dados em média ± desvio padrão.
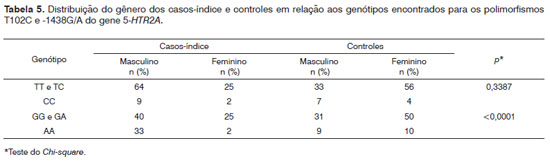
Houve maior prevalência do gênero masculino (73%) nos casos-índice e o gênero feminino foi o predominante no grupo controle em 60% dos casos, sendo esta relação significante (p<0,0001).
Em relação ao IMC, o grupo de pacientes com SAOS teve maior prevalência nas classificações de sobrepeso e obesidade Grau I, perfazendo o total de 82% dos casos, enquanto que o grupo controle teve a maior prevalência nas classificações de peso ideal e obesidade Grau I (73% do total), sendo esta diferença entre os grupos significante (p=0,0081).
Ambos os grupos, casos-índice e controles, tiveram a maior prevalência da idade nas faixas de adulto jovem e adulto, perfazendo o total de 92% e 96%, respectivamente. Não houve paciente adolescente nos casos-índice. A análise estatística para esta variável mostrou significância entre os casos-índice e controles (p<0,0001).
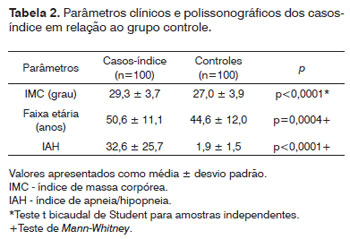
Conforme apresentado na Tabela 2, os casos-índice apresentaram os valores médios do IMC, da faixa etária e do IAH significativamente maiores, quando comparados aos valores médios do grupo controle.
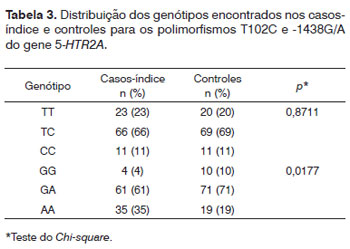
Os resultados moleculares encontrados e as comparações entre as variáveis obtidas no estudo estão apresentadas nas Tabelas 3 a 7.
As frequências alélicas T e C para os casos-índice foram T=0,56 e C=0,44 e para os controles foram T=0,545 e C=0,455, não apresentando diferença estatística entre os grupos (p=0,8406). As frequências alélicas G e A para os casos-índice foram G=0,345 e A=0,655 e para os controles G=0,455 e A=0,545, mostrando diferença estatística entre os grupos (p=0,0321).
Houve diferença estatística dos genótipos do polimorfismo -1438G/A encontrados nos casos-índice em relação ao grupo controle (p=0,0177).
As frequências genotípicas para o polimorfismo T102C não se encontram em equilíbrio de Hardy-Weinberg tanto para os casos-índice (χ2=11,511; p=0,00069) como para o grupo controle (χ2=15.309; p=0.00009). As frequências genotípicas para o polimorfismo -1438G/A não se encontram em equilíbrio de Hardy-Weinberg tanto para os casos-índice (χ2=12.229; p=0.00047) como para o grupo controle (χ2=18,628; p=0,00002).
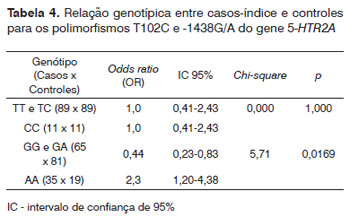
A Tabela 4 apresenta, em odds ratio, a relação dos genótipos encontrados no estudo entre casos-índice e controles.
Não houve diferença estatística dos genótipos TT e TC entre casos x controles, o mesmo ocorrendo para o genótipo CC, pois para estes genótipos ambos os grupos apresentaram a mesma frequência.
Apesar da alta frequência dos genótipos GG e GA em ambos os grupos, o grupo controle apresentou frequência significativamente maior em relação aos casos-índice. Mas, em relação ao genótipo AA, os casos-índice apresentaram frequência significantemente maior do mesmo em relação aos controles.
A prevalência do gênero masculino nos casos-índice em relação aos genótipos do polimorfismo -1438G/A foi significante quando comparada aos controles (p<0,0001).
Houve associação estatisticamente significante dos genótipos do polimorfismo -1438G/A com o IMC entre 25 e 35 Kg/m2 nos casos-índice em relação aos controles (p<0,0182).
Não houve associação de ambos os polimorfismos estudados e a gravidade da SAOS nos casos-índice.
DISCUSSÃO
O sistema serotoninérgico é um importante componente do sono e da abertura das vias aéreas durante o mesmo. Consequentemente, fatores que afetam as atividades desse sistema podem levar a distúrbios do sono e respiração. O receptor 5-HT2A é um componente essencial do sistema serotoninérgico, estando sua expressão sob controle gênico. Assim, polimorfismos de genes que codificam o receptor podem afetar o estado funcional do mesmo e, por sua vez, a atividade serotoninérgica9,12. Diante disso, o presente estudo teve como objetivos investigar a prevalência dos polimorfismos T102C e -1438G/A do gene 5-HTR2A em pacientes com e sem SAOS, pois até o momento não há trabalhos brasileiros sobre este tema, havendo somente dois estudos na literatura que relatam as frequências destes polimorfismos e a associação com a SAOS8,9, o que reforça a importância deste estudo.
Todos os indivíduos, de ambos os grupos do estudo, realizaram a polissonografia a fim de ser obtido o índice de apneia/hipopneia (IAH) que, pelo qual, foi possível o diagnóstico da presença ou não da SAOS enquadrando-os, respectivamente, em grupo com SAOS e grupo controle. Este critério foi rigorosamente seguido a fim de não se incluir pacientes, especialmente do grupo controle, com diagnóstico de exclusão de SAOS apenas por critérios clínicos, como realizado em outros estudos descritos na literatura6,8,9.
A SAOS é mais frequente em homens, encontrada em todas as faixas etárias, tornando-se mais prevalente com o avançar da idade1. Conforme a literatura, no presente estudo houve maior prevalência dos casos-índice no gênero masculino e na fase adulta, mas apenas 8% dos casos acima de 65 anos.
Em relação ao polimorfismo T102C, como o grupo controle apresentou a mesma frequência dos casos-índice para os genótipos TT/TC e CC, pode-se sugerir que não houve associação do polimorfismo T102C com o desenvolvimento da SAOS, sendo este resultado concordante com os descritos na literatura8,9. Embora o receptor 5-HT2A predominantemente contribua para a excitação da serotonina (5-HT) dentro do representativo núcleo motor das vias aéreas superiores, a falta de polimorfismos comuns ou modificações epigenéticas que alterem os níveis de RNA mensageiro do gene 5-HTR2A pode ser a razão para a ausência de associação do polimorfismo T102C com SAOS nesta população, além de ser considerado um polimorfismo silencioso e estar presente na mesma proporção no grupo controle8,9,13,14.
Mas o genótipo AA foi significantemente maior nos casos-índice, assim como os genótipos GG/GA no grupo controle, significando que, em relação ao polimorfismo -1438G/A, o genótipo AA pode estar associado com o desenvolvimento da SAOS na população do presente estudo, resultado este concordante com os da literatura8,9.Houve diferença significativa entre o gênero dos casos-índice e controles em relação aos genótipos do polimorfismo -1438G/A, o que não ocorreu com os genótipos do polimorfismo T102C. A comparação dos genótipos com o gênero foi realizada no estudo devido, conforme descrito na literatura, à maior prevalência da SAOS no gênero masculino1,6,9,19.
Não houve correlação entre o IAH, obtido pela polissonografia, e os genótipos de ambos os polimorfismos dos casos-índice, resultado este concordante com os da literatura8,9. Esta condição pode sugerir que outros mecanismos, além de polimorfismos no gene 5-HTR2A, estejam também envolvidos na fisiopatologia da SAOS. É evidente que a SAOS seja o fenótipo de um número de diferentes distúrbios, relacionados ou não, e resulte de uma complexa associação de genes e fatores modificadores e ambientais9. Essa pode ser uma explicação para a ausência da associação, estatisticamente significativa, entre ambos os polimorfismos analisados e os achados polissonográficos da amostra do presente estudo.
A variabilidade no tamanho das vias aéreas é provavelmente determinada por influências genéticas na estrutura óssea, tamanho da língua e do tecido tonsilar, assim como fatores adquiridos como a obesidade13,20-22. Embora polimorfismos do gene 5-HTR2A tenham um importante papel na atividade dos músculos dilatadores da faringe, outros fatores, tais como a característica cefalométrica e estruturas de tecidos moles podem ser determinantes na abertura das vias aéreas durante o sono8,23,24. No presente estudo, foram utilizados como critérios de inclusão a ausência de dismorfismo craniofacial ou alterações temporomandibular e IMC < 35 Kg/m2. Estes critérios foram rigorosamente seguidos a fim de se excluir estas variáveis e as outras descritas, que afetariam a patência das vias aéreas superiores. Diante do exposto, quando o IMC foi comparado aos genótipos de ambos os polimorfismos em relação aos casos-índice e controles, a relação do IMC entre 25 e 35 Kg/m2 foi significativa para os genótipos do polimorfismo -1438G/A nos casos-índice, resultado este concordante com os da literatura8,9,25 por ser decorrente do maior número de casos nesta faixa do IMC e não propriamente da influência do polimorfismo.
Em decorrência disto, o polimorfismo T102C parece não estar associado a SAOS nos pacientes do estudo quando comparado ao polimorfismo -1438G/A, o qual pode ser associado com a ocorrência da SAOS, na população estudada, especialmente nos pacientes do gênero masculino e com IMC entre 25 e 35 Kg/m2, devido à maior prevalência encontrada de pacientes nestas variáveis.
Estudos genéticos estão sendo realizados para esclarecer algumas das complexidades do sono e levar a novos enfoques para o tratamento de seus distúrbios25-27. Os genes estão, provavelmente, menos envolvidos nas mudanças de estado (non-REM->REM) observadas eletrofisiologicamente durante o ciclo do sono; eles estão, certamente, relacionados a determinar a ritmicidade circadiana e a homeostase do sono28. Os mais comuns distúrbios do sono resultam da interação de múltiplos genes e fatores ambientais. A compreensão do impacto dos fatores genéticos permitirá a elucidação da fisiopatologia destes distúrbios e fornecerá importantes indícios para possíveis esquemas terapêuticos25-27.
CONCLUSÕES
As técnicas moleculares PCR/RFLP permitiram a identificação dos polimorfismos T102C e -1438G do gene 5-HTR2A, colaborando para a investigação molecular da SAOS. Os mecanismos serotoninérgicos podem ser relacionados à SAOS. Não há diferenças na prevalência do polimorfismo T102C entre os pacientes com SAOS e o grupo controle. Há evidências de associação entre o polimorfismo -1438G/A e a SAOS.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Young T, Peppard P, Gottlieb D. The epidemiology of obstructive sleep apnoea: a population health perspective. Am J Respir Crit Care Med.2002;165:1217-39.
2. Palmer LJ, Redline S. Genomics approach to understanding obstructive sleep apnea. Respir Physiol.2003;135:187-205.
3. Shahar E, Whitney CW, Redline S, Lee ET, Newman AB, Javier Nieto F, et al. Sleep-disordered breathing and cardiovascular disease: crosssectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med.2001;163:19-25.
4. Fisher D, Pillar G, Malhotra A, Peled N, Lavie P. Long-term folowup of untreated patients with sleep apnea syndrome. Respir Med.2002;96:337-43.
5. Nieto FJ, Young TB, Lind BK, Shahar E, Samet JM, Redline S, et al. Association of sleep-disordered breathing, sleep apnea, and hypertension in a large community-based study. Sleep Heart Health Study. JAMA.2002;283:1829-36.
6. Yilmaz M, Bayazit YA, Ciftci T, Erdal E, Kokturk O, Gokdogan T, et al. Association of serotonin transporter gene polymorphism with obstructive sleep apnea syndrome. Laryngoscope.2005;115:832-6.
7. Jelev A, Sood S, Liu H, Nolan P, Horner RL. Microdialysis perfusion of 5-HT into hypoglossal motor nucleus differentially modulates genioglossus activity across natural sleep-wake states in rats. J Physiol. 2001;532:467-81.
8. Sakai K, Takada T, Nakayama H, Kubota Y, Nakamata M, Satoh M, et al.. Serotonin-2A and 2C receptor gene polymorphisms in Japanese patients with obstructive sleep apnea. Intern Med.2005;44:928-33.
9. Bayazit YA, Yilmaz M, Ciftci T, Erdal E, Kokturk O, Gokdogan T, et al. Association of the -1438G/A polymorphism of the 5-HT2A receptor gene with obstructive sleep apnea syndrome. ORL. 2006; 68:123-8.
10. Douse MA, White DP. Serotonergic effects on hypoglossal neural activity and reflex responses. Brain Res.1996;726:213-22.
11. Bayliss DA, Viana F, Talley EM, Berger AJ. Neuromodulation of hypoglossal motoneurons: cellular and developmental mechanisms. Respir Physiol.1997;110:139-50.
12. Barnes NM, Sharp T. A review of central 5-HT receptors and their function. Neuropharmacology.1999;38:1083-152.
13. Okada M, Northup JK, Ozaki N, Russell JT, Linnoila M, Goldman D. Modification of human 5-HT(2C) receptor function by Cys23Ser, an abundant, naturally occurring amino- acid substitution. Mol Psychiatry. 1998;9:55-64.
14. Fenik P, Veasey SC. Pharmacological characterization of serotonergic receptor activity in the hypoglossal nucleus. Am J Respir Crit Care Med.2003;167:563-9.
15. Estatuto do Idoso. Lei Nº 10.741, de 1º de Outubro de 2003. Série fontes de referência. Legislação: nº 53. 42 p. ISBN:85-7365-345-0.
16. Murahovski J. Puericultura no Ambulatório e Consultório. In: Pediatria: Diagnóstico + Tratamento. 6ª ed. São Paulo:Sarvier;2003.p.3-36.
17. Li HY, Chen NH, Lee LA, Shu YH, Fang TJ, Wang PC. Use of morphological indicators to predict outcomes of palatopharyngeal surgery in patients with obstructive sleep apnea. ORL J Otorhinolaryngol Relat Spec.2004;66:119-23.
18. WHO. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. WHO Technical Report Series 854. Geneva: World Health Organization, 1995.
19. Pillar G, Malhotra A, Fogel R, Beauregard J, Schnall R, White DP. Airway mechanics and ventilation in response to resistive loading during NREM sleep: the influence of gender. Am J Resp Crit Care Med.2000;162:1627-32.
20. Maes HH, Neale MC, Eaves LJ. Genetic and environmental factors in relative body weight and human adiposity. Behav Genet. 1997;27:325-51.
21. Rosmond R, Bouchard C, Bjorntorp P. 5-HT(2A) receptor gene promoter polymorphism in relation to abdominal obesity and cortisol. Obes Res.2002;10:585-9.
22. Bouchard C. Genetics determinants of regional fat distribution. Hum Reprod.1997;12:1-5.
23. Thomas DA, Swaminathan S, Beardsmore CS, McArdle EK, MacFadyen UM, Goodenough PC, et al. Comparison of peripheral chemoreceptor responses monozygotic and dizygotic twins infants. Am Rev Respir Dis.1993;148:1605-9.
24. Tishler PV, Redline S, Ferrete V, Hans MG, Altose MD. The association of sudden unexpected infant death with obstructive sleep apnea. Am J Resp Crit Care Med.1996;153:1857-63.
25. Riha RL. Genetics aspects of the obstructive sleep apnoea/hypopnoea syndroma - is there a common link with obesity? Respiration. 2009;78:5-17.
26. Riha RL, Gislasson T, Dienfenbachk. The phenotype and genotype of adult obstructive sleep apnoea/hypopnoea syndrome. Eur Respir. J.2009;33:645-55.
27. Taheri S. The genetics of sleep disorders. Minerva Med.2004;95:203- 12.
28. Reppert SM, Weaver DR. Molecular analysis of mammalian circadian rhythms. Annu Rev Physiol.2001;63:647-76.
1. Doutora em Ciências da Saúde, Professora Adjunta III-D do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço - FAMERP.
2. Graduação em Medicina, Residente R4 em Otorrinolaringologia e Cirurgia de Cabeça e Pescoço.
3. Doutora em Ciências da Saúde, Chefe do Ambulatório de Sono-FAMERP/FUNFARME.
4. Doutor em Ciências da Saúde, Chefe Ambulatório de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço-FAMERP/FUNFARME.
5. Livre Docente, Professor Livre Docente do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço-FAMERP.
Faculdade de Medicina de São José do Rio Preto, SP (FAMERP) - Av. Brigadeiro Faria Lima 5416 São José do Rio Preto SP 15090-000.
Endereço para correspondência:
Vânia Belintani Piatto
Faculdade de Medicina de São José do Rio Preto SP (FAMERP). Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço
Av. Brigadeiro Faria Lima 5416
São José do Rio Preto SP 15090-000
E-mail: vbpiatto@gmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 26 de maio de 2010. cod. 7119
Artigo aceito em 4 de outubro de 2010.
FAPESP (Processo Nº2008/01070-4).