Ano: 2010 Vol. 76 Ed. 6 - Novembro - Dezembro - (17º)
Seção: Artigo Original
Páginas: 776 a 782
Polimorfismo do gene metilenotetra-hidrofolato redutase (MTHFR) e o risco de carcinoma espinocelular de cabeça e pescoço
Polymorphism of Methylenetetrahydrofolate Reductase (MTHFR) gene and risk of head and neck squamous cell carcinoma
Autor(es): Juliana Olsen Rodrigues1; Ana Lívia Silva Galbiatti2; Mariangela Torreglosa Ruiz3; Luiz Sergio Raposo4; José Victor Maniglia5; Érika Cristina Pavarino-Bertelli6; Eny Maria Goloni-Bertollo7
Palavras-chave: genes, neoplasias decabeça e pescoço, polimorfismo genético.
Keywords: genes, head and neck neoplasms, polymorphism.
Resumo:
O polimorfismo C677T do gene metilenotetra-hidrofolato redutase (MTHFR) pode ser um fator de risco para o carcinoma espinocelular de cabeça e pescoço devido a alterações nos níveis de folato que podem induzir alterações na metilação intracelular, promovendo a carcinogênese. Objetivo: Avaliar o polimorfismo MTHFR C677T em pacientes com carcinoma espinocelular de cabeça e pescoço e em indivíduos sem história de neoplasia e verificar a associação desta doença com as características clínico-patológicas. Casuística e Métodos: Estudo retrospectivo no qual foram avaliados gênero, idade, tabagismo, etilismo e parâmetros clínico-histopatológicos em 200 indivíduos (100 com a doença e 100 sem história de neoplasia). A análise molecular foi realizada pela técnica de PCR- RFLP e os testes qui-quadrado de Pearson e Regressão Logística Múltipla foram utilizados para análise estatística. Resultados: Não houve associação entre o polimorfismo MTHFR C677T e a doença (p=0,50). Diferenças significantes entre o grupo de pacientes e o grupo controle foram observadas para idade superior a 50 anos, hábito tabagista e gênero masculino (p<0,001). Não houve associação da doença com os parâmetros clínico-histopatológicos. Conclusão: Não foi possível estabelecer uma associação entre o polimorfismo MTHFR C677T e o carcinoma espinocelular de cabeça e pescoço.
Abstract:
Methylenetetrahydrofolate reductase gene (MTHFR) C677T polymorphism may be a risk factor for head and neck squamous cell carcinoma due to changes in folate levels that can induce disorders in the methylation pathway, which results in carcinogenesis. Aim: To evaluate MTHFR C677T polymorphism in patients with head and neck squamous cell carcinoma and in individuals with no history of cancer, and to assess the association of this disease with clinical histopathological parameters. Series and Methods: A retrospective study that assessed gender, age, tobacco, alcohol consumption and clinical histopathological parameters in 200 patients (100 with disease and 100 with no history of cancer). PCR-RFLP molecular analysis was carried out and the chi-square test and multiple logistic regression were applied for the statistical analysis. Results: There was no association between MTHFR C677T polymorphism and head and neck cancer (p = 0.50). Significant differences between the study and control groups were observed at age over 50 years, tobacco use, and male gender (p <0.001). There was no association of disease with clinical-histopathological parameters. Conclusion: No association between the MTHFR C677T polymorphism and head and neck squamous cell carcinoma was possible in this study.
![]()
INTRODUÇÃO
O carcinoma espinocelular de cabeça e pescoço é um dos cinco tipos de cânceres mais comuns no mundo. Apresenta-se em sexto lugar em mortalidade por câncer e inclui cânceres de cavidade oral (40%), faringe (15%) e laringe (25%)1.
Os pacientes com carcinoma espinocelular de cabeça e pescoço geralmente são diagnosticados num estágio tardio da doença; aproximadamente 75% dos diagnósticos são realizados no estádio III ou IV. Essa situação torna-se pior em países em desenvolvimento, como Índia, Tailândia e Brasil3, países onde esse tipo de câncer é mais comum4. Os indivíduos com esta doença apresentam uma taxa de sobrevida que atinge em média cinco anos5. Além disso, a expectativa de vida em cinco anos é de aproximadamente 50%, quando há presença de metástases linfonodais6,7. Apesar das novas técnicas cirúrgicas, radioterapia e uso concomitante da quimioterapia, não se observa aumento significativo da taxa de sobrevida nas últimas décadas4,5,6,8.
Estudos epidemiológicos sugerem uma etiologia multifatorial para esse tipo de câncer e dentre os fatores que predispõem à doença estão tabagismo, etilismo, infecção oral pelo vírus papiloma humano (HPV) e fatores genéticos1,4,7,9,10.
Polimorfismos genéticos que resultam nesta deficiência parecem contribuir para o desenvolvimento do carcinoma espinocelular de cabeça e pescoço e outros tipos de câncer, devido à influência do folato no processo de metilação do DNA que é a transferência de grupos metil (CH3) para a posição 5' de resíduos de citosinas localizadas em dinucleotídeos citosina-guanina (CpG), por meio de reações catalisadas por proteínas denominadas DNA metiltransferases11. Esta modificação epigenética do DNA possui vários papéis funcionais, incluindo controle da expressão gênica, estabilidade da estrutura da cromatina e manutenção da estabilidade genômica11-22.
O polimorfismo C677T do gene Metilenotetra-hidrofolato redutase (MTHFR) parece estar relacionado à suscetibilidade ao câncer devido à diminuição da atividade da enzima MTHFR envolvida no metabolismo do folato, que pode ocasionar um descontrole da expressão gênica, instabilidade genômica e indução da carcinogênese 23,24.
Devido à grande variedade étnica e geográfica na frequência da variante C677T do gene MTHFR, estudos têm avaliado o equilíbrio de Hardy-Weinberg deste gene em diferentes populações para verificar se as frequências alélicas permanecem inalteradas ao longo das gerações. A meta-análise de Jim et al. (2009)25 que estudou cinco populações de etnia asiática e outras cinco de etnia europeia ou americana confirmou que a distribuição genotípica do grupo controle em dois estudos não estavam em equilíbrio de Hardy-Weinberg. Já o estudo de Suzuki et al. (2007)15, Solomon et al. (2008)26 e Kruszyna et al. (2009)27 em população oriental, polonesa e indiana, respectivamente, as frequências genotípicas apresentaram-se em equilíbrio de Hardy-Weinberg.
Baseado nas presentes evidências, o objetivo deste trabalho foi identificar o polimorfismo MTHFR C677T em pacientes com carcinoma espinocelular de cabeça e pescoço e em indivíduos sem história de neoplasia, avaliar a associação deste polimorfismo com características clínicas analisadas e investigar a associação dos dados demográficos (idade e gênero) e fatores de risco (tabagismo e etilismo) com a doença.
CASUÍSTICA E MÉTODOS
Este estudo foi aprovado pelo comitê de ética da instituição sob número 5566/2005.
Um total de 200 indivíduos foi incluído neste estudo, sendo 100 pacientes (84 homens e 16 mulheres, média de idade (DP) de 59,05 ± 10,4 anos) com diagnóstico histopatológico de carcinoma espinocelular de cabeça e pescoço, procedentes de um hospital universitário do noroeste do estado de São Paulo e 100 indivíduos sem história de neoplasia (76 homens e 24 mulheres, média de idade (DP) de 43,61 ± 2,2 anos. Os indivíduos foram incluídos no estudo após a obtenção do Termo de Consentimento Livre e Esclarecido.
No grupo controle foram inclusos indivíduos provenientes do Hemocentro de São José de Rio Preto sem diagnóstico de câncer de acordo com o protocolo de doadores de sangue que avalia a ocorrência de 20 doenças (http://www.hemonline.com.br/portarias/rdc153/indexframe.htm). O critério de inclusão foi idade acima de 40 anos e o critério de exclusão foi história familial de câncer na família e presença de qualquer doença avaliada no protocolo de doação de sangue. O grupo caso foi composto de pacientes com diagnóstico de carcinoma de cabeça e pescoço feito a partir de espécimes patológicos ou após excisão total ou biópsia. Como critério de inclusão foram avaliados apenas os pacientes com tumores do tipo histológico espinocelular e foram excluídos do estudo pacientes previamente tratados.
As variáveis analisadas foram idade, gênero, exposição a fatores de risco (consumo de álcool e cigarro) e parâmetros clínicos relacionados ao tumor. Foram considerados tabagistas indivíduos que consumiram cerca de 100 cigarros durante toda vida e etilistas aqueles que bebem mais de quatro drinques por semana28,29. Quanto aos parâmetros clínicos, foram analisados os sítios primários de ocorrência do tumor (subdivididos em cavidade oral, faringe e laringe) e os tumores foram classificados de acordo com os parâmetros da Union International Control Cancer (IUCC), 2002 e American Joint Committee for Cancer (AJCC), 2002, em três critérios: tamanho do tumor (T), presença de linfonodos regionais comprometidos (N). Todas as informações sobre os parâmetros clínico-patológicos foram obtidas através dos prontuários médicos
O DNA genômico extraído, segundo Miller et al. (1998),30 com modificações foi amplificado pela técnica de PCR (Polymerase Chain Reaction), segundo Yi et al. em 200231. O produto da amplificação foi submetido à digestão com a enzima de restrição Hinf I, segundo as instruções do fabricante, para detecção do sítio polimórfico (MTHFR 677T).
O modelo de regressão logística múltipla foi utilizado para avaliar o efeito das variáveis e da distribuição genotípica entre os grupos. As variáveis incluídas no modelo foram: idade (referência: idade abaixo da mediana de ambos os grupos), gênero (referência: sexo feminino), hábito tabagista (referência: não fumantes); hábito etilista (referência: não etilistas).
As características clínico-patológicas também foram analisadas por regressão logística múltipla. A classificação T foi igual em tumores com pequena extensão (T1, T2) e com grande extensão (T3, T4). A classificação N foi dividida em comprometimento de linfonodos negativo (N0) e positivo (N1, N2, N3).
Os resultados foram apresentados em odds ratio (OR) e intervalo de confiança de 95% (IC - 95%). O nível de significância foi estabelecido em 5% (p=0,05). A análise estatística foi realizada por meio dos programas computacionais Bioestat e Instat.
RESULTADOS
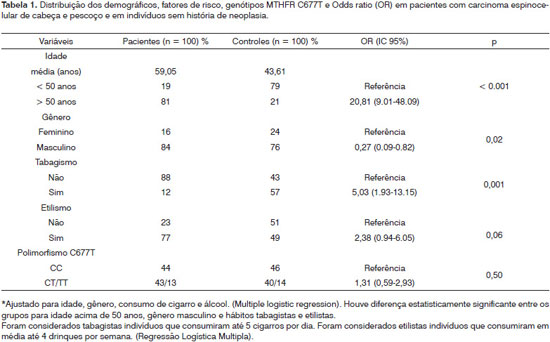
A Tabela 1 mostra os dados sócio-demográficos dos 100 pacientes com carcinoma espinocelular da cabeça e pescoço e dos 100 indivíduos sem história de neoplasia. Diferenças significantes entre o grupo de pacientes e o grupo controle foram observadas para idade superior a 50 anos, hábito tabagista e gênero masculino (p < 0,001). Cento e sessenta dos participantes foram homens (80% - 84 pacientes e 76 controles) e 40 foram mulheres (20% - 16 pacientes e 24 controles). O grupo caso apresentou 88% dos indivíduos fumantes comparado com 43% do grupo controle. Quanto ao consumo de álcool, 77% dos pacientes e 49% dos indivíduos controles eram etilistas e não houve diferença significante entre os grupos (p=0,06).
O equilíbrio de Hardy-Weinberg mostrou que as distribuições genotípicas foram semelhantes às esperadas entre os pacientes (X2 = 1,18; p = 0,23) e entre os indivíduos controles (X2 = 0,23; p = 0,63). As frequências genotípicas CC, CT e CC do polimorfismo C677T foram 44%, 43% e 13% respectivamente, para os pacientes e 46%, 40% e 14% respectivamente, para os controles. Não houve diferença significante entre os grupos em relação à distribuição genotípica (p= 0,92).
As frequências alélicas para os pacientes com câncer de cabeça e pescoço foram respectivamente (C=0,65 e T=0,35) e para os indivíduos controles (C=0,66 e T=0,34) e também não se observou diferença estatisticamente significante entre os grupos (p=1,00).
O teste de regressão logística múltipla foi realizado para avaliação do efeito das variáveis no desenvolvimento da doença (genótipos estudados, idade, gênero, tabagismo e etilismo) (Tabela 1). A idade superior a 50 anos (OR = 20,81; IC= 9,01 a 48,09; p < 0,0001) e tabagismo (OR= 5,03; IC =1,93 a 13,15; p < 0,001) foram fatores preditores da doença.
Quanto aos parâmetros clínicos, não foram observadas associações entre o polimorfismo e os sítios primários do tumor (cavidade oral, faringe e laringe), extensão tumoral e comprometimento de linfonodos. Um total de 34% dos pacientes apresentou como sítio primário a cavidade oral, 31% a laringe e 22% a laringe. O restante apresentou sitio primário desconhecido. Em relação ao TNM, as categorias T1 ou T2 estiveram presente em 59% dos pacientes, destes 34,6% com genótipo selvagem CC e 65,4% com pelo menos um alelo mutado (genótipos CT ou TT). O restante dos pacientes (41%) apresentou as categorias T3 ou T4, sendo 55% com genótipo selvagem CC e 45% com pelo menos um alelo mutado (genótipos CT ou TT). O envolvimento de linfonodo (N+) esteve presente em 26,6% dos pacientes (37,5% com genótipo CC e 62,5% com pelo menos um alelo mutado - genótipos CT ou TT).
DISCUSSÃO
O presente estudo demonstrou que o carcinoma espinocelular de cabeça e pescoço é mais frequente em indivíduos tabagistas e idade acima de 50 anos. Resultados encontrados na literatura também mostram que o câncer é mais frequente a partir da 5ª década de vida e em indivíduos tabagistas32-34.
Não foi observada relação entre etilismo e o carcinoma espinocelular de cabeça e pescoço, como no estudo de Boccia et al. (2009).35 Estudos em animais indicam que o álcool não é genotóxico, mas pode agir como solvente para a penetração de carcinógenos. Possui como metabólito primário o acetaldeído, o qual é altamente reativo ligando-se a proteínas, aos constituintes celulares e ao DNA, formando adutos de DNA36-38. O consumo excessivo de álcool também pode levar a deficiências nutricionais devido às falhas na absorção intestinal e pelas alterações em algumas vias metabólicas39. Os resultados de um estudo multicêntrico sugerem que na ausência do hábito tabagista, a associação entre o consumo de álcool e o risco de carcinoma de cabeça e pescoço é insignificante e que aparentemente, somente em altas doses o álcool é carcinogênico40.
Em nosso estudo, a casuística analisada também não mostrou associação do gênero com a doença, porém outros estudos confirmam essa associação e afirmam que nas ultimas décadas houve um aumento da incidência desta doença entre as mulheres, entretanto o gênero masculino ainda é o mais acometido por esse tipo de tumor41,42.
O polimorfismo MTHFR C677T têm sido investigado como fator de risco para suscetibilidade ao câncer devido a sua influência nas reações de metilação celulares e síntese de DNA. Sabe-se que a hipometilação global do genoma ocorre com maior frequência em tumores quando comparados a células normais, e acredita-se que a expressão elevada de oncogenes seja resultado desta hipometilação. Por outro lado, a hipermetilação de ilhas CpG, localizadas em regiões promotoras de genes, é associada a alterações na expressão gênica, resultando no silenciamento de genes supressores de tumor43.
As frequências genotípicas do presente estudo se encontram em equilíbrio Hardy-Weiberng (HWE). O genótipo polimórfico (MTHFR 677TT) esteve presente em 14% dos indivíduos controles e em 13% dos pacientes com carcinoma espinocelular de cabeça e pescoço. Há considerável variação étnica e geográfica na frequência da variante C677T do gene MTHFR. A prevalência do genótipo MTHFR 677TT varia cerca de 1% na população negra dos Estados Unidos, África e América do Sul para mais de 20% em europeus, colombianos e ameríndios e 12% dos japoneses apresentam-se homozigotos TT44. Considerando a grande miscigenação brasileira, não foi realizada a análise de etnias na casuística estudada.
No presente estudo, não foi observada associação entre o polimorfismo MTHFR C677T e o carcinoma de cabeça e pescoço. Outros estudos mostram associação deste polimorfismo com vários tipos de cânceres, tais como câncer de pulmão45,35, carcinoma hepatocelular46, certas leucemias47, câncer de próstata48, de mama49, de cólon49, endométrio, esôfago, estômago, pâncreas e bexiga46. Em carcinoma de cabeça e pescoço, uma meta-análise analisou nove estudos e não encontrou associação entre este polimorfismo e a doença, o que está de acordo com os resultados do nosso trabalho32. Porém, os estudos de Reljic et al. (2007)50 e Solomon et al. (2008)26 encontraram uma associação entre o carcinoma de cabeça e pescoço e o polimorfismo MTHFR C677T nas populações croata e indiana, respectivamente.
Reljic et al. em 200750 estudaram 81 pacientes com carcinoma de cabeça e pescoço e 102 indivíduos controles e observaram uma diferença estatisticamente significante na distribuição genotípica entre os grupos, o que fornece evidências da possível associação do polimorfismo MTHFR C677T no desenvolvimento do carcinoma de cabeça e pescoço. A análise demonstrou que o genótipo 677CT reduz em 2,8 vezes o risco para essa doença. Já o estudo de Solomon et al., em 200826, que analisou 126 indivíduos indianos com carcinoma oral (33 etilistas, 56 consumidores moderados de álcool e 37 não-etilistas) mostrou que indivíduos etilistas com o genótipo MTHFR 677TT possuem um alto risco para o desenvolvimento do carcinoma oral (odds ratio 3.0; 95% CI = 2.02-4.0) e portanto, o genótipo TT possui um efeito protetor somente em indivíduos não-etilistas e em consumidores moderados de álcool.
No Brasil, não há na literatura a descrição das alterações do gene estudado e carcinoma espinocelular de cabeça e pescoço e apesar dos resultados não apresentarem significância, é interessante a pesquisa destas alterações devido aos resultados contraditórios e escassez de estudos.
Em relação aos parâmetros clínicos, o tipo mais frequente de sítio primário tumoral foi cavidade oral, que representa 40% dos cânceres na região de cabeça e pescoço51,52. Em relação ao TNM, 19% dos casos pertenceram à categoria T1, 30% à categoria T2, 17% à categoria T3 e 17% à categoria T4, 73,4% não apresentaram comprometimento dos linfonodos e 99% não apresentaram metástase. Um estudo retrospectivo realizado no Brasil mostra frequência elevada desta doença em estágio avançado53. A discrepância dos nossos achados parece refletir o tipo de população estudada, ou seja, pacientes que estão em seguimento.
O polimorfismo MTHFR C677T não mostrou associação com os parâmetros clínicos estudados (sítios primários do tumor, extensão tumoral e comprometimento de linfonodos). Em relação ao sítio anatômico de tumor, Capaccio et al.54 em 2005 analisaram a presença deste polimorfismo nas diferentes localizações anatômicas na orofaringe e também não encontraram associação entre estas variáveis. Quanto à agressividade tumoral, não foi demonstrada associação deste polimorfismo com a extensão (categoria T) e com o estadiamento do tumor nas três grandes regiões de cabeça e pescoço (cavidade oral, faringe e laringe) analisadas, corroborando com o estudo feito por Vairaktaris et al.55 (2006).
CONCLUSÃO
Em conclusão, não foi possível estabelecer uma associação entre o polimorfismo MTHFR C677T e carcinoma espinocelular de cabeça e pescoço. Nossos dados mostram que essa doença é mais frequente a partir da quinta década de vida e em indivíduos tabagistas. A elucidação da associação desse polimorfismo com o desenvolvimento de carcinoma de cabeça e pescoço e da associação desse tipo de câncer com certos fatores de risco contribuirão no entendimento dos mecanismos envolvidos no processo neoplásico e na elaboração de estratégias de prevenção e controle desta doença.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Gallì P, Cadoni G, Volante MM, Feo ED, Amore R, Giorgio et al.. A case-control study on the combined effects of p53 and p73 polymorphisms on head and neck cancer risk in an Italian population. BMC Cancer. 2009; 9:137.
2. Alvarenga LM, Ruiz M T, Bertelli ECP, Ruback MJC, Maniglia JV, Bertollo E MG. Epidemiologic evaluation of head and neck patients in a university hospital of Northwestern São Paulo State. Braz J Otorhinolaryngol. 2008; 74(1):68-73.
3. Awada A, Junior GC. Head and neck cancer emerging strategies: advances and new challenges. Curr Opin Oncol. 2009; 21(3):191-3.
4. Farshadpour F, Hordijk GJ, Koole R, Slootweg PJ. Head and neck squamous cell carcinoma in non-smoking and non-drinking patients with multiple tumors: etiologic significance of p53 and Ki-67 in non-tumorous epithelium. J Oral Pathol Med. 2008; 37: 549-54.
5. Escher A, Piotet E, Waridel F, Iggo R, Monnier P. p53 mutation in histologically normal mucosa of the aero-digestive tract is not a marker of increased risk for second primary carcinoma in head and neck cancer patients. Eur Arch Otorhinolaryngol. 2009; 266(4):547-51.
6. Tachezy R, Klozar J, Rubenstein L, Smith E, Sala'kova' M, S mahelova' J et al.. Demographic and Risk Factors in Patients With Head and Neck Tumors. J Med Virol. 2009; 81:878-87.
7. Gold KA, Kim ES. Role of molecular markers and gene profiling in head and neck cancers. Curr Opin Oncol. 2009; 21:206-11.
8. Mitani T, Hoshikawa H, Mori T, Hosokawa T, Tsukamoto I, Yamaguchi F et al.. Growth inhibition of head and neck carcinomas by d-allose. Head Neck. 2009; 31(8):1049-55.
9. Poeta M L, Manola J, Goldwasser MA, Forastiere A, Benoit N, Califano JA et al.. TP53 Mutations and Survival in Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med. 2007; 20; 357(25): 2552-61.
10. Kumar B, Cordell K G, Lee J S, Worden F P, Prince M E, Tran H H et al.. EGFR, p16, HPV Titer, Bcl-xL and p53, Sex, and Smoking As Indicators of Response to Therapy and Survival in Oropharyngeal Cancer. J Clin Oncol. 2008; 26:3128-37.
11. DAlessio AC, Szyf M. Epigenetic tête-à-tête: the bilateral relationship between chromatin modifications and DNA methylation. Biochem Cell Biol. 2006; 84(4):463-76.
12. Ehrlich M. The ICF syndrome, a DNA methyltransferase 3B deficiency and immunodeficiency disease.Clinical Immunology.2003; 109: 17-28.
13. Tuck-Muller CM, Narayan A, Tsien F, Smeets DF, Sawyer J, Fiala ES, et al. DNA hypomethylation and unusual chromosome instability in cell lines from ICF syndrome patients. Cytogenet Cell Genet. 2000; 89(1-2):121-8.
14. Zhang Z, Shi Q, Liu Z, Sturgis EM, Spitz MR, WeiQ. Polymorphisms of Methionine Synthase and Methionine Synthase Reductase and Risk of Squamous Cell Carcinoma of the Head and Neck: A Case-Control Analysis. Cancer Epidemiol Biomarkers Prev. 2005; 14(5) 1188-93.
15. Suzuki T, Matsuo K, Hasegawa Y, Hiraki A, Wakai K, Hirose K, et al.. One-carbon metabolism-related gene polymorphisms and risk of head and neck squamous cell carcinoma: Case-control study. Cancer Sci. 2007; 98(9):1439-46.
16. Pande M, Chen J, Amos CI, Lynch PM, Broaddus R, Frazier ML. Influence of Methylenetetrahydrofolate Reductase Gene Polymorphisms C677T and A1298C on Age-Associated Risk for Colorectal Cancer in a Caucasian Lynch Syndrome Population. Cancer Epidemiol Biomarkers Prev. 2007; 16:1753-9.
17. Kim DH. The interactive effect of methyl-group diet and polymorphism of methylenetetrahydrofolate reductase on the risk of colorectal cancer. Mutat Res. 2007; 622: 14-8.
18. Ouerhani S, Oliveira E, Marrakchi R, Ben Slama MR, Sfaxi M, Ayed M et al.. Methylenetetrahydrofolate reductase and methionine synthase polymorphisms and risk of bladder cancer in a Tunisian population. Cancer Genet Cytogenet. 2007; 176(1):48-53.
19. Mu LN, Cao W, Zhang ZF, Yu SZ, Jiang QW, You NC et al.. Polymorphisms of 5,10-methylenetetralydrofolate reductase (MTHFR), fruit and vegetable intake, and the risk of stomach. Biomarkers. 2007; 12: 61-75.
20. Ott N, Geddert H, Sarbia M. Polymorphisms in methionine synthase (A2756G) and cystathionine beta-synthase (844ins68) and susceptibility to carcinomas of the upper gastrointestinal tract. J Cancer Res Clin Oncol. 2008; 134:405-10.
21. Galván-Portillo MV, Oñate-Ocaña LF, Pérez-Pérez GI, Chen J, Herrera-Goepfert R, Chihu-Amparan L et al.. Dietary folate and vitamin B12 intake before diagnosis decreases gastric cancer mortality risk among susceptible MTHFR 677TT carriers. Nutrition. 2009. [no prelo]
22. Gao CM, Tang JH, Cao HX, Ding JH, Wu JZ, Wang J et al.. MTHFR polymorphisms, dietary folate intake and breast cancer risk in Chinese women. J Hum Genet. 2009; 54(7):414-8.
23. Duthie SJ. Folic acid deficiency and cancer: mechanisms of DNA instability. Br Med Bull. 1999; 55(3):578-92.
24. Ames BN. DNA damage from micronutrient deficiencies is likely to be a major cause of cancer. Mutat Res. 2001; 475:7 - 20.
25. Jin F, Qu LS e Shen XZ. Association between the methylenetetrahydrofolate reductase C677T polymorphism and hepatocellular carcinoma risk: a meta-analysis. Diagn Pathol. 2009, 4:39.
26. Solomon PR, Selvan GS, Shanmugam G. Polymorphism in ADH and MTHFR genes in oral squamous cell carcinoma of Indians. Oral Dis. 2008; 14: 633-9.
27. Kruszyna L, Lianeri M, Rydzanicz M, Gajecka M, Szyfter K, Jagodzinski PP. Polymorphic variants of folate metabolism genes and the risk of laryngeal cancer. Mol Biol Rep. 2010; 37: 241-7.
28. Ahrendt SA, Chown JT, Yang SC, Wu L, Zhang MJ, Jen J et al.. Alcohol consumption and cigarette smoking increase the frequency of p53 mutations in non-small cell lung cancer. Cancer Res. 2000; 60:3155-9.
29. Kjaerhein K, Gaard M, Andersen A. The role of alcohol, tobacco, and dietary factors in upper aerogastric tract cancer: a prospective study of 10.900 Norwegian men. Cancer Causes Control. 1998; 9: 99-108.
30. Miller SA, Dikes DD e Polesky HF. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Research. 1988; 16: 1215.
31. Yi P, Pogribny IP, James SJ. Multiplex: PCR for simultaneous detection of 677 C-T and 1298 A - C polymorphisms in methylenetetrahydrofolate reductase gene for population studies of cancer risk. Cancer Letters. 2002; 181:209-13.
32. Kreimer AR, Clifford GM, Boyle P, Franceschi S. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev. 2005;14:465-75.
33. Psyrri A, DiMaio D. Human papillomavirus in cervical and head-and-neck cancer. Nat Clin Pract Oncol. 2006; 5: 24-31.
34. Guha N, Boffetta P, Wünsch Filho V, Eluf Neto J, Shangina O, Zaridze D et al.. Oral health and risk of squamous cell carcinoma of the head and neck and esophagus: results of two multicentric case-control studies. Am J Epidemiol. 2007;166:1159-73.
35. Boccia S, Boffetta P, Brennan P, Ricciardi G, Gianfagna F, Matsuo K et al.. Meta-analyses of the methylenetetrahydrofolate reductase C677T and A1298C polymorphisms and risk of head and neck and lung cancer. Cancer Letters. 2009; 273 55-61.
36. Hashibe M, Brennan P, Benhamou S, Castellsague X, Chen C, Curado MP et al.. Alcohol drinking in never users of tobacco, cigarette smoking in never drinkers, and the risk of head and neck cancer: pooled analysis in the International Head and Neck Cancer Epidemiology Consortium. J Natl Cancer Inst. 2007; 99: 777 - 89.
37. Boffetta P, Hashibe M. Alcohol and cancer. Lancet Oncol. 2006; 7:149-56.
38. Warnakulasuriya S, Parkkila S, Nagao T, Preedy VR, Pasanen M, Koivisto H et al.. Demonstration of ethanol-induced protein adducts in oral leukoplakia (pre-cancer) and cancer. J Oral Pathol Med.2008; 37: 157-65.
39. Lee YC, Boffetta P, Sturgis EM, Wei Q, Zhang ZF, Muscat J et al.. Involuntary smoking and head and neck cancer risk: pooled analysis in the international head and neck cancer epidemiology consortium. Cancer Epidemiol Biomarkers Prev. 2008; 17:1974-81.
40. Hashibe M, Brennan P, Benhamou S, Castellsague X, Chen C, Curado MP et al.. Alcohol drinking in never users of tobacco, cigarette smoking in never drinkers, and the risk of head and neck cancer: pooled analysis in the International Head and Neck. J Natl Cancer Inst. 2007; 99(10):777-89.
41. Vaezi MF, Sepi M, Qadeer MA, Lopez R, Colabianchi N. Laryngeal cancer and gastroesophageal reflux disease: a case-control study. Am J Med. 2006; 119:768-76.
42. Qadeer MA, Colabianchi N, Strome M, Vaezi MF. Gastroesophageal reflux and laryngeal cancer: causation or association? A critical review. Am J Otolaryngol. 2006; 27:119- 28.
43. Beier V, Mund C, Hoheisel JD. Monitoring methylation changes in cancer. Adv Biochem Eng Biotechnol. 2007;104:1-11.
44. Botto LD, Yang Q. 5,10-Methylenetetrahydrofolate reductase gene variants and congenital anomalies: a HuGE review. Am J Epidemiol. 2000; 151(9):862-77.
45. Jeng YL, Wu MH, Huang HB, Lin WY, You SL, Chu TY et al.. The methylenetetrahydrofolate reductase 677C-->T polymorphism and lung cancer risk in a Chinese population. Anticancer Res. 2003; 23: 5149-52.
46. Sohn K J, Jang H, Campan M, Weisenberger DJ, Dickhout J, Wang YC et al.. The methylenetetrahydrofolate reductase C677T mutation induces cell-specific changes in genomic DNA methylation and uracil misincorporation: A possible molecular basis for the site-specific cancer risk modification. Int J Cancer. 2009; 124, 1999-2005.
47. Krajinovic M, Lamothe S, Labuda D, Lemieux-Blanchard E, Theore TY, Moghrabi A et al.. Role of MTHFR genetic polymorphisms in the susceptibility to childhood acute lymphoblastic leukemia. Am Soc Hematol. 2004; 103:252-7.
48. Marchal C, Redondo M, Reyes-Engel A, Perea-Milla E, Gaitan MJ, Machuca J et al.. Association between polymorphisms of folate-metabolizing enzymes and risk of prostate cancer. Eur J Surg Oncol. 2008; 34:805-10.
49. Sohn KJ, Croxford R, Yates Z, Lucock M, Kim YI. Effect of the methylenetetrahydrofolate reductase C677T polymorphism on chemosensitivity of colon and breast cancer cells to 5-fluorouracil and methotrexate. J Natl Cancer Inst. 2004; 96:134-44.
50. Reljic A, Simundic AM, Topic E, Nikolac N, Justinic D, Stefanovic M. The methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism and cancer risk: The Croatian case-control study. Clinic Bioch. 2007; 40: 981- 5.
51. Dedivitis RA, França CM, Mafra ACB, Guimarães FT, Guimarães AV. Características clínicoepidemiológicas no carcinoma espinocelular de boca e orofaringe. Rev Bras Otorrinolaringol. 2004; 70: 35-40.
52. Döbrossy L. Epidemiology of head and neck cancer: magnitude of the problem. Cancer Metastasis Rev. 2005; 17: 24-9.
53. Wusch-Filho V. The epidemiology of oral and pharynx cancer in Brazil. Oral Oncol. 2002; 38:737-46.
54. Capaccio P, Ottaviani F, Cuccarini V, Cenzuales S, Cesana BM, Pignataro L. Association between methylenetetrahydrofolate reductase polymorphisms, alcoholintake and oropharyngolaryngeal carcinoma in northern Italy. J Laryngol Otol. 2005; 119(5):371-6.
55. Vairaktaris E, Yapijakis C, Kessler P, Vylliotis A, Ries J, Wiltfang J et al.. Methylenetetrahydrofolate reductase polymorphism and minor increase of risk for oral cancer. J Cancer Res Clin Oncol. 2006; 132(4):219-22.
1. Graduanda em Medicina
2. Bióloga, Mestranda em Ciências da Saúde
3. Doutora em Ciências da Saúde
4. Médico, Mestrando em Ciências da Saúde
5. Livre-Docente, Professor Adjunto
6. Livre-Docente em Genética Humana e Médica, Professora Adjunto
Centro Nacional de Desenvolvimento Científico e Tecnológico (CNPq) Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes)
Endereço para correspondência:
Faculdade de Medicina de São José do Rio Preto - FAMERP
Av. Brigadeiro Faria Lima 5416
São José do Rio Preto SP 15090-000
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 7 de janeiro de 2010. cod. 6868
Artigo aceito em 23 de maio de 2010.
FAMERP - Faculdade de Medicina de São José do Rio Preto