Ano: 2010 Vol. 76 Ed. 1 - Janeiro - Fevereiro - (18º)
Seção: Artigo Original
Páginas: 107 a 112
Avaliação da idade materna, paterna, ordem de paridade e intervalo interpartal para fissura lábio-palatina
Maternal and paternal age, birth order and interpregnancy interval evaluation for cleft lippalate
Autor(es): Daniella Reis Barbosa Martelli1, Kaliany Wanessa da Cruz2, Letízia Monteiro de Barros3, Marise Fernandes Silveira4, Mário Sérgio Oliveira Swerts5, Hercílio Martelli Júnior6
Palavras-chave: fenda labial, fissura palatina, idade materna, idade paterna, ordem de nascimento.
Keywords: cleft lip, cleft palate, maternal age, paternal age, birth order.
Resumo:
Fissuras do lábio e/ou palato representam as anomalias congênitas craniofaciais mais comuns. Objetivo: Avaliar fatores de risco ambientais em pacientes com fissuras lábiopalatinas não-sindrômicas, em um Serviço de Minas Gerais. Casuística e Método: Realizou-se estudo caso-controle, avaliando 100 crianças com fissuras e 100 crianças sem alterações clínicas. As dimensões de análise (idade, cor de pele, sexo, classificação das fissuras, idade materna e paterna, ordem de paridade e intervalo interpartal) foram obtidas a partir de um questionário, sendo posteriormente construído banco de dados e as análises realizadas pelo programa SPSS 17.0. Os resultados foram analisados com risco relativo para cada variável, para estimar odds ratios com intervalo de confiança de 95% seguido de análise bivariada e multivariada. Resultados: Entre as 200 crianças, 54% foram do sexo masculino e 46% do feminino. Com relação à cor da pele, houve predomínio de parda, branca e preta, respectivamente. Entre os tipos de fissuras, as mais comuns foram as fissuras lábio-palatinas (54%), seguidas pela fissura labial (30%) e fissura palatina (16%). Conclusão: Embora com uma população limitada, verificou-se associação entre idade materna e risco aumentado para fissuras lábio-palatinas, porém idade paterna, ordem de paridade e intervalo interpartal não foram significantes.
Abstract:
Cleft lip and palate (CL/P) are the most common congenital craniofacial anomalies. Aim: To evaluate environmental risk factors for non-syndromic CL/P in a reference care center in Minas Gerais. Materials and Methods: we carried out a case-controlled study, assessing 100 children with clefts and 100 children without clinical alterations. The analysis dimensions (age, skin color, gender, fissure classification, maternal and paternal age, birth order and interpregnancy interval), obtained from a questionnaire; and later we build a data base and the analyses were carried out by the SPSS 17.0 software. The results were analyzed with the relative risk for each variable, in order to estimate the odds ratio with a 95% confidence interval, followed by a bivariate and multivariate analysis. Results: among 200 children, 54% were males and 46% were females. As far as skin color is concerned most were brown, white and black, respectively. Cleft palates were the most common fissures found (54%), followed by lip cleft (30%) and palate cleft (16%). Conclusion: although with a limited sample, we noticed an association between maternal age and an increased risk for cleft lip and palate; however, paternal age, pregnancy order and interpregnancy interval were not significant.
![]()
INTRODUÇÃO
Defeitos do tubo neural e fissuras orofaciais estão entre as alterações congênitas mais comuns1. Fissuras lábio-palatinas (FL/P) (OMIM 119530) não-sindrômicas constituem as anomalias mais frequentes da área craniofacial. Em várias regiões mundiais, a ocorrência das FL/P é maior que a da síndrome de Down1. A cada dois minutos, uma criança nasce com FL/P no mundo, 660 crianças diariamente e 235 mil novos casos de fissuras são observados anualmente. Com o crescimento da população mundial, um adicional de 3200 novos casos anuais de FL/P são esperados2.
A incidência das FL/P varia de acordo com a localização geográfica, raça e condição socioeconômica3. Fogh-Andersen4 relatou a ocorrência de 1,5 casos de FL/P em cada 1.000 nascimentos na Dinamarca, enquanto em outras regiões a ocorrência mostrou-se variada (1-2,69:1.000)1,5. Recentemente, Martelli-Júnior et al.6 verificaram a incidência de 1,46 fissuras por cada 1.000 nativivos, no estado de Minas Gerais, Brasil. Estudos revelam que a população asiática, os ancestrais dos nativos americanos e os europeus do norte apresentam uma maior incidência de FL/P7. Em contraste, africanos e descendentes apresentam maior incidência de fissura labial isolada8.
Com relação à embriologia, as FL/P são resultantes de defeitos primários na fusão dos processos craniofaciais que formam o palato primário e secundário, no primeiro trimestre do desenvolvimento intrauterino9. Estas fissuras clinicamente podem ser classificadas tendo como base anatômica o forame incisivo, em 4 grupos: fissuras pré-forame incisivo ou fissuras labiais (FL), fissuras pós-forame incisivo ou fissuras palatinas (FP), fissuras transforame incisivo ou fissuras lábio-palatinas (FLP) e fissuras raras da face10.
Coletivamente, as FL/P constituem um grupo heterogêneo de alterações, possuindo origem multifatorial, onde fatores genéticos e ambientais contribuem para a etiologia das mesmas. A identificação dos fatores etiológicos envolvidos em uma doença é de grande importância, porque os conhecendo é possível melhorar a compreensão da doença e estabelecer medidas de prevenção11. Entre os fatores de risco ambientais para FL/P destacam-se, entre outros, fumo, álcool, idade materna e paterna, medicamentos, ordem de paridade, intervalo interpartal e deficiências de ácido fólico8,11. O objetivo deste estudo foi avaliar, em decorrência da escassez de investigações nacionais, a associação ou não de fatores de risco ambientais, particularmente, idade materna e paterna, ordem de paridade e intervalo interpartal com a ocorrência de FL/P.
CASUÍSTICA E MÉTODO
Realizou-se estudo caso-controle, para avaliar fatores de risco ambientais relacionados à FL/P, em um Serviço de Referência multiprofissional para deformidades craniofaciais, no estado de Minas Gerais, Brasil, entre os anos de 2006-2008. A população deste estudo foi composta por 200 crianças com e sem FL/P, não-sindrômicas, com condições socioeconômicas similares. O grupo "caso" foi composto por 100 pais de crianças (idade entre 0 a 12 anos) com FL/P não-sindrômicas, diagnosticadas e em reabilitação no referido Serviço, independente do sexo, cor da pele, naturalidade ou nacionalidade. O grupo "controle" contou com 100 pais de crianças com a mesma faixa etária (idade entre 0 a 12 anos), porém sem alterações clínicas ou defeitos craniofaciais, assistidos em um Serviço de odontopediatria da mesma instituição. Ambos os grupos apresentavam condições socioeconômicas e os demais critérios de inclusão similares. O referido Centro de Referência do presente estudo atua exclusivamente pelo SUS, sendo credenciado pelo Ministério da Saúde. Foram excluídos, em ambos os grupos, pais que não aceitaram participar do estudo, crianças com FL/P sindrômicas e pais com história de casamentos consanguíneos.
Para avaliação dos fatores de risco, em ambos os grupos, foi utilizado um instrumento (questionário dirigido) individual contemplando as seguintes dimensões de análise: idade, cor da pele, sexo, classificação do tipo de fissura apresentada pela criança, idades materna e paterna, ordem de paridade e intervalo interpartal. Os questionários foram aplicados sempre pelos mesmos examinadores (DRBM e KWC) após receberem treinamento para esta atividade. A aplicação foi realizada, em ambos os grupos, sempre após o atendimento clínico, com as mães, evitando assim qualquer prejuízo ao paciente em termos de consulta e atendimento clínico. Cada questionário foi respondido em um único momento. Realizou-se anteriormente estudo piloto para avaliação e verificação da calibração dos examinadores e viabilidade do instrumento de coleta de dados.
No grupo "caso" as FL/P não-sindrômicas foram classificadas tendo como referência anatômica o forame incisivo10 em: (1) FL: incluem fissuras pré-forame completas ou incompletas, unilaterais e bilaterais; (2) FLP: incluem fissuras transforame unilaterais, bilaterais e fissuras pré e pós-forame; (3) FP: incluem todas as fissuras pós-forame completas ou incompletas e (4) Outras: encontram-se as fissuras raras da face.
Após aplicação dos questionários, as informações coletadas foram arquivadas em um banco de dados e analisadas pelo programa estatístico SPSS versão 17.0 (Chicago, EUA). Os dados foram analisados com risco relativo para cada variável, para estimar odds ratios (OR) com intervalo de confiança de 95% seguido de análise bivariada e multivariada. Este estudo foi conduzido de acordo com os preceitos determinados pela resolução 196/88 do Conselho Nacional de Saúde do Ministério da Saúde, além de submetido e aprovado pelo Comitê de Ética em Pesquisa da Universidade. Cada participante do estudo assinou um Termo de Consentimento Livre e Esclarecido.
RESULTADOS
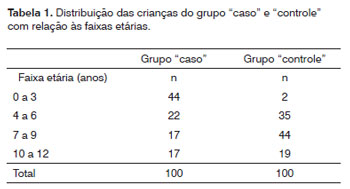
No grupo "caso" das 100 crianças com FL/P, 64 (64%) foram do sexo masculino e 36 (36%) do feminino, enquanto no "controle" 56 (56%) foram do sexo feminino e 44 (44%) do masculino. Com relação à cor da pele, no "caso" 64%, 30% e 6% foram, respectivamente, pardos, brancos e pretos, enquanto no grupo "controle" 45%, 32% e 23% foram, respectivamente, pardos, brancos e pretos. A Tabela 1 mostra, em ambos os grupos, a distribuição das crianças entre as diferentes faixas etárias. Observa-se que no "caso" houve prevalência da faixa etária entre 0 a 3 anos representando 44% deste grupo, enquanto no "controle" houve maior presença de crianças entre 7 a 9 anos, representando 44% do grupo. Assim, quando observados conjuntamente ambos os grupos verifica-se o predomínio de crianças entre 7 e 9 anos.
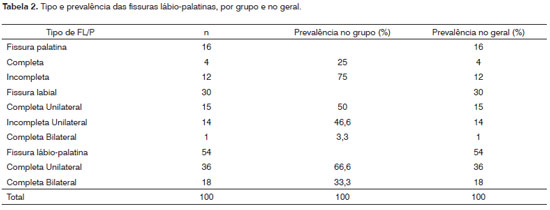
A Tabela 2 mostra a prevalência das FL/P observadas entre os participantes do estudo, assim como o percentual das mesmas na distribuição geral e por grupo. Verifica-se que não houve casos de fissuras raras nesta população. A mais comum entre as fissuras analisadas foi a FLP (54%), seguida, respectivamente, pela FL (30%) e FP isolada (16%). A Tabela 3 mostra a distribuição das idades maternas e paternas das crianças com FL/P, por faixas etárias. Observa-se que tanto no "caso" como no "controle" houve maior prevalência de mães entre 26 e 35 anos. No intervalo até 25 anos, o grupo "caso" apresentou maior número de mães comparado ao "controle" (26% e 12%, respectivamente), distribuição esta que se inverteu em mulheres acima dos 35 anos, onde houve mais mães no grupo "controle" comparado ao "caso" (34% e 22%, respectivamente). Em relação à idade paterna, verifica-se que a mesma foi dividida em intervalos de até 40 anos e acima de 40 anos. Tanto no grupo "caso" como no "controle" foi observada maior frequência até 40 anos, respectivamente, 75% e 70%.
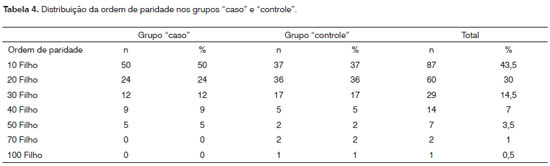
Com relação ao número de gestações, em ambos os grupos, verificou-se que no "caso" 39% das mães tiveram 1 gestação, 29% (2 gestações) e 15% com 3 gestações. Foram encontrados ainda 8% de mães que tiveram 4 gestações, 6% com 5 gestações e 3% com 6 gestações. No "controle" foram mais frequentes a ocorrência de 2 gestações (39%), 3 (24%), 1 (18%) e menos observado 4 gestações (10%), 5 (6%), 8 (2%) e 6 (1%). Em relação à ordem de paridade, a Tabela 4 mostra a distribuição, tanto no grupo "caso" como no "controle" das crianças com FL/P. Observa-se que 74% das crianças com fissuras nasceram nas duas primeiras gestações. Não houve diferença estatística entre os grupos com relação à ordem de paridade (OR: 0,6; 95% IC: 0,34-1,05). Todas as informações em relação à ordem de paridade foram estabelecidas considerando 1, 2, 3, 4 ou mais gestações para os indivíduos com FL/P e do grupo "controle". A categoria "1" foi considerada sem risco para FL/P (OR=1).
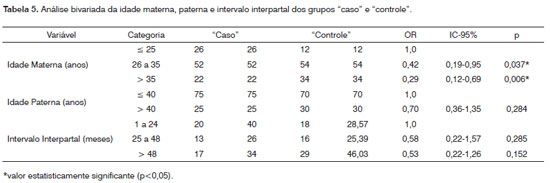
A Tabela 5 ilustra a aplicação da análise bivariada em relação às dimensões, idade materna e paterna e intervalo interpartal. Verifica-se que idade materna mostrou significância estatística (p<0,05), o que também foi observado na regressão logística (análise multivariada).
Quando foram tratadas estatisticamente as idades maternas e paternas de forma adicional não se verificou significância estatística (p<0,05). O intervalo interpartal foi distribuído nos seguintes intervalos cronológicos: 1 a 24 meses, 25 a 48 meses e acima de 48 meses. Não foram observadas diferenças estatísticas entre os grupos "caso" e "controle" e o intervalo interpartal.
DISCUSSÃO
Diferentes estudos epidemiológicos têm sido realizados para avaliar a distribuição das FL/P12,13. É bem aceito que os diferentes tipos de fissuras apresentam distribuição distinta e que as incidências variam entre os diferentes grupos populacionais14. Contudo, asiáticos, americanos nativos, australianos aborígenes e europeus da região norte são mais afetados pelas FLP, enquanto africanos e descendentes de africanos são mais acometidos pelas FP isoladas8. No presente estudo, das 100 fissuras avaliadas, o tipo mais comum encontrado foi as FLP, representando 54% das observadas. Seguindo as FLP, as FL isoladas que representaram 30% e as FP que constituíram 16% da população estudada. Estudo avaliando 126 crianças brasileiras com FL/P não-sindrômicas demonstrou uma prevalência de 2,57 vezes de FL/P em indivíduos do sexo masculino, comparado ao feminino. Esse mesmo estudo evidenciou maior ocorrência de FLP, seguidas, respectivamente, pelas FL e FP, isoladas15. Na presente investigação, estes aspectos epidemiológicos foram corroborados, sendo observado predomínio de FL/P no sexo masculino comparado ao feminino. Também se verificou maior ocorrência de FLP comparadas, respectivamente, as FL e FP, isoladas. Recentemente, estudo realizado no mesmo Serviço do presente estudo obteve resultados similares aos apresentados aqui16.
Idade materna é considerada como fator de risco para diversas alterações cromossômicas, mas não existe consenso se representa ou não fator de risco para FL/P. A maioria dos estudos até 1970 sugere associação entre FL/P e idade materna17. A partir de 1970 diversos trabalhos surgiram mostrando resultados conflitantes17. Estudo realizado na Califórnia mostrou que mulheres com mais de 39 anos apresentavam duas vezes mais risco de ter um filho com FL/P comparado a mães com idade entre 25 e 29 anos18. Outro estudo com americanas residentes de São Francisco encontrou associação entre FP e mulheres jovens19. Análise epidemiológica com chinesas encontrou relação entre aumento da idade materna e FL/P bilaterais no sexo masculino e FL/P no sexo feminino20. Contudo, estudos realizados no Canadá, Irã, Holanda e América do Sul não mostraram relação entre idade materna e ocorrência de FL/P17. Os resultados do presente estudo mostraram que, embora com uma população limitada de pacientes com FL/P, a idade materna foi significante para ocorrência de fissuras usando análise de OR e um intervalo de confiança de 95% (Tabela 5). Observa-se que os intervalos temporais de 26 a 35 anos e acima de 35 anos apresentaram riscos reduzidos para ocorrência de FL/P comparados a mulheres com idade ate 25 anos. Em uma meta-análise realizada por Vieira et al.17, não foi constatada associação entre idade materna e FL/P de maneira geral. Foi verificada relação de FP em mulheres entre 20 a 24 anos e acima de 30 anos. Um importante fator confundidor neste tipo de estudo pode ser o perfil da raça nas populações avaliadas. Dificuldades na obtenção no nível socioeconômico, especialmente em diferentes populações e em diferentes países, podem explicar as diferenças nas populações estudadas. No presente estudo a população avaliada foi do estado de Minas Gerais, que constitui uma mistura de europeus (maioria de origem portuguesa e italiana), africanos e um menor percentual de descendentes de índios nativos.
Outro aspecto confundidor da idade materna referese à idade paterna. É bem reconhecido que a idade paterna avançada (> 40 anos) está associada com o aumento do risco para diversas doenças, como acondroplasia, síndrome de Apert e neurofibromatose, sendo possível ter relação com FL/P17. Associação de mutações em MSX1 (muscle segment homeobox) e FL/P suporta a hipótese da relação entre idade paterna com FL/P o que já foi observado na síndrome de Apert8. Hay21 e Bille et al.22 relatam que o risco de FL/P com o aumento da idade materna pode ser refletido no aumento da idade paterna. No presente estudo, idade paterna não mostrou associação estatística significante com a ocorrência de FL/P (OR: 0,7; 95% IC: 0,36-1,35) (Tabela 5). Também não se observou significância estatística quando se avaliou idade materna e paterna concomitante para o risco de FL/P.
Existem evidências mostrando relação entre a ordem de paridade (filhos de gestações posteriores) e doenças como: diabetes tipo 1, esquizofrenia e câncer de mama23. Há também associação da ordem de paridade com doenças cardíacas congênitas, defeitos do tubo neural e FL/ P20. Contudo, não há consenso se ordem de paridade apresenta relação com FL/P23. No presente estudo não houve associação estatística significante entre ambas as variáveis (OR: 0,6; 95% IC: 0,34-1,05). Entre os pacientes com FL/P analisados, 74% nasceram nas duas primeiras gestações. Mesmo quando a análise estatística foi realizada no grupo dos pacientes com FL/P, não houve associação entre a ordem de paridade e FL/P (x2=0,76; p=0,383). Um dos primeiros estudos caso-controle realizados para aferir a relação entre ordem de paridade e FL/P foi realizado em 1953, na Inglaterra e não se observaram correlação entre ambas as condições24. Posteriormente, avaliações em populações do Sri Lanka, da França e do Irã também não observaram relação entre ordem de paridade e FL/P25-27. Por outro lado, investigações na América Latina, Suíça, EUA e China mostraram relação positiva entre ordem de paridade e FL/P20,28,29. Vieira e Orioli23, em um estudo de meta-análise sobre ordem de paridade e FL/P, mostraram associação estatística positiva entre as condições.
Investigações científicas têm mostrado relação entre intervalo interpartal curto (< 6 meses) e diversas alterações, incluindo defeitos do tubo neural, doenças cardíacas congênitas, nascimento de bebês com baixo peso e anemia11. Esta associação tem sido atribuída à redução no nível de ácido fólico30. Existem indicações que a suplementação com ácido fólico pode ter um efeito protetor para diversas doenças congênitas, incluindo as FL/P31. Nestas alterações, particularmente, a suplementação com ácido fólico reduz em um 1/3 o risco para FL/P32. Redução nos níveis de folato verificado em intervalos interpartais reduzidos tem sido associada a um risco aumentado para restrição no crescimento fetal33. Recentemente, foi mostrado que obesidade materna e aumento nos intervalos interpartais estão associados com FP isoladas34. No presente estudo, os períodos interpartais foram classificados em três intervalos, sendo que não se observou diferença estatística significante entre os mesmos (Tabela 5).
Com relação à etiopatogenia das FL/P, Vieira9 comparou este evento biológico com um quebra-cabeça, contendo mais de 100 peças e que diversos genes (entre 3 a 14) mais alguns fatores de risco estão envolvidos na origem das FL/P. Assim, embora se conheça melhor a participação de genes como IRF6 (fator regulador de interferon 6), FGF (fator de crescimento fibroblástico), MSX1 e fatores de risco ambientais, a aplicação prática deste conhecimento ainda é limitada. Assim, estudos para se compreender melhor a atuação destes agentes em modelos animais e em in vitro possibilitarão o desenvolvimento de testes e terapêuticas mais eficazes no futuro.
CONCLUSÃO
Observou-se neste estudo caso-controle, avaliando fatores de risco ambientais para ocorrência de FL/P nãosindrômicas, que houve predomínio, respectivamente, de FLP, FL e FP isoladas. Embora com uma população limitada e oriunda de um único estado brasileiro, observou-se associação entre idade materna e risco aumentado para FL/P. Verificou-se que os intervalos temporais de 26 a 35 anos e acima de 35 anos apresentaram riscos reduzidos para ocorrência de FL/P comparados a mulheres com idade até 25 anos. Entretanto, idade paterna, ordem de paridade e intervalo interpartal não se mostraram estatisticamente significante para ocorrência de FL/P.
AGRADECIMENTO
Aos pacientes e familiares participantes do estudo. Às sugestões do Dr. Antônio Prates Caldeira. À Fundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (HMJ).
REFERÊNCIAS BIBLIOGRÁFICAS
1. OPCS Congenital malformation statistics. Notifications 1992. London: HMSO; 1995.
2. Kot M, Kruk-Jeromini J. Analysis of family incidence of cleft lip and/or palate. Med Sci Monit. 2007;13(3):231-4.
3. Cobourne MT. The complex genetics of cleft lip and palate. Eur J Orthod. 2004;26(4):7-16.
4. Fogh-Andersen P. Inherance of harelip and cleft palate: contribution to the elucidation of the etiology of the congenital clefts of the face 1942 [Dissertation]. Copenhagen: Busck; 1942.
5. Tolarová MM, Cervenka J. Classification and birth prevalence of orofacial clefts. Am J Med Genet. 1998;75(2):126-37.
6. Martelli-Júnior H, Orsi-Júnior J, Chaves MR, Barros LM, Bonan PRF, Freitas JAS. Estudo epidemiológico das fissuras labiais e palatais em Alfenas, Minas Gerais, de 1986 a 1998. Rev Fac Odontol Univ São Paulo. 2006;13(1):31-5.
7. Mossey PA, Little J. Epidemiology of oral clefts: an international perspective. In cleft lip & palate. From origin of treatment. New York: Oxford University Press; 2006. p. 127-58.
8. Vieira AR. Unraveling human cleft lip and palate research. J Dent Res. 2008;87(2):119-25.
9. Meng L, Bian Z, Torensma R, Van der Hoff JW. Biological mechanisms in palatogenesis and cleft palate. J Dent Res. 2009;88(1):22-33.
10. Spina V, Psillakis JM, Lapa FS, Ferreira MC. Classificação das fissuras lábio-palatinas. Rev Hosp Clin Fac Med S Paulo. 1972;27(2):5-6.
11. Zeiger JS, Beaty TH. Is there a relationship between risk factors for oral clefts? Teratology. 2002;66(3):205-8.
12. Derijcke A, Eerens A, Carels C. The birth prevalence of oral clefts: a review. Br J Oral Maxillofac Surg. 1996;34(2):488-94.
13. Vanderas AP. Birth prevalence of cleft lip, cleft palate and cleft lip and palate among races: a review. Cleft Palate J. 1987;24(5):147-53.
14. Wantia N, Rettinger G. The current understanding of cleft lip malformations. Facial Plast Surg. 2002;18(4):147-53.
15. Martelli-Junior H, Porto LCVP, Barbosa DRB, Bonan PRF, Freitas AB, Coletta RD. Prevalence of nonsyndromic oral clefts in a reference hospital in Minas Gerais State, between 2000-2005. Braz Oral Res. 2007;21(4):314-17.
16. Paranaíba LMR, Almeida H, Barros LM, Martelli DRB, Orsi-Júnior JD, Martelli-Júnior H. Técnicas cirúrgicas correntes para fissuras lábiopalatinas, em Minas Gerais, Brasil. Braz J Otorhinolaryngol. 2009, in press.
17. Vieira AR, Orioli IM, Murray JC. Maternal age and oral clefts: A reappraisal. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;94(5):530-5.
18. Shaw GM, Croen LA, Cury CJ. Isolated oral cleft malformations: associations with maternal age and infant characteristics in a California population. Teratology. 1991;43(2):225-8.
19. Savitz DA, Schwingl PJ, Keels MA. Influence of paternal age, smoking, and alcohol consumption on congenital anomalies. Teratology. 1991;44(3):429-40.
20. Cooper ME, Stone RA, Liu YE, Hu DN, Melnick M, Marazita ML. Descriptive epidemiology of nonsyndromic cleft lip with or without cleft palate in Shangai, China, from 1980 to 1989. Cleft Palate Craniofac J. 2000;37(3):274-80.
21. Hay S. Incidence of clefts and parental age. Cleft Palate J. 1967;4(1):205-13.
22. Bille C, Skytthe A, Vach W, Knudsen LB, Andersen AMN, Murray JC, Christensen K. Parent's age and the risk of oral cleft. Epidemiology. 2005;16(3):311-6.
23. Vieira AR, Orioli I. Birth order and oral clefts: a meta analysis. Teratology. 2002;66(4):209-16.
24. Macmahon B, mckeown T. The incidence of harelip and cleft palate related to birth rank and maternal age. Am J Hum Genet. 1953;5(2):176-83.
25. Aramatunga NAS. A study of etiologic factors for cleft lip and palate in Sri Lanka. J Oral Maxillofac Surg. 1989;47(4):7-10.
26. Stoll C, Alembik Y, Dott B, Roth MP. Epidemiological and genetic study in 207 cases of oral clefts in Alsance, northeastern France. J Med Genet. 1991;28(5):325-9.
27. Rajabian MH, Sherkat M. An epidemiologic study of oral clefts in Iran: analysis of 1,669 cases. Cleft Palate Craniofac J. 2000;37(7):191-6.
28. Menegotto BG, Salzano FM. Epidemiology of oral clefts in a large South American sample. Cleft Palate Craniofac J. 1991;28(4):373-7.
29. Robert E, Kallen B, Harris J. The epidemiologic of orofacial clefts. J Craniofac Genet Dev Biol. 1996;16(2):234-41.
30. Oneill J. Do folic acid supplements reduce facial clefts? Evid Based Dent. 2008;9(3):82-3.
31. Czeizel AE, Toth M, Rockenbauer M. Population-based case control study of folic acid supplementation during pregnancy. Teratology. 1996;53(4):345-51.
32. Villamor E, Sparén P, Cnattingius S. Risk of oral clefts in relation to prepregnancy weight change and interpregnancy interval. Am J Epidemiol. 2008;167(11):1305-11.
33. Van Eijsden M, Smits LJ, van der Wal MF, Bonsel GJ. Association between short interpregnancy intervals and term birth weight: the role of folate depletion. Am J Clin Nutr. 2008;88(1):147-53.
34. Wilcox AJ, Lie RT, Solvoll K, Taylor J, mcconnaughey DR, Abyholm F. Folic acid supplements and risk of facial clefts: national population based care case-control study. BMJ. 2007;334(4):464.
1. Mestre, Professora de Semiologia da Universidade estadual de Montes Claros - Unimontes.
2. Cirurgiã-Dentista, Bolsista de Iniciação Científica do CNPq.
3. Doutora, Professora da Universidade de Alfenas.
4. Mestre, Professora Colaboradora do Programa de Pós-Graduação em Ciências da Saúde da Universidade Estadual de Montes Claros - Unimontes.
5. Doutor, Professor da Universidade de Alfenas.
6. Doutor, Professor Titular.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 20 de abril de 2009. cod. 6365
Artigo aceito em 9 de setembro de 2009