Ano: 2003 Vol. 69 Ed. 2 - Março - Abril - (3º)
Seção: Artigo Original
Páginas: 159 a 164
Alterações epiteliais e cartilaginosas em cirurgia traqueal: estudo experimental em cobaias
Epithelial alterations in tracheal transplantation: experimental study in guinea pigs
Autor(es):
Jair Cortez Montovani[1],
Victor Nakajima[2]
Palavras-chave: estenose, alterações epiteliais, transplante de traquéia.
Keywords: stenosis, epithelial alterations, tracheal homograf.
Resumo:
Transplante homógeno de traquéia foi realizado em 51 cobaias (Cavia Porcellus). Observamos reepitelização do enxerto a partir da traquéia receptora da cobaia, evoluindo de epitélio escamoso de 1 a 3 células nos animais com 3, 7 e 14 dias de observação para epitélio ciliado após 60 a 120 dias do transplante. A viabilidade do enxerto traqueal era boa, com reabsorção parcial da cartilagem e formação de estenose traqueal parcial, mas sem sinais clínicos evidentes de obstrução respiratória durante o tempo de observação dos animais.
Abstract:
Tracheal homograft was performed in 51 guinea pigs (cavia porcellus) in order to study the graft epithelization. After the transplant procedure we observed reepithelization of the graft which initiated from the recipient trachea. The new formed epithelium was of squamous type and had 1 to 3 cell layers and was observed in animals with 3, 7 and 14 days after the surgical procedure. Respiratory epithelium with cilia was present with 60 and 120 days after the transplant. Cartilage absorption close to the tracheal anastomosis was the cause of partial tracheal stenosis in some animals. No clinical repercussion was noted due to this partial stenosis. Our conclusion was that tracheal homograft is an efficient surgical procedure for tracheal reconstruction.
![]()
INTRODUÇÃO
O manuseio de estenose traqueal ou subglótica é motivo, ainda hoje, de controvérsias, e um dos tratamentos imediatos adotados, a traqueotomia, não é isenta de riscos. Estes incluem sangramento, pneumotórax, obstrução da cânula por rolha de secreção, extrusão da cânula traqueal, dificuldade para chorar, falar e taxa alta de mortalidade (2 a 24%)1-4.
Outro tratamento cirúrgico, a laringotraqueoplastia, tem como princípio incisão da cartilagem cricóide dos 2 primeiros anéis traqueais e colocação de um molde traqueal por 2 ou 3 semanas. A taxa de sucesso dessa técnica era de 75%3-5.
Prescott6 desenvolveu essa mesma técnica mas com colocação de um enxerto de cartilagem costal. Segundo ele e outros autores7-18, esse tipo de procedimento permitia uma extubação precoce, sem o uso de molde e com taxas de sucesso de 70 a 80% dos casos.
Outros procedimentos envolvem ressecções traqueais e anastomose término-terminal19-24. Essas cirurgias podem ser necessárias após trauma, cirurgias oncológicas ou estenoses de origem inflamatória, tumorais ou pós intubação. Geralmente ressecções até 6 a 8 cm podem ser reparadas usando anastomose término-terminal isoladas ou associada ao uso de próteses, enxertos de cartilagem nasal, costal e traqueal5,6,9,25,26. Freqüentemente, nestas cirurgias, o epitélio colunar ciliado transforma-se em epitélio escamoso com áreas de metaplasia epitelial e formação de tecido de granulação, obstruindo a luz traqueal17,27,28. A associação dessas alterações regenerativas epiteliais com reabsorção da cartilagem traqueal pode levar à formação de estenose circunferencial e, conseqüentemente, obstrução respiratória. A estenose resultante requer outras cirurgias, tais como dilatações e moldes de silicone ou metais25. Entretanto, mesmo com essas técnicas, há um potencial grande de complicações como: sangramento, erosão, deslocamento do molde, redução do lúmen, inflamação e formação de tecido de granulação25,26,29. É compreensível, portanto, que técnicas reconstrutivas traqueais usando materiais aloplásticos ou teciduais, em tese capazes de provocarem menor reação inflamatória, ao mesmo tempo que asseguram adequado lúmen traqueal, são motivos de constantes pesquisas9-17. O presente estudo tem por objetivo observar as características de regeneração do epitélio traqueal, ocorrência ou não de reabsorção cartilaginosa e luz traqueal adequada em transplante de traquéia.
MATERIAL E MÉTODOS
Cinqüenta e uma cobaias (Cavia Porcellus) de idade, peso e sexo variáveis, foram randomizados em grupos, de acordo com o tempo de observação dos animais (Tabela 1). Os animais foram submetidos à cirurgia, após anestesia intraperitoneal com pentobarbital (50 mg/kg de peso). Sob condições de assepsia, a traquéia cervical era exposta através de uma incisão mediana, após separação dos músculos e fascia pré-traqueal. Suturas de reparo foram colocadas na parede anterior da traquéia acima e abaixo do segmento a ser excisado. Depois da ressecção de 6 anéis traqueais, o homoenxerto traqueal foi colocado e suturado com fio mononylon 8.0, sutura término-terminal, pontos separados, sendo realizada, em primeiro lugar, a anastomose inferior.
O homoenxerto traqueal foi obtido de cobaias com idade e pesos semelhantes ao dos animais do grupo transplantado. A traquéia cervical foi excisada, retirando-se em média 6 a 8 anéis traqueais. A técnica de preparação e conservação deste enxerto, resumidamente, foi: lavagem com soro fisiológico, retirada do epitélio respiratório e partes moles e conservação em solução de formolaldeído 4,5% pH 5.6 durante 2 semanas. Antes do transplante, o homoenxerto foi lavado e embebido em solução fisiológica no mínimo por 2 horas, método este descrito com detalhes na literatura 4,9-11,13-16.
Os animais foram mantidos em cativeiro e sacrificados, conforme esquema da Tabela 1. Cinco animais foram eliminados do estudo, pois foram a óbito no primeiro dia do pós-operatório devido a depressão respiratória. Após o sacrifícios dos animais, os fragmentos traqueais foram preparados histologicamente com coloração para hematoxilina-eosina (HE), ácido tricrômico de Masson e ácido periódico de Schiff (PAS). Os cortes histológicos foram realizados transversalmente e longitudinalmente. Foram estudados os seguintes aspectos: lúmen da traquéia transplantada, reepitelização, reabsorção cartilaginosa e reação inflamatória.
RESULTADOS
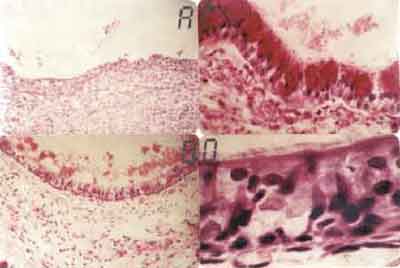
Nos animais com 3 dias de sobrevida, observamos exsudato fibrino-leucocitário na luz traqueal, com epitélio descamativo, destacando-se da parede traqueal. Intenso processo inflamatório neutrofílico acometia cório e submucosa, estendendo-se para adventícia e partes moles peritraquéias, inclusive da traquéia receptora (Figura 1A e 1B). Próximo à região da anastomose, na área receptora, notavam-se focos de metaplasia escamosa em 7 dos 9 animais deste grupo. O epitélio era reativo, constituído de células de núcleos volumosos, hipercorados e nucléolos evidentes. Aos 7 dias, encontramos exsudato fibrino-leucocitário compacto na luz traqueal, formando, às vezes, uma rolha traqueal. No enxerto próximo à anastomose, havia formação de epitélio escamoso reativo, hiperplasia de células basais e tecido de granulação com algumas células gigantes do tipo corpo estranho ao redor dos fios de sutura. Nos animais do subgrupo 3 (14 dias), o epitélio de revestimento do enxerto era formado de 1 a 3 camadas de células, preenchendo quase toda a área transplantada (Figura 1C e 1D). Em 2 animais, observamos a formação de células caliciformes e áreas de epitélio ciliado próximo à anastomose.
Nos animais com observação tardia (30 dias), havia estenose parcial da traquéia doadora, em graus variáveis, mas com adequada luz traqueal. Em 7 animais, o enxerto estava revestido totalmente por epitélio respiratório e, em 2, o epitélio era escamoso com 3 camadas de células em áreas centrais à anastomose. Nas áreas com epitélio reativo (metaplasia epitelial) o infiltrado inflamatório era neutrófilico com raros linfócitos no cório e submucosa (Figura 2A). Mesmo em áreas que o epitélio de revestimento do enxerto era do tipo respiratório, ocorreu intensa proliferação celular, congestão vascular no cório e submucosa. Nas regiões de anastomose, observamos, ao redor dos fios de sutura, reação granulomatosa constituída de histiócitos e células gigantes com focos de reabsorção cartilaginosa.
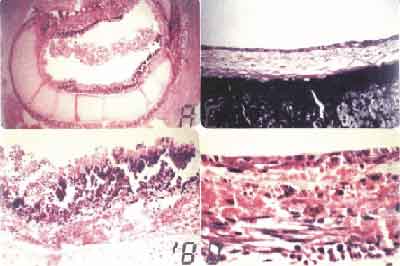
Nos animais do subgrupo 60 dias, o epitélio de revestimento do enxerto era do tipo respiratório com inúmeras células caliciformes e presença de cílios (Figura 2B). Em 3 animais, havia glândulas subepiteliais em meio ao tecido conjuntivo denso, revestidas por epitélio cilíndrico simples pseudoestratificado com células calidiformes. Em outros 3 animais, foram observados, na região da anastomose, focos de metaplasia escamosa, reabsorção cartilaginosa, graus variáveis de desestruturação traqueal e estenose parcial do enxerto. Os animais com tempo de observação de 120 dias mostravam, no cório e submucosa, fibroblastos jovens com formação de fibras elásticas em meio a tecido conjuntivo denso. O epitélio era cilíndrico, ciliado, com inúmeras células caliciformes produtoras de muco (Figura 2C e 2D).
FIGURA 1:- A. Reação inflamatória neutrofílica no cório, submucosa e pericôndrio agredindo e descamando o epitélio traqueal (HE - 31X). B. Aumento maior do campo anterior, mostrando em detalhe a reação inflamatória neutrofílica agredindo e lesando o epitélio. Observa-se a cartilagem de aspecto hialino e condrócitos com núcleos apagados (HE-500x). C. Epitélio escamoso constituído de 1 a 3 camadas de células. Área de calcificação da cartilagem mostrada pela cor preta (HE-320X). D. Maior aumento do campo anterior mostrando em detalhe o epitélio escamoso constituído de 1 a 3 camadas de células (HE 640 X).
FIGURA 2:- A. Área de metaplasia escamosa e epitélio reacional (HE - 200X). B. Epitélio respiratório mostrando células caliciformes e tecido conjuntivo frouxo na submucosa (HE-192X). C. Epitélio respiratório corado com PAS, mostrando em vermelho muco produzido pelas células caliciformes (PAS - 1250 X). D. Epitélio cilíndrico ciliado, células caliciformes e células de reserva (HE-1600X).Tabela 1
Tabela 1. Transplante traqueal em cobaias. Tempo de sobrevida em dias. Peso dos animais. Metaplasia. Estenose traqueal. (E) = epitélio de enxerto; (R) epitélio da traquéia receptora; (+) presença; (-) ausência dos aspectos estudados.
DISCUSSÃO
Um dos critérios para avaliar uma adequada prótese traqueal é a qualidade da reepitelização na traquéia transplantada5,11. Vários autores descreveram as características da regeneração epitelial bem como a sua origem e a formação de tecido de granulação traqueal3,7,12,27,28,30. Para Morfitt et al. (1955)7, a regeneração epitelial ocorre a partir da região da anastomose, dos tecidos moles adjacentes e da traquéia receptora. Nos primeiros dias, até a terceira semana, observa-se epitélio cubóide multiestratificado. Atamanyuk e Melrose (1965)14 descreveram que essas alterações histológicas tipo metaplasia epitelial e epitélio escamoso são fases evolutivas da regeneração epitelial, acompanham as fases em que a agressão é maior e tendem a desaparecer em fases com predomínio da reparação tecidual16. Outras alterações, como a hiperplasia de células basais e aumento da secreção glandular, também aparecem no início da regeneração epitelial, estando intimamente associadas à agressão cirúrgica e às fases reparativas de qualquer injúria tecidual16,17,27,28.
Essas alterações foram observadas por nós em todos os animais. Nos primeiros dias, até 1 semana, ocorria intenso processo inflamatório neutrofílico que agredia e descamava o epitélio do transplante. Porém, logo cedo, já na segunda semana, começava uma fase reparativa, com epitélio escamoso de 1 a 3 camadas de células, próximo à anastomose traqueal, com posterior evolução para epitélio respiratório. Em 30 dias, o epitélio do tecido transplantando não apresentava quase sinais de atividade inflamatória aguda, exceto a observação de grande quantidade de células caliciformes produtoras de mucina. A persistência destas células constitui sinal de atividade inflamatória residual e a formação de muco obstruindo as vias aéreas explicaria muito das complicações e óbitos que ocorrem em fases mediatas e tardias do pós-operatório1-3,6,9,1617.
É nesse período, após 4 a 6 semanas do transplante, que começa a haver substituição das áreas de reabsorção cartilaginosa, próximas às áreas de anastomose, por tecido conjuntivo denso. Estas áreas são mais frágeis e é nelas que se observa diminuição da luz traqueal (estenose). Para alguns autores estas alterações (processo inflamatório crônico, tecido cicatricial e estenose) poderiam estar associadas a uma rejeição ao tecido transplantado. Nesses casos o uso de drogas imunossupressoras, entre elas, os corticóides, ou mesmo a esplenectomia, seriam úteis, como meios terapêuticos de retardar ou diminuir a intensidade da rejeição19-22.
Em nosso trabalho não usamos nenhuma técnica imunossupresora para minimizar a rejeição ou diminuir o processo inflamatório pois entendemos que muito mais que uma rejeição em si, a formação de tecido cicatricial teve como causas: (1) a desvitalização da cartilagem pela técnica de conservação do enxerto ou (2) pelo trauma da técnica cirúrgica. Mesmo tendo o cuidado, como recomendado anteriormente por Maeda e Grillo23, de se usar fios de sutura com mini-agulhas sob técnicas microscópica e próteses com no máximo seis anéis traqueais para diminuir a tensão na anastomose, notamos que ocorria a fragmentação e necrose parcial da cartilagem traqueal transplantada e receptora, que era substituída por tecido colágeno denso.
Isto também foi observado por outros autores, em estudo com seguimento clínico maior19-22. A cartilagem traqueal era completamente substituída por colágeno com formação de estenose circunferencial parcial ou tardia, 8 a 12 meses após o transplante. Nessas situações, devido à diminuição da luz traqueal, seria de se esperar dificuldade respiratória e mesmo morte dos animais. No entanto, tanto nesses estudos como no nosso, nossos animais não apresentavam estridor e desenvolveram-se normalmente, inclusive com ganho de peso. Então como se explicaria, apesar da reabsorção e fragmentação da cartilagem que o lúmen traqueal era satisfatório? Para alguns autores, e concordamos com eles, a permeabilidade da luz traqueal seria explicada pelo aparecimento de fibras elásticas no córion e submucosa da traquéia transplantada, principalmente nos animais com sobrevida de 60 e 120 dias18-22. Estas fibras elásticas, parcialmente responsáveis pelas variações no comprimento, diâmetro e posição da traquéia normal durante a respiração, deglutição e movimentos do pescoço, teriam a capacidade também de manter a luz traqueal, se não em sua totalidade, em dois terços dela. Outros fatores, não excludentes, seria a formação de tecido colágeno e a calcificação em grande parte da cartilagem transplantada.
CONCLUSÃO
Embora ocorra reepitelização do enxerto, a persistência de processo inflamatório residual em fases tardias do transplante (120 dias) e a própria formação de tecido cicatricial com conseqüente estenose mostram que aspectos relacionados com a manutenção do lúmen traqueal e rejeição tecidual merecem novos estudos antes de uma inserção definitiva dessa técnica em cirurgias reparativas da traquéia no homem.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Flemming i, Hommerich kw. Tracheal stenosis development and the latest state of experimental surgery. J Fr Oto-Rhino-Laryngol 1974;23:387-92.
2. Cotton RT, Gray SD, Miller RP. Update of the cincinnati experience in pediatric laryngotracheal reconstruction. Laryngoscope 1989;99:1111-1116.
3. Grillo HC. Reconstruction of the trachea: experience in 100 consecutives cases. Thorax 1973;28:667-78.
4. Hoffer ME, Tom LW, Wermore, RF, Handler SD, Potsic WP. Congenital tracheal stenosis. The otolaryngologists perpectives. Arch Otolaryngo. Head Neck Surg 1994;120:449-53.
5. Cotton RT, Myer CM III, O´Connor DM, Smith ME. Pediatric laryngotracheal tube reconstruction with cartilage grafts and endotracheal tube stenting: the single-stage approach. Laryngoscope 1995;105:818-21.
6. Prescott CA. Protocol for management of the interposition cartilage graft laryngotracheoplasty. Ann Otol Rhinol Laryngol 1988;97:239-42.
7. Morfitt H, Neerken aj, Prevedel A, Liddle eb, Kircher l. Sleeve resections of the trachea. Arch Surg 1955;70:654-61.
8. Grillo hc. Experimental reconstruction of cervical trachea after circunferential resection. Surg Gynec Obstet 1966;122:73-77.
9. Bailey bj, Camp fa. Currents concepts in reconstruction of the cervical trachea. Am J Surg 1969;35:153-65.
10. Drettner B, Lindholm ce. Experimental tracheal reconstruction with composite graft from nasal septum. Acta Otolaryngol 1970;70:401-7.
11. Zalzal gh. Cartilage grafts for the treatment of posterior glottic and sugglottis stenosis in children. Ann Otol Rhinol Laringol 1988;97:509-11.
12. Ilberg c von. Reconstruction chirurgicalle de la trachée par homogreffe de trachée conservée dans du cialit. Paris: Ann Oto-Laryng 1982;99:505-508.
13. Tala P, Maamies tj. Observations in tracheal reconstruction in experimental animals. Annales Chirurgial et Gynaecologicae Fenn 1968;57: 493-6.
14. Atamanyuk my, Melrose dg. The treatment of the cincunferential defects of the tracheas. Brit J Surg 1965;52:59-65.
15. Denecke hj. Reconstruction of the trachea: surgical treatment with flaps and grafts. J Fr Oto-Rhino-Laryngol 1974;23:407-8.
16. Matsumura K, Shors ec, Cohen ah, Jensen ti, Benfield jr. Experimental canine tracheal grafts with reversible squamous metaplasia. Am Rev Respir Dis 1977;116:957-61.
17. Spain dm The distinction between regenerative and atypical alterations in the bronchial mucosa. Am Rev Tuberc 1959;79:591-6.
18. Idriss FA, Deleon SY, Ilbami MN, Gerson CR, Tucker GF, Holinger L. Tracheoplasty with pericardial patch for extensive tracheal stenosis in infants and children. J Thorac Cardiovasc Surg 1984;88:527-36.
19. Anand vk, Alemar g, Warren et. Surgical considerations in tracheal stenosis. Laryngoscope 1992;102:237-243.
20. Ferguson DJ, Wild JJ, Wangensteen OH. Experimental resection of the trachea. Surgery 1950;28:597-619.
21. Davies og, Edmiston m, mccorckle h.J. The repair of experimental tracheal defects with fresh and preserved homologous tracheal grafts. J Thorac Surg 1952;23:367-368.
22. Farrington wt, Hung wc, Binns pm. Experimental tracheal homografting. J Laryng 1977;91:101-10.
23. Alonso wa, Bridger pg, Bordley je. Tracheal transplantation in dogs. Laryngoscope 1972;82:204-9.
24. Seid AB, Pranski SM, Kearns DB. One-stage laryngotracheoplasty. Arch Otolaryngol Head Neck Surg 1991;117:408-10.
25. Wallace MJ, Charnsangavy C, Ogawa K et al. Tracheobronchial tree: expandable metallic stents used in experimental and clinical applications. Work in progress. Radiology 1986;158:309-12.
26. Trachbihler H, Hoelzl J, Dietz FG. Tissue compatibility and biodegradation of new absorbable stents for tracheal stabilization: na experimental study. J Pediatr Surg 1997;32:717-720.
27. Correl no jr, Beattie ej jr. The characteristics of regeneration of respiratory epithelium. Surg Gynec Obstet 1956;103:209-11.
28. Greenberg sd, Willms rk. Regeneration of respiratory epithelium: an experimental study in dogs. Arch Path 1962;65-70.
29. Pearson SE, Stelow EB, Rimell F, Pernell K. Tracheal reconstruction with a synthetic material in a porcine model. Ann Otol Rhinol Laryngol 2001;110:718-722.
30. Greenberg sd. Tracheal homografts in dogs. Arch Otolaryng 1958;67:577-86.
[1] Livre-Docente em Otorrinolaringologia do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Botucatu - UNESP.
[2] Professor Assistente do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Botucatu - UNESP.
Endereço para Correspondência: Prof. Dr. Jair Cortez Montovani - Faculdade de Medicina de Botucatu - Universidade Estadual Paulista "Júlio de Mesquita Filho" UNESP 18.618-0000. - Fax (0xx14) 6822-0421