Ano: 2003 Vol. 69 Ed. 2 - Março - Abril - (2º)
Seção: Artigo Original
Páginas: 151 a 158
O comportamento clínico e histológico da pele do rato submetida ao uso tópico e injetável de Mitomicina C
The clinical and histological behavior of rat skin submitted to topical and injected Mitomycin C
Autor(es):
Prof. Dr. Fernando de Andrade Quintanilha Ribeiro[1],
Janaina de Pádua Borges[2],
Dra. Flávia Fernandes Silva Zacchi[3],
Dra. Lusiele Guaraldo[4]
Palavras-chave: mitomicina C, cicatrização, inibição de fibroblastos.
Keywords: mitomycin-C, fibroblast inhibition.
Resumo:
Introdução: A Mitomicina C é um quimioterápico que apresenta a capacidade de inibir fibroblastos in vitro. Esta característica a levou a ser usada experimentalmente em animais de laboratório e no ser humano, principalmente em oftalmologia, para inibir o processo cicatricial. Este trabalho visa acompanhar o processo de cicatrização de feridas cirúrgicas feitas em dorsos de ratos e tratadas topicamente com Mitomicina C, comparando-as com feridas no mesmo local, não tratadas. Propõe-se também a avaliar a resposta da pele quando injetada com concentrações diferentes do medicamento. Material e Métodos: Foram feitas, em 10 ratos, duas feridas cirúrgicas em seus dorsos. Uma delas foi tratada topicamente com Mitomicina C na diluição de 0,5 mg/ml por 5 minutos e outra não. O processo de cicatrização destas feridas foi acompanhado clinicamente. Posteriormente, os ratos foram sacrificados em períodos diferentes, e suas feridas estudadas histologicamente quanto ao grau de fibrose por dois anatomopatologistas. Posteriormente, três ratos foram submetidos a injeções intradérmicas com concentrações diferentes de Mitomicina C, e o comprometimento local foi avaliado clínica e histologicamente, sendo que apenas na concentração de 0,01mg/ml não se observou necrose tecidual. Resultados: As feridas tratadas com Mitomicina C tiveram seu processo cicatricial retardado, com o desaparecimento das crostas locais 7 dias após o das feridas não tratadas. Ao exame histológico, observado separadamente por dois anatomopatologistas, observou-se no primeiro mês uma nítida diminuição do grau de fibrose nas feridas tratadas com Mitomicina C em relação às não tratadas. Este grau de fibrose se iguala, nas duas feridas, no terceiro mês. Quanto às diluições injetadas, notou-se clínica e histologicamente uma necrose tecidual proporcional ao grau de concentração (0,5; 0,1; e 0,05 mg/ml), que não foi observada na concentração de 0,01mg/ml. Conclusão: A Mitomicina C usada topicamente em feridas cirúrgicas em ratos retarda seu processo de cicatrização até a 4ª semana. Na 12ª semana este processo se equaliza. Quando usada intradermicamente, causa necrose tecidual apenas em concentrações elevadas. Estas características da Mitomicina C podem ser usadas, em otorrinolaringologia, como coadjuvante no tratamento de estenoses do meato acústico externo, imperfurações coanais, sinéquias nasais, estenoses laríngeas e quelóides.
Abstract:
Objective: The proven ability of Mitomycin-C of inhibiting fibroblasts in vitro, has stimulated its use in research animals and in humans to control healing. The objective of this prospective experimental study was to follow the healing process of surgical wounds in the dorsum of rats treated topically with Mitomycin-C. It also evaluates the skin response to injections of different concentrations of this drug. Material and Methods: Two distinct surgical wounds were made to the dorsum of ten adult rats, one of them received topical Mitomycin-C diluted at 0.5 mg/mL during 5 minutes and the other wound was used as a control. Three other rats were submitted to intradermal injections of Mitomycin C at different concentrations. The healing process of all three groups of rats was followed clinically and histologically after sacrificing the rats at different post-treatment periods. The degree of fibrosis was evaluated histologically by two distinct pathologists. Results: Surgical wounds treated with Mitomycin-C presented delayed healing when compared to the untreated wounds, with remission of scabs 7 days after the control wounds. Histological analysis at one month post-treatment revealed a significant reduction in fibrosis of the wounds treated with Mitomycin-C when compared to the untreated wounds. After the third month the degree of fibrosis was comparable in both wounds. As for the injected dilutions, clinical and histological necrosis was proportional to the concentration (0.5; 0.1; and 0.05 mg/ml). The only concentration at which no necrosis was observed was 0.01 mg/ml. Conclusion: Topical Mitomycin-C delays the healing of surgical wounds in rats up to the forth week following treatment, but the degree of fibrosis is comparable in both wounds after 12 weeks. Its intradermal use cased necrosis only at high concentrations. In otolaryngology this characteristic of the drug may be useful in the treatment of external ear canal stenosis, coanal atresias, nasal cicatricial stenosis, laryngeal stenosis and keloids.
![]()
Introdução
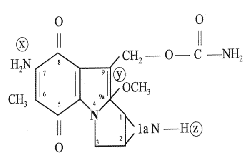
A cirurgia otorrinolaringológica, primordialmente cavitária, se depara, freqüentemente, com suas estenoses e sinéquias, quer congênitas, quer adquiridas, principalmente iatrogenicamente. Mesmo frente a uma técnica cirúrgica adequada, a recidiva nestes casos é incomodamente freqüente. Vários processos coadjuvantes à cirurgia são tentados no sentido de minimizar este problema, como o uso de medicamentos e beta-terapia, e nem sempre com resultados satisfatórios. Nestes casos, uma possibilidade promissora é o uso tópico da Mitomicina C, que já vem sendo usada por colegas, de modo empírico, em todo o mundo. Esta droga é um antibiótico isolado do Streptomyces caespitosus por Wakaki et al. em 1958. Apresenta-se sob a forma de cristais azul-violeta, tem peso molecular de 334 e é solúvel em água e solventes orgânicos. Sua molécula possui três grupos reconhecidamente carcinostáticos: um anel de aziridina, o grupo quinona e o grupo octano. (Figura 1). É comumente usada como quimioterápico, em aplicações endovenosas, para tratamento de corioepitelioma, sarcoma de células reticulares, seminoma e tumores epiteliais, além de tumores da cavidade bucal, pulmões, intestino, pâncreas e estômago. Também, em alguns casos, é usada em tratamento anti-neoplásico por contato, principalmente em tumores da bexiga1,2,3. Como efeitos colaterais graves, notou-se aplasias medulares em doses endovenosas acima de 50mg e necroses teciduais locais quando do extravasamento da droga no subcutâneo. Vários trabalhos na literatura demonstram sua eficácia como inibidor do crescimento tumoral, pela sua ação direta sobre o DNA. Trabalhos in vitro demonstram sua capacidade de inibição de fibroblastos4 e esta característica determinou, após estudos experimentais em animais5,6, o início de seu uso em oftalmologia para o controle da recidiva nas cirurgias do pterígeo e do glaucoma7,8,9. Raros trabalhos na área da otorrinolaringologia foram feitos, apenas experimentalmente, em animais, para observar cicatrizações de traumas laríngeos induzidos10-14, assim como para retardar a cicatrização de paracenteses da membrana timpânica, o que poderia ser usado como alternativa para a cirurgia de colocação de tubos de ventilação15-18. Um trabalho apresenta a possibilidade de seu uso tópico, no saco endolinfático, para tratamento da doença de Ménière19. Na área da cirurgia geral foi estudada no sentido de inibir sinéquias intra-abdominais20. Nenhum destes trabalhos, entretanto, são baseados em estudos detalhados e em uma metodologia bem definida.
Objetivo
Nossa proposta foi a de estudar, em ratos, clínica e histologicamente, o processo comparativo de cicatrização entre duas feridas cirúrgicas, uma apenas tratada topicamente com Mitomicina C, e o comportamento clínico e histológico do local de infiltração com concentrações diferentes do medicamento.
Material e Método
O trabalho foi realizado na Unidade de Técnica Cirúrgica e Cirurgia Experimental da Faculdade de Ciências Médicas da Santa Casa de São Paulo, e os estudos histológicos no Departamento de Anatomia Patológica.
Foram utilizados, para se observar o comportamento tópico do medicamento,10 ratos adultos machos jovens, e para avaliar as concentrações intradérmicas, três fêmeas, todos da linhagem Wistar, com idades entre 180 e 210 dias e pesos entre 355 e 400g, que foram acomodados em gaiolas individuais no biotério da Unidade de Técnica Cirúrgica.
Sobre as feridas cirúrgicas
Em cada um dos 10 ratos, no mesmo dia, usando-se uma medida padrão (arruela) (Figura 2), foram feitas, após depilação e sob anestesia geral: Quetamina (Francotar®) 10ml na concentração de 100mg/ml na dose de 0,5 ml/rato e Xilasina (Rompun®) 10 ml na concentração de 20 mg/ml na dose de 0,1 ml/rato - 2 feridas cirúrgicas circulares iguais em seus dorsos (local escolhido para que não se auto ferissem) (Figura 3). A ferida cranial foi chamada de A e a caudal de B, com tamanho de 1 cm de diâmetro, e a distância entre elas de aproximadamente 5 cm. Numa delas foi colocada, topicamente, a Mitomicina C, na concentração de 0,5mg/ml, pelo tempo de 5 minutos. Esta concentração foi a escolhida, pois em uma concentração superior a essa haveria precipitação do medicamento e por ser a normalmente usada na literatura, sem que se houvesse relato de qualquer tipo de lesão local9,12,13,15. Usou-se 2 ml da droga, gotejada sobre um pedaço de gaze que recobria a ferida (Figura 4). Após isso, a ferida foi lavada com 10 ml de soro fisiológico corrente. A mesma conduta foi utilizada na ferida não tratada com Mitomicina C, ou seja, colocação de 2ml de soro fisiológico sobre a ferida, por 5 minutos, e posterior lavagem com 10 ml de soro fisiológico. Usamos, aleatoriamente, ora as feridas craniais ora as caudais para o uso da Mitomicina C, evitando com isso qualquer diferença local de cicatrização. Os ratos foram numerados de 1 a 10, tanto nas gaiolas quanto através de marcação com tinta nas respectivas caudas. Foram acompanhados semanalmente para uma verificação visual das características das cicatrizações, por dois observadores, separadamente. Foram posteriormente sacrificados (KCl 19,1% intracardíaco, após anestesia geral), quatro ratos com 4 semanas, e seis ratos com 12 semanas, e as cicatrizes retiradas cirurgicamente e encaminhadas para exame histológico (hematoxilina-eosina). Dois anatomopatologistas experientes, que não tinham noção de quais cicatrizes (se dorsais ou caudais) haviam sido tratadas com Mitomicina C, as examinaram, separadamente, e teceram apreciações sobre seu grau de fibrose. Quando do sacrifício dos ratos, foi colhido sangue (1 em cada 3) para estudo hematológico no sentido de se averiguar eventual distúrbio hematopoiético.
Sobre as injeções intradérmicas
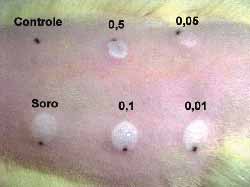
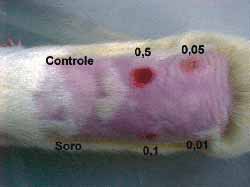
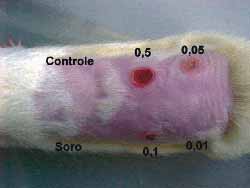
No dorso dos três ratos utilizados, após depilação e sedação conforme descrito anteriormente, foram escolhidas 6 regiões. Uma serviu como controle (acima à esquerda) e em cada uma das outras foram feitas 5 injeções intradérmicas. A primeira (abaixo e à esquerda) com soro fisiológico e as restantes com concentrações variadas de 0,5 mg/ml (acima, no centro); 0,1 mg/ml (abaixo, no centro); 0,05 mg/ml (acima á direita) e 0,01mg/ml. (abaixo à direita) (Figura 5). Os locais das injeções foram avaliados diariamente e após 7 dias os ratos foram sacrificados e os locais das injeções estudados histologicamente.
Resultados
Quanto ao uso tópico
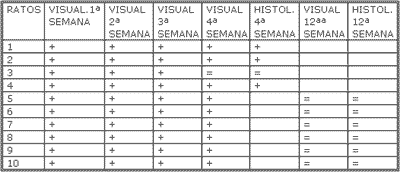
A observação visual da velocidade de cicatrização das feridas, em todos os ratos, foi a mesma. Todas as feridas formaram uma crosta nos dias subseqüentes à operação. Nas não tratadas com Mitomicina C, estas crostas iam diminuindo até cair por volta de 2 semanas. Nas tratadas com Mitomicina C, as crostas demoraram neste processo por volta de 3 semanas (Figura 6). Na observação visual das feridas, pelos dois observadores, constatou-se uma diferença no processo de cicatrização em todos ratos, exceto em um, até a 4ª semana. Na 12ª semana todas as cicatrizes se mostraram iguais, não sendo possível diferenciar as tratadas das não tratadas com Mitomicina C.
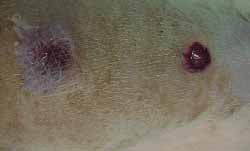
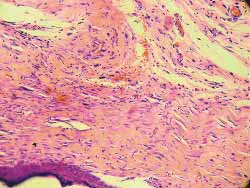
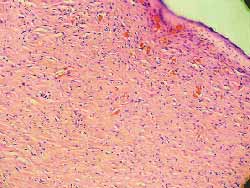
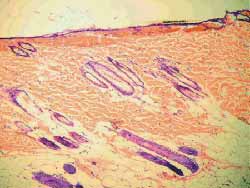
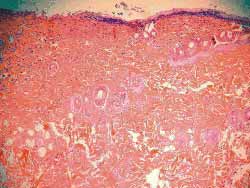
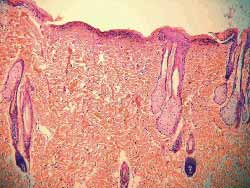
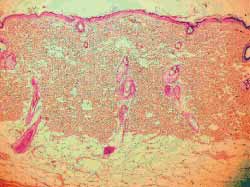
Nos 4 ratos sacrificados com 4 semanas observou-se, histologicamente (hematoxilina-eosina), menor grau de fibrose nas feridas tratadas com Mitomicina C (Figura 7) em relação às feridas não tratadas (Figura 8), exceto em 1 rato que as apresentava iguais. Nos 6 ratos sacrificados com 12 semanas, não se observou, histologicamente, diferença quanto ao grau de fibrose nas feridas tratadas ou não com Mitomicina C (Figuras 9 e 10) (Quadro 1).
Quadro 1. O sinal + determina quando ambos os observadores conseguiram diferenciar as feridas tratadas das não tratadas com Mitomicina C, quer na observação visual quer na histológica. O sinal = quando ambas as feridas se encontravam iguais.
Os exames de sangue dos ratos, feitos pelo laboratório Central da Santa Casa de Misericórdia de São Paulo, foram todos semelhantes e normais, não se observando nenhum sinal de aplasia medular, mesmo nos sacrificados mais precocemente.
Quanto às concentrações injetadas
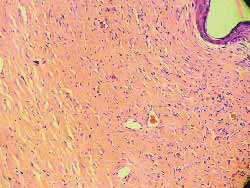
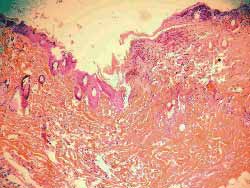
Notou-se, nos três ratos, a partir do segundo dia, mudança na coloração das regiões injetadas com concentrações de 0,5; 0,1 e 0,05 mg/ml. Nas regiões injetadas com soro fisiológico, e nas com concentração de 0,01 mg/ml, nada foi observado de diferente quando comparadas, visualmente, com a região controle. A partir deste dia, ocorreu necrose da pele, proporcionalmente mais intensa nas regiões injetadas com concentrações mais elevadas, e apenas na concentração de 0,01 mg/ml nenhum processo de necrose foi observado visualmente. (Figura 11). Os ratos foram sacrificados no 7º dia e os locais estudados histologicamente (hematoxilina-eosina-100 vezes). Os mesmos achados (necrose proporcional às concentrações) foram observados, sendo que na concentração de 0,01 mg/ml não se observou, à microscopia, qualquer lesão tecidual, resultado comparável aos das regiões controle e da injeção de soro fisiológico. (Figuras 12-17)Índice das figuras
Figura 1. Molécula da Mitomicina C
Figura 2. Arruela sobre o dorso do rato
Figura 3. Feridas (A e B) de 1cm nos dorsos dos ratos
Figura 4. Gaze embebida de Mitomicina C sobre uma das feridas, colocada por 5 minutos.
Figura 5. Dorso do rato com a área controle, a injetada com soro fisiológico e as nas diferentes concentrações.
Figura 6. Observação do dorso do rato, onde a ferida não tratada com Mitomicina C já se apresenta fechada, ao contrário da tratada (3 semanas)
Figura 7. Fibrose menos acentuada na ferida tratada com Mitomicina C (4 semanas). (100 vezes)
Figura 8. Fibrose mais acentuada na ferida não tratada com Mitomicina C (4 semanas) (100 vezes)
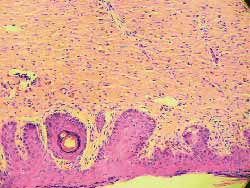
Figura 9-10. Mesmo grau de fibrose nas feridas tratadas ou não com Mitomicina C (12 semanas) (100 vezes)
Figura 11. Dorso do rato com as áreas controle, injetada com soro e nas diversas concentrações Nota-se os diferentes graus de necrose e o tecido normal na concentração de 0,01 mg/ml de Mitomicina C.
Figura 12. (A) controle, ausência de alterações (100 vezes)
Figura 13. (B) soro fisiológico, erosão superficial do epitélio em reparação ou já reparada (picada da agulha) (100 vezes)
Figura 14. (C), 0,5, extensa necrose da epidreme e derme, por vezes até a tela subcutânea, com acúmulos de piócitos, com discreta proliferação de tecido conjuntivo fibroso, com destruição dos anexos epidérmicos (100 vezes)
Figura 15. (D) 0,1,necrose mais superficial do que em C, com exsudato de piócitos, também mais discreto do que em C, com processo inflamatório importante e anexos epidérmicos mantidos. Homogeneização do tecido colágeno (100 vezes)
Figura 16. (E) 0,05, necrose da epiderme e derme mais superficial do que em D, com escasso exsudato de piócitos e anexos epidérmicos mantidos (100 vezes)
Figura 17. (F) 0,01: sem alterações (100 vezes)
Discussão dos resultados
A Mitomicina C, já usada há um bom tempo como quimioterápico, tanto endovenosamente como topicamente, mostra características de inibidora de fibroblastos, in vitro, o que a levou a ser usada principalmente em oftalmologia, no sentido de inibir o processo cicatricial. Em cirurgias de pterígio e glaucoma, vem mostrando resultados muito bons, inibindo suas recidivas. Alguns trabalhos, principalmente experimentais, têm sido realizados na área da otorrinolaringologia, mas sem uma metodologia determinada e uniforme.
Quanto ao seu uso tópico
A Mitomicina C na concentração de 0,5 mg/ml não traz nenhum comprometimento do local onde foi topicamente usada. A cicatrização da ferida onde a Mitomicina C foi colocada é mais lenta (queda das crostas com 21 dias) que a observada nas feridas não tratadas (queda das crostas com 14 dias). A cicatrização é retardada nas feridas tratadas com Mitomicina C até o primeiro mês, sendo que, neste período, a observação semanal constatou, por dois observadores separadamente, qual das feridas havia sido tratada com o medicamento. Na 4ª semana ainda se notava diferença de cicatrização das feridas em todos os ratos, menos em um, onde os dois observadores não as distinguiram. Na observação com 12 semanas não foi constatada nenhuma diferença visual entre as feridas tratadas e as não tratadas com Mitomicina C. Elas se completaram aparentemente do mesmo modo. O estudo histológico das cicatrizes mostra, inicialmente (4 semanas), uma diminuição da fibrose nas feridas tratadas com Mitomicina C, em comparação com as não tratadas. Posteriormente, esta fibrose se iguala em ambas as feridas. Portanto, existe um retardo na cicatrização, mas não uma inibição final do grau de fibrose.
A avaliação das características histológicas cicatriciais das feridas foi feita por dois observadores (anatomopatologistas experientes) independentemente, e aleatoriamente. Os resultados obtidos foram iguais em todos os casos, o que demonstra o acerto nas observações.
Os hemogramas dos ratos se mostraram normais, o que comprova que o efeito tóxico que a Mitomicina C tem sobre o tecido hematopoiético, quando usada endovenosamente e em grandes quantidades, não se faz presente nestas pequenas quantidades e usada topicamente.
Quanto ao seu uso injetável
A injeção intradérmica da Mitomicina C não é usada clinicamente pois é descrito que, quando do tratamento quimioterápico endovenoso de tumores, se a solução extravasar para os tecidos, ocorre necrose local. Esta parte do trabalho visou esclarecer qual a maior concentração em que a necrose não ocorre.
Observamos, nos três ratos que, na concentração usadas topicamente de 0,5 mg/ml, quando injetada intradermicamente, ocorre importante necrose local, que ainda se apresenta intensa na concentração de 0,1 mg/ml, e menos evidente na de 0,05 mg/ml. Na concentração de 0,01 mg/ml nada se observou de diferente do que ocorre nas injeções de soro fisiológico ou na pele normal. Cremos que nesta concentração a droga surta algum efeito inibitório de fibroplasto, mas sem danificar os tecidos. Esta característica pode ser valiosa para a complementação injetável de feridas cirúrgicas tratadas inicialmente com Mitomicina C tópica.
Dadas estas características, cremos que a Mitomicina C pode ser usada, como coadjuvante, em toda cirurgia onde a contenção cicatricial se faz necessária, como estenoses e sinéquias. Ressaltamos que após 3 meses parece haver uma igualdade no processo cicatricial, o que prejudicaria esta indicação, sendo talvez necessário uma complementação com o medicamento injetável. Assim, poderia ter uso em otorrinolaringologia nas estenoses do meato acústico externo e laríngeas, nas sinéquias nasais, nas imperfurações coanais, na permeabilidade dos óstios dos seios da face, etc. Em cirurgia geral, na inibição de quelóides, e quaisquer sinéquias ou estenoses.
Conclusões
1. A Mitomicina C não é tóxica para ratos na concentração de 5mg/ml, se usada topicamente em feridas cirúrgicas por 5 minutos e posteriormente lavada com soro fisiológico.
2. A Mitomicina C tópica, nesta concentração, retarda a velocidade do processo cicatricial em feridas cirúrgicas em dorsos de ratos.
3. A Mitomicina C tópica, nesta concentração, inibe, histologicamente, nas 4 primeiras semanas o processo de fibrose das cicatrizes cirúrgicas em dorsos de ratos.
4. O uso tópico da Mitomicina C na concentração de 0,5 mg/ml não produz efeito na cicatrização de feridas em dorso de ratos após 12 semanas.
5. A Mitomicina C não provoca necrose tecidual quando injetada na concentração de 0,01 mg/ml na pele de dorso de ratos.
Referências bibliográficas
1. Bradner WT. Mitomycin C: a clinical update. Cancer Treat Rev 2001 Feb;27(1):35-50.
2. Crooke ST, Bradner WT. Mytomicin C: a review. Cancer Tret Rev 1976;3:121-39.
3. Bruijn EA, Sleeboom HP, van Helsdinger PJRO, van Oosterom AT, Tjaden UR, Maes RAA. Pharmacodynamics and pharmacokinetics of intravesical Mitomycin C upon different dwelling times. Int J Cancer 1992;51:359-64.
4. Hu D, Sires BS, Tong DC, Royack GA, Oda D. Effect of brief exposure to mitomycin C on cultured human nasal mucosa fibroblasts. Ophthal Plast Reconstr Surg 2000 Mar16(2):119-25.
5. Sampaio MW, José NK, Alves MR. Efeitos do uso tópico da Mitomicina C em olhos de ratas. Arq Bras Oftal 1995;58:56-9.
6. Mattar DB, Alves MR, Silva MHT, José NK. Estudo da influência da aplicação subconjuntival da Mitomicina C na reparação de defeito epitelial corneano, em coelhas. Arq Bras Oftal 1995;58:6567.
7. Martins-Neto A, Paro G, Schellini SA, Moraes-Silva MRB. Mitomicina C no intra-operatório do pterígio. Arq Bras Oftalmol 1996;59:397.
8. Paro G, Martins-Neto A, Schellini SA, Padovani CR. Nossa experiência com o colírio de Mitomicina C no pós-operatório do pterígio. Arq Bras Oftalmol 1996;59:398-1.
9. Mandia CJ. Trabeculectomia com Mitomicina C no tratamento de glaucomas refratários. [Tese de Doutorado] Faculdade Medicina de Ribeirão Preto; 1997.
10. Ingrams DR et al. Sinus surgery: does mitomicyn-C reduce stenosis? Laryngoscope 1998;108:883-6.
11. Spector J E, Werkhaven J A, Spector N C, Huang S, Page R N, Baranowski B, Luther M, McGehee B, Reinisch L. Preservation of function and histologic appearance in the injured glottis with topical mitomycin C. Laryngoscope 1999;109:1125-29.
12. Garrett CG, Soto J, Riddick J, Billante CR, Reinisch L. Effect of mitomycin-C on vocal fold healing in a canine model. Ann Otol Rhinol Laryngol 2001 Jan;110(1):25-30.
13. Rahbar R, Shapshay SM, Healy GB. Mitomycin: effects on laryngeal and tracheal stenosis, benefits, and complications. Ann Otol Rhinol Laryngol 2001 Jan;110(1):1-6.
14. Coppit G, Perkins J, Munaretto J, Nielsen R, McKinney L, Ulnick K. The effects of mitomycin-C and stenting on airway wound healing after laryngotracheal reconstruction in a pig model. Int J Pediatr Otorhinolaryngol 2000 Jun 30;53(2):125-35.
15. Jassir D, Buchman CA, Gomez-Marin O. Safety and efficacy of topical mitomycin C in myringotomy patency. Otolaryngol Head Neck Surg 2001 Apr;124(4):368-73.
16. Estrem SA, Batra PS. Preventing myringotomy closure with topical Mitomicin C in rats. Otolaryngology-Head and Neck Surgery 1999;120(6):794-98.
17. Estrem S A, van Leeuwen RN. Use of Mitomycin C for maintaining myringotomy patency. Otolaryngology-Head and Neck Surgery 2000;122(1):8-10.
18. O'Reilly RC, Goldman SA, Widner SA, Cass SP. Creating a stable tympanic membrane perforation using mitomycin C. Otolaryngol Head Neck Surg 2001 Jan;124(1):40-5.
19. Yazawa Y, Suzuki M, Kitano H, Kitajima K. Intraoperative mitomicyn-C in endolynphatic sac surgery for Ménière´s disease: a pilot study. ORL J Otorhinolaryngol Relat Spec 1999;61:188-94.
20. Cubukcu A, Alponat A, Gonullu NN, Ozkan S, Ercin C. An experimental study evaluating the effect of Mitomycin C on the prevention of postoperative intraabdominal adhesions. J Surg Res 2001 Apr;96(2):163-6.
[1] Chefe de Clínica Adjunto, Dep. O.R.L., Faculdade de Ciências Médicas da Santa Casa de São Paulo.
[2] Pós-graduanda do Dep. De Farmacologiada da USP e farmacêutica da Técnica Cirúrgica da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
[3] Residente do Departamento de Anatomia-Patológica da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
[4] Professora Adjunto do Departamento de Ciências Fisiológicas da Faculdade de Ciências Médicas da Santa Casa de São Paulo
Trabalho realizado na Santa Casa de Misericórdia de São Paulo.
Endereço para Correspondência: Rua Itapeva, 500 10B Bela Vista São Paulo SP 01332-000 - Tel (0xx11) 288.5414 - E-mail: quinta@dialdata.com.br