Ano: 2003 Vol. 69 Ed. 3 - Maio - Junho - (16º)
Seção: Artigo de Revisão
Páginas: 394 a 403
Angiofibroma Nasofaríngeo: Revisão de Literatura
Nasopharyngeal Angiofibroma: literature review
Autor(es):
Luiz A. C. Ricardo; R
omualdo S. L. Tiago;
Antonio S. Fava
Palavras-chave: -
Keywords: -
![]()
INTRODUÇÃO
O angiofibroma é um tumor benigno, porém muito agressivo devido sua tendência a invasividade local. Histologicamente é composto por elementos miofibroblásticos e vasogênicos, portanto trata-se de um tumor altamente vascularizado.
O angiofibroma responde por 0,5 % de todas as neoplasias de cabeça e pescoço com uma incidência de 1:6.000 a 1:55.000 nos Estados Unidos14. Parece haver uma incidência maior em algumas partes do mundo como México, Egito, sudoeste da Ásia e Oceania, porém nenhum fator causal importante foi identificado5 Há uma nítida preferência pelo sexo masculino, ocorrendo na adolescência ou pré-adolescência.
Macroscopicamente, o tumor aparece como uma massa globosa, circunscrita, não encapsulada, coberta por mucosa de rinofaringe. A cor depende do componente vascular, podendo ser róseo-vinhoso ou pálido e esbranquiçado. O principal suprimento sangüíneo é pela artéria maxilar, embora possam haver ramos da artéria carótida interna ipsilateral ou do sistema carotídeo externo contralateral. Histologucamente, é constituído por tecido conjuntivo fibroso e vasos. A periferia do tumor é edemaciada e infiltrada, com áreas necróticas e vasos capilares. Os vasos mais profundos são mais calibrosos e com muitas anastomoses, lembrando o aspecto de um hemangioma cavernoso. A presença de uma única camada celular, sem componente muscular liso, associado a rigidez do estroma fibroso, conferem ao tumor sua característica hemorrágica.
Tipicamente os pacientes se apresentam com queixa de obstrução nasal unilateral e epistaxe sem sintomatologia dolorosa. Sintomas adicionais, como diplopia e deformidade facial, dependem de sua extensão local.
O diagnóstico é baseado nos sinais, sintomas, características morfológicas e epidemiológicas. A endoscopia nasal, tomografia computadorizada e a ressonância magnética nuclear fornecem um delineamento da localização e extensão tumoral e as relações com estruturas vasculares e nervosas, permitindo um estadiamento preciso do tumor. Por este motivo e devido a característica sangrante do tumor, a biópsia não é um procedimento de rotina atualmente
A angiografia carotídea é realizada para estudo do suprimento vascular em tumores extesos e realização de embolização, visando à redução do sangramento intraoperatório, sendo por isso realizada 24 a 48 horas antes do procedimento cirúrgico.
A cirurgia e a radioterapia são as principais formas de tratamento, embora a literatura aponte para a cirurgia radical com remoção completa do tumor como a terapêutica de eleição. Opções adicionais de tratamento são a embolização, a quimioterapia e a hormonioterapia.
Este artigo apresenta uma revisão sobre nomenclatura e classificação do angiofibroma, bem como da evolução da abordagem clínica e enfatizando sua terapêutica. O interesse deste trabalho é registrar de forma simples e didática as modificações ocorridas com o passar do tempo de acordo com a literatura.
REVISÃO DE LITERATURA
I. Etiopatogenia
A etiologia ainda é desconhecida. Sabe-se que não há relação com hereditariedade, uma vez que nunca foram relatados casos da doença numa mesma família. Teorias incluem uma resposta anormal do tecido conjuntivo do periósteo dos ossos da nasofaringe a um ninho vascular ectópico hamartomatoso, similar aos lagos venosos existentes no corneto inferior34 ou um crescimento aberrante da lâmina occipital embrionária antes de sua ossificação, que ocorre por volta dos 25 anos de idade.
Até meados do século passado acreditava-se que o tumor se originava nesta lâmina embrionária32. Trata-se de uma estrutura cartilaginosa que dá origem à porção basal do osso occipital, corpo do esfenóide, processo medial do pterigóide e ossos da região do forame lácero e espaço pterigopalatino. Até a adolescência e início da idade adulta, a base do osso occipital é unida ao corpo do esfenóide por esta placa cartilaginosa e o pericôndrio desta cartilagem seria o sítio de desenvolvimento do angiofibroma.
Atualmente acredita-se que o tumor tenha sua origem na parede póstero-lateral da cavidade nasal, onde o processo esfenoidal do osso palatino encontra a lâmina horizontal do vômer e parte do processo pterigóide do osso esfenoidal34. Essa junção forma a margem superior do forame esfenopalatino onde repousa a porção posterior do corneto médio (ou teto do esfenóide)15,19. Esta área parece estar sempre envolvida, uma vez que lesões irradiadas tendem a involuir a esta região específica8. A figura 1 mostra esquematicamente o ponto de origem do tumor e suas rotas de expansão. Alguns autores acreditam que esse crescimento tecidual anômalo deve-se à elevação dos níveis de andrógenos mediados por receptores hormonais específicos localizados no tecido tumoral15,17. A partir do seu ponto de origem o tumor começa, então, seu crescimento por debaixo da mucosa estendendo-se inicialmente a porção posterior da cavidade nasal e teto da rinofaringe. Conforme o tumor se alarga, estende-se através do forame pterigopalatino, crescendo lateralmente para as fossas pterigomaxilar e infratemporal (fig. 2). Deste ponto, pode se expandir para os tecidos moles da região geniana, causando abaulamento na face, ou para a fissura orbital inferior e órbita, causando proptose, ou ainda causar destruição óssea na base do processo pterigóide, adentrando a fossa crânica média, anterior ao forame lácero e lateral ao seio cavernoso. O crescimento segue ocupando os espaços disponíveis, preenchendo cavidade nasal e células etmoidais posteriores, podendo invadir diretamente a órbita. Posterior e inferiormente, o tumor abaula o palato mole e pode ser visto na orofaringe. Superiormente, o tumor pode atingir a fossa temporal causando abaulamento acima do zigoma, ou destruir o assoalho do seio esfenóide, ocupando este seio, podendo a partir daí invadir o crânio e causar deslocamento da glândula hipófise, sela túrcica e quiasma óptico.
Segundo Antonelli et al (1987)1 existem três rotas principais de invasão craniana: 1) a partir da fossa infratemporal, através da erosão do assoalho da fossa média; 2) através da fissura pterigomaxilar; junto às fissuras orbitais superior e inferior e; 3) pela parede superior do seio esfenoidal, atingindo o seio cavernoso e /ou fossa pituitária.
A invasão intracraniana é relativamente freqüente, sendo descrita uma incidência de 20 a 36%9. Essa invasão se dá por erosão óssea e deslocamento da dura-máter, mas raramente com invasão da mesma. Em nosso meio, Butugan et al (1995)6 numa revisão de 123 casos tratados, encontraram invasão tumoral de dura-máter em três pacientes, todos com invasão concomitante do seio cavernoso, sendo que em dois casos tratava-se de recidiva da doença, onde acredita-se ser mais comum a invasão desta meninge.
I. Nomenclatura
O angiofibroma é um tumor incomum no nariz e nasofaringe, de consistência firme, fibroso e extremamente vascularizado que causa obstrução nasal e epistaxe, esta última podendo ser muito severa. Há considerável controvérsia na literatura em torno desta neoplasia benigna, envolvendo desde sua nomenclatura até as abordagens terapêuticas.
Relatos desta doença parecem datar da antigüidade e muitos nomes têm sido dados a ela no decorrer do tempo. A revisão mais compreensível sobre este assunto foi feita por Harma (1958)23. Esse autor afirma que Hipócrates em seus escritos descreveu o chamado "pólipo nasal duro", provavelmente referindo-se a um angiofibroma. Durante o século XIX, esse tumor ainda era chamado de pólipo nasal fibroso. Bensch (1887) o designou de "pólipo típico da nasofaringe" para diferenciá-lo de outras condições semelhantes como pólipo antrocoanal e tumores malignos. Porém, o termo pólipo foi sendo gradativamente abandonado, dando lugar a denominações que se propunham a definições mais acuradas do tumor, como tumor basal fibróide ou simplesmente fibroma. Martin et al. (1948)32 sugeriram o termo angiofibroma nasofaríngeo juvenil. Hubbard (1958) considera que o termo juvenil deve ser omitido, uma vez que o tumor também ocorre em indivíduos adultos. Bremer et al (1986)2 contestam o termo nasofaríngeo, dizendo que esses tumores claramente se expandem para além dos limites da rinofaringe, preferindo simplesmente o termo angiofibroma. Deve-se ressaltar também, neste ponto, as origens extrafaríngeas do tumor. Isherwood et al. (1975)25, descreveram um raro caso de angiofibroma nascendo da base do crânio, fora da nasofaringe e se estendendo para a fossa pterigomaxilar e região geniana. Em nosso meio, Rapoport et al (1977)36 descreveram um caso de angiofibroma de base de língua em um jovem de 22 anos. As publicações mais recentes, contudo, se referem ao tumor como angiofibroma nasofaríngeo.
II. Classificação
A importância de um estadiamento para esse tumor tem sido ressaltada, como uma tentativa de padronização diagnóstica, programação terapêutica e avaliação dos resultados, levando a uma menor variabilidade nas comparações das taxas de cura e recorrência relatadas na literatura. Por outro lado, existem múltiplos esquemas de estadiamento propostos, dificultando a comparação dos dados.
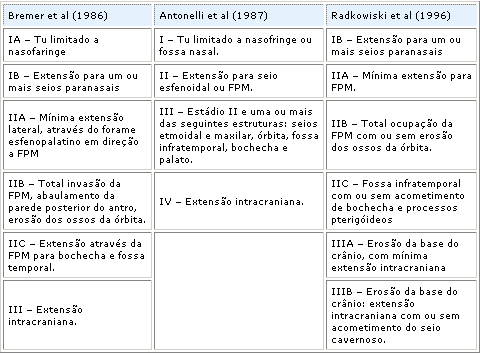
Sessions et al (1981)41,baseados nas rotas de expansão do tumor, propuseram um estadiamento radiológico, considerando mais importante o número de sítios envolvidos do que o tamanho do tumor. O estadiamento é como se segue: Ia - limitado ao nariz ou a nasofaringe; Ib - extensão para um ou mais seios paranasais; IIa - mínima extensão à fossa pterigomaxilar; IIb - total ocupação da fossa pterigomaxilar, com ou sem erosão dos ossos da órbita; IIc - invasão da fossa infratemporal, com ou sem invasão da região geniana; III - extensão intracraniana.
Chandler et al (1984)8, também baseados no padrão de crescimento tumoral e no seu provável sítio de origem propuseram um sistema semelhante ao da American Joint Committee para o câncer de nasofaringe: I - tumor confinado a nasofaringe; II - extensão para cavidade nasal e/ou seio esfenóide; III - extensão para uma ou mais das seguintes estruturas: antro maxilar, seio etmóide, fossas pterigomaxilar e infratemporal, órbita e/ou bochecha; IV - extensão intracraniana.
Outros autores sugeriram esquemas de estadiamento baseados em achados clinicorradiológicos (tabela1).Tabela 1 - Sistemas de estadiamento para o angiofibroma nasofaríngeo.FPM: fossa pterigomaxilar
III. Quadro Clínico e Diagnóstico
Pacientes na puberdade ou na pré-puberdade, do sexo masculino, com queixa de obstrução nasal uni- ou bilateral, epistaxes recorrentes e cujo exame clínico revela a presença de tumor na fossa nasal ou rinofaringe, com ou sem abaulamento de face, devem ser suspeitos quanto à possibilidade de serem portadores de angiofibroma de nasofaringe. Poucos casos isolados de angiofibroma em pacientes do sexo feminino têm sido relatados, e sua ocorrência é considerada tão rara que Yang et al.(1998)44 chegaram a recomendar a revisão da histologia e estudo cromossômico, pensando na possibilidade de poder tratar-se de uma alteração do cromossomo sexual que cursa com fenótipo feminino e cariótipo 46XY, como no pseudohermafroditismo masculino.
A determinação da idade em que o tumor inicia seu desenvolvimento é muito difícil, devido sua localização predominante na nasofaringe, por seu ritmo de crescimento e pela dificuldade de se obter uma informação segura do paciente. Evidentemente, todos os sintomas são dependentes do grau de extensão do tumor e este se desenvolve por um período inicial sem nenhuma manifestação clínica. A média de idade de aparecimento dos sintomas entre os diversos autores varia entre 14 e 16 anos2,23.
Martin et al (1948)32 fixou em 25 mm o diâmetro do tumor situado na rinofaringe e que passa a dar sintomas de obstrução nasal, mas afirma que um tumor menor ao nível de coana poderá apresentar o mesmo sintoma.
Com o advento e disponibilização das técnicas radiológicas computadorizadas, tanto a natureza vascular do tumor, quanto suas extensões puderam ser mostradas nos três planos e são de grande importância em todos os estadios do angiofibroma e, de fato, frente a possibilidade de sangramento severo, muitos cirurgiões preferem os métodos de imagem à biópsia para decidir se uma massa nasofaríngea é mais provavelmente um angiofibroma ou uma lesão não vascular como um pólipo antrocoanal29.
O raio-x simples mostra a presença de tecido mole em nasofaringe. Holman e Miller descreveram o sinal do "antro" na incidência de perfil, que consiste no abaulamento da parede posterior do antro maxilar, denotando invasão da fossa pterigomaxilar.
A avaliação da extensão tumoral é feita através da tomografia computadorizada (TC) e da ressonância magnética nuclear (RMN); a primeira para mostrar alterações ósseas e a segunda para mostrar a extensão aos tecidos moles. A TC é o exame mais importante29. A invasão do seio esfenoidal é o principal fator preditivo de recorrência do angiofibroma e a avaliação da presença e extensão desta invasão foi a maior contribuição da TC no diagnóstico e tratamento deste tumor. A identificação de pacientes sob alto risco de recorrência estabelece a necessidade de tratamento mais radical para eliminar ou reduzir em tamanho qualquer tumor remanescente dentro do esfenóide. A RMN presta-se principalmente a mostrar a extensão de uma recorrência, permite avaliar o tamanho do tumor durante a radioterapia e também monitorar uma possível involução natural.
A angiografia diagnóstuca freqüentemente falha em delimitar o tumor e estimar seu conteúdo vascular6 e alguns autores preconizam o seu uso apenas nos casos de tumores extensos, sobretudo aqueles com envolvimento intracraniano, para melhor planejamento terapêutico8,20, ainda assim seu uso rotineiro foi praticamente eliminado pela aplicação da TC e RMN. A angiografia tem maior importância quando se deseja realizar a embolizaão arterial seletiva, procedimento realizado 24 a 48 horas antes da remoção cirúrgica do tumor com intuito de reduzir o sangramento intra-operatório.
A biópsia é realizada em centro cirúrgico e sempre pela via nasal, devido ao risco de sangramento. Porém, não é um procedimento de rotina uma vez que os dados de anamnese, exame físico e exames de imagem, praticamente fecham o diagnóstico, que será confirmado pelo exame anatomopatológico da peça operatória.
A dosagem de 17-cetosteróides (esteróides, andrógenos e estrógenos) na urina de 24 horas, geralmente não revela alteração significativa.
Várias doenças, tumorais ou não, podem provocar obstrução nasal, epistaxe e rinorréia e podem ser confundidas com um angiofibroma. Entre os principais diagnósticos diferenciais podemos destacar:
· Pólipos inflamatórios - geralmente pedunculados e múltiplos;
· Tumores malignos de nasofaringe - são raros na adolescência, causam comprometimento neurológico e a adenopatia cervical geralmente está presente na primeira consulta;
· Hipertrofia de adenóides - raramente causa sangramento nasal de monta seu aspecto é mais ou menos elucidativo;
· Pólipo angiomatoso e cisto nasofaríngeo - especial atenção deve ser dada a essas entidades que são facilmente confundidas com o angiofibroma;
· Outras entidades devem ser lembradas como: cordomas de vértebra cervical, fibrossarcomas e fibromas de nasofaringe, neoplasias malignas do maxilar superior, estesioneuroblastoma de fossa nasal e tuberculose do gânglio retrofaríngeo.
IV. Tratamento
Muitas terapias para o angiofibroma se desenvolveram através dos anos, incluindo manipulação hormonal, quimioterapia, radioterapia, técnicas cirúrgicas intra e extracranianas, além da embolização arterial. O sucesso dessas terapias é variável e elas não são isentas de efeitos colaterais, seqüelas e possivelmente complicações maiores.
O uso de hormônios sexuais no tratamento dos angiofibromas remete a estudos tão antigos como os de Martin et al (1948)32. Esses e outros autores tentaram a redução da taxa de crescimento tumoral através da administração de estrogênios e androgênios. Farag et al (1987)16 encontraram in vitro receptores androgênicos específicos para testosterona e di-hidrotestosterona. Hagen et al (1994)22 apontaram que a presença de receptores androgênicos em fibroblastos tumorais deve ser considerada inequívoca e a aplicação clínica de antiandrogênios puros (flutamida, ciproterona) em casos selecionados pode representar uma alternativa a radioterapia.
A quimioterapia é uma alternativa de tratamento para casos selecionados. Goepfert et al (1985)19 descreveram dois casos tratados com doxorubicina e dacarbazina que apresentaram redução tumoral. Entretanto, os autores recomendam cuidado com o uso dessas substâncias devido ao risco de toxicidade, como a cardiomiopatia induzida pela doxorrubicina e recomendam seu uso em três situações específicas: recorrência após terapia local adequada, extensão intracraniana com envolvimento de estruturas vitais e suprimento sangüineo predominante de vasos intracranianos.
As abordagens cirúrgicas para o angiofibroma nasofaríngeo têm se modificado através de um longo período de tempo e muitas técnicas já foram usadas. Hipócrates descreveu uma das primeiras operações, que consistia em uma incisão nasal mediana através da qual o tumor era retirado, porém Hipócrates não fez menção sobre o sucesso ou fracasso da cirurgia.
Uma questão que sempre despertou grande interesse entre os investigadores do assunto, do ponto de vista terapêutico, é a característica recidivante do tumor. Essa observação levou ao desenvolvimento de técnicas cirúrgicas que permitissem boa exposição da nasofaringe e porções posteriores do nariz para excisão completa do tumor. Por outro lado, a multiplicidade de técnicas cirúrgicas desenvolvidas, algumas vezes até mutilantes, atesta a inacessibilidade das lesões nessa área. A questão não é recente, uma vez que há mais de 150 anos um método de abordagem da nasofaringe, através de rinotomia lateral já era praticado.
Wilson (1951)42, sugeriu uma abordagem transpalatal, através de uma incisão transversa separando o palato duro do palato mole, conforme sugerido por Precechtel (1929), para tratamento de tumores localizados na rinofaringe, descrevendo ótimos resultados e ausência de disfunção palatal no tocante a deglutição ou fonação. Essa abordagem tornou-se o procedimento de escolha de muitos cirurgiões para o tratamento de lesões benignas ou malignas de baixo grau de invasividade da nasofaringe e porções posteriores da cavidade nasal.
Em 1957, esse mesmo autor43 publicou um artigo descrevendo diversas opções para o tratamento cirúrgico dos tumores de rinofaringe, dividindo estes procedimentos em três grupos principais:
1. Acesso direto pela fossa nasal, através de diferentes tipos de incisões de rinotomia externa lateral;
2. Acesso transmaxilar, através de incisão sublabial pelo sulco alveolar ou através das abordagens por rinotomia externa. Nesse ponto, o autor cita a incisão proposta por Denker, em 1910, como a melhor abordagem sublabial, consistindo na remoção da parede anterior do antro maxilar, parede antrocoanal, parte do processo frontal da maxila e do osso próprio nasal;
3. Acesso transpalatino, considerado pelo autor como a melhor abordagem para a nasofaringe, ressaltando a incisão transversa no palato como a usada por Precechtel para o tratamento de atresia coanal.
Cooper (1963)11 publicou um método de tratamento cirúrgico de lesões tumorais benignas e malignas através do congelamento tecidual, a cirurgia criogênica. O método baseava-se no princípio de que os efeitos biológicos causados pela congelação são previsíveis e controláveis de acordo com as leis da física de condução térmica e que os tecidos congelados são marcadamente delimitados dos tecidos adjacentes e essencialmente hemostáticos ou avasculares. English et al (1972)13, utilizaram o princípio da criocirurgia de Cooper, em uma série de 12 pacientes operados através de uma abordagem transpalatal, seguida de dissecção subperiosteal do tumor, associada a compressão por clamp da artéria carótida externa. Com essa técnica os autores ressaltaram a adequada hemostasia e a facilidade na identificação do periósteo e ressecção tumoral do tecido ósseo subjacente.
Sardana (1965)40 sugeriu o uso de incisão sublabial em associação com abordagem transpalatal para remoção de extensões laterais do tumor, ressaltando ser uma opção racional, sem a necessidade de remoção óssea extensa, com a vantagem de não causar mutilação como nos casos das rinotomias externas e na cirurgia de Denker. Conley e Price (1979)10, descreveram um degloving com acesso sublabial e transnasal, com exposição de ambos antros maxilares e maior facilidade de abordagem em comparação com outros acessos sublabiais como Caldwell-Luc e incisão de Denker, além da ausência de incisões na face.
Maniglia (1986)31 relata a experiência de 15 anos onde foram tratados 30 pacientes com lesões benignas ou malignas de estruturas mediofaciais, palato ou nasofaringe, através do degloving mediofacial, associando a incisão sublabial e técnicas de rinoplastia e refere excelente exposição bilateral sem a necessidade de deformidade facial externa.
Euswas (1999)14, publicou uma série de onze pacientes classificados nos estádios de I a III de Sessions et al, tratados através de abordagem sublabial transnasomaxilar, semelhante ao acesso de Denker, porém sem a retirada do processo frontal da maxila e osso próprio nasal, ressaltando que em relação às abordagens transpalatal, rinotomia lateral e mediofacial, esse acesso tem as vantagens de prover ampla exposição dos seios maxilar, etmóide e esfenóide; acesso às artérias esfenopalatina e maxilar interna; ausência de risco de disfunção palatal; ausência de cicatriz facial; e fácil avaliação pós-operatória por rinoscopia anterior ou endoscopia, devido a ampla cavidade nasossinusal. O autor não obteve recorrência tumoral em 18 meses de seguimento. Alguns autores, porém, consideram a abordagem por rinotomia lateral e suas variantes como a rota mais direta e versátil para o corpo do tumor e todas as suas extensões2,27.
Briant et al (1978)4 enfatizaram a superioridade da radioterapia sobre a cirurgia em 45 pacientes. Os autores obtiveram controle da doença em 80% dos casos com um curso único de irradiação com dose moderada (3000 a 3500 rads), sendo que os 20% restantes alcançaram controle satisfatório com um ou dois ciclos adicionais de irradiação, além do que os efeitos colaterais imediatos foram mínimos e não houve relato de tumor induzido por radiação em vinte anos de seguimento após a terapia. Os autores não mencionam o estadiamento dos pacientes tratados.
Carvalho et. al. (1979)7 em uma revisão de 29 casos, reportaram o uso de tratamento cirúrgico inicial através das técnicas de rinotomia lateral e transpalatina em 27,5% e nos 72,5% restantes o tratamento inicial foi associação de radioterapia e hormonioterapia com testosterona. Ressaltaram a superioridade desta última modalidade terapêutica, sobretudo para tumores volumosos. Entre outros aspectos, os autores apontaram que o tratamento rádio-hormônioterápico leva a cura em mais de 50% dos casos, além de melhorar as condições locais do tumor caso haja necessidade de uma intervenção cirúrgica.
Fields at al (1990)17 estudaram a eficácia da radioterapia em 13 pacientes com nasoangiofibroma juvenil, durante um período médio de 136 meses. Os pacientes foram estadiados segundo a classificação de Antonelli et al1., sendo 06 pacientes nos estadios III e IV, 04 no estadio II e 03 no estadio I. Os autores concluíram que, devido ao aprimoramento de técnicas cirúrgicas, melhoria do diagnóstico por imagem e técnicas de embolização, a cirurgia é o tratamento de escolha para pacientes com lesão incipiente. Porém consideram que em pacientes com lesões extensas (estadios III e IV), sobretudo com invasão do crânio e aqueles com tumor recidivado, o risco/benefício no tocante a morbidade e mortalidade pesa a favor do tratamento radioterápico, recomendando uma dose total igual ou superior a 3600 cGy.
Gullane et al (1992)21 estudando 21 pacientes, classificados segundo Chandler et al8 (01 paciente no estádio II, 17 no estádio III e 03 no estádio IV) chegaram a conclusão semelhante, encontrando uma taxa de controle inicial de 64% com a cirurgia e 43% com a radioterapia. Novos ciclos de tratamento para cada uma dessas modalidades elevam essas taxas para 93% e 86% respectivamente, com uma média de controle da doença de 90%. Esses valores estão de acordo com outros dados publicados na literatura4,17.
Outros autores, como Ianetti et al (1994)23 apontam a cirurgia como tratamento de escolha para esses tumores, em qualquer estadio, considerando a radioterapia de alto risco para malignidade.
Reda (1996)37 publicou um caso de nasoangiofibroma juvenil tratado com cirurgia endoscópica transnasal. Esse autor acredita tratar-se de uma abordagem útil para tratamento de lesões limitadas, que se originam na região do forame esfenopalatino, com extensão medial para a porção posterior da cavidade nasal, posteriormente para o seio esfenoidal e lateralmente até a fossa pterigopalatina (fig. 1), sem a necessidade de incisão no palato, sublabial ou externa. Porém reconhece a limitação com a experiência de apenas um caso tratado.
DISCUSSÃO
O angiofibroma é um tumor raro, com características histológicas benignas, mas com um comportamento comparável ao dos tumores malignos, pela sua tendência ao crescimento invasivo e expansivo, destruindo os planos ósseos e invadindo seios paranasais, fossas temporais e base do crânio, além de episódios hemorrágicos freqüentes, maciços e potencialmente letais.
Apesar da considerável controvérsia na literatura a maioria dos autores prefere se referir ao tumor como angiofibroma nasofaríngeo e os principais sistemas de estadiamento utilizados são os de Sessions et al (1981)41 e o de Chandler et al. (1984)8, baseados respectivamente nas suas rotas de expansão e no padrão de crescimento e sítio provável de origem.
O quadro clínico não traz maiores dificuldades desde que o médico assistente tenha em mente a possibilidade de se tratar de um angiofibroma, A tomografia computadorizada aumentou nossa capacidade diagnóstica e define com segurança a extensão do tumor sendo o exame complementar mais importante. Sua maior contribuição foi a avaliação da invasão do esfenóide, que é o principal fator preditivo de recorrência tumoral, antevendo a necessidade de um tratamento mais radical.
Alguns autores do passado sugeriram que o tumor poderia apresentar resolução espontânea após a puberdade23,32, porém esse fenômeno tem sido raramente documentado na literatura e a conduta expectante é considerada demasiado otimismo atualmente e alguma forma de terapia deve ser praticada, dado sua característica infiltrante e destrutiva.
A ocorrência quase exclusiva no sexo masculino e o seu modo de origem sempre foram dados obscuros na fisiopatologia do tumor. Alguns autores23,32 chegaram a sugerir sua presença apenas no sexo masculino e Martin chegou a afirmar que o tumor é ligado ao sexo. As dosagens hormonais e o estudo das características sexuais secundárias não auxiliam no esclarecimento da questão, pois via de regra os pacientes apresentam desenvolvimento sexual esperado para a idade. Porém, há indícios de que o comportamento tumoral varie com alterações dos níveis séricos hormonais. Schiff38 em sua tese sobre a patogênese do angiofibroma, descreveu em detalhes a presença de fibroblastos imaturos e células endoteliais, típicas do tumor e ressaltou que o quadro é revertido drasticamente pela ação estrogênica, que causa maturação histológica do tecido conjuntivo e das células endoteliais. Porém, Schiff não identificou a potencial origem do tumor.
Johnson et al (1966)27 observaram crescimento acelerado após aplicação de testosterona e redução do tumor com uso de estrógenos. Hagen et al (1999)22 e Farag et al (1987)16 demonstraram a presença de receptores para di-hidrotestosterona nos fibroblastos tumorais, explicando seu crescimento através de uma resposta mediada por receptores específicos, sendo o hiperandrogenismo na puberdade masculina um estímulo para o desenvolvimento do angiofibroma. Se de um lado a presença de receptores androgênicos é considerada um fato confirmado22, diferentes trabalhos da literatura acusam a ausência de receptores estrogênicos1,3,26, sugerindo uma ação indireta desse hormônio. Schiff38 sugeriu um duplo mecanismo de ação dos estrógenos: redução da permeabilidade do tecido conjuntivo, reduzindo o número de vasos; e redução da produção de andrógenos por feed back negativo. Os achados desses autores apontam para a possibilidade de utilização de antiandrogênicos puros (flutamida, ciproterona) como uma alternativa aos tratamentos radioterápico e quimioterápico. Porém essas substâncias são consideradas alternativas potenciais em tumores extensos22 e o sucesso com o tratamento hormonal não é um achado constante na literatura. A questão provavelmente é mais ampla, uma vez que alguns autores5,7 conseguiram redução tumoral não com anti-androgênios ou estrógenos, mas com o uso de hormônio masculino (propionato de testosterona). De qualquer forma, a terapia hormonal isolada parece não ter nenhum valor curativo, sendo considerada sempre como terapêutica auxiliar à cirurgia ou à radioterapia5
Nos últimos anos deu-se também importância a possível ação de fatores de crescimento agindo na matriz extracelular do tumor, levando a sua progressão. Schiff et al (1992)39 encontraram quantidades significantes de bFGF (basic fibroblast growth factor) em extratos tumorais, através de técnicas de radioimunoensaio. Trata-se de um agente mitogênico para células endoteliais, células musculares lisas e fibroblastos. Em nosso meio, Nagai et al (1996)33, estudaram a expressão de RNA mensageiro de diversos fatores de crescimento possivelmente envolvidos na proliferação de células mesenquimais, sugerindo que o IGF-II (insulin-like growth factor-II) pode ser um potencial regulador de crescimento do angiofibroma de nasofaringe.
Baseando-se no princípio de que o crescimento do tumor se dá através de uma resposta específica mediada por receptor, a proposta de Yang et al44 de realizar-se estudo cromossômico em pacientes do sexo feminino na busca de alterações cromossômicas não parece viável, uma vez que estamos diante de uma alteração cromossômica com fenótipo feminino e cariótipo 46XY, o que não justificaria a ocorrência do tumor, pois estes indivíduos apresentam resistência a ação periférica de andrógenos ou mesmo a sua síntese.
A quimioterapia permanece uma alternativa para os casos de difícil tratamento, porém recomenda-se cautela na sua indicação, sobretudo em relação à toxicidade, e os resultados com este tipo de tratamento ainda são preliminares.
A cirurgia e a radioterapia parecem ser o tratamento mais efetivo2. A maioria dos autores, contudo, aponta a cirurgia radical como forma de tratamento mais eficaz. A literatura, no entanto, mostra que tanto em pacientes sob tratamento inicial cirúrgico como radioterápico, as taxas de controle final da doença são semelhantes (80%), ainda que os pacientes tenham necessitado de tratamento subseqüente para recorrências com associação desses métodos4,17.
A ressecção cirúrgica varia desde técnicas endoscópicas nasais até técnicas abertas combinadas intra e extracranianas, passando pelas abordagens por rinotomia lateral, sublabiais e transpalatais, também associadas ou não. A técnica cirúrgica a ser empregada depende da extensão da lesão, devendo sempre ser observados os princípios de boa exposição do campo cirúrgico e radicalidade e tem seus melhores resultados em lesões mais delimitadas que não invadiram o crânio.
O procedimento cirúrgico traz sempre a possibilidade de hemorragia grave que poderá levar o paciente a óbito. A ligadura das artérias carótidas externas já foi tentada como prevenção do sangramento, mas posteriormente considerada inútil devido a circulação colateral e anastomoses na nasofaringe e pela predominância de circulação venosa no tumor. O congelamento do tumor no intra-operatório (criocirurgia), conforme praticada por English et al (1972)13, diminui o sangramento e facilita o manuseio do tumor. A principal crítica em relação ao procedimento, no entanto, é sua limitação em lesões grandes, pois o congelamento não atinge todas as extensões tumorais que infiltram músculo e osso. Em lesões menores essa medida seria mais eficaz, porém essas podem ser extirpadas prescindindo-se da crioterapia, com um nível de sangramento aceitável.
A medida mais eficaz e utilizada atualmente é a embolização arterial seletiva, levando a uma diminuição da perda sangüinea durante a cirurgia e facilitando a remoção. A maior complicação desse procedimento seria o escape de êmbolos para a circulação intracraniana, porém é uma ocorrência tida como rara e não contraindica seu uso nesses pacientes. Outras complicações consideradas menores, associadas a embolização, são: reação sistêmica ao contraste, infecção no local da punção, hematoma e trombose femoral. A embolização arterial, embora reduza o sangramento intraoperatório, pode aumentar o risco de recidiva, sobretudo se houver invasão profunda do esfenóide, pois torna a remoção total mais difícil. Portanto, pacientes que mostram essa invasão ao exame tomográfico pré-operatório estão sob alto risco de recorrência e a embolização é contraindicada30.
Após Wilson (1951)43 ter sugerido uma abordagem cirúrgica transpalatal com uma incisão transversa no palato, semelhante a realizada por Precechtel, em 1929, para tratamento de atresia coanal, esta técnica se popularizou entre os cirurgiões da época, trazendo como principais vantagens a ausência de incisões externas e o fato de prover uma via de acesso direcionada à rinofaringe, diferentemente das técnicas transnasomaxilares que proviam uma linha de acesso direcionada ao esfenóide e células etmoidais posteriores (fig. 3). Alguns sugeriram associações da abordagem transpalatal com rinotomias13 e incisões sublabiais40 para o tratamento das extensões tumorais, sobretudo para a região geniana. Porém, por alguns autores o acesso transpalatino foi considerado restrito. Cocke, em 1964 (apud Conley e Price 197310) acreditava que não podia ser praticado para tumores maiores que 5 cm, além do que dele poderia resultar uma disfunção palatal importante.
As incisões sublabiais também têm seu lugar de destaque. É difícil determinar na literatura quem primeiro idealizou este acesso. Sabe-se que Rouge e Halsted, em 1870, descreveram operações nas quais uma incisão sublabial era empregada estendendo-se de uma fossa canina a outra, com posterior eversão do lábio superior, elevação da asa do nariz juntamente com o periósteo subjacente e divisão ou remoção parcial do septo nasal. Em 1910, Denker propôs uma incisão sublabial para acesso a nasofaringe, com exposição unilateral do antro maxilar, considerada por Wilson42 como a única abordagem sublabial útil. Durante a segunda metade do século passado muitos autores ressaltaram a importância da abordagem sublabial. Casson e Converse (apud Lloyd et al 199929), em 1974, descreveram uma técnica de degloving para exposição do esqueleto mediofacial no tratamento de 50 pacientes com diferentes patologias. Conley e Price (1979)10 descreveram também o degloving ressaltando a vantagem da exposisão de ambos os antros maxilares e facilidade de acesso ao espaço pterigopalatino, quando comparado aos acessos transpalatino, Caldwell-Luc e sublabial de Denker. Maniglia (1986)31 propõe o degloving como grande substituto das rinotomias laterais e Lloyd (1999)29 considera o degloving mediofacial o tratamento de escolha para os angiofibromas de nasofaringe.
A rinotomia lateral e suas variantes, conforme ressaltado por Bremer et al (1986)2, proporciona excelente exposição e versatilidade, no tocante a abordagem do tumor e suas extensões, porém traz o inconveniente de produzir uma cicatriz num local proeminente do terço médio facial.
Recentemente, a abordagem endoscópica surgiu como opção cirúrgica para tratamento desses tumores. Os avanços nesse campo permitiram o uso dos procedimentos endoscópicos transnasais e transorais para os angiofibromas. A abordagem endoscópica transnasal é melhor indicada para tumores pequenos, limitados a nasofaringe, cavidade nasal, seios etmoidais e esfenoidal, podendo também ser tentada para tumores com extensão até a fossa pterigopalatina15. As principais vantagens são a reduzida destruição de tecidos moles e ósseos e a ausência de incisões no palato, sublabial ou externa. As técnicas endoscópicas nasais também podem ser usadas junto com outras abordagens para avaliar a extensão do tumor e a suficiência da ressecção. Por outro lado, o campo cirúrgico é restrito e o sangramento torna-se um problema ainda maior, sendo essencial a embolização dos principais vasos que alimentam o tumor. Maior experiência é necessária para o uso das técnicas endoscópicas, mas essas vêm se consolidando como opção de tratamento cirúrgico para as lesões mais limitadas.
A melhor opção cirúrgica ainda não é um consenso e, obviamente, depende da experiência de cada cirurgião. Deve-se concordar com a proposição de Fagan et al (1997)15 que publicaram a experiência de 16 pacientes tratados cirurgicamente, considerando que a abordagem cirúrgica deve depender da extensão da doença. Dessa forma, utilizaram a abordagem endoscópica transnasal para os casos em que a doença não se estendia além da fossa pterigopalatina. A maxilectomia medial, através do acesso mediofacial (Degloving), ou das incisões de rinotomias externas, foi recomendada para lesões que acometiam as porções mediais da fossa infratemporal e seio cavernoso.
O tratamento de casos com envolvimento importante da fossa infratemporal e seio cavernoso, ou grande massa na base do crânio representam a maior divergência entre os autores20. As condutas variam desde autores que consideram irressecáveis os tumores com invasão intracraniana, até autores que advogam abordagem combinada intra e extracraniana, passando por aqueles que propõem ressecção apenas do tumor extracraniano e complementação do tratamento através de vários métodos como radioterapia, quimioterapia, hormoniooterapia, embolização, etc20.
O que parece bem estabelecido na literatura em relação ao tratamento cirúrgico de tumores com extensão intracraniana é que é preferível não arriscar uma ressecção completa da doença localizada no seio cavernoso e/ou fossa pituitária, optando-se por terapia complementar pós-operatória6,20.
A radioterapia,por sua vez, tem seus melhores resultados em lesões com extensão intracraniana ou recorrentes. A principal ressalva é a irradiação de uma lesão benigna, com risco de indução de malignidade. A estimativa na literatura é de que o risco de malignidade seja quatro vezes maior em pacientes irradiados em relação a população geral4 e o risco/benefício deve ser avaliado individualmente, recomendando-se dose moderada17 (3500 rads). Outros possíveis efeitos da radioterapia são o ressecamento de mucosa jugal e nasal, levando a cáries dentárias e rinite atrófica com formação de crostas, interferência nos processos de cicatrização, além do possível efeito nos centros de crescimento da face, relevante na faixa etária desses pacientes. Porém, na literatura pesquisada esses efeitos foram facilmente contornados não chegando a ser significantes.
A recidiva é uma preocupação constante nesses pacientes, sendo citada na literatura uma incidência de 6% a 24%1,21. A ausência de cápsula tumoral, dificultando o plano de clivagem cirúrgica, e a tendência de disseminação pela submucosa são as principais causas de recorrência dos casos tratados cirurgicamente15. A falha do tratamento radioterápico é geralmente atribuída às chamadas "perdas geográficas" no campo de irradiação e doses insuficientes. A presença de tumor no esfenóide é o principal fator preditivo para recorrência em ambas as modalidades de tratamento, cirúrgico e radioterápico.
COMENTÁRIOS FINAIS
A nosso ver e baseados na literatura estudada continua não havendo uma verdade absoluta em relação a melhor forma de tratamento para os angiofibromas. Porém notamos uma tendência a escolha de embolização arterial seletiva seguida de cirurgia radical como a melhor forma de tratamento. A radioterapia tem seu lugar em casos onde há grandes massas tumorais e/ou invasão intracraniana, sobretudo com invasão de dura-máter, seio cavernoso e fossa pituitária, onde a ressecção cirúrgica completa é difícil e arriscada, ou ainda em casos de recidiva. As demais abordagens terapêuticas como a hormonioterapia e quimioterapia são opções controversas, permanecendo como alternativas potenciais no tratamento do angiofibroma.
REFERÊNCIAS BIBLIOGRAFICAS
1. ANTONELLI, A.R.; CAPPIELLO, J.; DONAJO, C.A., LORENZO D., NICOLAI P., ORLANDINI B. Diagnosis, staging and treatment of juvenile nasopharyngeal angiofibroma. Laryngoscope, 97:1319-25, 1987.
2. BREMER, J.W.; NEEL, H.B.; DESANTO, L.W., JONES G. C. Angiofibroma treatment trends in 150 patients during 40 Years. Laryngoscope. 96:1321-8, 1986.
3. BRENTANI, M. M.;BUTUGAN, O.; OSHIMA, C. T. F.; TORLONI, H.; PAIVA, L. J. Multiple Steroid Receptors in Nasopharyngeal Angiofibromas. Laryngoscope, 99: 398-401, 1989.
4. BRIANT, T.D.R.; FITZPATRICK, P.J.; BERMAN, J. Nasopharyngeal angiofibroma: a twenty year study. Laryngoscope, 88:1247-51, 1979.
5. BUTUGAN, O. Angiofibroma Juvenil - Aspectos Atuais Terapêuticos. In BRANDÁO, L., G.: FERRAZ, A R. Cirurgia de Cabeça e Pescoço. Brasil. Editora Roca. Vol. 2: 415-20, 1989.
6. BUTUGAN, O.; SENNES, L. U.; ALMEIDA, E. R.; MINITI, A. Angiofibroma Juvenil Intracraniano com Invasão Meníngea e de Seio Cavernoso. Revista Brasileira de Otorrinolaringologia, 61: 400-12; 1995.
7. CARVALHO, M.B.; ANDRADE SOBRINHO J; RAPOPORT, A.; FAVA, A S.; MAGRIN, J.; SCANDIUZZI, D. Angiofibroma juvenil da nasofaringe. Rev. Paul. Med., 93; 52-62, 1979.
8. Chandler, J.R.; Moskowitz, L.; GOULDING, R.; QUENCEB R. M.. Nasopharyngeal angiofibromas: staging and management. Ann. Otol. Rhinol. Laryngol., 93:322-9, 1984.
9. CLOSE, L. Surgical Management of Nasopharyngeal Angiofibroma Involving the Cavernous Sinus. Arch. Otolaryngol. Head Neck Surg., 115: 1091-95, 1989.
10. CONLEY, J.; PRICE, J.C. Sublabial approach to the nasal and nasopharyngeal cavities. Am. J. Surg., 138:615-8, 1979.
11. COOPER, I.S. Cryogenic surgery: a new method of destruction or extirpation of benign or malignant tissues. N. Engl. J. Med., 268:743-8, 1963.
12. DOYLE, P.J. Approach to tumors of the nose, nasopharynx and paranasal sinuses Laryngoscope. 78: 1756-62, 1968.
13. ENGLISH, G.M.; HEMENWAY, W.G.; CUNDY, R. L. Surgical treatment of invasive angiofibroma. Arch. Otolaryngol., 96:312-8, 1972.
14. EUSWAS, C. A result of sublabial transnasomaxillary approach of nasopharyngeal angiofibroma: retrospective study. J. Med. Assoc. Thai., 82:234-41, 1999.
15. FAGAN, J.J.; SNYDERMAN, C.H.; CARRAU, R.L., JANECKA I. P. Nasopharyngeal angiofibromas: selecting a surgical approach. Head Neck, 19:391-9, 1997.
16. FARAG, M. M.; GHANIMAH, S. E.; RAGIE, A., Hormonal Receptor in Juvenile Nasopharyngeal Angiofibroma. Laryngoscope, 97; 208-211, 1987.
17. FIELDS, J.N.; HALVERSON, KJ.; DEVINENI V.R. Juvenile Nasopharyngeal Angiofibroma: Efficacy of Radiation Therapy Radiology 176: 263-5, 1990.
18. FINERMAN, W. B. Juvenile Nasopharingeal Angiofibroma in the Female Arch Otolaryngol., 54; 620-623, 1951.
19. GOEPFERT, H.; CANGIR, A.; LEE, Y. Chemotherapy for agressive juvenile nasopharyngeal angiofibroma. Arch. Otolaryngol., 111:285-9, 1985.
20. GRANATO, L. Angiofibroma Juvenil - Vias de Abordagem, Técnicas e Complicações. In BRANDÃO, L. G.; FERRAZ A. R. Cirurgia de Cabeça e Pescoço, Brasil. Editora Roca. Vol 2: 397-414, 1989.
21 GULLANE, P.J.; DAVIDSON, J.; O'DWYER, T., FORTE F. Juvenile angiofibroma: a review of the literature and a case series report. Laryngoscope, 102:928-33, 1992.
22. HAGEN, R.; ROMALO, G.; SCHWAB, B., HOPPE F SCHWEIKERT H. U. Juvenile nasopharyngeal fibroma: androgen receptors and their significance for tumor growth. Laryngoscope, 104:1125-9, 1999.
23. HARMA, RA. Nasopharyngeal angiofibroma Acta Otolaryng suppl 146; 1-76, 1958.
23. IANETTI, G.; BELLI, E., De PONTE, F., CICCONETTI A., DELFINI R. The surgical approaches to nasopharyngeal angiofibroma. J. Cranio Maxillo-Facial Surg., 22:311-6, 1994.
25. ISHERWOOD, I.; DOGRA, T.S.; FARRINGTON, W.T. Extranasopharyngeal juvenile angiofibroma. J. Laryngol. Otol. 89:535-44, 1975.
26. JOHN, M. E.; MACLEOD, R. M.; CANTRELL, R. W. Estrogen Receptors in Nasopharyngeal Angiofibromas. Laryngoscope, 90: 628-34, 1980.
27. JOHNSON, S.; KLOSTER, J. and SCHIFF, M. The action of hormones on juvenile angiofibroma. A case report. Acta Otolaryngol, 61; 153-160, 1966.
28. KAMEL, R. H. Transnasal endoscopic surgery in juvenile nasopharyngeal angiofibroma. J. Laryngol. Otol., 110:962-8-1996.
29. LLOYD, G.; HOWARD, D.; PHELPS, P., CHEESMAN A. Juvenile angiofibroma: the lessons of 20 years of modern imaging. J. Laryngol. Otol., 113:127-33, 1999.
30. LLOYD G.; HOWARD, D.; LUND, V.J., SAVY L.. Imaging for juvenile angiofibroma. J. Laryngol. Otol., 114:727-30, 2000.
31. MANIGLIA, A. J. Indications and techniques of midfacial degloving. Arch. Otolaryngol. Head Neck Surg., 112: 750-2, 1986.
32. MARTIN, H; EHRLICH, H.E.; ABELS, J.C. Juvenile nasopharyngeal angiofibroma. Ann. Surg., 137:513-35, 1948.
33. NAGAI, M. A ; BUTUGAN, O; LOGULLO, A; BRENTANI, M. M. Expression of Growth Factors, Proto-oncogenes and p53 in Nasopharyngeal Angiofibromas. Laryngoscope,106: 190-95, 1996.
34. NEEL, H.B.; WHICKER, J.H.; DEVINE, K.D., WEILAND L. H. Juvenile angiofibroma. Am. J. Surg., 126: 547-56, 1973.
35. RADKOWSKI, D.; Mc GILL, T.; HEALY, Gb.; OHLMS, L.; JONES, D. T. Angiofiroma: Changes in Staging and Treatment. Arch Otolaryngol Head Neck Surg, 122: 122-9, 1096.
36. RAPOPORT, A.; ANDRADE SOBRINHO J.; CARVALHO M.B.; GIANNOTTI FILHO O; SCANDIUZZI D. Angiofibroma Juvenil de Língua: relato de um caso. Revt Bras Cirurg 67; 339-343, 1977.
37. REDA H. KAMEL. Transnasal endoscopic surgery in juvenile nasopharyngeal angiofibroma.J Laryngol Otol 110; 962-968, 1996.
38. SCHIFF, M. Juvenile nasopharyngeal angiofibroma. A theory of patogenisis. Laryngoscope. 69; 981-1013, 1959.
39. SCHIFF, M.; GONZALEZ, A. M.; ONG, M.; BAIRD, A. Juvenile Nasopharyngeal Angiofibroma Contain an Angiogenic Growth Factor: Basic FGF. Laryngoscope, 102: 940-45, 1992.
40. SARDANA, D.S. Nasopharyngeal fibroma. Arch. Otol., 81:584-8, 1965.
41. SESSIONS, B. B.; BRYAN, B.; NACLERIO, R.; ALFORD, B. Radiographic staging of juvenile angiofibroma. Head And Neck Surg, 3; 279-283, 1981.
42. WILSON, C.P. The approach to the nasopharynx. Proc R. Soc. Med., 44:353-8, 1950.
43. WILSON, C.P. Observations on the surgery of the nasopharynx. Ann. Otol. Rhinol. Laryngol., 66:5-27, 1957. 44. YANG, P-W.; SHEEN, T-S.; KO, J-Y., LIU H. M., HSU M. M. Nasopharyngeal angiofibroma: a reappraisal of clinical features and treatment at National Taiwan University Hospital. J. Formos. Med. Assoc., 97:845-9, 1998.
Master studies in Otorhinolaryngology under course, IAMSPE (Instituto de Assistência Médica ao Servidor Público Estadual de São Paulo).
Master in Otorhinolaryngology and Head and Neck Surgery, Ph.D. studies at UNIFESP-SP. Assistant Physician of Head and Neck Surgery, Department of Otorhinolaryngology, HSPE-FMO, São Paulo. Assistant physician of the Service of Otorhinolaryngology, Hospital do Servidor Público Municipal (HSPM) São Paulo.
Ph.D. in surgery, Medical School, University of São Paulo. In Charge of the Service of Head and Neck Surgery, Department of Otorhinolaryngology, Hospital do Servidor Público Estadual - FMO, São Paulo.
Affiliation: Hospital do Servidor Público Estadual (HSPE)
Address correspondence to: Luiz A. C. Ricardo. Rua Coronel Camisão, 362 - Butantã, São Paulo.
CEP: 05590-201. Tel. (55 11) 3726-1442. E-mail: arturcostarica@ig.com.br
Article submitted on May 02, 2002. Article accepted on July 18, 2002.
All rights reserved - 1933 /
2025
© - Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico Facial