Ano: 2007 Vol. 73 Ed. 2 - Março - Abril - (9º)
Seção: Artigo Original
Páginas: 196 a 201
Anastomose do nervo facial de coelhos com cola de fibrina: estudo da velocidade de condução nervosa
Rabbit Facial Nerve Anastomosis with Fibrin glue: Nerve Conduction Velocity Evaluation
Autor(es): Francisco Aurelio Lucchesi Sandrini 1, Edwaldo Dourado Pereira-Júnior 2, Cosme Gay-Escoda 3
Palavras-chave: adesivo tecidual de fibrina, condução nervosa, regeneração nervosa.
Keywords: fibrin tissue glue, nerve conduction, nerve regeneration.
Resumo:
Objetivo: Este estudo tem o objetivo de avaliar através da velocidade de condução nervosa com eletrodos de superfície a utilização da cola de fibrina na anastomose nervosa. Métodos: Neste experimento, foram avaliadas as diferenças entre as velocidades de condução nervosa pré e pós-operatória do nervo facial esquerdo de 12 coelhos. Foi verificada a existência de correlação entre a velocidade de condução nervosa e o número de axônios regenerados no pós-operatório. Os nervos transeccionados foram unidos com cola de fibrina. O potencial de ação motora foi obtido com o uso de eletrodos de superfície. O eletrodo de estimulação foi colocado imediatamente à frente do pavilhão auditivo (tronco do nervo facial) e o eletrodo de gravação foi colocado no músculo quadrado do lábio inferior. Resultados: A média normal da velocidade de condução nervosa foi de 36,53 m/seg. Ao final do período, a velocidade de condução nervosa atingiu um valor de aproximadamente 81% do valor normal. Não foi observada correlação significativa entre a velocidade de condução nervosa pós-operatória e o número de axônios regenerados (p=0,146). Conclusão: A anastomose com cola de fibrina pode ser utilizada para anastomose nervosa no modelo animal e nervo estudados.
Abstract:
Aim: The aim of this study was to evaluate the use of fibrin glue on nerve anastomosis, and study conduction velocity obtained by surface electrodes. Methods: In this experimental model we evaluated nerve conduction velocity differences in the preoperative and postoperative periods, for the left facial nerve of 12 rabbits. Then, we evaluated whether there were correlations between conduction velocity and the number of postoperative regenerated axons. The sectioned nerves were anastomosed with fibrin glue. The muscle action potentials were obtained from surface electrodes. The stimulation electrode was placed immediately before the ear pinna (facial nerve trunk) and the recording surface electrode was placed on the quadratus labii inferioris muscle. Results: The facial nerve normal conduction velocity mean value was of 36.53 m/sec. On the postoperative period, the mean conduction velocity was approximately 81% of the normal mean value. A significant correlation was not observed between the postoperative conduction velocity and the number of regenerated axons (p=0.146). Conclusion: The fibrin glue can be used on nerve anastomosis in this animal model and nerve.
![]()
INTRODUÇÃO
A sutura epineural e fascicular são as técnicas microcirúrgicas mais usadas para o reparo de nervos. A sutura epineural é o procedimento mais comum por apresentar menor invasividade, conseqüentemente causando menor dano ao nervo durante o procedimento microcirúrgico. A sutura fascicular1-9 é teoricamente superior, pois o nervo é suturado interna e externamente permitindo a anastomose fascicular. Entretanto, a manipulação excessiva pode aumentar o trauma, a inflamação e induzir alterações degenerativas do tecido nervoso.
A reação de corpo estranho do tecido nervoso ao fio de poliamida (nylon) é outro possível problema ao usar materiais de sutura convencionais10-12. Materiais e instrumentais adequados e disponibilidade de microscópio cirúrgico melhoram consideravelmente o procedimento de reparo do tecido nervoso13. A possibilidade da realização de uma anastomose nervosa substituindo as suturas convencionais por substâncias biocompatíveis que não provoquem reações orgânicas e outros problemas relativos ao procedimento microcirúrgico seria ideal. Esta possibilidade é uma meta que vem sendo perseguida por vários pesquisadores14-16.
A cola de fibrina é um concentrado biológico constituído por componentes derivados do plasma de aplicação tópica cujo mecanismo de ação se assemelha à última fase da coagulação fisiológica (formação do fibrinogênio). O coagulo formado pelo adesivo é um componente fisiológico encontrado no reparo tecidual, e isto o difere de outros tipos de colas como os cianoacrilatos, que apresentam alta formação de fibrose e dificuldade de uso em tecidos úmidos17-24. A cola de fibrina Tissucol® (Immuno AG, Viena, Áustria) comercialmente apresenta-se em dois componentes, o fibrinogênio e o catalisador que, misturados através do sistema Duploject® (Immuno AG, Viena, Áustria), solidificam-se formando um coágulo plasmático. A cola de fibrina promove a formação precoce do coágulo, evitando a formação de hematoma e acelerando o processo de reparo3.
Pequenas quantidades de cola de fibrina podem ser facilmente aplicadas para realizar anastomose de nervos. A cola de fibrina não provoca reação de corpo estranho ou a formação de cicatrizes teciduais, além de diminuir a manipulação dos cotos nervosos e evitar o uso do fio de nylon que permanece em contato com a intimidade do tecido nervoso2,16,25-30.
Para a verificação dos resultados obtidos nos estudos sobre a dinâmica da reinervação pode-se realizar avaliações histológicas e avaliações funcionais. A avaliação funcional obtida pelo registro da velocidade de condução nervosa através da eletromiografia com eletrodos de superfície pode ser útil para estimular e registrar os potenciais de ação muscular e acessar o estado funcional do nervo facial após uma lesão ou cirurgia31.
Este estudo tem o objetivo de avaliar através da velocidade de condução nervosa com eletrodos de superfície a utilização da cola de fibrina como uma alternativa para a anastomose nervosa.
MATERIAIS E MÉTODOS
Para a realização deste estudo foram utilizados 12 coelhos brancos machos da raça Nova Zelândia pesando entre 2,5 e 3,0kg. O numero amostral foi definido de forma não-probabilística, seguindo-se os princípios preconizados pelas normas espanholas de experimentação animal. A divisão em subgrupos foi realizada de acordo com os períodos definidos para a avaliação da velocidade de condução nervosa. Todos os animais foram mantidos sob condições ambientais ideais (25°C, 10% a 55% de umidade relativa do ar). Para a realização do procedimento cirúrgico e obtenção das velocidades de condução, os animais foram submetidos à anestesia geral com hidrocloridrato de ketamina 50mg/kg (Ketolar®? ParkeDavis, El Prat de Llobregat, Barcelona, Espanha) e maleato de acepromazina 5 mg/kg (Calmo Neosan®? SmithKlineBeecham, Madrid, Espanha). Antes da indução anestésica foi utilizada atropina via subcutânea (Atropina? Palex, Barcelona, Espanha) devido a sua ação antiespasmódica e anticolinérgica. Após desinfecção do campo operatório com iodopovidona (Betadine? Asta Médica, Madrid, Espanha) a anestesia geral foi complementada com anestesia local com mepivacaina 3% com epinefrina 1:100.000 (Inibsa, Barcelona, Espanha) por infusão via subcutânea.
Procedimento cirúrgico e lesão nervosa
O animal anestesiado era colocado em decúbito lateral direito e era realizada a tricotomia da região pré-auricular e parte do pescoço do lado esquerdo. Uma incisão submandibular de tamanho suficiente para expor os ramos: bucal dorsal, bucal ventral e marginal mandibular do nervo facial era realizada (Figura 1). Após a exposição dos ramos do nervo facial, o anestésico local era gotejado diretamente sobre os mesmos para evitar o uso excessivo de anestésico geral. O ramo bucal dorsal era seccionado com tesoura microcirúrgica do tipo Barraquer (Hu-Friedy, Chicago, EUA) e unido com cola de fibrina (Tissucol®, Immuno AG, Viena, Áustria) (Figuras 2 e 3). Em todos os animais uma marca era realizada proximal e distalmente à anastomose nervosa utilizando um fio de seda 3-0 (BraunDexon, Barcelona, Espanha), para prevenir a remoção da amostra para exame histológico fora da região operada. A pele foi suturada com fio de seda 3-0 (BraunDexon, Barcelona, Espanha). A analgesia pós-operatória foi realizada com metamizol 30 mg/kg de peso corpóreo (Nolotil®, Europharma, Barcelona, Espanha). As suturas eram removidas 15 dias depois da cirurgia.
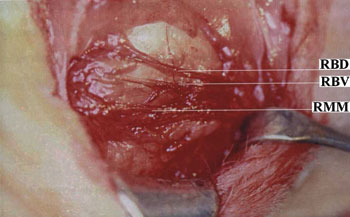
Figura 1. Anatomia cirúrgica do nervo facial.
RBD Ramo bucal dorsal;RBV Ramo bucal ventral;RMM Ramo marginal mandibular
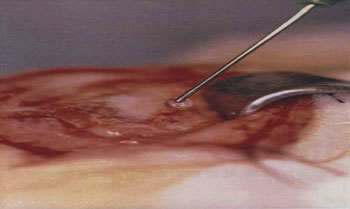
Figura 2. Aplicação da cola de fibrina.
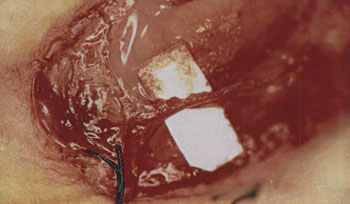
Figura 3. Anastomose nervosa com cola de fibrina.
Análise Eletrofisiológica e Histológica
Sob anestesia geral, a velocidade de condução nervosa foi determinada com eletrodos de superfície. O eletrodo de estimulação foi colocado imediatamente à frente do pavilhão auditivo (tronco do nervo facial) e o eletrodo de gravação foi colocado no músculo quadrado do lábio inferior. O potencial de ação muscular evocado foi gravado por um eletromiógrafo programável de 5 canais de aquisição (Medelec MS25, Mistro, Surrey, Inglaterra). A velocidade de condução nervosa foi medida em metros por segundo e obtida no pré e no pós-operatório (imediatamente antes da obtenção do nervo para análise histológica). Os 12 animais foram divididos em 4 grupos de tamanho igual e mortos através de overdose de pentobarbitol sódico por injeção intracardíaca aos 15, 30, 60 e 120 dias após a anastomose nervosa. A diferença (redução) na velocidade de condução entre o teste pré-operatório e o teste antes da morte (pós-operatório) foi calculada. O procedimento cirúrgico e a avaliação funcional (Velocidade de Condução Nervosa) foram realizados apenas no lado esquerdo, pois não há diferenças estatisticamente significativas entre a velocidade de condução nervosa entre o nervo facial direito e esquerdo em coelhos31.
Para a análise histológica foram obtidas secções da porção distal do nervo (próximas à região da anastomose). Os espécimes foram fixados em solução de glutaraldeído a 10% e corados com azul de toluidina. Foram realizados cortes transversais do ramo bucal dorsal e examinados por microscopia ótica sob magnificação de 400X. A média da contagem de axônios foi calculada pela média da contagem de 4 campos aleatórios de cada nervo.
A velocidade de condução nervosa pós-operatória e o número de axônios regenerados foram então correlacionados.
Análise Estatística
A análise dos dados foi realizada usando o SPSS 11.0 (Statistical Package for Social Science, Illinois, Chicago, EUA). A comparação entre a velocidade de condução no pré e pós-operatório foi realizada com o teste de Wilcoxon para dados pareados. A correlação entre a velocidade de condução e a contagem dos axônios regenerados foi avaliada pela análise de correlação de Pearson.
RESULTADOS
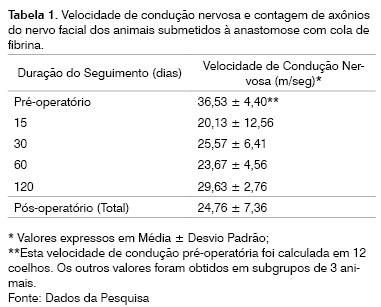
A Tabela 1 resume os resultados deste estudo.
Velocidade de condução nervosa
A velocidade de condução nervosa foi medida nos 12 animais estudados. A média da velocidade de condução pré-operatória foi de 36,53 ± m/seg. A máxima velocidade de condução foi de 46,10 m/seg. Para o seguimento pós-operatório, os animais foram subdivididos em 4 grupos de 3 animais (de acordo com os períodos de avaliação da velocidade de condução nervosa). Aos 15 dias de 12,56 m/seg, a avaliação da média da velocidade de condução foi de 20,13 ± 11,86 m/seg. diferença entre as medidas pré e pós-operatórias foi de 17,63 ± Após 30 dias de pós-operatório a média da velocidade de condução foi de 25,57 ± 6,41 m/seg, a diferença entre as medidas pré e pós-operatórias foi de 14,03 ± 12,00 m/seg. Aos 60 dias de avaliação a média da velocidade de condução foi de 23,67 ± 4,56 m/seg, a diferença entre as medidas pré e pós-operatórias foi de 2,66 m/seg. Após 120 dias de pós-operatório a média da velocidade de 8,40 ± 2,76 m/seg, a diferença entre as medidas pré e condução foi de 29,63 ± pós-operatórias foi de 7,00 ± 1,25 m/seg. Não houve diferenças significativas entre as medidas pré e pós-operatórias entre os grupos (Teste Wilcoxon p= 0,109).
O Gráfico 1 apresenta as diferença das médias das velocidades de condução entre os períodos pré e pós-operatórios por subgrupos. A 7,36 velocidade média pós-operatória global de todos os animais foi de 24,76 ± m/seg a média total da diferença da velocidade de condução entre as medidas pré e pós-operatórias foi de 11,77 ± 8,57 m/seg. Houve diferença significativa quando comparadas todas as velocidades de condução do período pré-operatório e todas as velocidades de condução pós-operatórias (Teste Wilcoxon p = 0,002).
Regeneração axonal pós-operatória
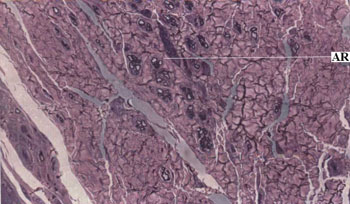
Decorridos 15 dias da anastomose nervosa com cola de fibrina nenhum sinal de regeneração axonal foi observado. Dos 30 aos 120 dias do período pós-operatório foi observado um aumento crescente na contagem de axônios com o decorrer do tempo. Não foi observada correlação significativa entre a velocidade de condução pós-operatória e a regeneração axonal (Teste de pearson p=0,146). A Figura 4 ilustra os espécimes nervosos usados para a contagem de axônios.
Figura 4. Fotomicrografia do nervo facial esquerdo após anastomose com cola de fibrina (Azul de Toluidina; magnificação 400 X).
Legenda: AR Axônios regenerados.
DISCUSSÃO
A cola de fibrina induz a anastomose dos cotos nervosos, reduz a dificuldade na união nervosa e minimiza o dano aos nervos periféricos no ponto de união. A cola de fibrina é permeável e permanece no local o tempo necessário para permitir a união dos cotos nervosos32,33.
Young e Medawar34 introduziram este material como uma alternativa para a sutura nervosa convencional. Estes autores relataram que nervos seccionados poderiam ser unidos aplicando uma substância concentrada derivada do plasma sanguíneo e coagulada ao redor do nervo. Neste estudo o adesivo foi insuficiente para manter os cotos nervosos unidos sobre tensão. Neste contexto a aderência e a retração relacionadas ao uso deste adesivo permaneceram como problemas por décadas35-37. Este problema foi solucionado posteriormente com o aumento da concentração de fibrinogênio neste tipo de adesivo.
A reação fundamental do fibrinogênio é a conversão em fibrina. O fibrinogênio é solúvel no plasma e sua conversão é catalisada pela trombina, que é formada pela protrombina circulante em resposta a ação do fator X ativado e íons cálcio. Para alcançar a concentração requerida de trombina uma solução de cloreto de cálcio é aplicada à trombina liofilizada a uma concentração de 500 UI/L (para coagulação rápida) ou 4 UI/L (para coagulação lenta)38,39.
A mistura dos componentes do adesivo de fibrina utilizado neste estudo é realizada através de um sistema composto de duas seringas (Duploject®, Immuno AG, Viena, Áustria) que misturam os componentes na agulha de aplicação do sistema, evitando a coagulação antes da aplicação do produto. Após a aplicação, a agulha pode ser substituída, permitindo várias aplicações com a mesma unidade do adesivo, dentro de um período máximo de 4 horas.
As reações da cola de fibrina são similares àquelas observadas na coagulação fisiológica: nenhuma retração significativa do coágulo é observada40. A cola de fibrina pode ser usada como uma alternativa à sutura convencional em várias situações, na região maxilofacial, a sua utilização em septoplastias previne hemorragias e hematomas pós-operatórios41.
Em relação ao reparo nervoso sua aplicação é segura e os resultados histológicos e eletrofisiológicos são favoráveis. Entretanto, os resultados relacionados à tensão nervosa e retração da sutura convencional são melhores32. A cola de fibrina utilizada no presente estudo (Tissucol®, Immuno AG, Viena, Áustria) foi a mesma utilizada por Maragh et al.32.
Vários autores5-7,16,18,22,30,34,42,43 analisaram novas alternativas de anastomose para otimizar a regeneração nervosa. As principais opções incluem o uso de condutos nervosos artificiais, laser de CO2 e adesivos ou colas teciduais.
Os adesivos teciduais podem ser sintéticos ou biológicos. Entre os adesivos existentes vale ressaltar os cianoacrilatos. Entretanto, estes induzem fibrose e reação de corpo estranho, não sendo portanto recomendados para anastomose nervosa33.
Para a avaliação da anastomose nervosa com a cola de fibrina neste estudo foram realizadas análises histológica e funcional. Aos 15 dias pós-operatórios não se observou a presença de axônios regenerados nos espécimes histológicos. Dos 30 aos 120 dias do período pós-operatório foi observado um aumento crescente na contagem de axônios, apesar do baixo número de axônios regenerados.
Para a avaliação do estado funcional do nervo facial a utilização da eletromiografia é bastante útil, pois pode estimular e registrar o potencial de ação muscular. A utilização dos eletrodos de superfície é capaz de registrar o estado funcional do nervo após um trauma ou cirurgia de maneira não-invasiva31.
Neste estudo a velocidade de condução nervosa foi determinada em todos os animais usando eletrodos cutâneos de superfície, evitando dano ao músculo e ao nervo5-7. A velocidade média de condução do nervo facial de coelhos é de 42,29 m/seg segundo Gay-Escoda et al.6 e de 41,1 m/seg de acordo com Vasconcelos7. Neste estudo a velocidade foi 4,40 m/seg. Todos estes resultados estão dentro dos padrões normais para o nervo e animal em questão.
Neste estudo as velocidades de condução nervosa obtidas no período pós-operatório de 15 dias representaram 53,4% do valor pré-operatório (inicial). No pós-operatório de 30 dias os valores foram 64,52% do valor inicial. No pós-operatório de 60 dias os valores representaram 73,8% do valor pré-operatório. No pós-operatório de 120 dias os valores foram 80,9% do valor inicial. No período global os valores pós-operatórios representaram 67,8% do valor normal.
A velocidade de condução nervosa pode ser obtida através do uso de eletrodos de superfície, eletrodos internos e eletrodos agulhados. O uso dos eletrodos de superfície permite a avaliação funcional de maneira precisa e não-invasiva, evitando um segundo tempo cirúrgico (requerido pelos eletrodos internos). Previne também a possibilidade de lesão muscular ou nervosa e infecção no sítio de implantação que podem ocorrer ao se utilizar eletrodos agulhados31,44,45.
Apesar do baixo número de axônios regenerados, a velocidade de condução nervosa demonstrou uma boa recuperação no nervo facial unido com a cola de fibrina, atingindo um valor de aproximadamente 81% do valor normal ao final do período. Este dado funcional credencia a cola de fibrina para ser usada como uma alternativa para a união nervosa neste modelo de lesão animal. A anastomose nervosa com cola de fibrina é tecnicamente simples e aparentemente é realizada em menor tempo do que a sutura epineural (apesar deste dado não ter sido medido neste estudo).
É necessária a realização de estudos comparando a sutura epineural e o adesivo de fibrina em lesões nervosas humanas, para garantir que o adesivo de fibrina apresenta resultados semelhantes à sutura convencional.
CONCLUSÕES
A cola de fibrina pode ser usada para a realização de anastomose nervosa no modelo animal e nervo estudados.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Levinthal R, Brown J, Rand RW. Comparison of fascicular, interfascicular and epineural suture techniques in the repair of simple nerve lacerations. J Neurosurg 1977? 47:744-50.
2. Kuderna H. Clinical application of nerveanastomoses adhesion using fibrinogen (in German). Fortschr Kiefer Gesichtschir 1976? 21:135-8.
3. Jin Y, Dehesdin D, Hemet J, et al. Étude expérimentale comparative des reparations nerveuses par suture classique ou par colle biologique. Neurochirurgie 1990?36:378-82.
4. Jacobson JH II. Microsurgical technique in repair of the traumatized extremity. Clin Orthop 1995;314:47.
5. Gay-Escoda C, Vicens-Justo A. Tratamiento quirúrgico de las lesiones nerviosas periféricas. Barcelona, Spain, Departamento de Ciencias Morfológicas y Odontoestomatología, Universidad de Barcelona, 1993.
6. Gay-Escoda C, Buenechea-Imaz R, Sentis-Vilalta J, et al. Reparación nerviosa inmediata con injerto nervioso: Modelo experimental en nervio facial de conejo. Barcelona, Spain, Departamento de Ciencias Morfológicas y Odontoestomatología, Universidad de Barcelona, 1993.
7. Vasconcelos BCE. Reparación microquirúrgica del nervio facial de conejo mediante conductos nerviosos artificiales. Estudio comparativo de conductos reabsorbibles y no reabsorbibles. Doctoral thesis, Barcelona, Spain, Departamento de Ciencias Morfológicas y Odontoestomatología, Universidad de Barcelona, 1999.
8. Waller A. Experiments on the section of the glossopharyngeal and hypoglossal nerves of the frog, and observations of the alterations produced thereby in the structure of their primitive fibres. Phil Trands 1850;140:423-9.
9. Wise AJ, Topuzlu C, Davis P, et al. A comparative analysis of macro and microsurgical neurorrhaphy techniques. Am J Surg 1969;117:566-72.
10. Terris DJ, Fee W. Current issues in nerve repair. Arch Otolaryngol Head Neck Surg 1993;119:725-30.
11. Urbaniak JR. Fascicular nerve suture. Clin Orthop 1982;163:57-64.
12. Parker G, Write T, Jenkins R. Surgical repair of extratemporal facial nerve:A comparison of suture repair and microfibrillar collagen repair. Laryngoscope 1984;94:950-3.
13. Renom JMS, Cañadell J. Técnicas de Microcirurgía. Pamplona, Spain, Ediciones Universidad de Navarra, 1979.
14. Ventura R, Torri G, Campari A, et al. Experimental suture of the peripheral nerves: "fibrin glue." Ital J Orthop Traumatol 1980;6:407-14.
15. Ventura R, Confalonieri N. Limpiego del tissucol nella riparazione delle lesioni nervose: Ricerche sperimentali. Orthop Traumat Oggi 1982;1:113-5.
16. BeriniAytés L, Sobré-Reche N. Sistema adhesiu de fibrina en la reparació del nervi facial. Protocol de model experimental en el nervi facial de conill. Barcelona, Spain, Facultat dOdontología, Universitat de Barcelona, 1995.
17. Caldas Jr AF, Gusmão ES. Estudo clínico comparativo da coaptação dos tecidos gengivais, após cirurgia a retalho, utilizandose etilcianoacrilato (super-bonder) e fio de sutura. Rev Period 1998;7:354-2.
18. Collins JA, Pani KC, Lehman RA, et al. Biological substrates and cure rates of cyanoacrylate tissue adhesives. Arch Surg 1966;93:428-32.
19. Kline DG, Hayes GJ. An experimental evaluation of the effect of a plastic adhesive, methyl 2cyanoacrylate, on neural tissue. J Neurosurg 1963;20:647-54.
20. Lehman AW, Hayes GJ, Leonard F. Toxicity of alkyl 2cyanoacrylates. Arch Surg 1966;93:441-6.
21. Lehman AW, West RL, Leonard F. Toxicity of alkyl 2cyanoacrylates. Arch Surg 1966;93:447-50.
22. Matsumoto T, Hardaway RM, Heisterkamp CA, et al. Higher homologous cyanoacrylate tissue adhesives in surgery of internal organs. Arch Surg 1967;94:861-4.
23. Ronis ML, Harwick JD, Fung R, et al. Review of cyanoacrylate tissue glues with emphasis on their otorhinolaryngological applications. Laryngoscope 1984;94:210-3.
24. Sachs E, Erbengi A, Margolis G, et al. Fatality from ruptured intracranial aneurysm after coating with methyl 2cyanoacrylate. J Neurosurg 1966;24:889-91.
25. Becker CM, Gueuning CO, Graff GL. Sutures of fibrin glue for divided rat nerves: Schwann cell and muscle metabolism. J Reconstr Microsurg 1984;1:139-45.
26. Bento RF, Miniti A. Comparison between fibrin tissue adhesive epineural suture and natural union in intratemporal facial nerve of cats. Acta Otolaryngol 1989;465 Suppl 1:130.
27. Boedts D. A comparative experimental study on nerve repair. Arch Otorhinolaryngol 1987;244 Suppl 1:16.
28. Cruz NI, Debs N, Fiol RE. Evaluation of fibrin glue in rat sciatic nerve repair. Plast Reconstr Surg 1986;78:36973.
29. Faldini A, Puntoni P, Magherini PC, et al. Comparative neurophysiological assessments of nerve sutures performed by microsurgical methods and with fibrin glue: Experimental study. Ital J Orthop Traumatol 1984;10:527-32.
30. Feldman MD, Staloff RT, Epsteinn G, et al. Autologous fibrin tissue adhesive for peripheral nerve anastomosis. Arch Otolaryngol Head Neck Surg 1987;113:9637.
31. Vasconcelos BCE, Gay-Escoda C, Vasconcellos RJH, Neves RFSN. Conduction velocity of the rabbit facial nerve: a noninvasive functional evaluation. Pesqui Odontol Bras 2003;17(2):12631.
32. Maragh H, Meyer BS, Davenport D, et al. Morphofunctional evaluation of fibrin glue versus microsuture nerve repairs. J Reconstr Microsurg 1990;6:331-7.
33. Wieken K, Angioi-Duprez K, Lim A, et al. Nerve anastomosis with glue: Comparative histologic study of fibrin and cyanoacrylate glue. J Reconstr Microsurg 2003;19:17-20.
34. Young JZ, Medawar PB. Fibrin suture of peripheral nerves: Measurement of the rate of regeneration. Lancet 1940;239:1268.
35. Tarlov IM, Benjamin B. Plasma clot and silk suture of nerves. Surg Gynecol Obstet 1943;76:36674.
36. Tarlov IM, Denslow C, Swarz S, et al. Plasma clot suture of nerves. Arch Surg 1943;47:445-8.
37. Tarlov IM. Plasma clot suture of nerve: Illustrated techniques. Surgery 1944;15:257-69.
38. Goldfarb AI, Tarlov IM, Bojar S, et al. Plasma clot suture tensile strength measurement: Its relation to plasma fibrinogen. J Clin Invest 1943;22:183-90.
39. Boedts D, Bouckaert JI. Anastomoses nerveuses: Suture or collede fibrinogéne? Resultats preliminaries. Acta Otorhinolaryngol (Belg) 1984;38:107-12.
40. Rheiner P. Utilisation de la colle biologique dans la reparation du nerve peripherique. Helv Chir Acta 1985;52:891-4.
41. Caldas Neto S, Oliveira RL, Caldas N. Uso da cola de fibrina na prevenção de sangramento e hematoma pós-operatório em septoplastias. Rev Bras Otorinolaringol 2002;68:635-8.
42. Vasconcelos BCE, Gay-Escoda C. Facial nerve repair with expanded polytetrafluoroethylene and collagen conduits: An experimental study in the rabbit. J Oral Maxillofac Surg 2000;58:1257-62.
43. Vasconcelos BCE, Júnior EDP, Berini-Aytés L, et al. Reparación microquirúrgica del nervio periférico: Técnicas y materiales. Rev Eur Odontoestomatol 1999;11:151-60.
44. Krarup C, Loeb GE. Conduction studies in peripheral cat nerve using implanted electrodes: I. Methods and findings in controls. Muscle Nerve 1988;11:922-32.
45. Zeng L, Worseg A, Albrecht G, Grisold W, Hopf R, Redl H, et al. A noninvasive functional evaluation following peripheral nerve repair with electromyography in a rat model. Plast Reconstr Surg 1994;94:146-51.
1 Doutorando em CTBMF FOP/UPE.
2 Doutor em Cirurgia e Traumatologia Bucomaxilofacial (CTBMF), Professor Adjunto da Faculdade de Odontologia da Universidade de Pernambuco - FOP/UPE.
3 PhD, Coordenador do programa de Master em CTBMF da Faculdade de Odontologia da Universidade de Barcelona.
Faculdade de Odontologia da Universidade de Pernambuco (FOP/UPE).
Endereço para correspondência: Edwaldo Dourado Pereira Júnior - Av. Gal. Newton Cavalcanti 1650 Tabatinga Camaragibe PE 54753-220.
Tel. (0xx81) 3458-2867 - E-mail: douradocbmf@hotmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 25 de março de 2006. cod. 1810.
Artigo aceito em 2 de setembro de 2006.