Ano: 2006 Vol. 72 Ed. 5 - Setembro - Outubro - (12º)
Seção: Artigo Original
Páginas: 654 a 658
Polimorfismos GSTT1 e GSTM1 em indivíduos tabagistas com carcinoma espinocelular de cabeça e pescoço
GSTT1 and GSTM1 polymorphism in cigarette smokers with head and neck squamous cell carcinoma
Autor(es): Joice Matos Biselli1, Renata Cristina de Angelo Calsaverini Leal2, Mariângela Torreglosa Ruiz3, Eny Maria Goloni-Bertollo4, José Victor Maníglia5, Andréa Regina Baptista Rossit6, Érika Cristina Pavarino-Bertelli7
Palavras-chave: glutationa transferase, neoplasmas de cabeça e pescoço, polimorfismo, tabaco, álcool.
Keywords: glutathione transferase, head and neck neoplasms, polymorphism, tobacco, alcohol.
Resumo:
A variabilidade em genes relacionados aos processos de ativação e detoxificação de carcinógenos pode interferir na suscetibilidade ao câncer. Objetivo: Investigar a relação entre os polimorfismos GSTT1 e GSTM1 nulos e o risco para o carcinoma espinocelular de cabeça e pescoço em indivíduos tabagistas. Material e Método: Este estudo caso-controle foi realizado na Faculdade de Medicina de São José do Rio Preto, Brasil. Foram avaliadas as freqüências dos genótipos nulos GSTT1 e GSTM1 por PCR multiplex em 60 pacientes com carcinoma espinocelular de cabeça e pescoço e 60 indivíduos sem a doença. Resultados: A cavidade oral foi o sítio de tumor mais freqüente. O genótipo GSTT1 nulo foi encontrado em 33,3% dos pacientes e em 23,3% dos indivíduos controles (p=0,311). Os grupos caso e controle apresentaram freqüências do genótipo GSTM1 nulo de 35% e 48,3%, respectivamente (p=0,582). Não foram encontradas associações entre o hábito etilista e genótipos nulos GSTT1 e GSTM1 em ambos os grupos (valores de p>0,05). O gênero masculino e o hábito etilista foram prevalentes em ambos os grupos. Conclusão: Neste estudo não foi possível estabelecer uma correlação entre os genótipos nulos GSTT1 e GSTM1 e o carcinoma espinocelular de cabeça e pescoço em indivíduos tabagistas.
Abstract:
Gene variability related to carcinogen activation and detoxification may interfere with susceptibility to head and neck cancer. Aim: To investigate the relation between GSTT1 and GSTM1 null polymorphisms and the risk of head and neck squamous cell carcinoma in cigarette smokers. Material and Method: A case-control study conducted at the Sao Jose do Rio Preto Medical School, Brazil. GSTM1 and GSTT1 null genotype frequencies were evaluated by multiplex PCR in 45 cigarette smokers with head and neck squamous cell carcinomas and 45 cigarette smokers without this disease. Results: The oral cavity was the most prevalent tumor site for squamous cell carcinoma. The GSTT1 null genotype was found in 33.3% of the Experimental Group and 23.3% of the Control Group (p= 0.311). Experimental and Control Groups had GSTM1 null genotype frequencies of 35% and 48.3% (p=0.582). No association between alcohol consumption and GSTT1 and GSTMI null genotypes was found in these groups (p-values>0.05). There were more men, and alcohol consumption was prevalent in both groups. Conclusion: In this study we were unable to show a correlation between GSTM1 and GSTT1 genotypes and the development of head and neck squamous cell carcinomas in cigarette smokers.
![]()
INTRODUÇÃO
O neoplasma de cabeça e pescoço é responsável por uma grande incidência de óbitos em todo o mundo, constituindo a sexta causa de morte por câncer1. O tipo histológico mais freqüente, o carcinoma de células escamosas (espinocelular), presente em mais de 90% dos casos2-4, é associado com o consumo de álcool e tabaco5-9. Sabe-se que a fumaça do cigarro é uma mistura complexa de mais de 4000 substâncias, entre as quais pelo menos 40 são carcinogênicas, iniciadoras ou promotoras de tumores em animais10. Os níveis de seus produtos eletrofílicos lançados na circulação sangüínea dependem da atuação de enzimas envolvidas no biometabolismo, que compreende a ativação (Fase I) e detoxificação (Fase II) de compostos químicos10,11. Polimorfismos em genes que codificam essas enzimas podem alterar sua expressão ou função, modificando o biometabolismo de compostos carcinógenos12.
Vários genes polimórficos que codificam enzimas envolvidas na biotransformação de carcinógenos têm sido associados ao desenvolvimento de câncer13-22. Dois genes em particular, GSTT1 e GSTM1, que codificam enzimas de fase II pertencentes à família das glutatião S-transferases (GSTs), parecem relevantes para a suscetibilidade ao carcinoma espinocelular de cabeça e pescoço, pois atuam na detoxificação de metabólitos reativos de substâncias carcinógenas da fumaça do tabaco11-12,13,15,18,20,23.
O gene GSTM1 é polimórfico na população humana com um alelo apresentando atividade nula (GSTM1-) devido a uma grande deleção gênica, e dois outros funcionais (GSTM1A e GSTM1B). O gene GSTT1 é também polimórfico na população humana, podendo apresentar genótipo nulo por deleção24,25. Indivíduos que apresentam genótipo nulo desses genes em homozigose agrupam-se no fenótipo conjugador negativo, uma vez que ocorre perda completa da atividade enzimática26,27, enquanto os que apresentam pelo menos um alelo funcional agrupam-se no fenótipo conjugador positivo28.
Desse modo, a variabilidade individual em genes relacionados aos processos de ativação e detoxificação metabólica parece crucial na suscetibilidade ao câncer de cabeça e pescoço.
Assim, este estudo teve como objetivo identificar os genótipos nulos dos genes GSTT1 e GSTM1 em pacientes tabagistas com carcinoma espinocelular de cabeça e pescoço e comparar essas freqüências com aquelas observadas em indivíduos tabagistas sem história neoplásica, visando uma possível identificação de biomarcadores de suscetibilidade ao câncer de cabeça e pescoço.
MATERIAL E MÉTODOS
Trata-se de um estudo caso-controle, realizado na Faculdade de Medicina de São José do Rio Preto, SP. Os indivíduos com diagnóstico carcinoma espinocelular de cabeça e pescoço confirmado histopatologicamente foram procedentes do Serviço de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço do Hospital de Base/ Faculdade de Medicina de São José do Rio Preto e do Instituto Arnaldo Vieira de Carvalho, SP. O grupo controle foi constituído por indivíduos sem história de doença neoplásica pareado por sexo, idade e etnia e hábito etilista. Todos os indivíduos (pacientes e controles) eram tabagistas. Os indivíduos foram incluídos no estudo após a obtenção do Termo de Consentimento Livre e Esclarecido e todas as informações necessárias foram obtidas por meio de questionário padronizado para coleta de dados (sexo, etnia, tabagismo e etilismo) e mantidas em sigilo. Informações sobre tabagismo e etilismo foram limitadas quanto ao uso ou não de tabaco e álcool. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de São José do Rio Preto (CEP-FAMERP -5639/2002) e pelo Conselho Nacional de Ética em Pesquisa (CONEP - parecer nº 842/2003).
O DNA genômico foi extraído de sangue periférico segundo a técnica de Abdel-Rahman et al.29. A amostra de sangue periférico foi colhida em tubo contendo anticoagulante (EDTA) e os linfócitos foram isolados com auxílio de Ficoll-Paque Plus. O DNA genômico foi obtido adicionando aos linfócitos isolados, SDS (Sodium Dodecyl Sulfate), proteinase K e RNAse A. Após purificação com NaCl, o DNA foi precipitado com etanol e armazenado a -20ºC em tampão Tris-EDTA para posterior análise.
A análise dos genes GSTT1 e GSTM1 foi realizada simultaneamente pela reação em cadeia da polimerase (PCR) multiplex, segundo Abdel-Rahman et al.30. A amplificação da seqüência do DNA de interesse foi obtida por 35 ciclos que compreenderam etapas de desnaturação do DNA a 94ºC por 2 minutos, anelamento das seqüências iniciadoras da reação (primers) a 59ºC por 1 minuto e extensão das cadeias de DNA pela adição dos nucleotídeos a 72ºC por 1 minuto. Uma seqüência do exon 7 do gene CYP1A1 foi coamplificada como um controle interno de amplificação. Os produtos de PCR foram analisados em gel de agarose 1,5% corado com brometo de etídio, sendo que o genótipo nulo (ambos os alelos com deleção) para os genes GSTT1 e GSTM1 foi identificado pela ausência dos fragmentos de amplificação de 480 pares de base (pb) e 219 pb, respectivamente. A presença do fragmento de 312 pb corresponde à seqüência amplificada do gene CYP1A1 e revela o sucesso da reação de amplificação.
Os dados demográficos foram apresentados como média ± desvio padrão (DP) ou proporções. Para a análise estatística das freqüências dos genótipos obtidos utilizou-se o teste exato de Fisher, com nível de significância menor que 5%.
RESULTADOS
Dados demográficos. Um total de 120 indivíduos foi recrutado para o estudo, dos quais 60 com carcinoma espinocelular de cabeça e pescoço (média de idade 54,6 ± 8 anos) e 60 sem história de doença neoplásica (média de idade 54 ± 9 anos). Observou-se predominância do sexo masculino (90% homens vs 10% mulheres) e do hábito etilista (70% etilistas vs 30% não etilistas).
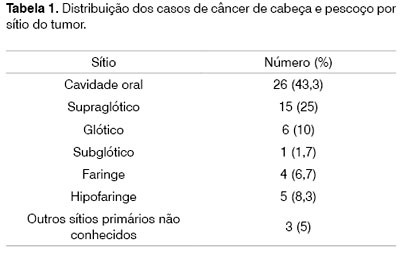
Sítios primários. Todos os casos foram diagnosticados e confirmados patologicamente como carcinoma espinocelular de cabeça e pescoço. A distribuição quanto ao sítio primário do tumor entre os casos está apresentada na Tabela 1. Os tumores de cavidade oral foram mais representados em nosso estudo.
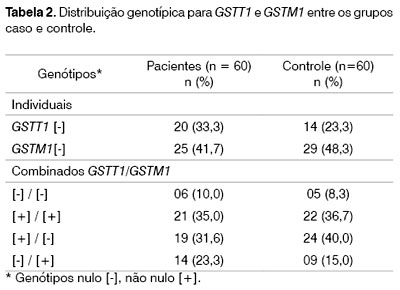
Freqüências dos polimorfismos. O genótipo GSTT1 nulo [-] foi encontrado em 33,3% (20 de 60) dos pacientes e em 23,3% (14 de 60) dos indivíduos controles (P = 0,311), e 21 (35%) dos pacientes e 29 (48,3 %) dos indivíduos controle revelaram genótipo GSTM1 nulo [-] (p = 0,582). O genótipo nulo combinado para os genes GSTT1 e GSTM1 foi observado em 10% (6 de 60) dos pacientes e em 8,3% (5 de 60) dos controles (p = 1,0). A combinação genotípica mais freqüente considerando a presença de um genótipo desfavorável (GST nulo) foi GSTT1 [+] / GSTM1 [-] em 31,6% (19 de 60) dos pacientes e 40% (24 de 60) dos controles (p = 0,353) (Tabela 2).
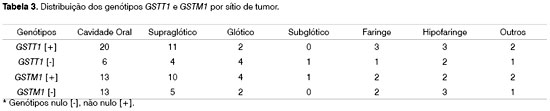
Os genótipos foram agrupados por sítio do tumor (Tabela 3) e não foi observada correlação com os genótipos nulos GSTT1 e GSTM1.
As análises estatísticas não evidenciaram relação entre etilismo e genótipos nulos [-] GSTT1 e GSTM1 quando comparados pacientes e controles etilistas (GSTT1, p = 0,34; GSTM1, p = 0,28; GSTM1[-] / GSTT1[-], p = 1,0).
DISCUSSÃO
Os dados epidemiológicos têm apontado para o consumo do fumo e do álcool como os principais fatores de risco de transformação maligna em casos de câncer de cabeça e pescoço31,32. A avaliação isolada da participação destes agentes na tumorigênese do câncer de cabeça e pescoço é de difícil tarefa, considerando que o fumante tende a consumir álcool e vice-versa. Além disso, há décadas as evidências mostram que os dois fatores atuam sinergisticamente e, quando combinados, constituem a principal causa de tumores32.
Estudos demonstraram associação entre o hábito etilista e o desenvolvimento de tumores de cabeça e pescoço quando considerados o tempo de exposição e quantidade de álcool ingerida12,34. Em nosso estudo, 70% dos pacientes com câncer são etilistas, o que reforça a associação entre o consumo de álcool e o desenvolvimento do câncer de cabeça e pescoço, especialmente em uma amostra composta por pacientes tabagistas, embora não tenha sido possível obter informações referentes à quantidade de álcool ingerida e o tempo de exposição.
A predominância do sexo masculino observada neste estudo corrobora com os achados de Drummond et al.22. Embora nossa casuística seja ainda pequena para explicar esta diferença entre os gêneros, em estudo epidemiológico realizado no Hospital A.C. Camargo, SP, Brasil, a predominância do sexo masculino em pacientes com carcinoma oral parece refletir as diferenças entre homens e mulheres em relação ao uso de tabaco e álcool em nosso país35.
O sítio de tumor mais freqüente em nossos pacientes foi o de cavidade oral, sítio mais freqüentemente relatado pela literatura em tumores de cabeça e pescoço36. Esta distribuição anatômica pode ser explicada pelo fato da nossa amostra ser constituída somente por pacientes tabagistas e, em sua maioria etilistas, uma vez que estes sítios do trato aéreo superior são expostos mais diretamente ao tabaco e ao álcool.
Estudos dos polimorfismos GSTT1 e GSTM1 realizados em populações brasileiras revelam freqüências similares dos polimorfismos. Rossit et al.37, em um estudo realizado em populações provenientes dos estados do Pará e São Paulo, mostraram freqüências de 18 e 47,3% para os genótipos nulos dos genes GSTT1 e GSTM1, respectivamente. O estudo de Rossini et al.38 revelou freqüências de 25,4% para GSTT1 [-] e 42,1% para GSTM1 [-] em indivíduos do Rio de Janeiro. Em nosso estudo, freqüências similares foram observadas para estes genótipos (24,4 e 17,8% para GSTT1 [-] em pacientes e controles, respectivamente, e 44,4 e 48,9% para GSTM1 [-] em pacientes e controles, respectivamente). Freqüências mais elevadas dos polimorfismos GSTT1 [-] e GSTM1 [-] foram observadas por Drummond et al.21,22 em pacientes tabagistas brasileiros com carcinoma espinocelular oral (81,8% para GSTT1[-] e 70,5% para GSTM1[-]).
Os estudos dos polimorfismos GSTT1 e GSTM1 realizados em carcinomas de cabeça e pescoço são contraditórios. Vários autores demonstram uma associação com o genótipo nulo [-] GSTM114,15,20,21,38,40,41, enquanto outros não5,16,42,43. Para o genótipo nulo [-] GSTT1 também foi demonstrada uma relação em alguns estudos15,20,22,44 e ausência da mesma em outros5,16,37,39,41,43,46. A combinação destes genótipos nulos e risco aumentado para este tipo de carcinoma também já foi observada14,41. Além disso, o tempo e a quantidade de exposição a carcinógenos (álcool e tabaco) pode influenciar na interação destes genótipos para o desenvolvimento deste tipo de neoplasia12,34, e esses dados não foram considerados em nosso estudo.
O estudo de Konig-Greger et al.47 mostrou que a atividade da enzima GSTM1 encontrava-se significantemente reduzida em pacientes com carcinoma de cabeça e pescoço em relação aos controles, mas não foi dependente do genótipo desfavorável GSTM1, o que pode sugerir a participação de outras enzimas em sua regulação.
Interessantemente, Evans et al.13 encontraram que o genótipo positivo [+] GSTT1 está associado ao risco de carcinoma espinocelular de cabeça e pescoço entre os tabagistas (OR = 1,6; CI 95% = 1,1-2,5) e sugerem que o genótipo nulo [-] GSTT1 pode proteger o indivíduo para o desenvolvimento deste tipo de câncer. Embora usualmente as GSTs sejam consideradas como enzimas de detoxificação, para alguns substratos químicos em particular, como por exemplo, o diclorometano (DCM), a conjugação da glutationa com a enzima GSTT1 pode resultar em ativação de um componente eletrofílico com conseqüente potencial mutagênico48,49. Embora o DCM não esteja associado com tabaco, podem existir outros bioprodutos do tabaco que ganham função carcinogênica pela ativação mediada da enzima GSTT1. Dois outros estudos também mostraram risco aumentado de doença coronária e vascular periférica em tabagistas com genótipo GSTT1 [+]50,51.
CONCLUSÃO
Neste estudo não foi possível estabelecer uma associação entre os genótipos nulos GSTT1 e GSTM1 e o desenvolvimento de carcinoma espinocelular de cabeça e pescoço em indivíduos tabagistas.
AGRADECIMENTOS
Agradecemos à Profa. Dra. Eloiza Helena Tajara pela sua contribuição para a realização deste trabalho.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Walker DM, Boey G, McDonald, LA. The pathology of oral cancer. Pathology 2003;35(5):376-83.
2. Casiglia J, Woo SB. A comprehensive review of oral cancer. Gen Dent 2001;49(1):72-82.
3. Reichart PA. Identification of risk groups for oral precancer and cancer preventive measures. Clin Oral Investig 2001;5(4):207-13.
4. Ahmed KA, Robbins KT, Wong F, Salazar JE. Efficacy of concomitant chemoradiation and surgical salvage for N3 nodal disease associated with upper aerodigestive tract carcinoma. Laryngoscope 2000;110(11):1789-93.
5. Chang HW, Ling GS, Wei WI, Yuen AP. Smoking and drinking can induce p15 methylation in the upper aerodigestive tract of healthy individuals and patients with head and neck squamous cell carcinoma. Cancer 2004;101(1):125-32.
6. Hasnis E, Reznick AZ, Pollack S, Klein Y, Negler RM. Synergistic effect of cigarette smoke and saliva on lymphocytes - the mediatory role of volatile aldehydes and redox active iron and possible implications for oral cancer. Int J Biochen Cell Biol 2004;36(5):326-839.
7. Kjaerhim K, Gaard M, Andersen A. The role of alcohol, tobacco, and dietary factors in upper aerogastric tract cancers: a prospective study of 10.900 Norwegian men. Cancer Causes and Control 1998;9(1):99-108.
8. Blot WJ, McLaughlin JK, Winn DM, Austin DF, Greenberg RS, Preston-Martin S, Bernstein L, Schoenberg JB, Stemhagen A, Fraumeni JF Jr. Smoking and drinking in relation to oral and pharyngeal cancer. Cancer Res 1988;48(11):3282-7.
9. Llewellyn CD, Linklater K, Bell J, Johnson NW, Warnakulasuriya S. An analysis of risk factors for oral cancer in young people: a case-control study. Oral Oncol 2004;40:304-13.
10. Maser E. Stress, hormonal changes, alcohol, food constituents and drugs: factors that advance the incidence of tobacco smoke-related cancer? TIPS 1997;18(8):270-5.
11. Anwar WA, Abdel-Rahman SZ, El-Zein RA. Genetic polymorphism of GSTM1, CYP2E1and CYP2D6 in Egyptian bladder patients. Carcinogenesis 1996;17(9):1929-32.
12. Olshan, AF, Weissler MC, Watson MA, Bell DA. GSTM1, GSTT1, GSTP1, and NAT1 polymorphisms, tobacco use, and the risk of head and neck cancer. Cancer Epidemiol Biomakers Prev 2000;9(2):185-91.
13. Evans AJ, Henner WD, Eilers KM, Montalto MA, Wersinger EM, Andersen PE et al. Polymorphisms of GSTT1 and related genes in head and neck cancer risk. Head Neck 2004;26(1):63-70.
14. Gronau S, Koenig-Greger D, Jerg M, Riechelmann H. Gene polymorphism in detoxification enzymes as susceptibility factor for head and neck cancer? Otolaryngol Head Neck Surg 2003;128(5):674-80.
15. Amador AG, Righi PD, Radpour S, Everett ET, Weisberger E, Langer M et al. Polymorphisms of xenobiotic metabolizing genes in oropharyngeal carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002;93(4):440-5.
16. To-Figueras J, Gené M, Gómez-Catalán J, Piqué E, Borrego N, Caballero M et al. Microsomal epoxide hydrolase and glutathione S-transferase polymorphism in relation to laryngeal carcinoma risk. Cancer Lett 2002;187(1-2):95-101.
17. Jourenkova-Mironova N, Voho A, Bouchardy C, Wikman H, Dayer P, Benhamou S et al. Glutathione S-transferase GSTM3 and GSTP1 genotypes and larynx cancer risk. Cancer Epidemiol Biomakers Prev 1999;8(2):185-8.
18. Matthias C, Jahnke V, Jones PW, Hoban PR, Alldersea JE, Worrall Sf et al. Cyclin D1, Glutathione S-Transferase, and Cytochrome P450 genotypes and outcome in patients with upper aerodigestive tract cancers: assessment of the importance of individual genes using multivariate analysis. Cancer Epidemiol Biomakers Prev 1999;8(9):815-23.
19. Denissenko MF, Pao A, Tang M, Pfeifer GP. Preferential formation of benzo[a]pyrene adducts at lung cancer mutational hotspots in P53. Science 1996;274(5286):430-2.
20. Sreelekla TT, Ramadas K, Pandey M, Thomas G, Nalinakumari KR, Pillai MR. Genetic polymorphism of CYP1A1, GSTM1 and GSTT1 genes in Indian oral cancer. Oral Oncol 2001;37(7): 593-8.
21. Drummond SN, de Marco L, Noronha JCM, Gomez RS. GSTM1 polymorphism and oral squamous cell carcinoma. Oral Oncol 2004;40:52-5.
22. Drummond SN, Gomez RS, Noronha JCM, Pordeus IA, Barbosa AA, de Marco L. Association between GSTT1 gene deletion and the susceptibility to oral squamous cell carcinoma in a cigarret-smoking subjects. Oral Oncol 2005;41:515-9.
23. Nair UJ, Nair J, Mathew B, Bartsch H. Glutathione S-transferase M1 and T1 null genotypes as risk factors for oral leukoplakia in ethnic betel quid/tobacco chewers. Carcinogenesis 1999;20(5):743-8.
24. Pemble S, Schroeder K, Spencer S, Meyer DJ, Hallier E, Bolt HM et al. Human glutathione S-transferase theta (GSTT1): cDNA cloning and the characterization of a genetic polymorphism. Biochem J 1994;300(1):271-6.
25. Rossit ARB, Conforti-Froes NDT. Suscetibilidade genética, biometabolismo e câncer. Sociedade Brasileira de Cancerologia 2000;10:22-30.
26. Bruhn C, Brockmoller J, Kerb R, Roots I, Borchert HH. Concordance between enzyme activity and genotype of glutathione S-transferases theta (GSTT1). Biochem Pharmacol 1998;56(9): 1189-93.
27. Seidgard J, Ekstrom G. The role of human glutathione transferases and epoxide hydrolases in the metabolism of xenobiotics. Environ Health Perspect 1997;105 Suppl 4:791-7.
28. Rebbeck TR. Molecular epidemiology of the human glutathione S-transferase genotypes GSTM1 and GSTT1 in cancer susceptibility. Cancer Epidemiol Biomarkers Prev 1997;6(9):733-43.
29. Abdel-Rahman SZ, Nouraldeen AM, Ahmed AE. Molecular interaction of 2,3-[14c]-acrylonitrile with DNA in gastric tissues of rat. J Biochem Toxicol 1994;9(4):121-8.
30. Abdel-Rahman SZ, El-Zein RA, Anwar NA. A Multiplex PCR procedure for polymorphic analysis of GSTM1 and GSTT1 genes in population studies. Cancer Lett 1996;107(2):229-33.
31. Ogden GR. Alcohol and oral cancer. Alcohol 2005;35:169-73.
32. Krauns KS, McClean MD, Nelson HH, Peters E, Calderon H, Kelsev KT. Duration but not intensity of alcohol and tobacco exposure predicts p16INK4A homozygous deletion in head and neck squamous cell carcinoma. Cancer Res 2006;66(8):4512-5.
33. Mc Mahon S, Chen AY. Head and neck cancer. Cancer Metastasis Rev 2003;22(1):21-4.
34. Wight AJ, Ogden GR. Possible mechanisms by which alcohol may influence the development of oral cancer-a review. Oral Onc 1998;34(6):441-7.
35. Carvalho AL, Singh B, Spiro RH, Kowalski LP, Shah JP. Cancer of the oral cavity: a comparison between institutions in a developing and a developed nation. Head Neck 2004;26(1):31-8.
36. Dobrossy L. Epidemiology of head and neck cancer: magnitude of the problem. Cancer Metastasis Rev 2005;24:9-17.
37. Rossit ARB, Cabral IR, Conforti-Froes NDT. Avaliação das freqüências alélicas de genes do biometabolismo em uma população brasileira. Genet Mol Biol 1999;22:23-23.
38. Rossini A, Rapozo DCM, Amorim LMF, Macedo JMB, Medina R, Neto JFM et al. Frequencies of GSTM1, GSTT1 and GSTP1 polymorphisms in a Brazilian population. Genet Mol Res 2002;1(3):233-40.
39. Buch SC, Notani PN, Bhisey RA. Polymorphism at GSTM1, GSTM3 and GSTT1 gene loci and susceptibility to oral cancer in an indian population. Carcinogenesis 2002;23(5):803-7.
40. Kietthubthew S, Sriplung H, Au WW. Genetic and environmental interactions on oral cancer in Southern Thailand. Environ Mol Mutagen 2001;37(2):111-6.
41. Hong YJ, Lee JK, Lee GH, Hong SI. Influence of glutathione S-transferase M1 and T1 genotypes on larynx cancer risk among Korean smokers. Clin Chem Lab Med 2000;38(9):917-9.
42. McWilliams JE, Evans AJ, Beer TM, Andersen PE, Cohen JI, Everts EC et al. Genetic polymorphisms in head and neck cancer risk. Head Neck 2000;22(6):609-17.
43. Liu CJ, Chang CS, Lui MT, Dang CW, Shih YH, Chang KW. Association of GST genotypes with age of onset and lymph node metastasis in oral squamous cell carcinoma. J Oral Pathol Med 2005;34:473-7.
44. Hamel N, Karimi S, Hebert-Blouin MN, Brunet JS, Gilfix B, Ghadirian P et al. Increased risk of head and neck cancer in association with GSTT1 nullizygosity for individuals with low exposure to tobacco. Int J Cancer 2000;87(3):452-4.
45. Minnard GC, Spitz MR, Wu X, Hong WK, Etzel CJ. Evaluation of glutathione S-transferase polymorphism and mutagen sensitivity as risk factors for the development of second primary tumors in patients previously diagnosed with early-stage head and neck cancer. Cancer 2006;105(12):2636-44.
46. Oude Ophuis MB, Manni JJ, Peters WH. Glutathione S-transferase T1 null polymorphism and the risk for head and neck cancer. Acta Otolaryngol 2006;126(3)311-7.
47. Konig-Greger D, Riechelmann H, Wittich U, Gronau S. Genotype and phenotype of glutathione-S-transferase in patients with head and neck carcinoma. Otolaryngol Head Neck Surg 2004;130(6):718-25.
48. Sherratt PJ, Manson MM, Thomson AM, Hissink EA, Neal GE, van Bladeren PJ, et al. Increased bioactivation of dihaloalkanes in rat liver due to induction of class theta glutathione S-transferase T1-1. Biochem J 1998;335:619-30.
49. Landi S. Mammalian class theta GST and differential susceptibity to carcinogens: a review. Mutat Res 2000;463:247-83.
50. Li R, Boerwinkle E, Olshan AF, Chambless LE, Pankow JS, Tyroler HA, et al. Increased bioactivation of dihaloalkanes in rat liver due to induction of class theta glutathione S-transferase T1-1. Biochem J 1998;335:619-30.
51. Li R, Folsom AR, Sharrett AR, Couper D, Bray M, Tyroler HA. Interaction of the glutathione S-transferase genes and cigarrete smoking on risk of lower extremity arterial disease: the Atherosclerosis Risk in Communities (ARIC) study. Atherosclerosis 2001;154:729-38.
1 Licenciada em Ciências Biológicas, Mestranda em Ciências da Saúde pela Faculdade de Medicina de São José do Rio Preto - FAMERP.
2 Fisioterapeuta, Mestranda em Ciências da Saúde pela Faculdade de Medicina de São José do Rio Preto - FAMERP.
3 Mestre em Ciências Biológicas (Genética), Doutoranda em Ciências da Saúde pela Faculdade de Medicina de São José do Rio Preto - FAMERP.
4 Professora Livre-Docente do Departamento de Biologia Molecular da Faculdade de Medicina de São José do Rio Preto - FAMERP.
5 Professor Livre-Docente do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de São José do Rio Preto - FAMERP.
6 Doutora em Ciências Biológicas (Genética), do Departamento de Doenças Dermatológicas Infecciosas e Parasitárias da Faculdade de Medicina de São José do Rio Preto - FAMERP.
7 Doutora em Ciências Biológicas (Genética), do Departamento de Biologia Molecular da Faculdade de Medicina de São José do Rio Preto - FAMERP.
Faculdade de Medicina de São José do Rio Preto - FAMERP, Departamento de Biologia Molecular, Unidade de Pesquisa em Genética e Biologia Molecular - UPGEM.
Endereço para correspondência: Unidade de Pesquisa em Genética e Biologia Molecular - UPGEM - Av. Brigadeiro Faria Lima 5416 Bloco U6 São José do Rio Preto SP
15090-000.
Tel: (0xx17) 3201-5720
FAPESP - processo nº 04/159444-5 / CNPq - processo nº 477665/04.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 28 de setembro de 2005. Cod. 1461.
Artigo aceito em 24 de julho de 2006.