Ano: 2005 Vol. 71 Ed. 5 - Setembro - Outubro - (1º)
Seção: Artigo Original
Páginas: 554 a 558
Aspectos morfométricos do nervo hipoglosso humano em adultos e idosos
Morphometric aspects of the human hypoglossal nerve in adults and elderly
Autor(es): Romualdo Suzano Louzeiro Tiago1, Flávio Paulo de Faria2, Paulo Augusto de Lima Pontes3, Osíris de Oliveira Camponês do Brasil4
Palavras-chave: nervo hipoglosso, envelhecimento, disfagia.
Keywords: hypoglossal nerve, aging, dysphagia.
Resumo:
Objetivo: Realizar análise morfométrica das fibras mielínicas do nervo hipoglosso direito, em dois grupos etários, com a finalidade de verificar modificações quantitativas decorrentes do processo de envelhecimento.
Forma de estudo: anatômico.
Material e Método: Foi coletado fragmento de 1cm do nervo hipoglosso direito de 12 cadáveres do sexo masculino, sem antecedentes para doenças como diabetes, alcoolismo e neoplasia maligna. A amostra foi dividida em dois grupos: grupo adulto (idade inferior a 60 anos), composto por seis cadáveres; grupo idoso (idade igual ou superior a 60 anos), composto por seis cadáveres. O material foi fixado em solução contendo 2,5% de glutaraldeído e 2% de paraformaldeído; pós-fixado em tetróxido de ósmio 2%; desidratado em concentrações crescentes de etanol e incluído em resina epóxi. Cortes semifinos de 0,3¼m de espessura foram obtidos, corados com azul de toluidina a 1% e avaliados em microscópio de luz acoplado a sistema analisador de imagens. Os seguintes dados morfométricos foram quantificados: área de secção transversal intraperineural, número e o diâmetro das fibras mielínicas.
Resultados: A área intraperineural do nervo hipoglosso foi semelhante nos dois grupos etários (p=0,8691). A média da área no grupo adulto foi de 1,697 mm2, e no grupo idoso foi de 1,649 mm2. O número total de fibras mielínicas do nervo hipoglosso foi semelhante nos dois grupos etários (p=0,9018). O grupo adulto apresentou média de 10.286 ± 2308 fibras mielínicas e o grupo idoso apresentou média de 10.141 ± 1590 fibras mielínicas. Foi observada distribuição bimodal das fibras mielínicas, com pico acentuado nas fibras de 9¼m e outro menor nas fibras de 2¼m.
Conclusão: A área intraperineural e o número total de fibras mielínicas do nervo hipoglosso direito é semelhante nos dois grupos etários.
Abstract:
Aim: Perform a morphometric analysis of the myelinic fibers of the right hypoglossal nerve, in two age groups; with the purpose of verifying quantitative changes as a result of the aging process.
Study design: anatomic.
Material and Method: A 1cm fragment of the right hypoglossal nerve was collected from 12 male corpses without any medical history of diseases such as: diabetes, alcoholism, and malignant neoplasia. The sample was divided in two groups: group with six corpses under sixty years old (adult), and another group with six corpses sixty years old or above (elderly). The material was fixed in a 2.5% glutaraldehyde and 2% paraformaldehyde solution; postfixed in a 2% osmium tetroxide; dehydrated with increasing ethanol concentrations, and included in epoxy resin. Semi-thin sections of 0.3µm were obtaining, colored in 1% toluidine blue, and evaluated with a light microscope combined with a image analyzing system. The following morphometric data were quantified: intraperineural transversal section area, number, and diameter of the myelinic fibers.
Results: The intraperineural area of the hypoglossal nerve was similar on both age groups (p=0.8691). The average area on adult group was 1.697mm² and on elderly group was 1.649mm². The total number of myelinic fibers of the hypoglossal nerve was similar on both age groups (p=0.9018). The adult group presented an average of 10,286 ± 2,308 myelinic fibers, and the elderly group presented an average of 10,141 ± 1,590 myelinic fibers. A bimodal distribution of the myelinic fibers was observed, with a significant peak on the 9µm fibers, and another, smaller peak on the 2µm fibers. Conclusion: The intraperineural area and the total number of myelinic fibers of the right hypoglossal nerve is similar on both age groups.
![]()
INTRODUÇÃO
O envelhecimento desencadeia no organismo modificações que são responsáveis pelos mais diversos tipos de manifestações clínicas, sendo representadas no trato aerodigestivo superior pelos distúrbios de voz e transtornos de deglutição. A disfagia orofaríngea é um sintoma freqüente em idosos, principalmente em homens a partir dos 60 anos e, geralmente, está associado ao aumento da duração da fase orofaríngea da deglutição.1
Diversos autores têm demonstrado que o processo de envelhecimento também está relacionado à redução da sensibilidade faríngea e supraglótica2,3 sendo considerada um dos fatores responsáveis pelo aparecimento da disfagia, aspiração e pneumonia de repetição em idosos, devido à diminuição dos reflexos que protegem as vias aéreas inferiores. Outra modificação observada em idosos é o retardo na abertura do esfíncter esofágico superior1,4,5 e a redução do tônus do músculo cricofaríngeo.5
Pouco tem sido estudado sobre a ação do envelhecimento nos músculos6,7 e nos nervos cranianos.8-12 Estudo realizado no músculo genioglosso em ratos demonstrou que há redução do número de junções neuromusculares em ratos mais velhos; no entanto, não observaram diferença na área do nervo responsável pela inervação deste músculo.7 Pesquisas envolvendo o sistema muscular da laringe apresentam resultados que sugerem: redução numérica das fibras musculares do músculo tireoaritenóideo, principalmente as fibras musculares de contração lenta;13 redução das proteínas responsáveis pela contração muscular14 e aumento do tecido conectivo ou endomísio.15,16 Outros autores, baseados em avaliação eletromiográfica, apresentam resultados sugestivos de desnervação ou lesão axonal envolvendo o controle motor da laringe em idosos, com conseqüente alteração na contração dos músculos laríngeos.17 Estudos morfométricos dos nervos laríngeos em humanos demonstram redução do número de fibras mielínicas, principalmente das fibras de menor diâmetro.10,12
O objetivo desta pesquisa é realizar análise morfométrica do número e do diâmetro das fibras mielínicas do nervo hipoglosso direito, em dois grupos etários (adulto e idoso), com a finalidade de verificar modificações quantitativas decorrentes do processo de envelhecimento.
MATERIAL E MÉTODO
O projeto de pesquisa deste estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital São Paulo/ Universidade Federal de São Paulo (UNIFESP). Foram coletados fragmentos de 1cm do nervo hipoglosso direito de 12 cadáveres submetidos a autópsia no Serviço de Verificação de Óbitos da Capital - Universidade de São Paulo, no período de junho de 2003 a novembro de 2004. Os fragmentos foram coletados entre 9 e 18 horas após o óbito e analisados no Centro de Microscopia Eletrônica da UNIFESP.
Foram selecionados cadáveres do sexo masculino e sem antecedentes para doenças como: diabetes, alcoolismo, neoplasia maligna e emagrecimento súbito.18-20 A amostra foi dividida em dois grupos etários: grupo Adulto (idade inferior a 60 anos), composto por seis cadáveres; grupo Idoso (idade igual ou superior a 60 anos), composto por seis cadáveres.
O fragmento do nervo hipoglosso direito foi obtido após o cruzamento do nervo com a artéria carótida interna e a artéria carótida externa, após a saída da alça do hipoglosso. Durante a obtenção os fragmentos foram cortados transversalmente (perpendicular ao eixo de comprimento do nervo) para possibilitar a quantificação dos seguintes dados morfométricos: área de secção transversal intraperineural (área representativa do número de fibras mielínicas), número e diâmetro das fibras mielínicas.21 Os fragmentos foram fixados em solução contendo 2,5% de glutaraldeído e 2% de paraformaldeído em solução tampão cacodilato de sódio 0,1 M, pH 7,4 (modificado de Karnovsky, 1965),22 pós-fixados em tetróxido de ósmio 2% em solução tampão cacodilato de sódio 0,1M, pH 7,4, desidratados em concentrações crescentes de etanol e incluídos em resina tipo Araldite 502®.
O material foi cortado em ultramicrótomo com navalhas de vidro para obtenção de cortes semifinos de 0,3mm de espessura e corado com azul de toluidina a 1%. Os cortes foram avaliados em microscópio de luz acoplado a sistema analisador de imagens.
A avaliação morfométrica foi dividida em duas etapas:
A. Quantificação da área intraperineural total: para obter as medidas da área as imagens do nervo foram digitalizadas a partir da objetiva de 5x, o que representou o aumento final de 120x na tela do monitor do computador. A obtenção da área intraperineural foi importante para o cálculo do número total de fibras do nervo a partir de amostragem representativa.
B. Quantificação do número e do diâmetro externo das fibras mielínicas: as imagens do nervo foram digitalizadas a partir da objetiva de 40x, o que representou o aumento final de 1920x na tela do monitor do computador. Foram avaliados quatro campos aleatórios por lâmina,23 sendo que além da contagem das fibras e medida dos seus diâmetros, foi medida a área representativa do campo, o que significou a exclusão das áreas de perineuro quando estas apareciam no campo. Desta forma, em cada lâmina, foi avaliada a área que variou de 7% a 14,2%. O número total de fibras mielínicas foi estimado a partir da área intraperineural total (obtida na primeira etapa) e do número de fibras e da área dos campos avaliados (obtida na segunda etapa).
Para evitar erro de amostragem (efeito de margem) foram excluídas as fibras mielínicas projetadas sobre as linhas inferior e esquerda que delimitam o campo.24 O menor diâmetro da fibra (maior distância perpendicular ao maior eixo da fibra mielínica) foi o escolhido para a medida das fibras mielínicas com perímetro elíptico ou irregular.10,21
Para a comparação das médias da área intraperineural e do número de fibras mielínicas entre os grupos Adulto e Idoso foi usado o método estatístico de Análise de Variância (ANOVA). Adotamos o nível de significância a de 0,05. O valor de p (probabilidade de ocorrer um evento) < 0,05 foi considerado como significante e determinou a rejeição da hipótese de igualdade entre os grupos.
RESULTADOS
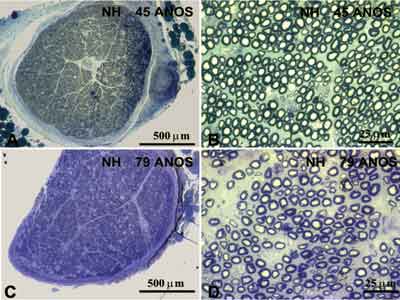
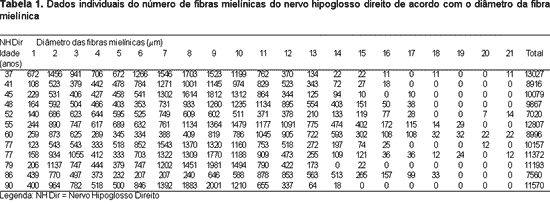
Os dados individuais do número de fibras mielínicas de acordo com o diâmetro são apresentados na Tabela 1. A média de idade do grupo Adulto foi de 46,3 anos e do grupo Idoso foi de 78,2 anos. Para melhor visibilizar a análise morfométrica do nervo hipoglosso direito são apresentadas as Figuras 1, 2 e 3. Na Figura 2 são apresentadas fotomicrografias típicas da área de secção transversal (menor aumento) e de um campo (maior aumento), representando cada grupo etário.
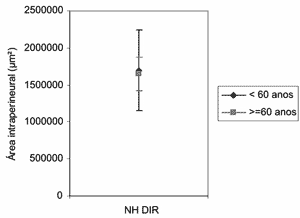
Na análise da área intraperineural do nervo hipoglosso direito (Figuras 1 e 2) não foi observada diferença entre os dois grupos etários (p=0,8691). A média da área no grupo Adulto foi de 1.696.918µm2 (1,697 mm2) e no grupo Idoso foi de 1.649.083µm2 (1,649mm2).
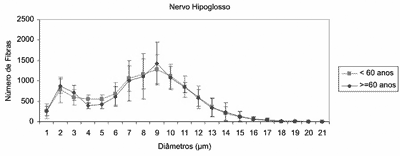
A análise do nervo hipoglosso direito (Figura 3) não mostrou diferença entre os dois grupos etários no que se relaciona ao número total de fibras mielínicas (p=0,9018) e à distribuição das fibras de acordo com o diâmetro. O grupo Adulto apresentou média de 10.286 ± 2308 fibras mielínicas e o grupo Idoso apresentou média de 10.141 ± 1590 fibras mielínicas.
Figura 1. Perfis das médias da área intraperineural (µm2) do nervo hipoglosso direito, de acordo com os grupos etários.
Figura 2. Fotomicrografia típica do nervo hipoglosso direito de indivíduo com 45 anos de idade (A e B) e de indivíduo com 79 anos de idade (C e D). Em A e C observa-se o corte transversal do nervo, corado com azul de toluidina. Em B e D observa-se um campo do corte transversal do nervo, corado com azul de toluidina.
Figura 3. Perfis das médias do número de fibras mielínicas do nervo hipoglosso direito nos grupos <60 anos e ³60 anos, de acordo com o diâmetro das fibras.
DISCUSSÃO
Os nervos hipoglossos formam o par craniano responsável pela inervação motora dos músculos da língua. O corpo (pericário) dos neurônios motores inferiores do nervo hipoglosso localiza-se no bulbo, próximo à linha média e sob o assoalho do quarto ventrículo. Os axônios destes neurônios deixam o núcleo do hipoglosso como uma fileira de pequenos fascículos e formam o nervo hipoglosso que desce pelo pescoço; próximo ao osso hióide se dirige anteriormente e penetra no corpo da língua para inervar os músculos hioglosso, genioglosso, estiloglosso e os músculos intrínsecos da língua.25
Na altura do osso hióide o nervo hipoglosso é composto, na maioria das vezes, por um único fascículo.26-28 Nossos resultados demonstraram que a média da área seccional intraperineural no grupo Adulto (1,697mm2) foi semelhante ao grupo Idoso (1,649mm2), sem diferença estatisticamente significante (Figuras 1 e 2). Diversos autores têm estudado as características morfométricas do nervo hipoglosso com o objetivo de obter dados para auxiliar na técnica de anastomose hipoglosso-facial no tratamento da paralisia facial periférica. Estes autores descreveram área média que variou de 1,54 a 2,02mm2, próximo ao osso hióide;27-29 entretanto, estes autores não relataram se a área avaliada incluiu o epineuro ou se foi medida apenas a área representativa do nervo (área intraperineural).
A média do número total de fibras mielínicas no grupo Adulto foi de 10.286 fibras e no grupo Idoso foi de 10.141 fibras, sem diferença entre os grupos. Nos dois grupos etários foi observada distribuição bimodal (Figura 3), com picos nas fibras de 2mm e 9mm e predomínio das fibras mielínicas de médio diâmetro. Com o decorrer da idade não foi observada redução no número de fibras mielínicas no nervo hipoglosso. Alguns trabalhos avaliaram o número total de fibras mielínicas do nervo hipoglosso, bem como a distribuição das fibras de acordo com o diâmetro, e descreveram resultados semelhantes aos observados neste estudo. Nestes trabalhos o número total de fibras variou de 9202 a 9920 fibras26,27,29, com distribuição bimodal, predomínio das fibras de 8-9mm e menor pico nas fibras de 3mm.27,29 Atsumi et al. (1987) sugerem que este pequeno pico de fibras mielínicas pode representar fibras aferentes ou fibras do sistema nervoso autônomo que se integram ao nervo hipoglosso após a passagem pelo canal do hipoglosso na base do crânio.29
Apesar de não termos observado modificação no número total e na distribuição das fibras mielínicas entre os indivíduos adultos e idosos é relatado na literatura que determinadas doenças que comprometem o neurônio motor inferior, como a esclerose lateral amiotrófica, levam à redução do número de fibras mielínicas de médio diâmetro (5-10mm) e que resulta na atrofia da língua; este é um dos principais sinais do estágio mais avançado desta doença.29
O envelhecimento parece determinar a perda seletiva de fibras mielínicas, sendo bastante comum no idoso a redução do número de fibras de menor diâmetro nos nervos laríngeos que são responsáveis pela sensibilidade10,12 e pela inervação motora de fibras musculares de contração lenta.30 A célula de Schwann, a partir da bainha de mielina, é a responsável pela nutrição do axônio e, quanto mais espessa a bainha de mielina, mais protegido é o axônio. Como o músculo da língua é composto principalmente por fibras musculares de contração rápida31,32, inervadas por fibras mielínicas de médio diâmetro (5-10mm), a redução destas fibras mielínicas praticamente não ocorre no nervo hipoglosso em idosos.
CONCLUSÃO
Apesar de o envelhecimento determinar modificações na fase orofaríngea da deglutição, não observamos alterações morfométricas no nervo hipoglosso do lado direito entre os indivíduos adultos e idosos. A área intraperineural, o número total e a distribuição das fibras mielínicas são semelhantes nos dois grupos etários.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Robbins J, Hamilton JW, Lof GL, Kempster GB. Oropharyngeal swallowing in normal adults of different ages. Gastroenterol 1992; 103:823-9.
2. Aviv JE, Martin JH, Jones ME, Wee TA, Diamond B, Keen MS, Blitzer A. Age-related changes in pharyngeal and supraglottic sensation. Ann Otol Rhinol Laryngol 1994; 103: 749-52.
3. Aviv JE. Effects of aging on sensitivity of the pharyngeal and supraglottic areas. Am J Med 1997; 103: 74s-76s.
4. Ekberg O, Feinberg MJ. Altered swallowing function in elderly patients without dysphagia: radiologic findings in 56 cases. AJR 1991; 156: 1181-4.
5. McKee GJ, Johnston BT, McBride GB, Primrose WJ. Does age or sex affect pharyngeal swallowing? Clin Otolaryngol 1998; 23: 100-6.
6. McComas AJ. Oro-facial muscles: internal structure, function and ageing. Gerondotology 1998; 15: 3-14.
7. Hodges SH, Anderson AL, Connor NP. Remodeling of neuromuscular junctions in aged rat genioglossus muscle. Ann Otol Rhinol Laryngol 2004; 113: 175-9.
8. Malmgren LT, Ringwood MA. Aging of the recurrent laryngeal nerve: an ultrastructural morphometric study. In: Fujimura O, editor. Vocal physiology: voice production, mechanisms and functions. New York: Raven Press; 1988. p. 159-80.
9. Rosenberg SI, Malmgren LT, Woo P. Age-related changes in the internal branch of the rat superior laryngeal nerve. Arch Otolaryngol Head Neck Surg 1989; 115: 78-86.
10. Mortelliti AJ, Malmgren LT, Gacek RR. Ultrastructural changes with age in the human superior laryngeal nerve. Arch Otolaryngol Head Neck Surg 1990; 116: 1062-9.
11. Nakai T, Goto N, Moriyama H, Shiraishi N, Nonaka N. The human recurrent laryngeal nerve during the aging process. Okajimas Folia Anat Jpn 2000; 76: 363-8.
12. Tiago RSL, Munhoz MSL, Faria FP, Guilherme A. Aspectos histomorfométricos do nervo laríngeo superior. Rev Bras Otorrinolaringol 2002; 68: 157-65.
13. Malmgren LT, Fisher PJ, Bookman LM, Uno T. Age-related changes in muscle fiber types in the human thyroarytenoid muscle: an immunohistochemical and stereological study using confocal laser scanning microscopy. Otolaryngol Head Neck Surg 1999; 121: 441-51.
14. Suzuki T, Connor NP, Lee K, Bless DM, Ford CN, Inagi K. Age-related alterations in myosin heavy chain isoforms in rat intrinsic laryngeal muscles. Ann Otol Rhinol Laryngol 2002; 111: 962-7.
15. Rodeño MT, Sánchez-Fernández JM, Rivera-Pomar JM. Histochemical and morphometrical age in changes in human vocal cord muscles. Acta Otolaryngol 1993; 113: 445-9.
16. Kersing W, Jennekens FGI. Age-related changes in human thyroarytenoid muscles: a histological and histochemical study. Eur Arch Otorhinolaryngol 2004; 261: 386-92.
17. Takeda N, Thomas GR, Ludlow CL. Aging effects on motor units in the human thyroarytenoid muscle. Laryngoscope 2000; 110: 1018-25.
18. Shuman CR, Weissman B. Recurrent laryngeal nerve involvement as a manifestation of diabetic neuropathy. Diabetes 1968; 17: 302.
19. Dyck PJ. Hypoxic neuropathy: does hypoxia play a role in diabetic neuropathy? Neurology 1989; 39: 111-8.
20. Grisold W, Drlicek M. Paraneoplastic neuropathy. Curr Opin Neurol 1999; 12: 617-25.
21. Fraher JP. On methods of measuring nerve fibres. J Anat 1980; 130: 139-51.
22. Karnovsky MJ. A formaldehyde-glutaraldehyde fixative of high osmolarity for use in electron microscopy. J Cell Biol 1965; 27: 137A-8A.
23. Mayhew TM, Sharma AK. Sampling schemes for estimating nerve fibre size: methods for nerve trunks of mixed fascicularity. J Anat 1984; 139: 45-58.
24. Gundersen HJG. Notes on the estimation of the numerical density of arbitrary profiles: the edge effect. J Microsc 1977; 111: 219-23.
25. Burt AM. Neuroanatomia. Rio de Janeiro: Guanabara Koogan; 1995. p. 343-4.
26. Mackinnon SE, Dellon AL. Fascicular patterns of the hypoglossal nerve. J Reconstr Microsurg 1995; 11: 195-8.
27. Asaoka K, Sawamura Y, Nagashima M, Fukushima T. Surgical anatomy for direct hypoglossal-facial nerve side-to-end "anastomosis". J Neurosurg 1999; 91: 268-75.
28. Vacher C, Dauge MC. Morphometric study of the cervical course of the hypoglossal nerve and its application to hypoglossal facial anastomosis. Surg Radiol Anat 2004; 26: 86-90.
29. Atsumi T, Miyatake T. Morphometry of the degenerative process in the hypoglossal nerves in amyotrophic lateral sclerosis. Acta Neuropathol 1987; 73: 25-31.
30. Sasaki CT, Kim Y, Sims HS, Czibulka A. Motor innervation of the human cricopharyngeus muscle. Ann Otol Rhinol Laryngol 1999; 108: 1132-9.
31. Sutlive TG, Shall MS, McClung JR, Goldberg SJ. Contractile properties of the tongue's genioglossus muscle and motor units in the rat. Muscle Nerve 2000; 23: 416-25.
32. Saigusa H, Niimi S, Yamashita K, Gotoh T, Kumada M. Morphological and histochemical studies of the genioglossus muscle. Ann Otol Rhinol Laryngol 2001; 110: 779-84.
1 Doutor em Ciências pelo programa de Pós-graduação em Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da UNIFESP. Médico Pesquisador do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo - Escola Paulista de Medicina.
2 Doutor em Ciências pela Universidade de São Paulo, Professor Adjunto do Centro de Microscopia Eletrônica da
Universidade Federal de São Paulo - Escola Paulista de Medicina.
3 Livre Docente pelo Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo - Escola Paulista de Medicina. Professor Titular do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo - Escola Paulista de Medicina.
4 Doutor em Medicina pela Universidade Federal de São Paulo - Escola Paulista de Medicina. Professor do Programa de Pós-graduação em
Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo - Escola Paulista de Medicina.
Universidade Federal de São Paulo.
Endereço para correspondência: Romualdo Suzano Louzeiro Tiago - Rua Pio XII 439 ap. 122 Bela Vista São Paulo SP 01322-030.
Tel. (0xx11) 3285-6824 - E-mail: romualdotiago@uol.com.br
Artigo recebido em 23 de abril de 2005. Artigo aceito em 19 de setembro de 2005.