Ano: 2002 Vol. 68 Ed. 1 - Janeiro - Fevereiro - (2º)
Seção: Artigo Original
Páginas: 07 a 13
Otoproteção das células ciliadas auditivas contra a ototoxicidade da amicacina
Otoprotection of auditory hair cells against amikacin ototoxicity
Autor(es):
José Antonio A. de Oliveira 1
Daniel Mendes Canedo 2,
Maria Rossato 3
Palavras-chave: ototoxicidade, antibióticos aminoglicosídeos, amicacina, autodefesa.
Keywords: ototoxicity, aminoglycoside antibiotics, amikacin, self-protection.
Resumo:
Objetivo: Este estudo teve por objetivo verificar a ocorrência de otoproteção contra a ototoxicidade da amicacina em cobaias. Forma de estudo: experimental. Material e método: Foram estudadas as células ciliadas externas do órgão de Corti de 31 animais por meio de microscopia eletrônica de varredura (JEOL-JMS 5200). Foram estudados 4 grupos: A, controle; B, amicacina 20 mg/kg/dia por 30 dias; C, amicacina 400 mg/Kg/ dia 12 dias; grupo D, amicacina 20 mg/kg/dia por 30 dias seguido de 400 mg/kg/dia por 12 dias. Resultados: Nos grupos A e B, as células estavam normais em todas as cócleas; no grupo C houve lesões extensas nas duas espiras mais basais; no grupo D houve redução significante das lesões nas duas mais basais em comparação com o grupo C que recebeu a dose ototóxica de amicacina isoladamente. Conclusão: Conclui-se que a dose não ototóxica de amicacina administrada previamente à dose ototóxica do mesmo antibiótico tem efeito protetor, estatisticamente significante, nas duas espiras mais basais das cócleas de cobaias.
Abstract:
The objective of the present study was to determine the occurrence of self-protection of hair cells against the ototoxicity of amikacin in guinea pigs. Study design: experimental. Material and method: The outer hair cells of the organ of Corti of 31 animals were studied by scanning electron microscopy. The animals were divided into four groups: A, control; B, amikacin, 20 mg/kg/day for 30 days; C, amikacin, 400 mg/kg/day for 12 days; group D, amikacin, 20 mg/kg/day for 30 days followed by 400 mg/kg/day for 12 days. Results: In groups A and B, the cells were normal in all cochleae, in group C there were extensive lesions of the two more basal turns, in group D there was a significant reduction of lesions in the two more basal turns compared to group C, which had received the ototoxic dose of amikacin alone. Conclusion: We concluded that the non-ototoxic dose of amikacin administered before the ototoxic dose of the same antibiotic had a statistically significant protective effect on the two more basal turns of the guinea pig cochlea.
![]()
1 Professor Titular e Chefe de Clínica.
2 Aluno do Curso de Pós-Graduação da Área de Otorrinolaringologia.
3 Técnica do Serviço de Otorrinolaringologia.
Serviço de Otorrinolaringologia do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto. Universidade de São Paulo.
Apoiado por verbas da FAPESP e CNPq.
Apresentado como "Contributed Paper" 2000 Annual Meeting Of American Academy Of Otolaryngology Head Neck Surgery.
Endereço para correspondência: Serviço de Otorrinolaringologia do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo. Av.Bandeirantes, 3900 CEP 14049-900 - Ribeirão Preto - Tel: (0xx16) 602 2862 - Fax (0xx16) 602 2860 - Residência: (0xx16) 623 2878.
Artigo recebido em 13 de setembro de 2001. Artigo aceito em 29 de outubro de 2001.
Introdução
O órgão de Corti é a estrutura neuro-sensorial fundamental no processamento auditivo periférico da mensagem acústica. É formado por uma série de estruturas epiteliais complexas, com células sensoriais e de sustentação, situadas sobre a membrana basilar. As células sensoriais são de dois tipos: células ciliadas externas e células ciliadas internas.
Diversos grupos farmacológicos apresentam potencial ototóxico, sendo os antibióticos aminoglicosídeos os mais estudados. As perturbações transitórias ou definitivas das funções auditiva e vestibular, induzidas por aminoglicosídeos de aplicação terapêutica, constituem a ototoxicidade.
Os antibióticos aminoglicosídeos aminociclitólicos são incontestavelmente os mais importantes por serem eficazes e baratos e um dos mais comumente usados atualmente no mundo, principalmente nos países em desenvolvimento. Constituem uma família de antibióticos de estrutura química complexa, ativos e principalmente usados contra os bacilos gram-negativos, e na tuberculose, com ação bactericida sobre os germes sensíveis. Por sua natureza policatiônica (pH entre 7 e 8), as moléculas dos aminoglicosídeos interagem fortemente com receptores fosfolipídeos da membrana carregados negativamente, os polifosfoinositídeos presentes nas células ciliadas da orelha interna(7). Os complexos entre os antibióticos aminoglicosídeos e os polifosfoinositídeos produzem diversos efeitos inibitórios nos receptores das membranas celulares, bloqueando os canais de cálcio, causando lesões no órgão de Corti. As lesões são preferencialmente nas células ciliadas externas(4). O mecanismo de ototoxicidade crônica dos aminoglicosídeos tem sido esclarecido recentemente por uma seqüência de pesquisas "in vivo" e "in vitro"(14). A principal descoberta foi a capacidade da gentamicina de quelar ferro formando um complexo com propriedades oxidativas(22). Estes complexos podem se formar também com outros aminoglicosídeos(17) e podem provocar a formação de radicais livres que podem oxidar uma grande variedade de substâncias como proteínas, lipídios de membranas, DNA. Estes radicais livres são agentes biológicos que provocam lesões teciduais(7). Este complexo parece ser o metabolito tóxico que leva a produção das lesões ototóxicas nas células ciliadas, especialmente as externas do órgão de Corti, pela formação de radicais livres.
A estreptomicina foi a primeira droga do grupo dos aminoglicosídeos inicialmente usada para o tratamento da tuberculose no final da Segunda Guerra Mundial. Desde então, seus efeitos ototóxicos e vestibulotóxicos são conhecidos. Com o passar dos anos foram introduzidos no mercado outros aminoglicosídeos, entretanto, atualmente têm sido usados em terapêutica a amicacina, gentamicina e tobramicina. Todos esses aminoglicosídeos possuem o agrupamento amina, que lhes conferem a característica básica responsável por sua ação antiinfecciosa bactericida sobre as bactérias gram-negativas, mas também seus efeitos tóxicos sobre o orelha interna e os rins(15). Apesar do surgimento de outras drogas que atuam contra bactérias gram-negativas, como as quinolonas e cefalosporinas de terceira geração, os aminoglicosídeos persistem sendo muito utilizados em todo o mundo pela alta eficácia, amplo espectro de atividade e baixo custo.
A amicacina é um aminoglicosídeo semi-sintético derivado da kanamicina, ativo contra a maioria das espécies microbianas resistentes à gentamicina e kanamicina1. Muitos estudos clínicos dos efeitos da amicacina no homem têm revelado que a mesma pode produzir alterações que provocam zumbidos, perda auditiva nas freqüências altas e, mais raramente, distúrbios vestibulares(18). Uma das limitações mais sérias na aplicação terapêutica desta droga é a ototoxicidade induzida que provoca lesões permanentes no sistema coclear e vestibular(6). A amicacina em dose de 400mg/kg/dia intramuscular provoca completa eliminação das células ciliadas externas e lesão parcial das internas, na primeira e na segunda espira da cóclea de cobaias, com lesões menos intensas na terceira e quarta espiras, ocorrendo lesões parciais nas células ciliadas internas(8). Considerando as três fileiras de células ciliadas externas, as lesões ocorrem inicialmente na primeira fileira, progredindo em seguida para as segunda e terceira fileiras, nas espiras mais apicais(12). A microscopia eletrônica de varredura, método bastante utilizado em estudos de ototoxicidade, permite um estudo minucioso do órgão de Corti normal e alterado, ao nível da cóclea(8).
Têm sido muito estudados ultimamente os fenômenos de otoproteção contra ruídos traumáticos denominados de condicionamento e resistência desenvolvidos pela célula ciliadas da cóclea. O condicionamento sonoro consiste na exposição do animal a um estímulo acústico contínuo, de baixo nível, não lesivo à audição(3). O fenômeno chamado de resistência ("toughening") é provocado por exposição a estímulos acústicos interrompidos não lesivos. Estes estímulos não lesivos de baixa intensidade sonora, aplicados durante um tempo longo, previamente à exposição de ruído traumático do mesmo tipo, protegem as cócleas de animais experimentais contra o ruído traumático diminuindo as alterações fisiológicas e as lesões das células sensoriais ciliadas da cóclea(3). As células ciliadas se modificariam pelos estímulos condicionantes e a proteção parece ser mediada por alterações restritas à cóclea(23).
Planejamos nossa pesquisa para um estudo de otoproteção contra ototoxicidade usando o antibiótico aminoglicosídico amicacina. A técnica utilizada foi a microscopia eletrônica de varredura para estudar as lesões estruturais do órgão de Corti, especialmente as células ciliadas externas em grupos de cobaias, que receberam doses diferentes do antibiótico aminoglicosídeo amicacina, avaliando a extensão das lesões nas diferentes espiras cocleares. Estes estudos tiveram o objetivo de verificar se a administração prévia prolongada de doses do aminoglicosídeo amicacina não lesivas e bem menores que as doses ototóxicas promoveriam proteção do órgão de Corti contra lesões provocadas pela aplicação posterior da mesma amicacina em doses ototóxicas.
Material e Método
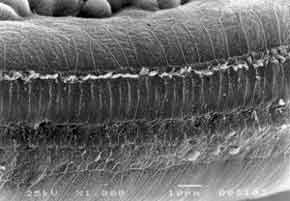
Neste experimento foram utilizadas 31 cobaias-macho, albinas, pesando em torno de 250 a 280 gramas, com reflexo de Preyer normal. No decorrer desse experimento as cobaias permaneceram no Laboratório de Técnica Cirúrgica Experimental da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP). Os animais foram usados de acordo com as diretrizes da nossa instituição que está baseado no guia para o cuidado e uso de animais de laboratório do Institute of Laboratory Animal Resources, Comission on Life Sciences, National Research council, National Academy Press, Washington, D.C., 1996. A droga utilizada nesta pesquisa foi o antibiótico aminoglicosídeo amicacina administrado por via intramuscular. O reflexo de Preyer foi testado diariamente, o mesmo ocorrendo com a avaliação do peso, apenas para controle dos dias de sacrifício do animais. As cobaias foram divididas em 4 grupos: grupo A - grupo controle (placebo) - constituído de cinco cobaias (10 cócleas) que receberam água destilada por via intramuscular, por período de 30 dias, e após foram sacrificadas; grupo B, constituído de cinco cobaias (10 cócleas) que receberam Amicacina 20 mg/kg/dia, via intramuscular, por 30 dias e após foram sacrificadas; grupo C, constituído por sete cobaias que receberam Amicacina 400 mg/kg/dia, via intramuscular, até que o reflexo de Preyer se mostrasse ausente (13 cócleas, uma foi desprezada por defeitos na técnica); grupo D, constituído por 14 cobaias que receberam amicacina 20 mg/kg/dia, via intramuscular durante 30 dias e após 400 mg/kg/dia pelo período médio durante o qual ocorreu a ausência do reflexo de Preyer do grupo que foi de 12 dias (26 cócleas), duas cócleas foram desprezadas por problemas técnicos. As cobaias inicialmente foram anestesiadas utilizando-se éter por inalação.Figura 1. Cobaia do grupo A. Microestrutura do órgão de Corti com as células ciliadas externas (OHC); células ciliadas internas (IHC) e células suportes (SC) normais. Scanning Electron Microscopy. Aumento 1000XFigura 2. Cobaia do grupo C. Microestrutura do órgão de Corti. Maior grau de lesão na espira 1 mais basal, nas células ciliadas externas (OHC). Scanning Electron Microscopy. Aumento 1000X
Figura 3. Cobaia do grupo D. Microestrutura do órgão de Corti com grande quantidade de células ciliadas externas (OHC) normais. Células ciliadas internas (IHC) normais ou com poucas lesões. Scanning Electron Microscopy. Aumento 500X
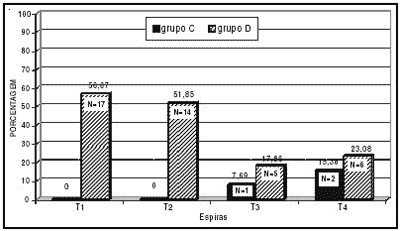
Gráfico 1. Porcentagem de cócleas com células normais, nas espiras de cobaias do grupo C (tratadas com 400 mg de Amicacina) e do grupo D (tratadas com 20mg + 400 mg de Amicacina).
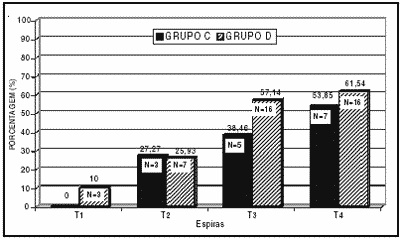
Gráfico 3. Porcentagem de cócleas com células parcialmente lesadas, nas espiras de cobaias do grupo C (tratadas com 400 mg de Amicacina) e do grupo D (tratadas com 20mg + 400 mg de Amicacina).
Após realizada sua decapitação, os ossos temporais contendo as bulas foram removidos. As bulas foram abertas no ápice e na janela redonda da cóclea, onde foi injetado, para fixação, glutaraldeído a 2,5% em tampão fosfato 0,1 M (Sorensen), a 4o C. A microdissecção foi realizada preservando-se as espiras. Esse material foi conservado por 12 horas na solução tampão 0,1M, sendo refixado em solução de tetróxido de ósmio a 1% com tampão fosfato 0,1 M, por 1 hora, a 4o C. A desidratação foi feita usando etanol. Foi feita a secagem pelo método do ponto crítico, usando o dióxido de carbono líquido com o equipamento BALTEC-CPD 030 - "CRITICAL POINT DRYER".
A cóclea foi colocada em um porta-espécimen cilíndrico com pasta condutora de carbono. Foi realizada a metalização da cóclea para a perfeita visualização à microscopia eletrônica de varredura (JEOL JMS - 5200), o que é feito através da inserção de uma fina camada de ouro, utilizando o vaporizador (BAL-TEC SDC 050).
A análise dos resultados foi feita em seguida. As espiras de cada cobaia foram fotografadas e avaliadas. A porção mais apical da cóclea de menores dimensões foi considerada a espira 4. Amostras representativas de cada espira com 150 células ciliadas externas em três fileiras e 50 células ciliadas internas foram utilizadas no estudo. O número e as porcentagens de cócleas com células normais (N), totalmente lesadas (TD), parcialmente lesadas (PD) foram calculados para cada espira de cada grupo. Foram avaliadas as cócleas de cada grupo dos quatro estudados (duas cócleas por cobaia). Estes valores foram lançados em tabela e analisados através do teste não paramétrico Qui-quadrado (c2) para investigar a significância das diferenças nos resultados entre os grupos. Os valores percentuais foram lançados em Gráficos para comparação entre os grupos.
Resultados
GRUPO A - CONTROLE (cobaias normais) - Todas as cobaias apresentaram células ciliadas externas normais em todas as espiras de todas as cócleas (Figura 1). GRUPO B - Todas as cobaias apresentavam reflexo de Preyer presente quando foram sacrificadas. O órgão de Corti e células ciliadas estavam normais em todas as espiras de todas as cócleas. GRUPO C, foram observadas lesões das células ciliadas externas em todas as espiras, na maioria das cócleas. As espiras mais basais (T1 e T2) apresentaram maior grau de lesão e as células ciliadas externas praticamente desapareceram (Figura 2). As células ciliadas internas estavam presentes com algumas pequenas áreas de lesão. As espiras T3 e T4 (mais apicais) apresentaram lesões menos extensas. GRUPO D - Nas espiras mais basais T1 e T2 foi observada grande quantidade de células ciliadas externas normais e algumas lesões parciais em maior grau na primeira fileira das células ciliadas externas. As células ciliadas internas estavam normais (Figura 3). Nas espiras mais apicais (T3 e T4) foi notado predomínio de lesões na primeira fileira das células ciliadas externas, lesões esparsas na segunda fileira e poucas lesões na terceira fileira. Células ciliadas internas com poucas lesões.
O Gráfico 1 indica a porcentagem e o número de cócleas com células ciliadas externas normais (N), nas diferentes espiras das cobaias do grupo C. Podemos observar que nas espiras T1 e T2 não foram encontradas células normais tendo sido encontradas pequenas porcentagens de células normais nas espiras T3 e T4. Podemos observar também que da espira basal para a mais apical há um pequeno aumento na porcentagem de cócleas com células normais mostrando que as espiras mais basais (T1 e T2) da cóclea são mais sensíveis ao agente ototóxico decrescendo esta sensibilidade em direção ao ápice. O Gráfico mostra também a porcentagem de cócleas com células ciliadas externas normais (N) nas diferentes espiras das cócleas das cobaias do grupo D. Pode-se observar que a porcentagem foi de 56,67 na espira T1, 51,85 na espira T2, 17,86 na espira T3 e 23,08 na espira T4. A porcentagem de células ciliadas externas normais (N) presentes foi maior nas espiras mais basais (T1 e T2), decrescendo para as mais apicais (T3 e T4). O Gráfico mostra as diferenças entre as porcentagens de cócleas com células ciliadas externas normais nas espiras T1 e T2 nos grupos C e D. Com a análise dos números de cócleas com células normais nos grupos C e D pelo teste estatístico do Qui-quadrado as diferenças observadas entre as espiras T1 e T2 dos grupos C e D foram estatisticamente significantes, o que não aconteceu com as espiras T3 e T4. Estes dados mostram a efetiva proteção das células ciliadas externas das cócleas nas espiras basais (T1 e T2) no grupo D que recebeu dose não ototóxica (20 mg/kg/dia) durante 30 dias antes de receber a dose tóxica de 400 mg/kg/dia.
No Gráfico 2 estão representadas as porcentagens de cócleas com células ciliadas externas totalmente lesadas (TD), nas diferentes espiras das cobaias do grupo C. O Gráfico mostra os valores da espira T1 (100%), da espira T2 (72,73%), da espira T3 (53,85%) e da espira T4 (30,77%). A porcentagem de cócleas com células ciliadas externas totalmente lesadas (TD) neste grupo de cobaias é maior na primeira e segunda espira (T1 e T2) decrescendo gradualmente até a quarta espira (T4), revelando a alta toxicidade da droga, nesta dose, nas espiras basais. Nas espiras mais apicais (T3 e T4), o número de cócleas com células ciliadas externas totalmente lesadas é menor. O Gráfico mostra também as porcentagens de cócleas com células ciliadas externas totalmente lesadas (TD), nas espiras das cócleas das cobaias do grupo D que foram tratadas com 20 mg/kg/dia de amicacina antes de receberem a dose tóxica de 400 mg/kg/dia. Como se pode observar, os valores são bem menores neste grupo D com relação às células ciliadas externas mais basais: T1, 33,33%; e T2, 22,22%; T3, 25%; T4, 15,38%. As diferenças foram significativas nas duas espiras mais basais (T1 e T2) e não significativas nas espiras mais apicais (T3 e T4). O Gráfico permite a comparação das porcentagens do número de cócleas totalmente lesadas (TD) nas espiras das cobaias dos grupo C e D. Pode ser observado que, em todas as espiras, a porcentagem de cócleas com células ciliadas externas totalmente lesadas foi maior no grupo C do que no grupo D. As diferenças encontradas no número de cócleas totalmente lesadas nas espiras 1 e 2 em relação aos grupos C e D foram significativas segundo o teste do Qui-quadrado.
O Gráfico 3 mostra a porcentagem de cócleas com células ciliadas externas parcialmente lesadas nas diferentes espiras das cobaias do grupo C. Estes resultados (espira T1, 0%; espira T2, 27,27%; espira T3, 38,46% e espira T4, 53,85%) demonstram um crescimento gradual na porcentagem de células ciliadas externas parcialmente lesadas (PD) da parte basal das cócleas em relação ao ápice. Este Gráfico mostra também as porcentagens das cócleas com células parcialmente lesadas (PD) nas espiras das cócleas das cobaias do grupo D, podendo-se observar as pequenas porcentagens de células ciliadas externas parcialmente lesadas nas espiras T1 e T2, sendo que as lesões vão aumentando em direção às espiras T3 e T4, mais apicais. As diferenças entre porcentagens de cócleas com células ciliadas externas parcialmente lesadas, nas diferentes espiras das cobaias dos grupos C e D são pequenas, mas nos dois grupos aumentam da base em direção ao ápice. Neste caso os estudos estatísticos com o teste Qui-quadrado não mostram diferenças significantes entre os dois grupos.
Discussão
Estudos experimentais estão sendo realizados para encontrar terapias menos tóxicas e meios de prevenção eficientes na proteção da cóclea contra agressão por agentes químicos e físicos. A descoberta do fenômeno da resistência e condicionamento ao ruído traumático pela exposição prévia a ruídos de baixa intensidade nos chamou a atenção para realização de uma pesquisa com intuito de avaliar se a cóclea, o órgão de Corti como um todo ou as células ciliadas externas poderiam desenvolver algum mecanismo de otoproteção contra a ototoxicidade dos aminoglicosídeos. O mecanismo que poderia determinar aquela otoproteção contra o ruído é desconhecido; sua presença em várias espécies animais sugere envolvimento de processos anatômicos, fisiológicos, metabólicos, homeostáticos, no sistema auditivo de mamíferos, acionados pelo estresse do ruído condicionante11.
Nesta pesquisa com Amicacina avaliamos as diferentes espiras cocleares nas cobaias dos grupos A e B e não ocorreram alterações no órgão de Corti. Todas as preparações apresentavam células ciliadas externas presentes nas 3 fileiras, células de suporte sem alterações em sua arquitetura e células ciliadas internas normais. No grupo C, todas as espiras estavam bastante degeneradas com grandes alterações estruturais nas células ciliadas externas. Grande ototoxicidade nestas doses foi também encontrada por outros autores13. Quando comparamos os grupos C (400 mg/kg/dia) e D (20 mg/kg/dia por 30 dias e após 400 mg/kg/dia) notamos uma grande diferença em relação à presença das células ciliadas externas normais nas cócleas das cobaias. Houve conservação das células ciliadas, com aspecto normal em muitas áreas principalmente nas duas espiras mais basais mostrando existir um efeito protetor estatisticamente significante com dose prévia de 20 mg/kg/dia por 30 dias antes da dose ototóxica, quando as lesões foram comparadas com as resultantes da aplicação isolada da dose tóxica de amicacina. Pudemos observar que a proteção mais significativa ocorreu nas espiras mais basais do grupo, local onde houve maior sensibilidade às lesões no grupo C. Podemos então pensar que as células ciliadas puderam desenvolver um mecanismo de proteção durante a aplicação do estímulo não ototóxico que possibilitou a resistência posterior a dose lesiva. Houve proteção evidente e significante nesse grupo. Chamamos este fenômeno de aumento da resistência ou da autodefesa das células ciliadas auditivas (Gráficos 1, 2, 3).
Os radicais livres são produzidos em cada célula como um subproduto de eventos bioquímicos normais, principalmente na respiração celular ao nível das mitocôndrias e em processos anormais no organismo, como na inflamação, radiação, doenças degenerativas, neurotoxicidade, reações adversas a drogas. A gentamicina amplifica a produção de radicais livres superóxido e peróxido de hidrogênio porque forma o complexo gentamicina-ferro que induz a formação daqueles radicais livres e com isso havendo lesões de células ciliadas externas no órgão de Corti1(6). Os radicais livres podem levar à produção de lesões celulares distintas, bem como à diminuição do nível de antioxidantes ou antiradicais livres que seriam responsáveis pelo processo biológico de autodefesa, como é o caso da glutationa e isto levaria a morte celular por apoptose. Este seria o destino das células ciliadas externas do órgão de Corti afetadas por antibióticos aminoglicosídeos. Sabemos também que várias substâncias quelantes de ferro e que também são anti-radicais livres têm demonstrado otoproteção contra a ototoxicidade induzida pela gentamicina, em cobaias, como é o caso da deferoxamina(20); 2,3 dihidroxibenzoato(5); do ácido alfa-lipóico(2); do 2-hidroxibenzoato (salicilato)(17). Estas pesquisas nos levam a acreditar que realmente os antibióticos aminoglicosídeos quelam ferro e formam um metabolito ototóxico provocando, este complexo, a formação de radicais livres que seriam responsáveis pelas lesões das células ciliadas especialmente as externas, ocorrendo assim a ototoxicidade.
Este processo que descrevemos pela primeira vez nesta pesquisa com amicacina não tem um mecanismo conhecido, entretanto, poderíamos sugerir um mecanismo de aumento da defesa das células sensoriais pela ação do primeiro estímulo que provocaria uma preparação gradual destas células para melhorar sua autodefesa, aumentando, por exemplo, o nível de anti-radicais livres sendo que, no final de 30 dias, as células estariam com suas defesas elevadas e com capacidade de otoproteção. As células estariam preparadas para se proteger da dose altamente tóxica de amicacina. Sabemos que a glutationa é uma molécula antioxidante e que funciona, direta ou indiretamente, em muitas funções biológicas como: síntese de proteínas; de DNA; processos de transporte; atividade enzimática; metabolismo, proteção celular; desintoxicação. Esta função celular de proteção é importante em tecidos que geram substâncias oxigênio-ativas ou radicais livres. A glutationa foi encontrada na orelha interna21 e protege as células ciliadas contra a ototoxicidade de aminoglicosídeos como a gentamicina interferindo no mecanismo citotóxico10.
Com base nestes achados poderíamos supor que a dose estimulante de amicacina aplicada em nosso estudo poderia, de algum modo, aumentar a defesa das células ciliadas externas. Sabe-se que existe nos fluidos corporais e nos tecidos um sistema de autodefesa formado por vários tipos de substâncias que protegem as células contra lesões provocadas por radicais livres, ou seja, um sistema de defesa contra substâncias agressoras que se formam no metabolismo celular normal. O aumento da autodefesa poderia ser por ação de um aumento do nível de glutationa que é um dos mecanismos básicos de defesa celular contra ototoxicidade. É possível que a glutationa aumentada inative o metabolito da amicacina em uma ação enzimática envolvendo glutationa transferase ou glutationa peroxidase, podendo a inativação ocorrer também não enzimaticamente, havendo proteção contra a dose tóxica altamente lesiva de 400 mg/kg/dia. Outros elementos que poderiam participar no mecanismo de otoproteção que descrevemos, sendo também elementos de defesa, são as enzimas glutationa peroxidase, glutationa redutase, glutationa transferase, superóxido dismutase catalase e substâncias não enzimáticas como a vitamina C e a vitamina E. A co-administração de substâncias de defesa como os anti-radicais livres foi feita em cobaias que receberam gentamicina e houve atenuação das perdas auditivas19 semelhante ao aumento da autodefesa celular pela amicacina 20 mg/kg/dia em nosso estudo. Deste modo, esta pesquisa revelou otoproteção e poderia sugerir uma hipótese de ototoxicidade de aminoglicosídeos por radicais livres e de sua desintoxicação glutationa-dependente. A administração de anti-radicais livres ou o aumento destas substâncias protetoras provocadas por algum tipo de estimulação, como nos achados deste trabalho, promoveria otoproteção das células. Não poderíamos esquecer, contudo, que as células ciliadas têm outros mecanismos protetores que poderiam estar envolvidos neste processo por nós demonstrado, como é o caso da atuação de fatores de crescimento (neurotrofinas)(9). Com base em nossos achados poderíamos perguntar: este processo de autodefesa, como o demonstrado, pela amicacina contra as lesões da própria amicacina existiria em outras células, outros tecidos para proteção contra outras drogas tóxicas ou contra drogas não tóxicas que tivessem efeitos colaterais indesejáveis? Acreditamos que, se isto ocorrer, o conhecimento bioquímico do processo de autodefesa e das substâncias envolvidas seria de grande benefício em terapia médica na prevenção de efeitos indesejáveis de medicamentos, com doses pequenas das mesmas drogas, isto especialmente em tratamentos prolongados. Que fatores poderiam aumentar esta autodefesa?
comparadas ao grupo A (controle) pode-se afirmar que a dose de 20 mg/kg/dia não é lesiva às células ciliadas externas, administrada no período de 30 dias. A dose de 400 mg/kg/dia de amicacina aplicada nos animais do grupo C durante 12 dias foi altamente tóxica ocorrendo extensas destruições das células, principalmente nas duas primeiras espiras. Lesões menos extensas ocorreram nas células ciliadas internas (grupo C). No grupo D que recebeu uma dose de estimulação de 20 mg/kg/dia de amicacina durante 30 dias, e após, a dose ototóxica de 400 mg/kg/dia do mesmo aminoglicosídeo por 12 dias, houve redução acentuada das lesões das células ciliadas externas, principalmente nas duas primeiras espiras e que foi estatisticamente significante. Deste modo, pode-se afirmar que a dose provocadora (estimulante) não lesiva de amicacina prévia protege as células ciliadas externas contra a ototoxicidade da própria amicacina, de modo significante nas duas espiras mais basais.
Agradecimentos: Gostaríamos de agradecer à Maria Helena de Andrade por sua contribuição na preparação deste trabalho e seu apoio na área de estatística e a C.A.P.E.S. e CNPq e FAPESP pelo apoio financeiro.
Referências Bibliográficas
1. Acar, J.F.; Witchitz, J.L.; Goldstein, F.; Talbot, J.N.; Le Goffic, L. - Suscepptibility of aminoglycoside-resistant gram-negative baccili to amikacin: delineation of individual resistance patterns. J Infect Dis., (SUPPL. 134):280-5,1976.
2. Conlon, B.J; Aran, J.M.; Erre, J.P.; Smith, D.W. - Attenuation of aminoglycoside-induced cochlear damage with the metabolic antioxidant alpha-lipoic acid. Hear Res.,128(1-2):40-4, 1999.
3. Dagli, S.; Canlon, B. - The effect of repeated daily noise exposure on sound conditioned and unconditioned guinea pig. Hear Res.,104:39-46, 1997.
4. Dulon, D.; Zajic, G.; Schacht, J. - Differential motile response of isolated inner and outer hair cells to stimulation by potassium and calcium ions. Hear Res., 52:225-32,1991.
5. Ernfors, P.; Canlon, B. - Aminoglycoside excitement silences hearing. Nature Med., 2:1338-43, 1996.
6. Garetz, S.L.; Schacht, J. - Ototoxicity: of mice and men. In: van De Water, T.R.; Popper, N.A.: Fay, R.R., eds. Handbook of auditory reseach vol.VII: (Clinical aspects of hearing. New York:Springer Verlag; 1996:116-54.
7. Halliwell, B.; Gutteridge, J.M.C. - Oxygen free radicals and iron in relation on biology and medicine: some problems and concepts. Arch Biochem Biophys.,246:501-14, 1986.
8. Harrison, R.V.; Shirane, M.; Fukushima, N.; Mount, R.J. - Morphological changes to the cochlea in an animal model of profound deafness. Acta Otolaryngol. (Stockh), (SUPPL.489):5-11, 1991.
9. Kimura, N.; Nishizaki, K.; Orita, Y.; Masuda, Y. - 4-methylcatechol, a potent inducer of nerve growth factor synthesis, protects turn ganglion neurons from aminoglycoside ototoxicity-preliminary report. Acta Otolaryngol Suppl:540:12-5, 1999.
10. Lautermann, J.; McLaren, J.; Schacht, J. - Glutathione protection against gentamicin ototoxicity depends on nutritional status. Hear Res.,86:15-24, 1995.
11. Lim, H.H.; Jenkins, O H.; Myers, W.; Miller, J.M.; Altschuller, R.A. - Detection of HSP 72 synthesis after acoustic overstimulation in rat cochlea. Hear Res.,69:146-50, 1993.
12. Oliveira, J.A.A. - Audiovestibular toxicity of drugs. Vol I e II p.551 Florida Boca Raton CRC Press 1989.
13. Oliveira, J.A.A.; Rossato, M.; Anselmo-Lima, W.T. - Células ciliadas isoladas em cultura: um novo modelo para estudo da ototoxicidade. Rev Bras Otorrinolaringologia, 61(1):70-8, 1995.
14. Priuska, E.; Schacht, J. - Formation of free radicals by gentamicin and iron and evidence for an iron/gentamicin complex. Biochem. Pharmacol.,50:1749-52, 1995.
15. Schacht, J. - The biochemical basis of ototoxicity. In: Rybak, L. P., ed. Otolaryngologic clinics of North America, vol. 26. Philadelphia: W.B. Saunders; 1993:845-56.
16. Sha, S.; Schacht, J. - Amplification of free radicals by gentamicin in a biological system. Assoc Res Otolaryngol.,19:30, 1996.
17. Sha, S-H., Schacht, J. - Stimulation of free radical forming by aminoglycoside antibiotics. Hear Res.,128: 112-8, 1999.
18. Sharp, P.M.; Saenz, C.A.; Martin, R.R. - Amikacin (BB-K8) treatment of multiple drug-resistant proteus infections. Antimicrob Agents Chemother.,5:435-8, 1974.
19. Song, B.B.; Schacht, J. - Variable efficacy of radical scavengers and iron chelators to attenuate gentamicin ototoxicity in guinea pig in vivo. Hear Res., 94:87-93, 1996.
20. Song, B.B.; Sha, S.; Schacht, J. - Iron chelators protect from aminoglycoside-induced cochleo- and vestibulotoxicity in guinea pig. Free Radical Biol Med.,25:189-95, 1998.
21. Usami, S.; Hjelle, OP.; Ottersen, OP. - Differential cellular distribution of glutathione-an endogenous antioxidant - in the guinea pig inner ear. Brain Res.,743:337-40, 1996.
22. Wang, H.; Priuska, E.M.; Schacht, J. - The iron embrace: exposing the secret activities of gentamicin. Abstr Assoc Res Otolaryngol,19:29, 1996.
23. Yamasoba, T.; Schacht, J.; Shoji, F.; Miller, J.M. - Attenuation of cochlear damage from noise trauma by an iron chelator a free radical scavenger and glial cell line-derived neurotrophic factor in vivo. Brain Res.,815:317-25, 1999.