Ano: 2004 Vol. 70 Ed. 5 - setembro-outubro - (1º)
Seção: Artigo Original
Páginas: 584 a 588
Células de Langerhans no epitélio da prega vocal humana: estudo imunoistoquímico
Langerhans cells in human vocal fold mucosa: immunohistochemical study
Autor(es):
João Aragão Ximenes Filho1,
Francisco Valdeci Ferreira2,
Francisco Dário Rocha Filho3,
Domingos Hiroshi Tsuji4,
Luiz Ubirajara Sennes5
Palavras-chave: cordas vocais/ anatomia & histologia, células de langerhans, imunohistoquímica.
Keywords: vocal cords/ anatomy & histology, langerhans cells, immunohistochemistry.
Resumo:
Células de Langerhans (CL) são um tipo de células dendríticas que têm funções que envolvem apresentação de antígeno e a estimulação de resposta T dependente. Elas representam aproximadamente 4% das células do epitélio laríngeo. Objetivo: Identificar a presença de CL no epitélio das pregas vocais, comparar suas subpopulações, bem com comparar a capacidade de quatro marcadores imunoistoquímicos. Forma de Estudo: Experimental. Casuística e Método: Seis cadáveres, 3 homens e 3 mulheres foram estudados. Foram analisadas amostras de pele e das pregas vocais coradas e imunomarcadas para vimentina, proteína S-100, CD-68 e fascina. Após análise histológica, foi realizado o teste t de Student e análise de variância no estudo estatístico. Resultados e Conclusões: Foi possível identificar a presença de CL no epitélio das pregas vocais de humanos não fumantes de ambos os sexos. A fascina, a vimentina o CD-68 mostraram-se bons marcadores das CL, enquanto a proteína S-100 teve estatisticamente menor poder de marcação tanto na prega vocal (p=0,01) como na pele (p=0,02). Foi possível identificar três diferentes subpopulações de CL presentes tanto na prega vocal como na pele destes indivíduos, contudo apenas na pele observarmos maior quantidade estatisticamente significante na camada basal do epitélio.
Abstract:
Introduction: Langerhans Cells (LC) are a type of dendritic cells that have functions which involves antigen presentation and the stimulation of a T cell response. They represent about 4% of the laryngeal epithelial cells. Objective: The aim of this study was to identify the presence of LC in the epithelium of the vocal folds, to compare their subpopulations, as well as to compare the capacity of four immunohistochemistry markers. Study Design: Experimental. Material and Method: Six cadavers, 3 men and 3 women, were studied. Analysis of vocal folds and skin paraffin blocks stained with commercially available polyclonal S-100, vimentin, CD-68 and fascin were done. After histological analysis, Student t test and Analysis of Variance (ANOVA) were accomplished in the statistical study. Results and Conclusions: It was possible to identify the presence of LC in the epithelium of the human vocal folds in no smokers of both sexes. Fascin, vimentin and CD-68 were superior markers of LC than S-100 polyclonal antibody in vocal folds (p=0,01) and in the skin (p=0,02). It was also possible to identify three different subpopulations of LC in the vocal folds and skin. However, just in the skin it was observed larger amount in the basal layer of the epithelium statistically significant.
![]()
INTRODUÇÃO
As células de Langerhans (CL) são um tipo de células dendríticas, realizando a função de células apresentadoras de antígenos encontradas em tecidos linfóides e não linfóides. Nesses últimos, são especializados na defesa e processamento de antígenos estranhos1. Assim, apresentam função imunológica vital que envolve apresentação do antígeno e estimulação da resposta imunitária mediada por linfócitos timo-dependentes (linfócitos T)2.
Apesar de já bem conhecidas e estudadas em tecidos cutâneos e em mucosa oral, apenas em 1994, Thompson e Griffin3 descrevem a presença de CL no interior do epitélio escamoso estratificado das pregas vocais humanas normais e estimam que representam cerca de 4% em proporção às células epiteliais da laringe de homens. Estas células (CL) possuem papel importante na resposta imune ao secretarem citocinas e expressarem receptores de superfície. São importantes componentes do sistema imune, participando da ativação dos linfócitos T, sendo as principais células apresentadoras de antígeno do sistema imune.
A importância deste achado aumentou quando foi descrito que tumores laríngeos com baixa concentração de CL apresentam pior prognóstico quando comparados a tumores com alta densidade destas células4. Atualmente, os tumores de laringe representam algo em torno de 5% de todos os novos casos de câncer, com exceção do câncer de pele. Aproximadamente 6.600 novos casos de câncer da laringe são registrados por ano no Brasil, com cerca de 3.500 mortes decorrentes dessa doença registradas anualmente em nosso país5. Estes tumores são mais comuns em indivíduos entre 50 e 60 anos6.
No entanto, estas células apresentam dificuldades de identificação com métodos histológicos habituais, requerendo marcação imunoistoquímica. Diversos marcadores têm sido utilizados, dificultando a comparação dos resultados em diferentes estudos. Assim, propusemo-nos a realizar um estudo com os seguintes objetivos:
1. Identificar a presença de CL no epitélio de cobertura da porção intermembranácea das pregas vocais de humanos não-fumantes de ambos os sexos;
2. Comparar quatro marcadores imunoistoquímicos quanto à capacidade de detectar estas células no epitélio vocal e na pele;
3. Observar e comparar as subpopulações de CL presentes na prega e na pele destes indivíduos, mediante imunomarcação múltipla.
CASUÍSTICA E MÉTODOS
Casuística
Após aprovação pela Comissão de Ética para Análise de Projetos de Pesquisa (CAPPesq) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, foram estudados 6 cadáveres do Serviço de Verificação de Óbito da Capital da Universidade de São Paulo (SVO), sendo 3 de indivíduos do sexo masculino e 3 do sexo feminino, no período de outubro de 2003 a janeiro de 2004.
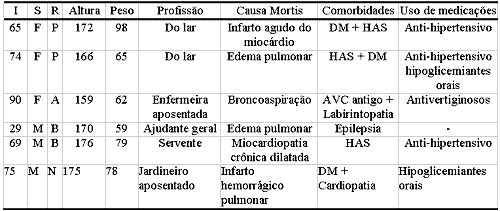
As características dos cadáveres estudados, como raça, sexo, idade, altura, peso e causa do óbito, foram coletados. Do prontuário do cadáver no SVO, retiramos informações como profissão, uso de medicações e doenças que apresentavam em vida. A Tabela 1 resume estas informações juntamente com aquelas obtidas dos atestados de óbito emitidos pelo SVO.
Foram incluídos somente cadáveres cuja laringe pôde ser retirada em até 18 horas pós-morte e que se apresentavam totalmente preservadas macroscopicamente, sem nenhuma lesão ou alteração estrutural. Excluímos cadáveres que tivessem sido submetidos previamente a intubação oro ou nasotraqueal, traqueotomia, cirurgia laríngea, radioterapia na região cérvico-facial, fumantes ou que apresentaram alguma doença laríngea em vida. Excluímos cadáveres com história de doença tireoideana ou uso crônico de corticosteróides, além de mulheres falecidas no período gravídico ou puerperal. Indivíduos que tivessem profissões nas quais utilizassem profissionalmente a voz não foram incluídos no estudo. Cadáveres que continham lesão dermatológica difusa e/ou na região inguinal também foram excluídos.Tabela 1. Dados dos cadáveres obtido no Serviço de Verificação de Órgão da Capital da Universidade de São Paulo
NOTA: (-) indica que fenômeno não existe; Ident (identificação); I (idade); S (sexo); R (raça); M (masculino); F (feminino); B (branca); N (negra); A (amarela); P (parda); DM (diabetes melittus); HAS (hipertensão arterial sistêmica); AVC (acidente vascular cerebral)
Método
Obtenção da laringe
Nos cadáveres selecionados segundo critérios acima descritos, foi realizada incisão na pele da região torácica alta e levantamento de retalho cutâneo. Removemos a laringe em bloco após secção cranial ao osso hióide e ao nível do quarto anel traqueal. No Laboratório de Investigação Médica (LIM 32) da Faculdade de Medicina da Universidade de São Paulo, realizamos a dissecção e abertura da laringe pela face posterior com posterior corte coronal, perpendicular ao bordo livre da prega vocal, contento suas três camadas (epitélio, córion e músculo), com retirada de um fragmento de 0,3 x 0,5 x 0,3cm. A seguir, identificamos o material com o número do SVO.
Obtenção da pele
Do mesmo cadáver que retiramos a laringe, também foi removida uma porção de pele situada 2 cm lateral a prega inguinal direita ao nível do púbis. No LIM 32, retiramos um fragmento central da amostra de pele, medindo 0,3 x 0,5 x 0,3 cm e o identificamos com o número do SVO. A escolha da referida região da pele deu-se para evitar áreas expostas ao sol ou a atritos que pudessem interferir nos resultados.
Preparo das peças para estudo imunoistoquímico
A partir dos blocos de parafina com as amostras de prega vocal e pele, foram feitos cortes de 5 m de espessura montados em lâminas com cola (Cascurez 1:4). A seguir, após recuperação antigênica pelo calor úmido e bloqueio da peroxidase endógena, foram aplicados os anticorpos primários, num total de quatro marcadores de células histiocíticas e reticulares: CD68, Vimentina, Fascina e a proteína S-100. Também foram aplicados o anticorpo secundário e a demonstração (streptABC, DAKO Corparation -Carpinteria USA), revelação pelo DAB, além da contracoloração com hematoxilina diluída. Em cada bateria foram feitos controles externos positivos (casos de histiocitose de Langerhans) e negativos (por exclusão dos anticorpos primários).
Parâmetros analisados
A leitura das lâminas levou em consideração a presença de Células de Langerhans especificamente marcadas e a sua localização.
1. Foi feito, inicialmente, a contagem total das CL presentes em cada um dos espécimes analisados. Foram estudados 10 campos seqüenciados, com ocular de 12x e objetiva de 40x (aumento 480x) tanto na amostra de pele como de prega vocal em cada uma das amostras estudadas.
2. A seguir, foram definidas três áreas distintas para a classificação de subpopulações das CL: região basal - quando a célula achava-se em contato direto com a lâmina basal (LB) do epitélio, região suprabasal - quando a célula encontrava-se no epitélio, porém sem contato com a LB; e região subepitelial - quando a célula estava abaixo da LB. Foi feita a quantificação das células presentes em cada uma destas regiões em 10 campos seqüenciados com o mesmo aumento supracitado.
Foi utilizado um Microscópio Óptico "Leica DMLS", triocular com sistema de captura de imagem a ele acoplado.
Análise estatística
Foi realizado o teste de normalidade de Kolmogorof-Smirnov, sendo positivo em todos os parâmetros em estudo. A seguir, foram obtidas as médias destes parâmetros e realizado o teste t de Student na comparação das CL por campo com cada um dos marcadores imunoistoquímicos utilizados. Para a comparação das três subpopulações em estudo, utilizamos análise de variância (ANOVA one-way). Foi considerado índice de significância de 95% (p<0,05). Os programas estatísticos utilizados foram: SPSS® versão 10.0 para Windows e Microsoft Excel®.
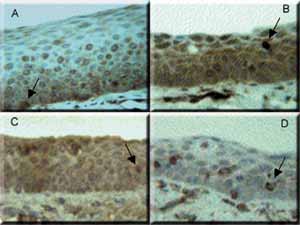
Foto 1. Epitélio da prega vocal humana corada com quatro imunomarcadores diferentes. A: Fascina. B: CD-68. C: Proteína S-100. D: Vimentina. Setas indicam Células de Langerhans. Em A na camada basal do epitélio e nas demais, suprabasal. Aumento 400x.
RESULTADOS
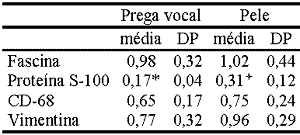
Os resultados estão sumarizados em duas tabelas. Na Tabela 2, demonstramos a comparação das Células de Langerhans com diferentes imunomarcadores evidenciando que a Proteína S-100 diferiu estatisticamente dos demais tanto na prega vocal como na pele. Na Tabela 3, apresentamos a comparação das diferentes subpopulações de Células de Langerhans na prega vocal e na pele com os diferentes marcadores, demonstrando que apenas na pele a camada basal diferiu das demais.
DISCUSSÃO
O epitélio de revestimento da laringe não é uniforme, apresentando epitélio pavimentoso estratificado na face ventral e parte da face dorsal da epiglote, além das pregas vocais, enquanto nas demais regiões é do tipo respiratório, com cílios que batem em direção a faringe7. No bordo livre da prega vocal, o epitélio pavimentoso estratificado é constituído por uma ou duas camadas de células basais e até seis camadas de células planas mais superficiais8.
Os epitélios do tipo escamoso estratificado são formados mitoticamente a partir das células mais basais que são levadas, pela proliferação contínua, em direção a superfície do epitélio. Neste processo, modifica seu formato de colunar ou cubóide para pavimentoso9. Da superfície, a célula é removida por abrasão.
Em meio a estas células, encontram-se as Células de Langerhans (CL), um tipo de célula dendrítica, participante do sistema imunológico. Acredita-se que as CL capturam antígenos encontrados na epiderme e então migram subseqüentemente da epiderme para os linfonodos subepiteliais. Chegam à região paracortical dos gânglios linfáticos e ativam linfócitos T em área restrita de Complexo Maior de Histocompatibilidade Classe II10.
Assim, é possível separamos morfologicamente três subpopulações de CL no epitélio e adjacências: células da camada basal, células suprabasal e células subepitelial. Neste estudo, observamos maior quantidade de CL na camada basal tanto na pele como nas pregas vocais. Contudo, quando comparamos estatisticamente as três subpopulações, notamos que apenas na pele houve estatisticamente mais células na camada basal. Isto poderia representar maior turnover celular das CL na pele ou ainda função imunológica mais intensa na pele. Contudo, nosso modelo de estudo não nos permite responder a este questionamento.
Utilizamos, neste estudo, uma amostra reduzida, em decorrência do alto custo dos marcadores imunoistoquímicos e por termos utilizados quatro tipos diferentes deles com o fim de identificar-lhes o grau de adequação, de sensibilidade e a de especificidade em relação à pele (modelo mais ricamente já investigado) e na laringe.
Foi possível, assim, demonstrar estatisticamente que a proteína S-100, um dos marcadores mais utilizado para identificação de CL3,4,11,12 apresenta a mais baixa capacidade em marcar estas células entre os quatro marcadores utilizados (Tabela 2). A fascina, uma proteína empacotadora de actina de 55-kd inicialmente isolada de células HeLa, apresenta alta especificidade e sensibilidade na marcação de células dendríticas13. A presença da fascina nas células dendríticas não é surpresa uma vez que esta proteína é similar a actina e está envolvida na formação de faixas de microfilamentos, importante na mobilidade destas células13. Em nosso estudo, apesar de não diferir estatisticamente da vimentina e do CD-68, a fascina apresentou maiores índices de marcação de CL e a melhor definição tintorial. Desta forma, será adotada em futuros estudos que estamos desenvolvendo em oncologia.Tabela 2. Comparação das Células de Langerhans humanas com diferentes imunomarcadores, por campo histológico com aumento de 480x, evidenciando que a Proteína S-100 diferiu estatisticamente dos demais tanto na prega vocal como na pele
DP: Desvio Padrão (* p= 0,01; ª p= 0,02)
Tabela 3. Comparação das diferentes sub-populações de Células de Langerhans humanas na prega vocal e na pele com os diferentes marcadores (valores de p), demonstrando que apenas na pele a camada basal diferiu das demais
Os efeitos do tabaco sobre as CL também ainda estão incertos. Barret et al.14 (1991) afirmam que, em grandes fumantes, ocorre um aumento da densidade das CL no epitélio oral destes indivíduos. Daniels et al.15 (1992), contudo, demonstram uma redução na ocorrência de CL na mucosa oral em decorrência do tabagismo. Na cérvix uterina, há concordância sobre a redução na densidade das CL devido ao hábito do tabagismo16,17. No estudo das CL no epitélio laríngeo normal3, foram utilizados 7 laringes, sendo 5 não fumantes, 1 fumante e 1 desconhecido. Optamos, neste estudo, por não incluir indivíduos fumantes, evitando este viés.
CONCLUSÃO
Podemos concluir que:
1. Foi possível identificar a presença de CL no epitélio de cobertura da porção intermembranácea das pregas vocais de humanos não-fumantes de ambos os sexos;
2. A fascina, a vimentina o CD-68 mostraram-se bons marcadores das CL tanto no epitélio das pregas vocais como na pele, enquanto a proteína S-100 teve estatisticamente menor poder de marcação;
3. Foi possível identificar três diferentes subpopulações de CL presentes tanto na prega vocal como na pele destes indivíduos, além de observarmos que a maior quantidade destas células encontra-se na camada basal do epitélio.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Austyn JM. Dendritic cells. Curr Opin Hematol 1998; 5:3-15.
2. Braathen LR, Bjerke S, Thorsby E. The antigen presenting function of human Langerhans cells. Immunobiology 1984; 168: 301-12.
3. Thompson AC, Griffin NR. Langerhans cells in normal and pathological vocal cord mucosa. Acta Otolaryngol 1994; 115: 830-2.
4. Gallo O, Libonati GA, Gallina E, Fini-Storchi O, Giannini A, Urso C, Bondi R. Langerhans cells related to prognosis in patients with laryngeal carcinoma. Arch Otolaryngol Head Neck Surg 1991; 117: 1007-10.
5. GLOBOCAN 2000 - Cancer incidence, mortality and prevalence worldwide, Version 1.0. IARC Carcer Base. No 5. Lyon, IARC, 2001.
6. Gould WJ, Sataloff RT, Spiegel JR. Voice Surgery. St. Louis: Mosby; 1993.
7. Junqueira LC, Carneiro J. Histologia básica. 7a ed. Rio de Janeiro: Guanabara; 1990.
8. D'Andretta Neto C. Estudo e importância das alterações epiteliais da laringe. São Paulo, Dissertação (Mestrado). Faculdade de Medicina, Universidade de São Paulo, 1984.
9. Stiblar-Martin?i? D. Histology of laryngeal mucosa. Acta Otolaryngol Suppl 1997; 527: 138-41.
10. Teunissen MB. Dynamic nature and function of epidermal Langerhans cells in vivo and in vitro: a review, with emphasis on human Langerhans cells. Histochem J 1992; 24(10): 697-716.
11. Hammar S, Bockus D, Remington F, Bartha M. The widespread distribution of Langerhans' cells in pathologic tissues. Hum Pathol 1986; 17: 894-905.
12. Kurihara K, Hashimoto N. The pathological significance of Langerhans cells in oral cancer. J Oral Pathol 1985; 14(4): 289-98.
13. Pinkus GS, Pinkus EL, Matsumura F, Yamashiro S, Mosialos G, Said JW. Fascin, a sensitive new marker for Reed-Sternberg cells of Hodgkin's disease. Evidence for a dendritic or B cell derivation? Am J Pathol 1997; 150(2): 543-61.
14. Barrett AW, Williams DM, Scott J. Effect of tobacco and alcohol consumption on the Langerhans cell population of human lingual epithelium determined using a monoclonal antibody against HLADR. J Oral Pathol Med 1991; 20: 49-52.
15. Daniels TE, Chou L, Greenspan JS, Grady DG, Hauck WW, Greene JC, Ernster VL. Reduction of Langerhans cells in smokeless tobacco-associated oral mucosal lesions. J Oral Pathol Med 1992; 21: 100-4.
16. Poppe WA, Drijkoningen M, Ide PS, Lauweryns JM, Van Assche FA. Langerhans' cells and L1 antigen expression in normal and abnormal squamous epithelium of the cervical transformation zone. Gynecol Obstet Invest 1996; 41: 207-13.
17. Barton SE, Maddox PH, Jenkins D, Edwards R, Cuzick J, Singer A. Effect of cigarette smoking on cervical epithelial immunity: a mechanism for neoplastic change? Lancet 1988; 17; 2(8612): 652-4.
1 Doutor em Otorrinolaringologia pela FMUSP. Médico Pesquisador do Hospital do Câncer do Ceará - ICC.
2 Prof. Adjunto do Departamento de Patologia da Faculdade de Medicina da Universidade Federal do Ceará. Coordenador do Laboratório de Patologia do Hospital do Câncer do Ceará - ICC.
3 Prof. Adjunto do Departamento de Patologia da Faculdade de Medicina da Universidade Federal do Ceará.
4 Prof. Livre Docente e Responsável pelo Grupo de Voz da Divisão de Clínica Otorrinolaringológica do HC-FMUSP.
5 Prof. Livre Docente e Associado da Disciplina de Otorrinolaringologia da FMUSP e Diretor do Serviço de Bucofaringolaringologia do HC-FMUSP
Trabalho realizado em conjunto entre Hospital do Câncer do Ceará - Instituto do Câncer do Ceará (ICC) e a Divisão de Clínica Otorrinolaringológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP).
Endereço para correspondência: João Aragão Ximenes Filho - Rua Paula Ney, 700/1202 Fortaleza CE 60140-200.
Tel (0xx85) 268-3641 - E-mail: joaoximenesf@bol.com.br