Ano: 2002 Vol. 68 Ed. 6 - Novembro - Dezembro - (18º)
Seção: Artigo de Revisão
Páginas: 896 a 902
Manifestações orais do líquen plano
Oral manifestations of lichen planus
Autor(es):
Paula Moreno Fraiha 1,
Adriana Rung 2,
Christiane Spitz da Cruz 3,
Lília Mendes 4,
Mônica Barros Pereira 5,
Patrícia Tramontano Fraiha 6
Palavras-chave: líquen plano, doença cutâneo-mucosa, lesões orais
Keywords: lichen planus, mucous-cutaneous disease, oral lesions
Resumo:
O Líquen Plano é uma doença cutâneo-mucosa crônica cujas lesões orais podem preceder ou seguir as lesões cutâneas ou mesmo serem as manifestações exclusivas da doença. Acomete principalmente adultos de ambos os sexos. Tem origem desconhecida, porém hoje, a teoria imunogenética é bastante aceita pela maioria dos autores. A lesão oral clássica se caracteriza por uma rede esbranquiçada arboriforme no terço posterior da mucosa jugal. As lesões ulcerativas na boca não são comuns mas, uma vez surgindo, torna-se importante o acompanhamento médico e/ou odontológico por serem sítios de transformação maligna. As lesões orais são geralmente assintomáticas. O diagnóstico é feito através da clínica, visualização das lesões, imunofluorescência direta e indireta, e principalmente pelo exame histopatológico. O diagnóstico diferencial é feito com diversas doenças auto-imunes que acometem a pele e as mucosas. O tratamento não é específico e inclui corticoterapia, tetraciclinas, imunossupressores, PUVA, dapsona, retinóides, interferon e talidomida. O prognóstico é bom e a evolução variável. As recidivas são comuns.
Abstract:
The lichen planus (LP) is a chronic mucous-cutaneous disease that oral lesions can precede or follow the skin lesion or even been the exclusive manifestation of it. Occurs commonly in adulthood of both sexes. It has unknown origin but today, the immunogenetic therapy is satisfactory for majority of the authors. The classic oral lesion characterizes with a forest with lines net on the posterior third part of buccal mucosa. The oral ulcers lesions are uncommon, but once arised, should be controlled by medical and/or dentist follow because they are sites of malignization. Usually oral lesions are asymptomatics. The diagnosis is made by the clinical appearance, view of lesion and biopsy results. The differential diagnostic is made with immuno diseases that involve the skin and mucous membranes. The treatment isn't specific. Includes steroids, tetracydines, immunomodulators, PUVA, dapsona, retinoids, interferon and thalidomide. The prognosis is good and the evolution is variable. Relapse of disease are common.
![]()
INTRODUÇÃO
O líquen plano (LP) é o protótipo de um grupo de dermatoses conhecidas como desordens liquenóides. Estas se caracterizam por um dano histológico na camada mais profunda da epiderme atingindo as células basais.1
É uma enfermidade bastante conhecida que acomete a mucosa oral principalmente de adultos.2, 3 Pode acompanhar, preceder ou seguir as lesões cutâneas ou acometer exclusivamente a mucosa oral.3 As lesões são descobertas ao acaso quando o paciente as vê ou as sente, ou quando é notada por um dentista ou médico.4
A lesão oral clássica é a que forma uma rede esbranquiçada no terço posterior da mucosa jugal. Porém existem várias manifestações deste processo, o que muitas vezes dificulta o diagnóstico.3
Seu aspecto histológico é típico.3 Há lesões reticulares que mostram uma leve hiperqueratose ou hiperparaqueratose, lise das células basais, espessamento da lâmina basal e mucosite devida exclusivamente à ação linfocitária.5
A patogênese é desconhecida, mas pode envolver algum mecanismo imune, pois foi demonstrado supressão da função leucocitária e destruição das células epiteliais por mecanismos imune-mediados.2 Quando acomete uma mesma família foi observado o aumento da freqüência do HLA-B76, HLA-A3, HLA-A5, HLA-Bw35, HLA-B8 e HLA-B16.7, 8 O fato de ter sido descrito LP em gêmeos monozigóticos numa freqüência relativamente alta reforça a idéia de predisposição genética para a doença.6 Existem também hipóteses sobre a possibilidade de origem viral e psicogênica.9 Pode existir correlação com diabetes, disfunção tireoidiana e hipertensão arterial. Foi sugerido relação com lupus eritematoso e outras doenças imuno-mediadas, bem como doença hepática.3, 10 O componente emocional, assim como traumas, reações tóxicas, tabagismo e infecções podem ser fatores predisponentes. 1, 3, 4
O câncer aparece como complicação nas lesões de mucosa oral em cerca de 5% dos casos.3 ,11 Alguns autores, como Eisenberg et ai. em 1985 e 1992 e Lovas et al. em 1989, sugerem que a transformação maligna estaria relacionada há uma entidade denominada Displasia Liquenóide e não ao LP oral. Em desacordo com esta opinião está o fato de que, desde a década de 70, tem-se reportado casos de LP oral controlado por vários anos, os quais evoluíram com malignização das lesões.11
O diagnóstico é feito através dos aspectos clínicos e da biópsia.2
Ainda hoje, não existe tratamento efetivo 4 É usado a corticoterapia para alívio dos sintomas.2, 4 Várias outras drogas têm sido utilizada com maior ou menor sucesso.2
O prognóstico é bom, embora as lesões possam persistir indefinidamente.4
REVISÃO DA LITERATURA
CONCEITO
O LP é uma doença inflamatória crônica2 que compromete a pele, os anexos e as mucosas.9, 12 É uma enfermidade rara.13 Caracteriza-se por lesões papulosas pruriginosas2 muito típicas. O termo líquen é originado do grego leichén e do latim lichen, palavra cujo significado original designa certas formas simbióticas de plantas. Pela vaga semelhança com essas formas botânicas, as lesões cutâneo-mucosas aqui referidas recebem a mesma designação.1 Os achados clínicos do LP são resumidos pelos quatro Ps: púrpura, poligonal, prurido e pápulas.8
HISTÓRICO
Em 1869, Erasmus Wilson deu nome ao LP, mas a dermatose foi provavelmente descrita antes por Hebra como líquen rubro.8, 14, 15 Por muito tempo foi considerada uma patologia bucal benigna que não se degenerava. '6 Em 1892, Kaposi relatou uma variante da doença que apresentava bolhas e denominou líquen penfigóide rubro.15 Wickham, em 1895, descreveu a aparência característica das estrias e os pontilhados sobre as pápulas.8, 15 Os achados histológicos foram evidenciados por Darier em 1909.8, 15 Em 1910, Hallopeau descreveu um caso de carcinoma epidermóide bucal desenvolvido sobre uma lesão de LP.16 Pinkus em 1973, definiu formalmente a lesão típica da doença como reação tecidual liquenóide.1, 8, 15
EPIDEMIOLOGIA
Sua distribuição é a mesma nos dois sexos e com maior freqüência na faixa etária entre trinta e sessenta anos.1, 7, 9, 17 Entretanto, nos países de clima tropical e subtropical foi observado o acometimento de um grupo de pacientes mais novos.1 LP oral é extremamente raro em crianças (2 a 3%)7, 17 e ocorre nos locais típicos ou nos lábios.8 Não existe predomínio por raça.8, 9, 15 Acredita-se que a prevalência está em torno de menos de 1% da população em geral.15
LP familiar foi descrito, parece estar ligado ao sistema HLA e seu início ocorre mais precocemente do que o usual.8
ETIOPAIOGENIA
Sua etiologia é desconhecida. Existem hipóteses de origem viral e psicogênica. O perfil psicológico dos pacientes com reações liquenóides, incluindo o LP oral idiopático, demonstra certas características, incluindo preocupação exagerada com a saúde e a tendência à depressão. Estudo feito por Burkhart et al. em 1996 revelou que 51% dos pacientes com LP oral relatavam que a doença iniciou em um momento de stress.6, 8, 18, 19 Como existem depósitos de imunoglobulina em disposição linear ao nível da membrana basal e predominância de linfócitos T helper na derme superficial, a etiologia imunológica também é coerente. Esta infiltração de linfócitos T helper, na doença ativa, ocorre tanto na junção dermo-epidérmica quanto na camada profunda da derme.8 A produção de citocinas está muito aumentada no LP com elevação dos níveis de interleucinas (IL) 1 , 4, 6 e o fator de necrose tumoral (TNF).8 Interferon é produzido pelos linfócitos ativados que expressam os queratinócitos aos antígenos HLA-DR e progridem nas células lesadas.8 A lesão do queratinócito e a liquefação das células basais podem ser intermediadas pelas citocinas e pelo recrutamento das células T citotóxicas que seguem a ativação da célula T.ª A molécula de adesão intercelular (ICAM) 1 tem uma distribuição celular difusa e provavelmente está envolvida não só no recrutamento de células inflamatórias mas também no controle de suas funções, sua retenção e migração para a pele.8 Estudos demonstraram que células T CD28 presentes no LP interagem com um específico ligand (B7/BB1) encontrado nas células dendríticas e nos queratinócitos.8 Como seqüela das ações da inflamação induzida pelas citocinas algumas mudanças estruturais são observadas. Distúrbios no sistema de ancoragem epitelial são demonstrados pela presença de desenho listrado de colágeno VII no tecido conectivo profundo. O hemidesmossoma se torna descontínuo no LP. O perfil da queratina na doença se modifica com a expressão de K6, K16 e K17 e ocorre uma hiperproliferação.
A questão ainda é: o que iniciaria o evento? Alguns autores questionam infecções virais pela presença de proteína humana Mxa nesta dermatose e também pela evidência de que o LP oral pode estar associado ao papiloma vírus humano. De que maneira o vírus age como um antígeno estranho induzindo mudanças nos queratinócitos e como os anticorpos anticélulas basais podem ser parte da resposta inflamatória ainda deve ser vista.8 A demonstração dos anticorpos anticélulas basais na doença, a detecção do antígeno LP-específico em 80% dos pacientes com LP e a associação do LP com uma variedade de desordens auto-imunes sugerem pelo menos a possibilidade de uma patogênese celular e humoral combinadas.8 Parece não haver associação uniforme do HLA com LP.20
Algumas drogas (antimaláricos, ouro, bismuto, PAS, quinidina, isoniazida, mercúrio e outros) e reveladores fotográficos (substitutos de parafenilenodiaminas) produziram o líquen plano-like, isto é, erupção liquenóide, porém provavelmente, sem relação com o líquen plano típico.2 A radiação solar pode originar a instalação das lesões ou precipitar o aparecimento de novas lesões em casos de portadores da doença.9
MANIFESTAÇÕES CLÍNICAS ORAIS
Como manifestação única do LP, a doença oral acomete de 15 a 35% dos pacientes, porém cerca de 65% dos portadores da doença cutânea clássica apresentam concomitantemente doença oral.8 A mucosa jugal é comumente afetada. A língua, o palato, os lábios e as gengivas podem estar ocasionalmente acometidos.2 O envolvimento geralmente é simétrico, lesões isoladas foram relatadas nos lábios.8
As lesões iniciais são pequenas pápulas que podem coalescer ou exibir arranjos que resultam em uma grande variedade de formas clínicas: reticular, atrófica, erosiva, vesicular, papular, descamativa e em placas.2, 8, 14 A forma clássica é o padrão reticular o qual é mais facilmente reconhecido. Mostra mucosa jugal aparentemente normal com umas linhas branco-acinzentadas, discretamente elevadas, que formam estrias denominadas de Estrias de Wickham.2, 4 Estas linhas unem-se umas às outras e formam ângulos com padrão reticular.4 As lesões variam de tamanho, podem ter poucos milímetros ou até mesmo envolver toda a mucosa bucal.4 Na língua, as lesões surgem usualmente como placa branca fixa fortemente deprimida, circundada por mucosa normal.1 A pápula possui características próprias: é poligonal e facetada, brilhante, com pontos na superfície ou estrias.9 São inicialmente eritematosas e posteriormente se tornam violáceas quando acometem a pele.9 Na mucosa oral, as lesões são esbranquiçadas com aspecto arboriforme, raramente com erosões ou ulcerações.2, 9 Lesões ulcerativas na boca são incomuns, mas se surgirem, são importantes locais de observação e acompanhamento porque podem ser sedes de transformação epiteliomatosa.1 Eventualmente atinge a mucosa perianal, genitália, faringe, laringe, membrana timpânica, esôfago, estômago, cólon e bexiga.1, 2, 9, 14 Existem vários trabalhos publicados a respeito da estreita associação entre LP oral e vulvar.14, 21
O padrão papular consiste em manchas brancas brilhantes, de tamanho da cabeça de um alfinete, discretamente elevadas, que ocorrem em grupos ou difusamente na mucosa oral. Podem adquirir a forma de uma placa sólida esbranquiçada que, quando examinada com aumento evidencia que esta é composta de numerosas pápulas menores.4
O quadro de gengivite descamativa evidencia erosão, atrofia e descamação da gengiva, que nos casos mais severos podem levar a uma mobilidade dos dentes e queda dos mesmos. Pode ser manifestação, também, do penfigóide ou do pênfigo vulgar. 22
Na imunofluorescência direta, a IgM é encontrada em depósitos granulosos na membrana basal. Porém IgG, IgA, C3 e fibrina podem estar nos corpos colóides.9, 13
Na imunofluorescência direta, a IgM é encontrada em depósitos granulosos na membrana basal. Porém IgG, IgA, C3 e fibrina podem estar nos corpos colóides.9 , 23
O LP pode se instalar de forma aguda, com pápulas disseminadas no tronco e membros e muito prurido, ou, de forma insidiosa, crônica, com poucas lesões ou estas aumentando em número após meses.9 Os sintomas do líquen plano são muito variáveis.4 As lesões orais são geralmente assintomáticas mas o paciente pode queixar-se de sensação de queimação ou mesmo dor quando apresenta a forma erosiva.2 LP esofageano pode ser a causa de disfagia em associação com o LP oral.
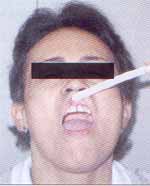
Figura 1. Paciente portadora de LP erosivo em fase inicial de comprometimento gengival
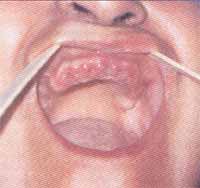
Figura 2. Paciente após remoção dos dentes por mobilidade excessiva dos mesmos, respectivamente.
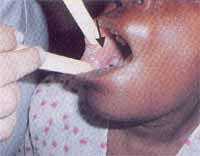
Figura 3. Paciente portadora de líquen plano apresentando estrias de Wickham
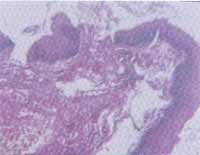
Figura 4. Fragmento de mucosa com acantose e exocitose com infiltrado inflamatório do tipo mononuclear liquenóide. O mesmo infiltrado se observa no córion subjacente.
Pode ocorrer, na pele, o fenômeno de Koebner, no qual se reproduz a lesão linear pelo trauma no momento de coçar ou por outra natureza.9
O LP familiar esta associado com lesões atípicas, lineares, erosivas ou ulcerativas. O início é geralmente mais precoce, 40% antes de 30 anos de idade e com recaídas mais freqüentes.8
A história revela remissões e exacerbações por anos.4
Um dado importante é o desenvolvimento do epitelioma espinocelular em lesões de líquen de mucosa oral (1 a 10%).1 O homem é mais acometido pelo câncer de boca e provavelmente o tabagismo é um cofator que pode contribuir para esta diferença.8 O desenvolvimento do câncer foi descrito nos pacientes com LP do tipo erosivo, atrófico e em placas. O local de maior acometimento é a mucosa bucal mas pode ocorrer na língua e lábios.8
Classificação do LP segundo aspecto da lesão:
o Reticular
o Atrófica
o Papular
o Erosiva
o Vesicular
o Descamativa
o Em placas
DIAGNÓSTICO
O diagnóstico é feito através da clínica, visualização das lesões, imunofluorescência direta e principalmente pelo exame histopatológico.
O material a ser enviado para imunofluorescência direta deve ser colhido da própria lesão.23 A biópsia revela queratose e paraqueratose, com padrão de destruição das células basais.4 Também mostra hipergranulose focal e acantose irregular, caracterizada por fendas entre o epitélio e o tecido conectivo.9, 24 Células inflamatórias, geralmente linfócitos, estão presentes diretamente abaixo do epitélio basal.4, 24 Os cones interpapilares apresentam forma de "dentes de serra".9, 25 Existe vacuolização das células basais.9 Em 37% dos casos encontra-se corpúsculo de Civatte que são queratinócitos basais degenerados. 9, 24
Na imunofluorescência direta, a IgM é encontrada em depósitos granulosos na membrana basal. Porém IgG, IgA, C3 e fibrina podem estar nos corpos colóides.9, 23
DIAGNÓSTICO DIFERENCIAL
É feito com Lues secundária, lupus eritematoso, psoríase, líquen nítido, líquen estriado, granuloma anular, psoríase, leucoceratose, leucoplasia, erupção liquenóide à droga, onicomicose, escabiose, penfigóide e pênfigo vulgar.8, 9, 12, 22, 26
A diferenciação entre LP e lupus eritematoso não é fácil. Fatores histológicos ajudam esta distinção. Corpos colóides tendem a ser encontrados mais profundamente na derme, enquanto no lupus eritematoso na membrana basal. Achados da imunofluorescência direta no lupus eritematoso mostram IgG e C3 linear na junção dermo-epidérmica.8
Em 1991, Boyd associou o LP com a doença hepática. Um estudo recente revelou a presença de anticorpos anti-hepatite C em 17 de 45 pacientes com LP. Houve a mesma prevalência em homens e mulheres e acometendo pacientes com doença somente cutânea, somente mucosa e cutâneo-mucosa.8 O LP pode surgir após vacinação contra hepatite C.
Um estudo semelhante com pacientes vacinados contra o vírus da hepatite tipo B, não encontrou subsídios suficientes para estabelecer uma conclusão a respeito da associação entre o LP e esse tipo de hepatite.27 Também foi reportado em associação com cirrose biliar.8
TRATAMENTO
Até os dias de hoje, não existe tratamento específico para ó LP.1
A aplicação tópica de corticosteróides em oro-base alivia os sintomas.1, 13, 25, 28 A injeção intra-lesional do mesmo está indicada quando os sintomas são severos, melhora o prurido e o espessamento no LP hipertrófico.2, 8 Os corticosteróides sistêmicos podem ser utilizados nas lesões ulcerativas.4 A dose de prednisolona deve ser de 15 a 20 mg/dia, algumas vezes maior, e retirada gradativamente de acordo com a melhora clínica.8, 13
Os colutórios anti-sépticos aliviam o desconforto do paciente e os anti-histamínicos ajudam a diminuir o prurido da pele e mucosas.2, 9
Lundquist et al. demonstraram que PUVA é efetivo para LP oral.2, 13, 25, 28
Tetraciclina tópica para bochechos (250 mg dissolvido em 100 ml de água) duas a três vezes ao dia foi utilizado em paciente com LP erosivo oral. As lesões cicatrizaram em 6 semanas e não recidivaram por um ano, embora LP permanecesse clinicamente ativo.29
É importante minimizar os cofatores que podem agravar a doença como: trauma, tabagismo, infecções por Cândida e maximizar a higiene oral.8
Segundo Capella e Finzi, em 2000, existem tratamentos que não estão de acordo com as normas da FTN (Italian Therapeutic Formulary), mas são utilizados e muitas vezes com sucesso. Este tipo de terapia seria recomendado quando o tratamento preconizado não funcionar ou quando o mesmo não possa ser utilizado por algum motivo especial.30
Até 1995, os trabalhos realizados sobre o uso de ciclosporina tanto oral quanto tópica obtiveram resultados conflitantes. Estes variavam desde nenhum benefício a uma melhora acentuada.14, 19 Capella e Finzi conseguiram bons resultados com ciclosporina tópica em 5 ml para bochechos ou aplicação local divulgando este trabalho em 2000 como uma alternativa de tratamento.30 A ciclosporina oral (5 a 6 mg/kg/dia) pode ser efetiva nas formas mais severas da doença.8, 13, 29, 30
Formas erosivas podem se beneficiar da azatioprina, metotrexate e ciclosfosfamida.8, 30 O uso destes imunossupressores é limitado pela sua toxicidade e alto custo.29
Retinóides tópicos podem ser efetivos no LP oral13. Um análogo da vitamina D, KH 1060, possui uma atividade imunossupressora importante que modifica células da epiderme no LP.8, 30 Vitamina A e tetraciclina tópica são algumas vezes utilizados no LP oral.31 Hidroxicloroquina em 200 a 400 mg/dia por 3 a 6 meses pode ser utilizada.8, 14
A infecção por Cândida é comum acontecer nestes pacientes e por isso o cetoconazol pode ser utilizado. Nos casos de esofagite, a associação cetoconazol e corticosteróide está indicada.30
A eficiência da grisofulvina no LP oral está sendo estudada.14, 30
Em pacientes idosos com LP erosivo de longa duração pode se usar a dapsona. Também a mesma pode ser utilizada em crianças com LP.8, 14
Interferon-2b pode atenuar o LP generalizado após 8 a 10 meses de tratamento, a eficácia do interferon no tratamento da hepatite viral faz com que seja uma boa alternativa em pacientes portadores do vírus da hepatite C.8
A talidomida pode ser usada como tratamento de LP erosivo. Em 1985, Naafs and Faber publicaram que obtiveram sucesso no tratamento de paciente com LP utilizando esta droga. Este paciente permaneceu livre da doença após que o tratamento com a talidomida foi descontinuado. Mais recentemente, Dereure et al. reportaram sucesso em tratamento de dois pacientes com LP oral erosivo severo que não responderam ao tratamento convencional. Estes pacientes responderam rapidamente a doses diárias de 150 mg de talidomida. O efeito colateral apresentado foi uma moderada linfopenia que cessou quando o tratamento terminou. Pode haver cefaléia, náuseas, constipação, rash, sedação, reação eritema-nodoso "like", ganho ponderal e edema.29
A associação sulfametoxazol com trimetoprim provou ser efetivo em casos de LP agudo. Também pode ser utilizado o metronidazol.8, 30
Cirurgia pode ser necessária no LP oral se aparece lesão maligna.8 O número reduzido de casos de carcinoma epidermóide oral relacionados diretamente com LP requer um controle semestral das lesões, bem como a erradicação total dos possíveis fatores sabidamente carcinogênicos.16 Criocirurgia e laser podem ser úteis também no LP.8
Além destes, outra miscelânea de medicamentos vem sendo utilizados para o LP como tratamento alternativo.30
EVOLUÇÃO E PROGNÓSTICO
A evolução é variável. As lesões podem regredirem semanas ou meses nos casos agudos ou, nas formas crônicas, serem insidiosas e durar anos. As recidivas são comuns 90 envolvimento cutâneo no LP possui um curso menor do que as variantes orais e hipertróficas.8
O prognóstico é bom. Porém, quando surge o epitelioma espinocelular em lesões mucosas o prognóstico torna-se pior.8
DISCUSSÃO
As lesões mucosas são comuns no LP e podem ser encontradas sem a presença de lesões cutâneas. Ocorre principalmente em adultos sem preferência de sexo. É muito menos comum na raça negra. Ainda não se conhece sua etiologia e muitas hipóteses têm sido levantadas. A mucosa jugal e a língua são bastante acometidas, porém, a laringe, a membrana timpânica e o esôfago podem estar raramente afetados. As estrias esbranquiçadas na mucosa oral são características. Na língua as lesões geralmente formam placas brancas fixas na mucosa e discretamente depressivas abaixo de mucosa normal. Pode apresentar-se com um quadro de gengivite descamativa e se for intenso pode causar mobilidade dos dentes até mesmo com avulsão dentária. Devemos, portanto, estar sempre atentos para as características da doença e assim diagnosticar com maior precisão e iniciar terapia precoce. Espera-se, com as pesquisas futuras, que se possa encontrar uma terapia mais específica para a doença.
COMENTÁRIOS FINAIS
O LP é um dos processos mais bem conhecidos da mucosa bucal. As múltiplas formas de apresentação da doença dificultam seu tratamento clínico, porém quase sempre em algum local da mucosa oral, existe uma lesão clássica. As lesões erosivas podem sítios de malignização tardia, devendo ser acompanhadas periodicamente. Além disso, podem existir complicações decorrentes do tratamento com corticosteróides, imunossupressores e outros que também exijam atenção.
As lesões da mucosa oral podem ser de difícil diagnóstico. Deve-se, então, estar atento para uma diferenciação detalhada entre elas promovendo um tratamento direcionado e um melhor prognóstico. Ressaltamos a importância de uma abordagem interdisciplinar no acompanhamento destes pacientes.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Black MM. Lichen Planus and Lichenoid Disorders in ROOK, A; Wilkinson DS, Ebling FSG. Blackwell Science; Textbook of Dermatology. 5ª edição; England; 1995, p.1675-98.
2. Bluestone, Stool & Kenna. Inflammatory Disease of the Mouth and Pharynx , In:_____-, WB Saunders Company, Pediatric Otolaryngology vol II, 3ª edição, Philadelphia, 1996, 1052-3.
3. Grinspan D. In: - Líquen rojo plano - Editorial Mundi. Enfermedades de la Boca. Tomo II, 1383-411.
4. Bluestone, Stool & Kenna. Idiopathic Conditions of the Mouth and Pharynx, In: _______-, WB Saunders Company,, Pediatric Otolaryngology vol II, 3ª edição, Philadelphia; 1996; 1088-91.
5. Eversole LR. Immunopathogenesis of Oral Lichen Planus and Recurrent Aphtomus Stomatitis. Seminars in Cutaneous Medicine and Surgery, 1997; 16(4):284-94.
6. Burkhart NW, Burker EJ, Burkes EJ, Wolfe I. Assessing the characteristics of patients with oral lichen planus. J.Am.Dent.Assoc. 1996; 127: 648,651-2,655-6.
7. Howard R & Tsuchiya A. Adult Skin Disease in the Pediatric Patient. Dermatologic Clinics; July 1998; 16(3): 593-608.
8. Marshman G. Lichen planus. Australasian Journal of Dermatology. 1998; 39:1-13
9. Azulay & Azulay. Dermatoses Basicamente Papulosas. In: Dermatologia. Rio de janeiro: Guanabara Koogan; 1997.p.109214.
10. Ramírez-Amador VA, Esquive i-Pedraza L, Orozco-Topete R. Frequency of oral conditions in a dermatology clinic. International Journal of Dermatology 2000; 39:501-5.
11. Villarroel M, Mata M, Salazar N, Tinoco P, Oliver M, Vaamonde J. Transformación Maligna Dei Liquen Plano Bucal Vs Displasia Liquenoide. Acta odontol. Venez; 1997; 35(2):61-3.
12. Moreno, Sonia, Qüerio RS, Ramallo Y, Zelarayan LG. Líquen Plano. Arch. Argent. Dermatol; Enero-Febrero; 2000; 50(1): 3940.
13. Cribier B, Frances C, Chosidow O. Treatment of Lichen Planus. Arch Dermatol, 1998, 134: 1521-30.
14. Lewis FM. Vulval Lichen Planus. Br J Dermatol; 1998; 138: 569-75.
15. Pittelkow MR. Lichen Planus in 1c ed Editora Irwing M. Freedberg ... [et al];. Fitztatrick's Dermatology in General Medicine; 5ª edição; 1999; 561-76.
16. Rebai-Chabchoub N & Reychler H. Lichen pian oral dégénéré. Acta Stomatologica Belgica vol. 90, n° 3, p.163-69, 1993.
17. Herane MI & Hasson À. Lichen Planus en la Infancia. Dermatologia. 1992. 8(3). 163
18. Bergdahl J, Ostman PO, Anneroth G, Perris H, Skogland A. Psychological aspects of pacients with oral lichen planus. Acta Odontol.Scand. 1995; 53: 236-44.
19. Sieg P, Von Domarus H, Von Zitzewitz V, Iven H, Fárber L. Topical Cyclosporin in Oral Lichen Planus: A Controlled, Randomizzed, Prospective Trial., Br J Dermatol. 1995; 132: 790-4.
20. Duvic M. Influence of the HLA System on Disease Susceptibility in 1c ed Editora Irwing M. Freedberg ... [et al];. Fitztatrick's Dermatology in General Medicine; 5ª edição, 1999, 561-76.
21. Micheletti L, Preti M, Bogliato F et al. Vulval Lichen Planus in the Practice of Vulval Clinic. Br J Dermatol, 2000, 143:1349-50.
22. Ramos-e-Silva M & Fernandes NC. Afecções das Mucosas e Semimucosas. JBM, 2001; 80(3): 50-66.
23. Gately III LE & Nesbitt Jr LT. Update On Immunofluorescent Testing In Bullous Diseases And Lupus Erythematosus. Dermatologic Clinics, January, 1994, 12(1):133-42.
24. Sugerman PB, Savage NW, Zhou X, Walsh LJ, Bigby M. Oral Lichen Planus. Clinics in Dermatology, 2000; 18: 533-9.
25. Schiller PI, Flaig MJ, Puchta U, Kind P, Sander CA. Detection of clonal T cells in lichen planus. Arch.Dermatol.Res, 2000; 292: 568-9.
26. Cucê LC & Festa Neto C. Líquen Plano. Manual de Dermatologia. Editora Atheneu, 1990: 98-100.
27. Rebora A, Rongioletti F, Drago F, Parodi A. Lichen Planus as a Side Effect of HBV Vaccination. Dermatology, 1999, 198:1-2.
28. Boyd AS & Neldner KH. Lichen planus. J. Am. Acad. Dermatol. 2000; 25: 593-619.
29. Popovsky JL. & Camisa C. New and Emerging Therapies for Diseases of Oral Cavity. Dermatologic Clinics, 2000; 18(1):113-25.
30. Capella GL & Finzi AF. Psoriasis, Lichen Planus, and Disorders of Keratinization: Unapproved Treatments or Indications. Clinics in Dermatology, 2000; 18:158-69.
31. Tüzün B, Tüzün Y, Wolf R. Oral Disorders: Unapproved Treatments or Indications. Clinics in Dermatology, 2000; 18:197-200.
32. Ho VC, Gupta AK, Ellis CN et al. Treatment of severe lichen planus with cyclosporine. J.Am. Acad. Dermatol. 1990; 22:64-8.
33. Sharma R & Maheshwari V. Childhood Lichen Planus: A Report of Fifty Cases. Pediatric Dermatology, 1999; 16(5): 345-8.
1, 2, 3, 4, 5, 6 Membro do staff da Clínica Professor José Kós.
Endereço para correspondência: Dra. Paula Moreno Fraiha
Rua Padre Elias Gorayeb 15 sala 606 - Tijuca - Rio de Janeiro - RJ - 20520-140
1 Coordenadora do Curso de Aperfeiçoamento em Otorrinolaringologia da Clínica Professor José Kós.
Artigo recebido em 13 de novembro de 2001. Artigo aceito em 20 de dezembro de 2001