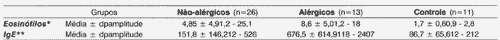Ano: 2002 Vol. 68 Ed. 6 - Novembro - Dezembro - (1º)
Seção: Artigos Originais
Páginas: 781 a 787
Expressão da molécula de adesão VCAM-1 em pacientes portadores de polipose nasal
The expression of VCAM-1 in patients with nasal polyposis
Autor(es):
Richard L. Voegels1,
Patricia Santoro2,
Ossamu Butugan3,
Aroldo Miniti4.
Palavras-chave: polipose nasal, alergia, molécula de adesão, VCAM-1
Keywords: nasal polyposis, allergy, adhesion molecules, VCAM-1
Resumo:
A polipose nasal 2 uma doença inflamatória crônica da mucosa nasal cuja fisiopatologia é motivo de controvérsia, existindo inúmeras teorias descritas na literatura sobre o assunto. Objetivo: O objetivo desta pesquisa foi a de estudar o papel da expressão em endotélio vascular da molécula de adesão VCAM-1 em três grupos de pacientes: não-alérgicos portadores de PN, alérgicos portadores de PN e um grupo controle. Forma de estudo: Clínico prospectivo. Material e método: Foram selecionados prospectivamente 39 pacientes com polipose nasal, sendo 13 considerados alérgicos e 26 não-alérgicos, além de um grupo controle com 11 indivíduos. A pesquisa da expressão de VCAM-1 foi realizada através de imunoistoquímica em tecido congelado. Houve uma maior incidência de polipose nasal após a quarta década de vida e no sexo masculino. O quadro clínico foi semelhante nos dois grupos e se caracterizou principalmente por obstrução nasal e hiposmia. Conclusão: A expressão de VCAM-1 foi significativa nos dois grupos de portadores de polipose nasal, sugerindo que esta molécula de adesão possivelmente está envolvida na intensa migração de eosinófilos que ocorre nesta doença.
Abstract:
Nasal polyposis (NP) is a chronic inflammatory disease of the nasal mucosa. The etiology and formation of NP are still not elucidated and Nave been debated for many years. Aim: The objective of the present study was to investigate the role of the expression of VCAM-1 in the endothelium of the group of patients: allergic with NP, non-allergic with NP and a control group. Study design: Clinical prospective. Material and method: Thirty-nine patients with NP were selected, 13 of them allergic and 26 non- allergic. A control group of 11 individuals was also studied. The expression of VCAM-1 was investigated with immunohistochemistry of frozen tissue. There was a higher incidence of NP after the fourth decade of life and among men. The clinical symptoms were similar in both groups of patients with nasal polyposis and characterized by nasal obstruction and anosmia. Conclusion: The expression of VCAM-1 was significant in both groups of patients with nasal polyposis, suggesting that this adhesion molecule is probably involved in the intense migration of eosinophils that occurs during nasal polyp formation.
![]()
INTRODUÇÃO
A polipose nasal (PN) é uma doença inflamatória crônica da mucosa nasal que acomete mais de 0,5% da população1, 2. Na grande maioria dos pacientes existe um intenso infiltrado eosinofílico. O mecanismo e o significado deste infiltrado é motivo de controvérsia, existindo inúmeras teorias descritas na literatura a respeito3-6.
Vários autores definem a PN como decorrente de um processo alérgico mediado por IgE e a intensa eosinofilia presente nestes pacientes seria decorrente deste processo7, 8, 9. Outros autores acreditam que a migração eosinofílica presente na PN não possui relação com alergia e decorreria de algum mecanismo imunológico distinto10, 11.
Para melhor se compreenderem a migração eosinofílica presente na grande maioria dos pacientes com PN e os mecanismos imunológicos envolvidos na sua gênese, houve a opção pelo estudo de dois grupos de pacientes portadores de polipose nasal: o de alérgicos e o de não-alérgicos e compará-los a um grupo-controle. O objetivo desta pesquisa foi a de estudar o papel da expressão em endotélio vascular da molécula de adesão VCAM-1 na migração eosinofílica de pacientes portadores de PN.
MATERIAL E MÉTODO
Foram estudados prospectivamente 39 pacientes portadores de polipose nasal atendidos e operados no segundo semestre de 1997 na Divisão de Clínica Otorrinolaringológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo. Foram utilizados, neste estudo, os seguintes critérios de inclusão e exclusão:
o Critérios de inclusão; Foram incluídos unicamente os pacientes que apresentavam diagnóstico de polipose nasal bilateral e que seriam submetidos a tratamento cirúrgico.
o Critérios de exclusão: Foram excluídos pacientes portadores de pólipo único (antrocoanal, esfenocoanal) ou de outras doenças correlacionadas com a polipose nasal, como fibrose cística, discinesia ciliar primária e sinusite fúngica. Por último, foram descartados aqueles os quais não foi possível classificar como alérgicos ou não-alérgicos.
Os 39 pacientes assim selecionados foram divididos em dois grupos:
1. grupo alérgicos (13 pacientes)
- história de rinite alérgica (prurido nasal, espirros, rinorréia, obstrução nasal)
- teste cutâneo de hipersensibilidade positivo
2. grupo não-alérgicos (26 pacientes)
- ausência de história de rinite alérgica
- teste cutâneo de hipersensibilidade negativo
Grupo-controle: Foi constituído por 11 adultos voluntários, sem nenhum antecedente de sintomatologia nasal e/ou sintomas alérgicos de qualquer natureza. O exame das fossas nasais, com endoscópio rígido, mostrava-se normal. Neste grupo, 7 indivíduos (63,6%) eram do sexo masculino e 4 (36,4%) eram do sexo feminino. A idade média foi de 29,8 ± 5,3 anos (25-42 anos) (média ± desvio padrão).
Todos os pacientes foram avaliados uma semana antes da cirurgia, sendo que foi solicitado aos pacientes que atribuíssem uma nota 1 a 10 aos seguintes sintomas: cefaléia, obstrução nasal, hiposmia, secreção purulenta, coriza e tosse. Considerou-se como sendo nota 1 o estado sem o sintoma e nota 10 com o sintoma intenso. Foi realizada também coleta de sangue IgE e eosinófilos, além de teste cutâneo alérgico.
A coleta de fragmentos dos pólipos nasais foi efetuada durante o ato cirúrgico com anestesia geral (Figura 1). Foram separados dois fragmentos do pólipo de cada paciente, um foi submetido a coloração com hematoxilina e eosina enquanto que o segundo foi colocado sobre um pedaço de cortiça medindo 1,0 cm x 1,0 cm e com 1,0 mm de espessura. Este foi totalmente recoberto com CRYO-GEL® (Instrumedics Inc., NJ, EUA) tomando-se o cuidado de não firmar bolhas de ar. Realizou-se então a imersão do fragmento recoberto com CRYO-GEL® em névoa de nitrogênio líquido até atingir o estado sólido de toda a massa (aproximadamente dez minutos) (Figura 2). O fragmento foi embrulhado em papel alumínio e devidamente identificado. Todos os procedimentos acima descritos foram realizados dentro da sala cirúrgica e o transporte imediato em garrafa térmica com nitrogênio líquido até congelador a -70°C, onde o material foi armazenado até a realização da reação imunoistoquímica10.
A coleta de fragmentos de mucosa normal do grupo-controle foi feita com pinça Grünwald. Foi retirada mucosa de concha média sob visão de endoscópio rígido de 4,0mm e 30°. A mucosa destes pacientes foi submetido ao mesmo processo descrito para os pólipos.
Através de reação imunoistoquímica foram pesquisados antígenos nos pólipos nasais com anticorpo primário monoclonal de camundongo contra VCAM-1 (CD106) humano, clone 1.463, IgG, kappa (DAKOM 7106, Denmark), em diluição 1:50, através do complexo fosfatase alcalina/ antifosfatase alcalina (complexo APAAP).
O fragmento sofreu congelamento de choque com nitrogênio líquido e foi armazenado a -70°C pela melhor preservação antigênica em relação ao tecido levado a fixação em formol e inclusão em parafina. Os fragmentos congelados foram submetidos a cortes de 3 m (micrômetros) de espessura em criostato e foram aderidos a lâminas tratadas com adesivo SILANE A174 (Pharmacia, USA). Cada lâmina recebeu quatro cortes, sendo um para a reação de controle negativo e três para a diluição do anticorpo monoclonal primário. Os cortes assim preparados foram mantidos a 4°C por uma noite (catorze horas)10 e em seguida colocados em fixação em acetona (21605-MERCK) a 4°C por 10 minutos. Após isto, foram secados em temperatura ambiente por dez minutos, envolvidos em papel alumínio e filme de PVC e armazenados a -70°C até a realização das reações.
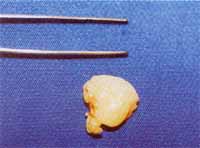
Figura 1. Pólipo nasal logo após a exérese cirúrgica
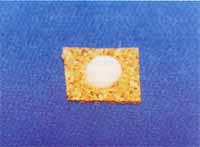
Figura 2. Vista superior de pólipo recoberto com CRYO-GELO e congelado em névoa de nitrogênio líquido
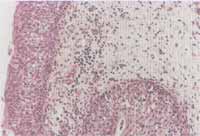
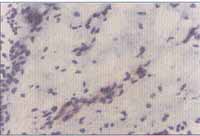
Figuras 3 e 4. Intenso infiltrado eosinofílico em toda extensão do tecido (pólipo nasal) (microscopia óptica - H&E x100 e x200)
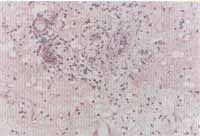
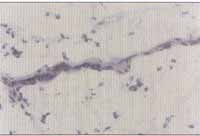
Figuras 5 e 6. Reação de imunoistoquímica demonstrando a expressão de VCAM-1 no endotélio vascular de pólipo nasal (microscopia óptica - x200)
O método imunoenzimático utilizado foi o do complexo APAAP10. O antígeno tecidual é exposto inicialmente ao anticorpo monoclonal específico, posteriormente a um anticorpo secundário não marcado dirigido contra a imunoglobulina murina primária e, por fim, a um complexo APAAP murino que também se liga ao anticorpo secundário e reage com um substrato enzimático específico. As principais etapas do procedimento foram as seguintes:
o incubação primária: o primeiro corte (controle negativo) e os dois subseqüentes com o anticorpo monoclonal primário em duas diluições sucessivas.
o incubação secundária de todos os cortes com anticorpo de coelho anti-camundongo (Rabbit-anti-mouse, RAM) (Rabbit Anti Mouse Immunoglobulins code n° Z 259, lot n° 071, DAKO, Denmark), em diluição 1:100.
o incubação terciária de todos os cortes com o complexo APAAP (APAAP Mouse Monoclonal code nQ D 651, lot no 023, DAKO, Denmark) (Figura 9), em diluição 1:100.
o incubação final com o substrato associado ao levamisole (para bloqueio da fosfatase alcalina endógena)10.
A comparação entre grupos foi realizada utilizando-se testes estatísticos paramétricos e não-paramétricos levando-se em consideração a natureza dos dados e a variabilidade das medidas efetuadas. Foram utilizados os seguintes testes estatísticos, sempre com o nível de significância fixado em 5%12, 13.
RESULTADOS
A faixa etária dos pacientes variou de 16 anos a 88 anos. A idade média foi de 42,6 anos ± 16,9 anos (16 anos-88 anos) (média ± desvio-padrão).
Quanto ao sexo, 22 pacientes (56,4%) eram do sexo masculino e 17 (43,6%) do sexo feminino.Tabela 1. Concentração de eosinófilos e imunoglubulina encontrados nos grupos estudados
NOTA: dp - desvio padrão
* valores em percentagem (%) do total de leucócitos
** valores expressos em unidades internacionais/ mililitro (UI/mL)
*** valores expressos em miligrama/ decilitro (mg/dL)
Valores assinalados quando estatisticamente significantes (p<_ 0,05)
Teste estatístico utilizado: teste de kruskal - wallis (eosinófilos e IGE)
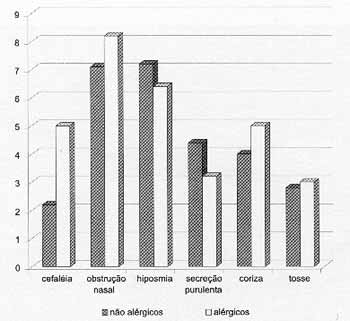
Gráfico 1. Avaliação do quadro clínico pelos pacientes.
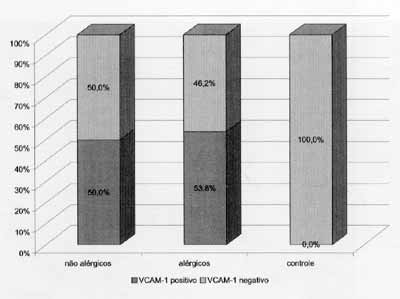
Gráfico 2. Distribuição dos pacientes quanto a positividade do exame imunoistoauímico para VCAM-1.
Quando se compararam as médias aritméticas dos escores do quadro clínico dos grupos alérgicos e não-alérgicos, observou-se que não houve diferença significante entre os grupos para nenhum dos sintomas (Gráfico 1).
Os níveis séricos de eosinófilos e imunoglobulinas estão representados na Tabela 1. Os parâmetros eosinófilos e IgE no grupo de pacientes alérgicos apresentou níveis significativamente maiores (p<0,001) do que os dos outros grupos.
O exame histológico através da coloração com hematoxilina e eosina evidenciou intenso infiltrado eosinofílico em 37 (94,8%) dos 39 pacientes portadores de PN estudados (Figuras 3 e 4). Em dois destes não foi visualizada eosinofilia tecidual importante, sendo que ambos pertenciam ao grupo de não-alérgicos.
Os resultados do exame imunoistoquímico estão expostos no Gráfico 2 e foram expressos em positivo (sim) ou negativo (não) (Figuras 5 e 6). Não houve diferença significante entre os dois grupos de portadores de PN, entretanto todos os pacientes do grupo-controle foram classificados como negativos e, portanto, diferiram significativamente (p(0,001) dos outros.
DISCUSSÃO
A exata fisiopatologia da PN ainda é desconhecida3,4, 6, 14-20. Existe nesses pacientes um complexo e intenso infiltrado inflamatório com a presença de inúmeros mediadores químicos9, 21.
Entre os pacientes portadores de PN houve um predomínio de indivíduos com mais de 30 anos, representando quase 75% (29/39) do total. Tais dados corroboram com aqueles referidos na literatura. Settipane e Chafee22, em uma revisão de 149 casos, encontraram 122 (82%) com mais de 30 anos. Informações semelhantes são relatados por Jamal; Marant23 e Granström et al. 8, sugerindo a alta prevalência dessa doença a partir da terceira década de vida.
Não encontramos diferença significante entre a idade dos pacientes nos dois grupos estudados, alérgicos e não-alérgicos. Enquanto que a idade média no primeiro grupo de alérgicos foi de 37,3 anos, no segundo foi de 45,3 anos.
É interessante notar que, assim como na literatura, encontramos pouquíssimos casos nas duas primeiras décadas de vida, sugerindo que, com exceção dos portadores de fibrose cística, a PN raramente acomete pessoas nessa faixa etária.
Do total de 39 pacientes portadores de PN, 22 (56,4%) eram do sexo masculino. Esses dados confirmam aqueles que observados na literatura, com predomínio do sexo masculino8, 23, 24.
Os pacientes portadores de PN freqüentemente cursam com sinusite crônica associada, sendo seu quadro clínico normalmente caracterizado por cefaléia, obstrução nasal, hiposmia, secreção purulenta, coriza e tosse.
Embora alguns autores sugerem que a presença de alergia associada à PN poderia exacerbar a sintomatologia desses pacientes25, em nossa casuística não observamos diferença significativa entre os dois grupos (alérgicos e não-alérgicos) em relação ao quadro clínico. Em ambos, os principais sintomas foram obstrução nasal e hiposmia. O grupo de pacientes alérgicos apresentou escores piores para cefaléia, obstrução nasal, coriza e tosse. Entretanto, não houve variação estatisticamente significante para nenhum dos sintomas.
O papel da atopia na fisiopatologia da PN é motivo de controvérsia há muitos anos. Vários autores acreditam que a alergia tem um papel importante na formação dos pólipos7-9, 26-29. Contudo, estudos recentes com citocinas têm sugerido o contrário11, 30, 31. Considerando tal polêmica, dividimos os nossos pacientes em dois grupos, o de alérgicos e o de não-alérgicos. Os alérgicos perfizeram 33,3% do total de pacientes com PN, o que corresponderia à incidência de atopia na população geral de um grande centro urbano como São Paulo32.
Settipane et al.25 ressalta que, apesar de a polipose nasal não ser mais freqüente em pacientes atópicos, quando essas doenças coexistem, ocorre uma exacerbação da PN.
Existe ainda uma forte correlação entre esses dados e o nível sérico de IgE. Enquanto não houve desigualdade relevante no nível sérico de IgE entre o grupo-controle e o de pacientes não-alérgicos, o nível sérico de IgE encontrado nos pacientes alérgicos foi significantemente maior quando comparado com o do grupo-controle (p<0,001) e com o dos pacientes não-alérgicos (p<0,001).
As moléculas de adesão são proteínas de membrana que permitem que duas células interajam. Tal fato pode ser modulado tanto pelo aumento do número de moléculas de adesão expostas na superfície celular, como pela alteração da afinidade dessas mesmas moléculas33.
O principal sítio de expressão das moléculas de adesão encontra-se no endotélio vascular, sendo o ICAM-1 e o VCAM-1 os principais representantes desse grupo34. A interação dessas moléculas, presentes na superfície celular endotelial, com os respectivos contra-receptores ativos na membrana das células inflamatórias facilita a migração transendotelial dessas últimas para os sítios inflamatórios35.
No caso dos portadores de PN, a principal célula inflamatória do tecido da PN é o eosinófilo8. Mais de 90% dos pólipos nasais apresentam intensa eosinofilia2. Em nossa casuística, apenas dois pacientes (5,1%) não possuíam tal característica, sendo que ambos pertenciam ao grupo dos pacientes não-alérgicos e apresentaram reação imunoistoquímica para VCAM-1 negativa.
O exato mecanismo envolvido na migração transepitelial dessas células em tais pacientes não foi ainda bem definido.
Com o objetivo de averiguar a expressão de VCAM-1 em.tecido de pólipo nasal, decidimos utilizar o método da imunoistoquímica em tecido congelado. A vantagem desse método é que permite visualizar o local exato onde existe a expressão de VCAM-1. Entretanto a dificuldade em quantificar o resultado, especialmente em tecido de pólipo nasal, no qual existe grande variação na densidade tecidual dos pólipos nos diversos pacientes, constitui sua desvantagem. Por essa razão, optamos por classificar os pacientes, no que diz respeito a essa abordagem, em apenas dois grupos:
1. positivo, quando ao menos um vaso sangüíneo apresentou-se positivo para VCAM-1;
2. negativo, quando não foi visualizado, em toda a extensão do corte estudado, algum vaso positivo para VCAM-1.
Esse tipo de classificação, em positivo e negativo, também é utilizado por outros autores36.
Symon et al.37 não referem um aumento da expressão de VCAM-1 no tecido de PN em nenhum dos oito pacientes estudados. Já outros autores demonstram um aumento da expressão de VCAM-1 em endotélio vascular de pacientes alérgicos e não-alérgicos portadores de PN36, 38-40. Estes, portanto, sugerem que o VCAM-1 estaria envolvido na migração transepitelial de eosinófilos para o tecido da PN.
Em nossa casuística, não observamos a expressão de VOAM-1 no endotélio vascular de mucosa normal de nenhum dos pacientes do grupo-controle. Por outro lado, nos portadores de PN constatamos a expressão de VCAM-1 em mais da metade deles, tanto no grupo de alérgicos como no de não-alérgicos. Não houve diferença significante entre os dois grupos. Desta forma a expressão VCAM-1 foi significativa nos dois grupos de portadores de polipose nasal quando comparados ao grupo controle.
CONCLUSÃO
A expressão de VCAM-1 foi significativamente maior nos pacientes com polipose nasal, independentemente de haver ou não alergia, sugerindo que esta molécula de adesão possivelmente está envolvida na intensa migração de eosinófilos que ocorre nesta doença.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Caplin I,- Haynes JT, Spahn J. Are nasal polyps an allergic phenomenon? Ann Allergy 1971; 29: 631-4.
2. Settipane GA, Lund VJ, Berstein JM, Tos M. Nasal polyps: epidemiology, pathogenesis and treatment. Rhode Island: Oceanside Publications; 1997. 97p.
3. Bernstein JM, Gorfien J, Noble B, Yankaskas JR. Nasal polyposis: Immunohistochemistry and bioelectrical findings (a hypothesis for the development of nasal polyps). J Allergy Clin Immunol 1997; 99: 165-75.
4. Davison FW. Hiperplastic sinusitis, a five year study. Ann Otol 1963; 72: 462-74.
5. Norlander T, Fukami M, Westrin KM, Stierna P, Carlsöö B. Formation of mucosal polyps in the nasal and maxilary sinus cavities by infection. Head Neck Surg 1995; 109: 522-9.
6. Tos M. The pathogenetic theories in formation of nasal polyps. Am J Rhinol 1990; 4:51-6.
7. Calenoff E, Guilford T, Green J, Engelhard CS. Bacteria-specific IgE in patients with nasal polyposis. Arch Otolaryngol 1983; 109: 372-5.
8. Granström G, Jacobsson E, Jeppsson PH. Influence of allergy, asthma and hypertension on nasal polyposis. Acta Otolaryngol 1992; 492: 22-7.
9. Jacobs RL, Freda EJ, Culver WG. Primary nasal polyposis. Ann Allergy 1983; 51:500-5.
10. Bachert K, Wagenmann M, Hauser U, Rudack C. IL-5 synthesis is upregulated in human nasal polyp tissue. J Allergy Clin Immunol 1997; 99: 837-42.
11. Simon H-U, Yousefi S, Schranz C, Schapowal A, Bachen C, Blaser K. Direct demonstration of delayed eosinophil apotosis as a mechanism causing tissue eosinophilia. J Immunol 1997; 158: 3902-8.
12. Snedecor W, Cochran G. Statistical methods: the comparison of two samples; analysis of frequencies in one-way and two-way classifications. Ames: The Iowa State University Press; 1982. p.83-106.
13. Sokal R, Rohlf F. Biometry: the principles and practice of statistics in biological research: Estimation and hypothesis testing. San Francisco: W. H. Freeman and Co.; 1969. p.127-74.
14. Billroth R. Uber den Bau der Schleimpolyppen. Vienna: Georg Reimer; 1885. p.1-32.
15. Cauna N, Manzetti GW, Hinderer KH, Swanson EW. Fine structure of nasal polyps. Ann Otol 1972; 81: 41-58.
16. Dolowitz DA, Dougherty TF. A study of cilia and conective tissue in normal and hiperplastic nasal mucous membrane. Laryngoscope 1966; 76: 555-59.
17. Drake-Lee A. Nasal polyps in identical twins. J Laryngol Otol 1992; 106: 1084-5.
18. Jenkins JL. Blockade theory of polyp formation. Laryngoscope 1932; 42: 703-4.
19.Ohno I, Lea R, Finotto S, Marshall J, Denburg J, Dolovich J, Gauldie J, Jordana M. Granulocyte/Macrophage Colony-stimulating Factor (GM-CSF) Gene Expression by Eosinophils in Nasal Polyposis. Am J Respir Cell Mol Biol 1991; 5: 505-10.
20. Weille FL. Further experiments in the viral theory of nasal polyp etiology. Ann Allergy 1966; 24: 549-51.
21. Oppenheimer EH., Rosenstein BJ. Differencial pathology of nasal polyps in cystic fibrosis and atopy. Lab Invest 1979; 40: 445-9.
22. Settipane GA, Chafee FH. Nasal polyps in asthma and rhinitis. J Allergy Clin Immunol 1977; 59: 17-21.
23. Jamal A, Marant AGD. Atopy and nasal polyposis. J Laryngol Otol 1987; 101: 355-8.
24. Moloney JR. Nasal polyps, nasal polypectomy, asthma, and aspirin sensitivity. J Laryngol Otol 1977; 81: 837-46.
25. Settipane GA, Klein DE, Settipane RJ. Nasal polyps. State of the art. Rhinology 1991: 11: 33-6.
26. Baumgarten C, Kunkel G, Rudolph R, Stand R D, Sperner I, Gelderblom H. Histopathological examinations of nasal polyps of different etiology. Arch Otorhinolaryngol 1980; 226: 187-97.
27. Berdal P. Serological examination of nasal polyp fluid. Acta Otolaryngol 1954 (Supplement.) 115: 1.
28. Kern RA, Schneck HP. Allergy a constant factor in the etiology of so-called mucous nasalmpolyps. J Allergy 1933; 4: 485-97.
29. Samter M, Becker EL. Ragweed reagins in nasal secretions. Proc Soc Exp Biol Med 1947; 65: 140.
30. Miller CH, Pudiak DR, Hatem F, Looney RJ. Accumulation of interferon gamma-producing TH1 helper T cells in nasal polyps. Otolaryngol Head Neck Surg 1994; 111: 51-8.
31. Terada N, Konno A, Fukuda S, Yamashita T, Abe T, Shimada H, Yoshimura K, Shirotori K, Ishikawa K, Togawa K. Interleukin-5 Upregulates Intercellular Adhesion Molecule-I Gene Expression in the Nasal Mucosa in Nasal Allergy but not in Nonallergic Rhinitis. Int Arch Allergy Immunol 1995; 106: 139-4,5.
32. Castro FFM. Rinite alérgica: modernas abordagens para uma clássica questão. São Paulo: Lemo Editorial; 1997. p.178.
33. Roitt I, Brostoff J, Male D. Immunology. 4ª ed. St. Louis: Mosby; 1996. p. 89.
34. Haraldsen G, Kuale D, Lien B, Farstad IN, Brandtzaeg P. Cytokineregulated expression of E-selectin, Intercellular Adhesion Molecule-I (ICAM-I), and Vascular Cell Adhesion Molecule-I (VCAM-I) in human intestinal microvascular endothelial cells. J Immunol 1996;156: 2558-65.
35. Petzelbauer P, Bender JR,Wilson J, Pober JS. Heterogenity of dermal microvascular endotelial cell antigen expression and cytokine responsiveness in sito and in cell culture. J Immunol 1993; 151: 5062-72.
36. Jahnsen FL, Haraldsen G, Aanesen JP, Haye R, Brandtzaeg P. Eosinophil infiltration is related to increased expression of vascular cell adhesion molecule-I in nasal polyps. Am J Respir Cell Mol Biol 1995;12: 624-32.
37. Symon F, Walsh GM, Watson SR, Wardlaw AJ. Eosinophil adhesion to nasal polyp endothelium is P-selectin-dependent. J Exp Med 1994; 180: 371-6.
38. Beck LA, Stellato C, Beall LD, Schall TJ, Leopold D, Bickel CA, Baroody F, Bochner BS, Schleimer RP. Detection of the chemokine RANTES and endothelial adhesion molecules in nasal polyps. J Allergy Clin Immunol 1996; 98: 766-80.
39. Bochner BS, Luscinskas FWJr, Gimbrone MA, Newman W Sterbinsky SA, Derse-Anthony CP, Munk D, Schleimer RP. Adhesion of human basophils, eosinophils, and neutrophils to interleukin 1-activated human vascular endothelial cells: contributions of endothelial cell adhesion molecules. J Exp Med 1991; 173: 1553-6.
40. Hamilos DL, Leung DYM, Wood R, Bean DK, Song YL, Schotman E, Hamid Q. Eosinophil infiltration in nonallergic chronic hyperplastic sinusitis with nasal polyposis (CHS/NP) is associated with endothelial VCAM-I upregulation and expression of TNF-a. Am J Respir Cell Mol Biol 1996; 15: 443-50.
41. Cordell JL, Falini B, Erber WN, Ghosh AK, Abdulaziz Z, Macdonald S, Pulford KAF, Stein H, Mason DY. Immunoenzymatic labeling of monoclonal antibodies using immune complexes of alkaline phosphatase and monoclonal anti-alkaline phosphatase (APAAP complexes). J Histochem Cytochem 1984; 32: 219-29.
42. Min Y, Lee CH, Rhee C, Kim KH, Kim CS, Koh Y, Min K, Anderson PL. Inflammatory citokine expression on nasal polyps in allergic and infectious rhinitis. Acta Otolaryngol 1997; 117: 302-6.
1 Professor Doutor da Disciplina de ORL da FMUSP.
2 Médica pós graduando do depto. de ORL da FMUSP.
3 Professor associado da Disciplina de ORL da FMUSP.
4 Professor titular da Disciplina de ORL da FMUSP.
Trabalho realizado na Disciplina de Otorrinolaringologia da FMUSP
Endereço para correspondência: Dr. Richard Louis Voegels - Rua Iubatinga, 145 ap. 61-B
São Paulo SP 05716-110 Brasil
Fax (0xx11) 3749-0719 - E-mail: voegels@attglobal.net
Artigo recebido em 13 de maio de 2002. Artigo aceito em 18 de julho de 2002.