Ano: 2001 Vol. 67 Ed. 2 - Março - Abril - (12º)
Seção: Artigos Originais
Páginas: 220 a 227
Polipose Nasal e Alergia: Existe Correlação?
Nasal Polyposis and Allergy: Is There a Correlation?
Autor(es):
Richard L. Voegels*,
Patrícia Santoro**,
Ossamu Butugan***,
Lázaro G. Formigoni****,
Aroldo Miniti*****.
Palavras-chave: polipose nasal, alergia, interleucinas 1 , 3, 4, imunoglobulinas
Keywords: polyposis, allergy, interleukins 1 , 3, 4, immunoglobulin
Resumo:
Introdução: A polipose nasal é uma doença inflamatória crônica da mucosa nasal cuja fisiopatologia é motivo de controvérsia, existindo inúmeras teorias descritas na literartura sobre o assunto. Objetivo: O objetivo deste trabalho foi o de estudar pacientes portadores de polipose nasal, dividindo-os em dois grupos: o de alérgicos e o de não alérgicos. Foram estudados os seguintes aspectos: idade, sexo e quadro clínico dos pacientes; correlação entre asma, intolerância ao ácido acetilsaliclico e polipose nasal; níveis séricos de imunoglobulinas (A, E, G e M), eosinófilos e concentração das interleucinas 1 , 3 e 4 no pólipo nasal. Forma de estudo: Clínco prospectivo. Material e método: Foram selecionados prospectivamente 39 pacientes com polipose nasal, sendo 13 considerados alérgicos e 26 não alérgicos, além de um grupo controle com 11 indivíduos. As dosagens das concentrações das interleucinas 1 , 3 e 4 ocorreram através de ELISA em macerado de pólipo nasal. Resultados: Houve maior incidência de polipose nasal após a quarta década de vida e no sexo masculino. O quadro clínico foi semelhante nos dois grupos e se caracterizou principalmente por obstrução nasal e hiposmia. Não houve correlação entre asma ou intolerância ao ácido acetilsalicllico com a presença ou não de alergia. Os niveis séricos de IgE e eosinófilos foram significativamente maiores nos pacientes alérgicos portadores de polipose nasal e apresentaram uma relação direta com as concentrações de interleucinas 3 e 4 no pólipo nasal. Não houve diferença entre o grupo de pacientes não alérgicos com polipose nasal e o grupo controle quanto aos níveis de interleucinas 3 e 4, sugerindo que estas não tenham um papel importante na fisiopatologia da polipose nasal. Conclusão: Estes dados sugerem que a polipose nasal possui um mecanismo imunológico diferente daquele envolvido nos processos alérgicos.
Abstract:
Introduction: Nasal polyposis (NP) is a chronic inflammatory disease of the nasal mucosa. The etiology and formation of NP are still not elucidated and Nave been debated for many years. Aim: The objective of the present study was to investigate the role of nasal allergy in the development of NP. The following aspects were analyzed: age, sex and patient's symptoms; correlation between asthma, aspirin intolerance and NP; serum immunoglobulin levels and eosinophilia, and concentration of interleukins 1 , 3, and 4 in NP. Study design: Clinical prospective. Material and method: Thirty nine patients with NP were selected, 13 of them allergic and 26 non- allergic. A control group of 11 individuals was also studied. The concentrations of interleukins 1 , 3, and 4 were measured by enzyme-linked immunosorbent assay (ELISA). Results: There was a higher incidence of NP after the fourth decade of life and among men. We found no correlation of asthma or aspirin intolerance with the presence or absence of allergy. Serum levels of IgE and eosinophils were significantly higher in patients with allergy and NP and the concentrations of interleukins 3, and 4 were positively correlated with NP. There was no difference in interleukin 3 and 4 concentration between the non-allergic group with NP and the control group, suggesting that these interleukins do not play. an important role in the etiology and formation of NP. Conclusion: These results suggest that the immunologic pathway involved in the etiology of NP is different from the one correlated with allergy (IgE mediated).
![]()
INTRODUÇÃO
A polipose nasal (PN) é doença inflamatória crônica da N mucosa nasal, que acomete em torno de 0,5% da população9, 43. A fisiopatologia da PN é motivo de controvérsia, existindo numerosas teorias descritas na literartura sobre a doença.
No começo deste século, Bourgeois7 publicou a teoria alérgica, segundo a qual a PN seria um processo inflamatório decorrente de algum tipo de alergia. Desde então, numerosas outras teorias têm surgido na tentativa de elucidar os mecanismos envolvidos na gênese da PN5, 12, 33, 49. Entretanto, muitos autores continuam definindo a PN como decorrente de um processo alérgico, principalmente devido à intensa eosinofilia presente no tecido dos pólipos8, 15, 19.
Nos últimos anos, com os grandes avanços atingidos pela imunologia, diversos autores vêm tentando identificar os mediadores imunológicos envolvidos na gênese da PN, para tentar elucidar sua possível origem.
Para se compreenderem o desenvolvimento da polipose nasal e os mecanismos imunológicos envolvidos na sua gênese, houve a opção pelo estudo de dois grupos de pacientes portadores de polipose nasal: o de alérgicos e o de não alérgicos e compará-los a um grupo controle. O objetivo desta pesquisa foi estudar:
- a relação entre asma, intolerância ao ácido acetilsalicílico e polipose nasal;
- os níveis séricos de imunoglobulinas (IgA, IgE, IgG e IgM) e eosinófilos;
- a concentração das interleucinas 1 , 3 e 4 no pólipo nasal.
MATERIAL E MÉTODO
Foram estudados prospectivamente 39 pacientes portadores de polipose nasal, atendidos e operados no segundo semestre de 1997 na Divisão de Clínica Otorrinolaringológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo. No grupo, 22 pacientes (56,4%) eram do sexo masculino; e 17 (43,6%), do sexo feminino. A idade média foi de 42,6 anos ± 16,9 anos (16 anos - 88 anos) (média ± desvio-padrão).
Foram utilizados, neste estudo, os seguintes critérios de inclusão e exclusão:
o Critérios de inclusão: Foram incluídos unicamente os pacientes que apresentavam diagnóstico de polipose nasal bilateral e que seriam submetidos a tratamento cirúrgico.
o Critérios de exclusão: Foram excluídos pacientes portadores de pólipo único (antrocoanal, esfenocoanal) ou de outras doenças relacionadas com a polipose nasal, como fibrose cística, discinesia ciliar primária e sinusite fúngica. Por último, foram descartados aqueles que não puderam ser classificados como alérgicos ou não alérgicos.
Os 39 pacientes assim selecionados foram divididos em dois grupos:
o grupo de alérgicos (13 pacientes):
- história típica de rinite alérgica (prurido nasal, espirros, rinorréia, obstrução nasal),
- teste cutâneo de hiper-sensibilidade positivo;
o grupo não alérgicos (26 pacientes):
- ausência de história de rinite alérgica,
- teste cutâneo de hiper-sensibilidade negativo.
Grupo controle: Foi constituído por 11 adultos voluntários, sem qualquer antecedente de sintomatologia nasal e/ou sintomas alérgicos. O exame das fossas nasais, com endoscópio rígido, acusava normalidade. Neste grupo, sete indivíduos (63,6%) eram do sexo masculino; e quatro (36,4%), do sexo feminino. A idade média foi de 29,8 ± 5,3 anos (25-42 anos) (média ± desvio padrão).
Todos os pacientes foram avaliados uma semana antes da cirurgia, sendo que foi solicitado aos pacientes que atribuíssem uma nota 1 a 10 aos seguintes sintomas: cefaléia, obstrução nasal, hiposmia, secreção purulenta, coriza e tosse. Considerou-se como sendo nota 1 o estado sem o sintoma e nota 10 com o sintoma intenso. Foi realizada também coleta de sangue para dosagem de IgA, IgG, IgM, IgE e eosinófilos, além de teste cutâneo alérgico.
A coleta de fragmentos dos pólipos nasais foi efetuada durante o ato cirúrgico com anestesia geral. Foram separados dois fragmentos do pólipo de cada paciente, e um foi submetido a coloração com hematoxilina e eosina, enquanto que o segundo foi cortado em pequenos pedaços e centrifugado por dez minutos a 3.000 rotações por minuto. O sobrenadante foi separado e guardado em freezer a -70° C, até a realização do teste por ensaio imunoenzimático (ELISA)22, 44.
A coleta de fragmentos de mucosa normal do grupo controle foi feita com pinça Grünwald. Foi retirada mucosa de concha média sob visão de endoscópio rígido de 4,0 mm a 302. A mucosa destes pacientes foi submetida ao processo descrito para os pólipos.
A determinação da concentração de interleucina-1 (IL-1 ), 3, 4 em macerado de pólipo nasal, foi efetuada por método imunoenzimático, através do uso de kit comercial disponível (R&D - Mineápolis, EUA - Lote 9716605). No grupo controle, as interleucinas 1, 3 e 4 foram dosadas em macerado de mucosa nasal normal.
Na análise dos resultados, foram estudados e relacionados os seguintes dados:
- idade e sexo dos pacientes;
- asma e intolerância ao ácido acetilsalicílico;
- quadro clínico;
- eosinófilos e imunoglobulinas séricas (IgE total, IgA, IgG e IgM);
- ELISA (interleucinas 1 , 3 e 4).TABELA 1 - Distribuição da média, desvio-padrão e amplitude da idade
dos pacientes nos grupos estudados.
Nota: dp - desvio-padrão. Não houve diferença estatisticamente significante (p < 0,05) entre os grupos alérgicos e não alérgicos. Teste estatístico utilizado: teste t de student.
TABELA 2 - Distribuição do sexo dos pacientes nos grupos estudados.
Nota: Não houve diferença estatisticamente significante (p < 0,05) entre os três grupos.
Teste estatístico utilizado: teste qui-quadrado.
TABELA 3 - Distribuição da incidência de asma nos grupos estudados.
Nota: dp - desvio padrão. Valores assinalados quando estatisticamente significantes (p < 0,05). Teste estatístico utilizado: teste qui-quadrado.
A comparação entre grupos foi realizada utilizando-se testes estatísticos paramétricos e não paramétricos, levando-se em consideração a natureza dos dados e a variabilidade das medidas efetuadas. Testes estatísticos foram utilizados, sempre com o nível de significância fixado em 5%45, 46.
RESULTADOS
A faixa etária dos pacientes variou de 16 a 88 anos (Tabela 1).
Quanto ao sexo, considerando-se todos os pacientes estudados, ocorreu um discreto predomínio da incidência de PN nos do sexo masculino (Tabela 2).
Observou-se incidência significantemente maior (p < 0,001) de asma entre os pacientes alérgicos (Tabela 3). Dos 15 pacientes portadores de asma, 11 (73,3%) tinham mais de 30 anos de idade, sendo que a idade média do aparecimento de asma foi de 34,6 anos.
Com base na história clínica, diagnosticou-se intolerância ao AAS em quatro pacientes, sendo dois de cada grupo (alérgico e não alérgico). Não houve, portanto, diferença significante na incidência de intolerância ao AAS entre os dois grupos.
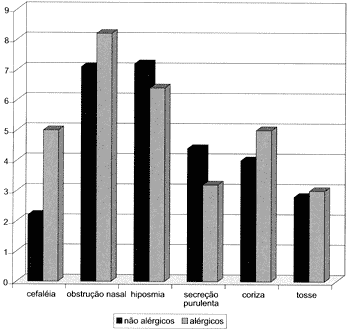
Quando se compararam as médias aritméticas dos escores do quadro clínico dos grupos alérgicos e não alérgicos, observou-se que não houve diferença significante entre os grupos para qualquer dos sintomas (Gráfico 1).
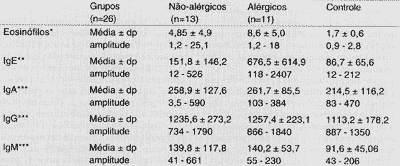
Os níveis séricos de eosinófilos e imunoglobulinas estão representados na Tabela 4. Não houve diferença significante entre os três grupos para IgA, IgG e IgM. Contudo, para os parâmetros eosinófilos e IgE, o grupo de pacientes alérgicos apresentou níveis significativamente maiores (p < 0,001) em relação aos outros. grupos.
As concentrações de IL-1 encontradas em secreção nasal foram bem maiores nos pacientes portadores de PN (alérgicos e não alérgicos), quando em comparação com o grupo controle. No entanto, essa diferença não atingiu significância estatística (Tabela 5).
Gráfico 1. Avaliação do quadro clínico pelos pacientes. Nota: Não houve diferença estatisticamente significante (p < 0,05) entre os grupos alérgicos e não alérgicos. Teste estatístico utilizado: teste de Mann Whitney.
Com relação às interleucinas 3 e 4, os resultados revelaram-se similares entre si. Foi possível observar que o grupo de pacientes alérgicos apresentou níveis significativamente maiores dessas interleucinas, enquanto que entre os outros dois grupos (controle e o de não alérgicos) não houve diferença relevante.
O exame histológico através da coloração com hematoxilina e eosina evidenciou intenso infiltrado eosinofílico em 37 (94,8%) dos 39 pacientes portadores de PN estudados. Em dois destes, não foi visualizada eosinofilia tecidual importante, sendo que ambos pertenciam ao grupo de não alérgicos.
DISCUSSÃO
A exata fisiopatologia da PN ainda é desconhecida5, 6, 11, 12, 13, 14, 22, 34, 49, 50. Existe nos pacientes portadores um complexo e intenso infiltrado inflamatório, com a presença de numerosos mediadores químicos19, 35.
Entre os pacientes portadores de PN houve um predomínio de indivíduos com mais de 30 anos, representando quase 75% (29/39) do total. Tais dados corroboram aqueles referidos na literatura. Settipane e Chafee41, em revisão de 149 casos, encontraram 122 (82%) com mais de 30 anos. Informações semelhantes são relatadas por Jamal; Marant20 e Granström e colaboradores15, sugerindo a alta prevalência dessa doença a partir da terceira década de vida.TABELA 4 - Concentração sérica de eosinófilos e imunoglubulinas E, A, G e M encontrados nos grupos estudados.
NOTA: dp - desvio padrão.
* valores em percentagem (%) do total de leucócitos.
** valores expressos em unidades internacionais/ mililitro (UI/mL).
*** valores expressos em miligrama/ decilitro (mg/dL).
Valores assinalados quando estatisticamente significantes (p< 0,05).
Testes estatísticos utilizados: teste de Kruskal - Wallis (eosinófilos e IGE).
Análise de variância (IgA, IgG e IgM).
TABELA 5 - Concentração das cítocinas IL-1 , 3 e 4 encontradas nos grupos estudados (valores em picograma/mililitro).
NOTA: dp - desvio-padrão. Valores assinalados quando estatisticamente significantes (p< 0,05). Testes estatísticos utilizados: teste de Kruskal - Wallis (IL-1 . Análise de variância (IL-3).
Não encontramos diferença significante entre a idade dos pacientes nos dois grupos estudados, alérgicos e não alérgicos. Enquanto que a idade média no primeiro grupo de alérgicos foi de 37,3 anos, no segundo foi de 45,3 anos.
É interessante notar que, assim como na literatura, encontramos pouquíssimos casos nas duas primeiras décadas de vida, sugerindo que, com exceção dos portadores de fibrose cística, a PN raramente acomete pessoas nessa faixa etária.
Do total de 39 pacientes portadores de PN, 22 (56,4%) eram do sexo masculino. Esses dados confirmam os observados na literatura, com predomínio do sexo masculino15, 20 ,29.
Os pacientes portadores de PN freqüentemente cursam com sinusite crônica associada, sendo seu quadro clínico normalmente caracterizado por cefaléia, obstrução nasal, hiposmia, secreção purulenta, coriza e tosse.
Embora alguns autores sugiram que a presença de alergia associada à PN poderia exacerbar a sintomatologia desses pacientes42, em nossa casuística não observamos diferença significativa entre os dois grupos (alérgicos e não alérgicos) em relação ao quadro clínico. Em ambos, os principais sintomas foram obstrução nasal e hiposmia. O grupo de pacientes alérgicos apresentou escores piores para cefaléia, obstrução nasal, coriza e tosse. Entretanto, não houve variação estatisticamente significante para qualquer dos sintomas.
O papel da atopia na fisiopatologia da PN é motivo de controvérsia há muitos anos. Vários autores acreditam que a alergia tem um papel importante na formação dos pólipos3, 4, 8, 15, 19, 24, 39. Contudo, estudos recentes com citocinas têm sugerido o contário27, 44, 48. Considerando tal polêmica, dividimos nossos pacientes em dois grupos, o de alérgicos e o de não alérgicos. Os alérgicos perfizeram 33,3% do total de pacientes com PN, o que corresponderia à incidência de atopia na população geral de um grande centro urbano como São Paulo10.
Settipane e colaboradores42 ressaltam que, apesar de a polipose nasal não ser mais freqüente em pacientes atópicos, quando essas patologias coexistem ocorre uma exacerbação da PN.
A associação de asma e PN já é reconhecida há muitos anos29, 38, 41.
A incidência de PN na população em geral parece ser de 0,2% a 1,0%43. Estudos em cadáveres demonstram uma incidência de PN de até 42%24. Por outro lado, a incidência de asma na população como um todo em geral gira em torno de 0,5%43.
Em nossa casuística, encontramos 38,4% (15/39) de asmáticos, o que estaria de acordo com a literatura. Quando comparados os dois grupos de pacientes, a incidência de asma foi bem maior no grupo de pacientes alérgicos: 61,5% (8/13) contra 24,1% (7/29) no grupo dos não alérgicos. Essa discrepância foi significativa (p<0,001) entre os dois grupos, sendo, portanto, a asma muito mais comum entre os pacientes alérgicos. Tal dado sugere que a presença de alergia nos pacientes portadores de PN pode facilitar o aparecimento de asma.
Em vários estudos, ressalta-se que o surgimento de asma se dá principalmente a partir da terceira década de vida24, 29, 36, com média de manifestação aos 35 anos. No nosso estudo também houve uma incidência maior da doença a partir da terceira década de vida. Dos 15 pacientes portadores de asma, 11 (73,3%) tinham mais de 30 anos, sendo que a idade média do aparecimento da moléstia foi de 34,6 anos.
A ocorrência de intolerância ao AAS em indivíduos com PN varia de 3% a 26%, dependendo do estudo15, 21, 24, 29. Entre os nossos pacientes, 11,1% (4/36) manifestaram intolerância ao AAS, o que é compatível com os índices encontrados na literatura. Curiosamente, todos eles também apresentavam quadro asmático importante concomitante, formando a tríade clássica descrita por Widal e colaboradores51.
Na literatura não encontramos estudo correlacionando concentrações de imunoglobulinas A, G, M (sérica e/ou tecidual) e a presença ou não de PN. Nos nossos pacientes os resultados obtidos foram parecidos nos três grupos, não havendo diferença significativa entre eles. Tais dados sugerem que essas imunoglobulinas não devem possuir um papel expressivo na fisiopatologia da PN.
A interleucina 1 já foi denominada de pirógeno endógeno, fator ativador de linfócitos e catabolina. Ela é produzida por diversas células, tais como: as endoteliais, os linfócitos B, os fibroblastos e os macrófagos. Uma de suas principais funções é estimular linfócitos B e T a induzir a reação inflamatória. Outras funções da IL-1 incluem indução à febre por estímulo no SNC e estimulação para liberação de corticóide nas glândulas supra-renais. Praticamente, todas as células do organismo respondem ao estímulo da IL-1, através de receptores específicos na membrana celular. Portanto a IL-1 é uma citocina inespecífica, presente em grande quantidade sempre que existe um processo inflamatório importante37.
Em nosso estudo, decidimos dosar a fração- da IL-1, que corresponde à fração ativa dessa citocina. A presença de IL-1 em tecido de pólipo nasal foi demonstrada por Hamaguchi e colaboradores16 e Mullol e colaboradores30. Contudo, esses autores não apresentam um grupo controle, para que possamos comparar os resultados, o que impede que afirmemos se os níveis de IL-1 por eles encontrados eram ou não significativos.
Durante nossa pesquisa, observamos níveis de IL- bem mais elevados nos pacientes com PN (alérgicos e não-alérgicos) quando comparados com os do grupo controle, sugerindo que a presença de IL-1 estaria relacionada com o processo inflamatório crônico presente no tecido com PN, não havendo relação com a ocorrência ou não de alergia. Contudo, essa diferença entre o grupo controle e os outros dois não atingiu níveis estatisticamente significativos, impedindo que pudéssemos tirar conclusões respeitantes a essa diversidade.
A interleucina 3, conhecida como hemopoietina multiespecífica, estimula o crescimento dos precursores de todas linhagens hemopoiéticas e é produzida principalmente pelos linfócitos T37.
A IL-3 desempenha importante papel na migração e ativação de eosinófilos nos processos alérgicos26. Sua ação específica na PN, em especial sobre os eosinófilos presentes nessa patologia, ainda é motivo de controvérsia.
Hamilos e colaboradores18 demonstram, através de hibridização in sito com mRNA, que em tecido de pólipo nasal existiria uma intensa eosinofilia e que esses eosinófilos seriam intensamente positivos para IL-3 mRNA. Allen e colaboradores1, usando imuno-histoquímica, chegam a resultados semelhantes. Esses autores sugerem ainda que neste tecido a IL-3 seria produzida pelos próprios eosinófilos.
Em contrapartida, Bachert e colaboradores2, analisando pólipos de 23 pacientes através de ELISA, não observam níveis significativamente elevados de IL-3 nesses tecidos.
Em nossa casuística, encontramos níveis de IL-3 significativamente elevados apenas no grupo de pacientes alérgicos (p< 0,001). O grupo de pacientes não alérgicos apresentou valores de IL-3 mais elevados, quando comparado com o grupo controle, contudo esta diferença não foi significante, o que estaria de acordo com os resultados obtidos por Bachert e colaboradores2. Tais resultados sugerem que a IL-3 possuiria um papel importante na fisiopatologia da alergia, não estando, contudo, envolvida na fisiopatologia da PN.
Os autores que encontraram aumento da expressão de IL-3 nos pacientes com PN não definem se os mesmos são ou não portadores de alergia1, 18. Assim, é possível que os valores elevados de IL-3 verificados por esses autores sejam decorrentes do fator alergia entre os indivíduos estudados.
A interleucina 4 era conhecida como fator ativador de linfócitos B. Sua principal característica é a indução e ativação de linfócitos B para a produção de IgE.37 Outra ação importante da IL-4 é levar à transformação de linfócitos T HELPER (Th) em linfócitos T HELPER 2 (Th2). O aumento da produção de IL-4 é característico das reações alérgicas.31, 40, causando elevada concentração de IgE47.
Não existe um consenso quanto à presença e o papel da IL-4 na PN. Enquanto que estudos de Nonaka e colaboradores32 e Min e colaboradores28 sugerem que a IL-4 estaria aumentada no tecido de pólipos nasais, outros autores17, 27 não encontram aumento de IL-4 em tecido de pólipo nasal em pacientes não alérgicos. É importante ressaltar que no estudo de Nonaka e colaboradores3z não há diferenciação entre pacientes alérgicos e não alérgicos, podendo estar a IL-4 aumentada devido à presença de pacientes alérgicos no grupo. Na pesquisa de Min e colaboradores32, apesar de ter sido encontrada IL-4 aumentada no tecido de PN de pacientes não alérgicos, os autores sugerem que o mecanismo que levaria a esse crescimento seria diferente daquele típico da hipersensibilidade tipo I.
Em nossa casuística, não houve variação estatisticamente significativa nos valores de IL-4 encontrados no tecido normal de mucosa nasal do grupo controle e no tecido de pólipo nasal dos pacientes não alérgicos, uma vez que todas as dosagens realizadas em ambos os grupos foram negativas. Por outro lado, quando comparados os valores de IL-4 encontrados no tecido de pólipo nasal de pacientes alérgicos com os dos não alérgicos, observamos uma diferença significante (p<0,001), sendo que apenas uma dosagem de IL-4 no grupo de pacientes alérgicos foi negativa.
Existe ainda uma forte relação entre esses dados e o nível sérico de IgE. Enquanto que não houve desigualdade relevante no nível sérico de IgE entre o grupo controle e o de pacientes não alérgicos, o nível sérico de IgE encontrado nos pacientes alérgicos foi significantemente maior quando comparado com o do grupo controle (p<0,001) e com o dos pacientes não alérgicos (p<0,001). É interessante observar que o único paciente alérgico que obteve níveis normais de IgE foi exatamente aquele no qual a dosagem de IL-4 foi negativa.
Nossos resultados sugerem uma forte associação da IL-4 com a presença de alergia e altos níveis séricos de IgE e, provavelmente, que o papel da IL-4 na eosinofilia encontrado na PN não deve ser importante.
Desta forma, analisando os fatores estudados, podemos observar que não houve relação entre asma ou intolerância ao ácido acetilsalicílico, com a presença ou não de alergia. Os níveis séricos de IgE e eosinófilos foram significativamente maiores nos alérgicos portadores de polipose nasal e apresentaram relação direta com as concentrações de interleucinas 3 e 4 no pólipo nasal. Não houve diferença entre o grupo de não alérgicos com polipose nasal e o grupo controle quanto aos níveis de interleucinas 3 e 4, sugerindo que essas interleucinas não tenham um papel importante na fisiopatologia da polipose nasal. Estes dados sugerem que a polipose nasal possui um mecanismo imunológico diferente daquele envolvido nos processos alérgicos.
CONCLUSÕES
1.) - A presença ou não de alergia nos pacientes portadores de polipose nasal não se relacionou com a presença de asma ou intolerância ao ácido acetilsalicílico.
2.) - Os níveis séricos de IgA, IgG e IgM mostraram-se iguais em todos os grupos, independentemente da presença ou não de polipose nasal.
3.) - Os níveis séricos de IgE e eosinófilos relacionaram-se com a presença de polipose nasal e alergia.
4.) - As concentrações das interleucinas 3 e 4 apresentaram relação direta com a presença de polipose nasal e alergia.
REFERÊNCIAS BIBLIOGRÁFICAS
1. ALLEN, J.S.; EISMA, R.; LEONARD, G.; KREUTZER, D. Interleukin-3, Interleukin-5, and granulocyte-macrophage colony-stimulating factor expression, in nasal polyps. Am. J. Otolaryngol., 18, 239-46, 1997.
2. BACHERT, K.; WAGENMANN, M.; HAUSER, U.; RUDACK, C. IL-5 synthesis is upregulated in human nasal polyp tissue. J Allergy Clin. Immunol., 99, 837-42, 1997.
3. BAUMGARTEN, C.; KUNKEL, G.; RUDOLPH, R.; STAND, R. D.; SPERNER, L; GELDERBLOM, H. Histopathological examinations of nasal polyps of different etiology. Arch. Otorhinolaryngol., 226, 187-97, 1980.
4. BERDAL, P. Serological examination of nasal polyp fluid. Acta Otolaryngol. (Supplement.), 115, 1, 1954.
5. BERNSTEIN, J. M.; GORFIEN, J.; NOBLE, B.; YANKASKAS, J.0R. Nasal polyposis: Immunohistochemistry and bioelectrical findings (a hypothesis for the development of nasal polyps). J. Allergy Clin. Immunol., 99, 165-75, 1997.
6. BILLROTH, R. Uber den Bau der Schleimpolyppen. Vienna, Georg Reimer, 1885, 1-32.
7. BOURGEOIS, H. A propos d"un cas de coryza spasmodique. Progr. Med., 95-6, 1925.
8. CALENOFF, E.; GUILFORD, T.; GREEN, J.; ENGELHARD, C. S. Bacteria-specific IgE in patients with nasal polyposis. Arch. Otolaryngol., 109, 372-5, 1983.
9. CAPLIN, I.; HAYNES, J. T.; SPAHN, J. Are nasal polyps an alergic phenomenon? Ann. Allergy, 29, 631-4, 1971.
10. CASTRO, F.F.M. Rinite alérgica: modernas abordagens para uma clássica questão. São Paulo, Lemo Editorial, 1997, 178.
11. CAUNA, N.; MANZETTI, G. W.; HINDERER, K. H.; SWANSON, E. W. Fine structure of nasal polyps. Ann. Otol., 81, 41-58, 1972.
12. DAVISON, F. W. Hiperplastic sinusitis, a five year study. Ann. Otol., 72, 462-74, 1963.
13. DOLOWITZ, D. A.; DOUGHERTY, T. F. A study of cilia and conective tissue in normal and hiperplastic nasal mucous membrane. Laryngoscope, 76, 555-59, 1966.
14. DRAKE-LEE, A. Nasal polyps in identical twins. J. Laryngol. Otol., 106, 1084-5, 1992.
15. GRANSMM, G.; JACOBSSON, E. JEPPSSON, P. H. Influence of allergy, asthma and hypertension on nasal polyposis. Acta Otolaryngol., 492, 22-7, 1992.
16. HAMAGUCHI, Y.; SUZUMURA, H.; ARIMA, S.; SAKAKURA, Y. Quantitation and immunocytological identification of interleukin-1 in nasal polyps from patients with chronic sinusitis. Int. Arch. Allergy Immunol., 104, 155-9, 1994.
17. HAMILOS, D.L.; LEUNG, D.Y.M.; WOOD, R.; CUNNINGHAM, L.; BEAN, D.K.; YASRUEL, Z.; SCHOTMAN, E.; HAMID, Q. Evidence for distinct cytokine expression in allergic versus nonallergic chronic sinusitis. J. Allergy Clin. Immunol., 96, 53744, 1995.
18. HAMILOS, D.L.; LEUNG, D.Y.M.; WOOD, R.; MEYERS, A.; STEPHENS, J.K.; BARKANS, J.; MENG, Q.; CUNNINGHAM, L.; BEAN, D.K.; KAY, A.B.; HAMID, Q. Chronic hyperplastic sinusitis: association of tissue eosinophilia with mRNA expression of granulocyte-macrophage colony-stimulating factor and interleukin-3. J. Allergy Clin. Immunol., 92, 39-48, 1993.
19. JACOBS, R. L.; FREDA, E. J.; CULVER, W. G. Primary nasal polyposis. Ann. Allergy, 51, 500-5, 1983.
20. JAMAL, A.; MARANT, A. G. D. Atopy and nasal polyposis. J. Laryngol. Otol., 101, 355-8, 1987.
21. JANTTI-ALANKO, S.; HOLOPAINEN, E.; MALMBERG, H. Recurrence of nasal polyps after surgical treatment. Rhinology (Supplement.), 8, 59-64, 1989.
22. JENKINS, J. L. Blockade theory of polyp formation. Laryngoscope, 42, 703-4, 1932.
23. KERN, R. A.; SCHNECK, H. P. Allergy a constant factor in the etiology of so-called mucous nasal polyps. J. Allergy, 485- 97, 1933.
24. LARSEN, K.; TOS, M. Clinical course of patients with primary nasal polyps. Acta Otolaryngol (Stockh) Supplement., 114, 1994, 556-9.
25. LARSEN, P.L.; TOS, M. Anatomic side of origin of nasal polyps: endoscopic nasal sinus surgery as a screening method for nasal polyps in an autopsy material. Am. J. Rhinol., 10, 2116, 1996.
26. LIU, C.M.; SHUN, C.T.; CHENG, Y.K. Soluble adhesion molecules and cytokines in perennial allergic rhinitis. Ann. Allergy Asthma Immunol., 81, 176-80, 1998.
27. MILLER, C.H.; PUDIAK, D.R.; HATEM, F.; LOONEY, R J. Accumulation of interferon gamma-producing THl helper T cells in nasal polyps. Otolaryngol. Head Neck Surg., 111, 51-8, 1994.
28. MIN, Y; LEE, C.H.; RHEE, C.; KIM, K.H.; KIM, C.S.; KOH, Y.; MIN, K.; ANDERSON, P.L. Inflammatory citokine expression on nasal polyps in allergic and infectious rhinitis. Acta Otolaryngol., 117, 302-6, 1997.
29. MOLONEY, J. R. Nasal polyps, nasal polypectomy, asthma, and aspirin sensitivity. J Laryngol. Otol., 81, 837-46, 1977.
30. MULLOL, J.; XAUBET, A.; GAYA, A.; ROCA-FERRER, J.; LÓPEZ, E.; FERNANDEZ, J.C.; FERNANDEZ, M.D.; PICADO, C. Cytokine gene expression and release from epithelial cells. A comparison study between healthy nasal mucosa and nasal polyps. Clinical Exp. Allergy, 5, 1994, 607-15.
31. NACLERIO, R.M. Pathophysiology of perennial allergic rhinitis. Allergy (Supplement.), 52, 7-13, 1997.
32. NONAKA, M.; NONAKA, R.; WOOLLEY, K.; ADELROTH, E.; MIURA, K.; OKHAWARA, Y.; GLIBETIC, M.; NAKANO, K.; O'BYRNE, P.; DOLOVICH, J.; JORDANA, M. Distinct immunohistochemical localization of IL-4 in human inflamed airway tissues. J. Immunol., 155, 3234-44, 1995.
33. NORLANDER, T.; FUKAMI, M.; WESTRIN, K. M.; STIERNA, P.; CARLSÖÖ, B. Formation of mucosal polyps in the nasal and maxilary sinus cavities by infection. Head Neck Surg., 109, 52z9, 1995.
34. OHNO, I.; LEA, R.; FINOTTO, S.; MARSHALL, J.; DENBURG, J.; DOLOVICH, J.; GAULDIE, J.; JORDANA, M. Granulocyte/ Macrophage Colony-stimulating Factor (GM-CSF) Gene Expression by Eosinophils in Nasal Polyposis. Am. J Respir. Cell Mol. Biol., 1991, 505-10.
35. OPPENHEIMER, E. H.; ROSENSTEIN, B. J. Differencial pathology of nasal polyps in cystic fibrosis and atopy. Lab. Invest., 1979, 445-9.
36. PEARSON, B. R. S. Hipersensitivity to aspirin. In: DIXON, A.; MARTIN, K. B., ed. Salicylates. London, J&A. Churchill, 1963, 170.
37. ROITT, I.; BROSTOFF, J.; MALE, D. Immunology. 4.ed. Mosby, (St. Louis), 1996, 89.
38. SAMTER, M.; BEERS, R. F. Concerning the nature of intolerance to aspirin. J. Allergy, 40, 281-93, 1967.
39. SAMTER, M.;BECKER, E.L. Ragweed reagins in nasal secretions. Proc. Soc. Exp. Biol. Med., 65, 140, 1947.
40. SCHLEIMER, R.P.; STERBINSKY, S.A.; KAISER, J.; BICKEL, C.; KLUNK, D.; TOMIOKA, K.; NEWMAN, W.; LUSCINSKAS, F.W.; GIMBRONE, M.AJR.; McINTYRE, B.W.; BOCHNER, B.S. IL-4 induces adherence of human eosinophils and basophils but not neutrophils, to endothelium. J. Immunol., 148, 1086-92, 1992.
41. SETTIPANE, G. A.; CHAFEE, F. H. Nasal polyps in asthma and rhinitis. J Allergy Clin. Immunol. , 59, 17-21, 1977.
42. SETTIPANE, G. A.; KLEIN, D. E.; SETTIPANE, R. J. Nasal polyps. State of the art. Rhinology, 11, 33-6, 1991.
43. SETTIPANE, G.A.; LUND, V J.; BERSTEIN, J.M.; TOS, M. Nasal polyps: epidemiology, pathogenesis and treatment. Rhode Island, Oceanside Publications, 1997, 97.
44. SIMON, H-U.; YOUSEFI, S.; SCHRANZ, C.; SCHAPOWAL, A.; BACHERT, C.; BLASER, K. Direct demonstration of delayed eosinophil apotosis as a mechanism causing tissue eosinophilia. J. Immunol., 158, 3902-8, 1997.
45. SNEDECOR, W.; COCHRAN, G. Statistical methods: the comparison of two samples; analysis of frequencies in one-way and two-way classifications. Ames, The Iowa State University Press, 1982, 83-106.
46. SOKAL, R.; ROHLF, F. Biometry: the principles and practice of statistics in biological research: Estimation and hypothesis testing. San Francisco, W.H. Freeman and Co., 1969, 127-174.
47. TEPPER, R.I.; LEVINSON, D.A.; STANGER, B.Z.; CAMPOSTORRES, J.; ABBAS, A.K.; LEDER, P. IL-4 Induces Allergic-like Inflamatory Disease and Alters T Cell Developmente in Transgenic Mice. Cell, 62, 457-67, 1990.
48. TERADA, N.; KONNO, A.; FUKUDA, S.; YAMASHITA, T.; ABE, T.; SHIMADA, H.; YOSHIMURA, K.; SHIROTORI, K.; ISHIKAWA, K.; TOGAWA, K: Interleukin-5 Upregulates Intercellular Adhesion Molecule-I Gene Expression in the Nasal Mucosa in Nasal Allergy but not in Nonallergic Rhinitis. Int. Arch. Allergy Immunol., 106, 139-45, 1995.
49. TOS, M. The pathogenetic theories in formation of nasal polyps. Am. J Rhinol., 4, 51-56, 1990.
50. WEILLE, F. L. Further experiments in the vital theory of nasal polyp etiology. Ann. Allergy, 24, 549-51, 1966.
51. WIDAL, M.F.; ABRAMI, P.; LERMOYEZ, J. Anaphylaxie et idiosyndraise. Press Med., 30, 189, 1922.
* Diretor de Rinologia do Departamento de ORL do HCFMUSP e Doutor pela Disciplina de ORL da FMUSP.
** Médica Pós-Graduando do Departamento de ORL da FMUSP.
*** Professor Associado da Disciplina de ORL da FMUSP.
**** Professor da Disciplina de ORL da FMUSP.
***** Professor Titular da Disciplina de ORL da FMUSP.
Trabalho realizado no Departamento de Oftalmologia e Otorrinolaringologia da FMUSP, apresentado no Congresso Triológico de ORL, realizado em São Paulo, em novembro de 1999, tendo recebido o prêmio "Ermírio de Lima", como melhor trabalho na área de Rinologia.
Endereço para correspondência: Dr. Richard Louis Voegels - Rua Iubatinga, 145 apto. 61-B - 05716-110 São Paulo/SP - Brasil - Fax: (0xx11) 3749-1029.
E-mail: voegels@attglobal.net
Artigo recebido em 20 de outubro de 2000. Artigo aceito em 7 de dezembro de 2000.