Ano: 1999 Vol. 65 Ed. 3 - Maio - Junho - (1º)
Seção: Artigos Originais
Páginas: 198 a 203
Comportamento Histológico da Cartilagem de Orelha de Coelhos em Dobrados Forçada.
Histological Behavior of the Ear Cartilage of Rabbits
Autor(es):
Fernando de A. Quintanilha Ribeiro*,
Celina Siqueira Barbosa Pereira**,
Carmem Lúcia Penteado Lancellotti***,
Flávia Coelho****.
Palavras-chave: orelha, coelho, histologia, cartilagem, ossificação
Keywords: ear, rabbits, histology, cartilage, ossification
Resumo:
Foram estudadas de forma macroscópica e histologicamente 16 orelhas de oito coelhos quanto ao comportamento cicatricial na presença de dobradura forçada por ponto com mononáilon. Os pontos foram retirados nos prazos de 1, 4, 12 e 24 semanas e, após um mês da retirada, as orelhas foram reavaliadas quanto à persistência da dobradura. Após o sacrifício dos animais estudou-se histologicamente a cicatrização que ocorreu nestas áreas e observou-se neoformação cartilaginosa e ossificação.
Abstract:
The healing of 16 ears of 8 adult rabbits was studied after an artificial fold was made by means of a single mononylon suture. The suture were removed at 1, 4,12 and 24 weeks. One month after removal the ears were re-evaluated regarding the persistence of the fold. The animais were sacrificed and their ears were studied histologically. The authors found ossification and new cartilage formation at the site of suture.
![]()
INTRODUÇÃO
Em várias técnicas cirúrgicas dentro da otorrinolaringologia, lida o cirurgião com tecido cartilaginoso, principalmente nas rino-septoplastias, otoplastias e cirurgias laríngeas. Estão, portanto, os otorrinolaringologistas, assim como os cirurgiões plásticos, acostumados a manipular a cartilagem; porém, sem um conhecimento profundo quanto ao seu comportamentoeicatricial, quando esta é seccionada, suturada ou transplantada. A cartilagem se regenera pobremente e nunca se observam mitoses em suas células. Uma lesão articular por artrite degenerativa, por exemplo, mostra ninhos de células regenerativas, mas de forma não coordenada9.10. O que nos levou a este trabalho foi a dúvida quanto ao comportamento da cartilagem auricular quando suturada em posição forçada para a correção da anti-helix, nas otoplastias, procedimento este feito -com fio mononãilon incolor, com ponto dado pelo subcutâneo e que deveria permanecer para sempre contendo a cartilagem numa posição forçada a que não estava acostumada14,11,16. Se este ponto, por algum acidente, viesse a se soltar, ficaria a cartilagem fixa na nova postura, ou sua "memória histológica" a faria reverter à posição original? Se realmente a cicatrização desta cartilagem a mantivesse em uma nova e definitiva posição, tal fato poderia nos ajudar, não só nas otoplastias, mas também nas cirurgias nasais, como septoplastias para correção de pequenos desvios, nas rinoplastias (cirurgia da ponta nasal, correções da válvula ou uso de implantes de dorso) e numa série de outras intervenções na área da rinologia, otologia e laringologia3,21
MATERIAL E MÉTODO
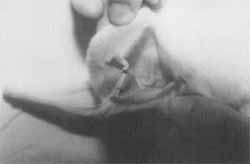
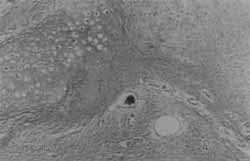
Foram utilizados oito coelhos adultos jovens, brancos, da raça Nova Zelândia, do biotério da Santa Casa de Misericórdia de São Paulo. Separados em quatro pares foram numerados de 1 a 8 e suas orelhas definidas em direita (D) e esquerda (E). Sob anestesia geral, com tilétamina- zolazepan (Zoletil ®) 0,3 ml/ Kg e fentanil-droperidol (Inoval ® )0,4 ml/Kg Im, associadas na mesma seringa, foram anestesiados num mesmo dia.Todas as 16 orelhas foram suturadas com fio mononãilon 4.0 preto, com dois pontos paralelos transfixantes englobando a pele da face posterior da orelha, a cartilagem e a pele da face anterior. Estes pontos criaram na orelha uma dobradura, conforme mostra a Figura 1. A localização dos pontos foi definida no local onde a cartilagem possui a textura mais semelhante à da orelha humana. Os coelhos foram mantidos em gaiolas individuais e submetidos ao mesmo tipo de dieta balanceada.
Os pontos foram retirados de cada dupla de coelhos (quatro orelhas por vez), após períodos de 1, 4,12 e 24 semanas. Depois de serem retirados os pontos, cada coelho foi reavaliado novamente após 4 semanas, para observar-se macroscopicamente se a dobradura persistia ou não. Nestas oportunidades, foram sacrificados: com injeção de acepromazina (1 mg/Kg IM), como medicação pré-anestésica; e, após 10 minutos foi administrado o tiopental sõdico em super-dosagem (30 mg/Kg) intracardíaco. A região onde foram dados os pontos foi seccionada com tesoura, para exame histológico. Uma região não manipulada da orelha de um dos coelhos também foi seccionada, para servir de comparação e padrão de normalidade. Os cortes histológicos foram corados com hematoxilina-eosina, tricrômico de masson azul e verde, e observados nos aumentos de 2,5 e 10 vezes.
RESULTADOS
Quanto ao exame macroscópico - Avaliamos a persistêncía ou não da dobradura, após 4 semanas da retirada dos pontos, onde a intensidade da dobradura é medida de (-) ausente, até (++++) intensa.
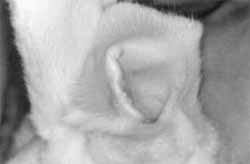
Nota-se que os coelhos de número 1 e 2, cujos pontos só ficaram 1 semana, após observados por 4 semanas, não apresentavam macroscopicamente qualquer dobradura. Os de número 3 e 4 (4 semanas), após 4 semanas da retirada dos pontos, já as apresentavam discretamente, 1; e estas apresentavam - se bem definidas naqueles cujos pontos ficaram 12 ou 24 semanas (Figura 2). No coelho de número 8, a observação foi prejudicada, pois o mesmo apresentou uma erisipela na região, por trauma com as unhas. Observou-se, portanto, que os pontos que permaneceram 12 semanas ou mais tenderam a manter definitivas as respectivas dobraduras, quando observados macroscopicamente após 4 semanas.
Quanto Ao Exame Histológico
Os 16 cortes foram observados à microscopia óptica, onde, nos cortes das orelhas dos animais com menor tempo de experimento, notou-se uma predominância nítida de resposta celular inflamatória, possivelmente pelo trauma causado pelo próprio ponto; mas, desde os primeiros animais; já se observou proliferação de cartilagem e osteogênese no nível da dobradura. Em contrapartida, nos animais de tempo de experimento mais longo, predominou nitidamente a proliferação da cartilagem, com transformação osteogênica exuberante formando verdadeira capa óssea sobre a cartilagem, com expansão centrífuga à dobradura; quanto à resposta celular inflamatória nestes últimos, foi bem discreta; e, quando apareceu, estava relacionada a traumatismo externo provocado pelo próprio animal (ungueal) não tendo interferência na ossificação.
Figura 1. Orelha de coelho com dois pontos paralelos, que lhe conferem um dobradura.
Figura 2. Orelha D do coelho 7, onde se nota uma dobradura bem configurada após 1 mês da retirada dos pontos.
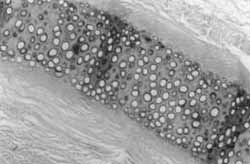
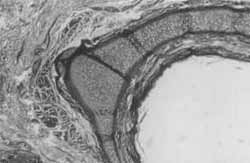
Figura 3. Padrão normal. Notar a cartilagem circundada por tecido intersticial frouxo (HE,IOX),
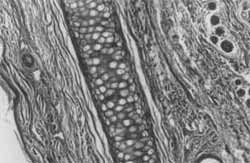
Figura 4. Coelho 4 (4 semanas). Cartilagem neoformada, irregular, envolta por proliferação fibrosa com vasos neoformados e ossificação (HE, 10X).
Tem-se portanto a impressão, ao estudar todas as lãminas, que primeiramente ocorre um desarranjo na estrutura da cartilagem, pelo trauma da dobradura, acompanhado de processo inflamatório inespecífico e reorganização cicatricial, através de neoformação de cartilagem que primeiramente se calcifica e depois inicia um processo de osteogênese. Estas características cicatriciais se firmaram e notamos, com o passar do tempo, uma reorganização da cartilagem, recoberta por exuberante ossificação que se expande a partir da região do ponto e que mantém a nova posição assumida pela cartilagem. Para melhor demonstrar este fato, escolhemos 10 fotos e as colocamos de modo a se observar comparativamente o que ocorre.
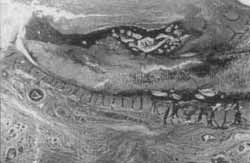
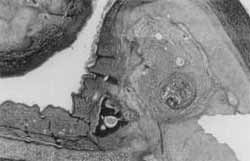
Comparando-se as Figuras 3 e 4 (hemaiozilina - eosina 10 x), a primeira nos mostra tecido cartilaginoso normal; e a segunda (corte de orelha do coelho 4 - 4 semanas), o processo cicatricial que ocorreu, desestruturando a cartilagem, que é envolta por tecido fibroso, cote vasos neoformados e presença de ossificação. Este processo é melhor visualizado se observarmos as Figuras 5 e 6 (tricrômico de masson verde, 10x), comparando-se um corte normal com a cicatrização da orelha do coelho 8 (24 semanas). Este coelho, de número 8, teve prejudicada sua avaliação macroscópica devido a uma erisipela, mas não houve comprometimento de sua avaliação histológica. Em um aumento menor (2,5 x - tricrômico de masson verde), a Figura 7 nos mostra um corte normal, onde se observa um espaçamento da cartilagem, devido a um reforço normal desta para a sustentação da orelha dó coelho. Já a Figura 8 (coelho 8 - 24 semanas) nos mostra cartilagem neoformada em continuidade com cartilagem normal, tecido fibroso e grande capa de ossificação (em escuro) envolvendo a cartilagem reestruturada. Nas Figuras 9 e 10, comparamos com colorações diferentes o que está ocorrendo na cicatrização da orelha dos coelhos 1 e 2 (1 semana), onde se nota desarranjo da cartilagem, proliferação conjuntiva fibrosa e início de calcificação, mas aincla sem processo de osteogênese. Nas Figuras 11 e 12, (tricrômico de masson azul e HE), respectivamente, com cortes dos coelhos 5 (12 semanas) e 7 (24 semanas), notamos a presença de grande capa de ossificação centrífuga à região do ponto, sobre cartilagem neoformada, com tecido inflamatório discreto. No corte da Figura 11, notamos também um granuloma de corpo estranho causado provavelmente pela inserção de pele durante a feitura do ponto.
Figura 5. Padrão normal. Notar a cartilagem envolta por tecido intersticial frouxo (tricrômico de masson verde, 10X).
Figura 6. Coelho 8 (24 semanas). Cartilagem neoformada, irregular, envolta por proliferação fibrosa com vasos neoformados e grande ossificação em faixa (em escuro) (tricrômico de masson verde, 10X)/.
Figura 7. Padrão normal. Observar região mais espessa da cartilagem (reforço da sustentação da orelha, normal nos coelhos) musculatura e tecido frouxo (tricrômico de masson verde, 2,5X).
Figura 8. Coelho 8 (24 semanas). Cartilagem neoformada em continuidade com cartilagem normal, tecido fibroso e -grande capa de ossificação (em escuro) envolvendo a cartilagem reestruturada) (tricrômico de masson verde, 2,5X).
Figura 9. Coelho 1 (1 semana). Trecho de cartilagem normal (madura) que se continua com cartilagem desestruturada e neoformada, sem a presença de ossificação ou calcificação da cartilagem (tricrômico de masson verde, 10 X).
Figura 10. Coelho 2 (1 semana). Cartilagem neoformada com calcificação da matriz, sem ossificação, circundada por proliferação conjuntiva fibrosa, com vasos neoformados (HE, 10X).
Figura 11. Coelho 5 (12 semanas). Trecho de cartilagem normal madura, que se desarranja formando tecido cartilaginoso neoformado recoberto por capa de ossificação. Notar processo inflamatório granulomatoso de corpo estranho, pela presença de tecido epitelial (possivelmente inserido pelo ponto (tricrômico de masson azul, 2,5X).
Figura 12. Coelho 7 (24 semanas). Tecido cicatricial com pequeno trecho de cartilagem madura parcialmente calcificada, que logo se transoforma em cartilagem neoformada recoberta por grande capa de ossificação (HE, 2,5X).
DISCUSSÃO
Que o tecido cartilaginoso tem o potencial de ossificação já é sabido e observado. Ocorre em todo animal vertebrado 17,21,em várias regiões de crescimento e maturação de nosso esqueleto 4,19,12,15, como também, embriologicamente, em várias partes do corpo, como nos chamados ossos do condrocrânio, quando um molde cartilaginoso precede a ossificação futura, fato que ocorre nos ossos da base do crânio, cápsula ótica e cadeia ossicular (cartilagens de Meckel e Reichert) 20,6,7, assim como casos tem sido descritos de ossificação da cartilagem da orelha pós-trauma8, ou quando transplantada para cirurgias nasais13. Este processo pode também ser induzido artificialmente18 ou ocorrer em malformações induzidas por medicamentos5. Com nosso trabalho, pudemos observar que esta transformação cicatricial pode ser desencadeada por traumatismo orientado, neste caso através de dobradura forçada por pontos, no intuito de se modificar a posição de uma cartilagem. Esta cicatrização, com neoformação cartilaginosa e ossificação, perpetuou uma nova postura nas cartilagens submetidas à dobradura forçada, o que pode vir a ser importante para as programações cirúrgicas, quer seja na área da otologia ou da rinologia e laringologia.
REFERÊNCIAS BIBLIOGRÁFICAS
1. AVELAR, J. M. - Creation of the auricle. São Paulo, Hipócrates. 1997.p 418.
2. CAMPONÊS DO BRASIL, O. -Tratamento do câncer da laringe. In: Lopes Filho, O.; Campos, C. A. H. - Otacilio & Campos - Tratado de Otorrinolaringologia. São Paulo. Roca, 1994. p 106679.
3. DOLCI, J. E. L.; BUSSOLOTI FILHO, I.; SAMPAIO, P. L.; CAROPRESO, C. A.; CASTRO, JR. N. P. -Rinosseptoplastia. In: Lopes Filho, O.; Campos, C. A. H. - Otacilio & Campos-Tratado de Otorrinolaringologia. São Paulo. Roca,1994. p. 353-71.
4. FAZZALARI, N. L.; MOORE, A. J.; BYERS, S.; BYARD, R. W. - Quabtitative analysis of trabecular morphogenesis in the human costochondral junction during the postnatal period in normal subjects. Anat. Rec., 248:1-12, 1997.
5. HOWE, A. M.; LIPSON, A. H.; DE SILVA, M.; OUVRIER, R.; WEBSTER, W. S. - Severe cervical dysplasia and nasal catilage calcification following prenatal warfarin exposure. Am.J. Med. Genet., 71:4, 391-6, 1997.
6. LANGMAN, J.- Embriologia médica. São Paulo, Atheneu Editora. 1996.p 295 .
7. LENGELÉ, B.; SCHOWING, J.; DHEM, A. - Chondroid tissue in the early facial morphogenesis of the chick embryo. Anat. Embryol. (Berl), 193:5, 505-13.
8. LIQUIDATO, B. M.; GRANATO, L.; PRÓSPERO, J. D. - Ossificação ectópica de pavilhão auricular: relato de caso com formação de massa tumoral. Rev. Bras. ORL, 63:607-10.
9. MAJNO, G.; JORIS, I. - CellularAdaptations. In: -Cells Tissues, and Disease. Principles of General Pathology. Massachusetts, Blackwell Sience, 1995. p. 15-70.
10. NIAJNO, G.; JORIS,1. - Extracellular Pathology. In: - Cells Tissues, and Disease. Principles of General Pathology. Massachusetts, Blackwell Sience, 1995. p. 247-87
11. IVIANIGLIA, A. J.; INIÁNIGLIA, J. J.; WITTEN, B. R. -Otoplasty -Naeclectictechnique. TbeLaryngoscope, 87.8,1359-68.1977.
12. MASTANTUONO, M.; MILELLA, P. P.; DELLA ROCCA, C.; NANNERINI, M.; DE PAOLIS, M.; LARCIPRETE, M.; BASSETTI, E.; PASSARIELLO, R. - Role of magnetic resonance in the evaluation of the normal and osteochondrosis hip in early and late childhood. Radiol. Med. (Torino), 94:6,571-8, 1997.
13. MIN, Y. G.; KIM, Y. K.; KIM, H. S. -The histology of autologous auricular cartilage implanted into the nasal septum. Clin. Otolaryngol., 21.-4,339-42, 1996.
14. MUSTARDE, J. C. - Correction of prominent ear using simple mattress sutures. Bi-it. Jour. Plast. Surg.,16170-76,1963.
15. ONEAL, M. L.; DWORNIK, J. J.; GANEY, T. M.; OGDEN, J.A. - Postnatal development of the human sternum. J. Pediatr. Orthop., 183,398-405,1998.
16. RIBEIRO, F. A. Q.; BUSSOLOTI FILHO, 1. -OTOPLASTIACorreção da orelha em abano. R.B.M.- ORL ., 53,83-8,1998.
17. RUOHONIEMI, M.; LAUKKANEN, H.; OJALA, M.; KANGASNIEMI, A.; TULAMO, R. M. -Effects of sex and age on the ossification of collateral cartilages of the distal phalanx of the finhorse and the relationships between ossification and body size and type of horse. Res. Vet. Sci., 62:1,34-8, 1997.
18. SASANO, Y.; MIZOGUCHI, L; TAKAHASHI, L; KAGAYAMA, M.; SAITO, T.; KUBOKI, Y. - BMPs induce endochondral ossification in rats when implanted ectopically within a carrier made of fibrous glass membrane. Anat. Rec., 247 472-8,1997.
19. SHIMAZU, A.; NAH, H. D.; KIRSCH, T.; KOYAMA, E.; LEATHERMAN, J. L.; GOLDEN, E. B.; KOSHER, R. A.; PACIFICI, M.- Syndecan-3 and the control of chondrocyte proliferation during endochondral ossification. Exp. Cell Res., 229: 126-36, 1996.
20. WARWICK, R.; WILLIAMS, P. L.- Embriologia. In Gray Anatomia. Rio de Janeiro. Guanabara Koogan, 35 ed. 1979. p 105-8
21. WILD, E. R.-- Description of the adult skeleton and developmental osteology of the Hyperossified horned frog, ceratophrys cornuta (Anura:Leptodactylidae). J. Morphol., 232..2,169-2o6,1997.
*Professor Adjunto e Coordenador da Pós-Graduação em Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo (FCMSCSP).
** Doutoranda da Pós-Graduação em ORL da FCMSCSP.
*** Chefe de Clínica do Serviço de Anatomia Patológica e Professora Adjunta da FCMSCSP.
**** Professora Instrutora da Disciplina de Técnica Cirúrgica e Cirurgia Experimental e Chefe do Biotério da FCMSCSP, Mestranda da Escola Paulista de Medicina.
Instituição: Faculdade de Ciências Médicas da Santa Casa de São Paulo -Rua Cesário Mota jr., 112 - 01221020 São Paulo /SP -Telefone: (011) 222-8405. Endereço para correspondência: Rua Itapeva 500 1013 - 01332000 São Paulo / SP - Telefone/Fax: (011) 288-5414 e 289-6048. Artigo recebido em 17 de janeiro de 1999. Artigo aceito em 6 de abril de 1999.