



Trabalho Clínico
Tratamento do Câncer de Cabeça e Pescoço com Biópsia de Linfonodo Sentinela sem Esvaziamento Cervical
Head and Neck Cancer Treatment with Sentinel Node Biopsy without Neck Dissection
Autores:
Carlos Takahiro Chone (Professor Doutor) Chefe do Serviço de Cabeça e Pescoço da Disciplina de Otorrinolaringologia, Cabeça e Pescoço da UNICAMP
Rodrigo Sousa Magalhães (Médico Otorrinolaringologista) Disciplina de Otorrinolaringologia, Cabeça e Pescoço da UNICAMP
Flávio M. Gripp (Médico Assistente) Disciplina de Otorrinolaringologia, Cabeça e Pescoço da UNICAMP
Elba Etchehebere (Professora Doutora) Disciplina de Medicina Nuclear, UNICAMP
Edwaldo Camargo (Professor Doutor) Chefe da Disciplina de Medicina Nuclear, UNICAMP
Albina Altemani (Professora Doutora) Departamento de Anatomia Patológica, UNICAMP
Agricio N. Crespo (Professor Doutor) Chefe da Disciplina de Otorrinolaringologia, Cabeça e Pescoço da UNICAMP
Palavras-Chave
Cabeça e Pescoço, Linfonodo Sentinela, Carcinoma Espinocelular
Resumo
A utilização da pesquisa de linfonodo sentinela parece ser um método seguro para estadiamento do pescoço clinicamente negativo. Aparentemente, a técnica em questão remove os linfonodos metastáticos em pacientes com pescoço clinicamente negativo, com recorrência cervical semelhante àquela observada após o esvaziamento cervical eletivo. O objetivo deste estudo foi determinar a taxa de recidiva cervical após a remoção dos linfonodos sentinelas, sem realização do esvaziamento cervical eletivo. Foi realizado estudo clínico prospectivo com 25 pacientes com carcinoma espinocelular de cavidade oral, orofaringe, laringe e pele da face. Todos apresentavam pescoço clinicamente negativo, sem tratamento prévio, com indicação de esvaziamento cervical eletivo. Todos foram submetidos à ressecção do tumor primário seguida pela pesquisa e biópsia dos linfonodos sentinelas. Na presença de fatores prognósticos adversos no tumor primário ou metástases linfáticas múltiplas, o paciente foi encaminhado para radioterapia pós-operatória. Os pacientes foram seguidos após a cirurgia, com exame clínico mensal e tomografia cervical semestral. A taxa de recidiva cervical global foi de 4% (1/25) e, em estádio IV, de 25% (1/4). Sete pacientes (28%) apresentaram linfonodos sentinelas comprometidos por neoplasia. A média de seguimento após a cirurgia foi de oito meses, com variação entre um e 18 meses. O método de pesquisa e biópsia de linfonodo sentinela é promissor no tratamento do pescoço em pacientes com carcinoma espinocelular de cabeça e pescoço. Porém, é necessário um tempo maior de seguimento, com um número maior de pacientes para consolidar o método como opção de tratamento seletivo do pescoço.
Keywords
Head and Neck, Sentinel Node, Squamous Cell Carcinoma
Abstract
The sentinel lymph node biopsy seems to be clinically safe as a staging procedure in the clinically negative neck. Besides, this technique apparently removes all the metastatic lymph nodes and neck recurrence seems similar to that after elective neck dissection. The objective of this study was to determine the cervical recurrence rate after sentinel node biopsy without elective neck dissection. Prospective clinical study was accomplished with 25 patients with squamous cell carcinoma of oral cavity, oropharynx, larynx and face's skin. All of them were cN0, without previous treatment, with indication of elective neck dissection. All of them were submitted to primary tumor surgery and sentinel nodes biopsy. In the presence of adverse prognostic factors in the primary tumor or multiple lymphatic metastases, patients were submitted to adjuvant radiation therapy. Subjects were followed after surgery monthly with clinical exam and half-yearly with neck CT scan. The overall cervical recurrence rate was 4% (1/25) and in stage IV pacients was 25% (1/4). Seven out of 25 patients (28%) were sentinel node positive. The average follow up time was eight months, with a range from one to eighteen months. The sentinel node biopsy stays as a promising method in the neck treatment in head and neck tumors. However, more follow up time, with more patients, is imperative to achieve significant results to establish the sentinel node biopsy without mandatory neck dissection as routine care of head and neck cancer patients with clinically negative necks.
Instituição: Disciplina de Otorrinolaringologia Cabeça e Pescoço, Disciplina de Medicina Nuclear, Departamento de Anatomia Patológica Universidade Estadual de Campinas - UNICAMP
Suporte Financeiro:
Introdução
O carcinoma espinocelular (CEC) da cabeça e pescoço dissemina-se preferencialmente por via linfática para os linfonodos cervicaisl e a controvérsia permanece sobre as melhores técnicas para determinar quais pacientes realmente têm metástases linfáticas cervicais. Exame clínico e técnicas radiológicas são relativamente inexatos, com aproximadamente 30% de falsos negativos e falsos positivos na determinação da presença de metástases linfáticas cervicais2-10. O único método preciso para o estadiamento do pescoço ainda é o exame histopatológico do espécime cirúrgico após um esvaziamento cervical11. No câncer da via aerodigestiva superior, o tratamento cirúrgico para o pescoço do paciente é determinado de acordo com o seu risco de metástases ocultas. Nos pacientes cujos tumores apresentem possibilidade de metastatização linfática maior que 20% é necessário esvaziamento cervical, mesmo não havendo metástase linfática palpável, devido aos benefícios na sobrevida do paciente em 11% a 14%. Essa probabilidade varia de acordo com o estágio clínico do tumor. Porém, se o risco de metástase linfática de pelo menos 20% justifica o esvaziamento cervical em todos pacientes com este risco, muitas das peças cirúrgicas, até 80%, serão histopatologicamente negativas. No campo do melanoma maligno cutâneo, um debate semelhante foi centralizado na investigação e tratamento de linfonodos regionais e, nesse respeito, a técnica de pesquisa e biópsia de linfonodo sentinela (LS) está consagrada12. Nessa técnica, um radiocolóide é injetado ao redor de um tumor ou no local de excisão prévia. Esse radiofármaco é drenado para a primeira cadeia de linfonodos, essa denominada LS. O uso de linfocintilografia pré-operatória e "gamma probe" (GP) intra-operatório ajudam na localização dos LS radioativos que podem conter depósitos microscópicos de tumor13. Com a utilização dessa técnica em pacientes com melanoma maligno, encontrou-se que é altamente improvável que os pacientes sem doença linfonodal palpável e com LS livre de doença metastática tenham doença metastática em outros grupos de linfonodos14. Pacientes com CEC de cavidade oral (CO) em estágios iniciais, quando apresentam infiltração maior que dois milímetros, já podem apresentar risco considerável para metástase linfática cervical, com indicação de esvaziamento cervical15-
Sujeitos e Métodos
Pacientes com CEC de cavidade oral (CO), orofaringe (OROF), laringe e pele da face, que necessitariam de esvaziamento cervical como parte do tratamento cirúrgico, sem metástase linfática palpável e sem tratamento prévio no pescoço, foram convidados a entrar no estudo. A partir de maio de 2005 até março de 2007, 25 pacientes foram incluídos no estudo, sendo doze com CEC de CO, oito de OROF, quatro de laringe e um de pele da face. O termo de consentimento informado foi obtido de todos os pacientes deste estudo e a pesquisa foi aprovada no Comitê de Ética da FCM-Unicamp. Todos tiveram confirmação histopatológica de CEC. Foram incluídos pacientes com estádio clínico T1 a T3 de CO, OROF, laringe e face sendo três cT1, onze cT2 e onze cT3. Todos pacientes foram submetidos a exames tomográficos prévios do pescoço para ser considerado elegível para o estudo como pescoço negativo. Todos foram submetidos a duas injeções peri-tumorais de 0,2 MCI de fitato99m-TC, duas horas antes da cirurgia e linfocintilografia duas horas após a injeção. Uma atividade de 25.6 MBq foi injetada ao longo da mucosa normal que cerca o tumor e da submucosa, no aspecto profundo do tumor, em um volume de aproximadamente 0.2 ml (Figura 1). Tomou-se o cuidado de prevenir extravasamento inadvertido de colóide na boca. Foram realizadas imagens estáticas em projeções laterais e ântero-posteriores (Figuras 2 e 3) e os linfonodos radioativos foram marcados na pele com tinta (Figura 4). A seguir, o tumor primário foi ressecado. Com utilização de GP manual Neoprobe-1500Ò (Neoprobe Corp, Dublin, OH) (Figuras 5) foi localizado e dissecado o LS (Figura 6). Após, o restante do pescoço foi reavaliado quanto à presença de radioatividade e confirmada radioatividade no linfonodo dissecado. O LS foi encaminhado para exame histopatológico (HISTO) com hematoxilina-eosina com cortes seriados do LS e foi realizado exame de imunohistoquímica nos LS que não apresentaram CEC ao exame HISTO com hematoxilina-eosina. A seguir, os pacientes foram acompanhados ambulatorialmente, com exame clínico mensal e realização de tomografia computadorizada cervical semestral. Pacientes com linfonodo sentinela com extensão extra-capsular ou múltiplos positivos ou cujo tumor primário apresentasse fatores adversos (margens comprometidas, invasão peri-neural, êmbolos vasculares ou linfáticos) foram submetidos à radioterapia pós-operatória entre quatro a oito semanas de cirurgia. Se apenas o tumor primário apresentou fatores adversos, a radioterapia pós-operatória foi realizada apenas no leito do tumor primário. Se apenas o linfonodo sentinela apresentou extensão extra-capsular ou houve múltiplos linfonodos sentinelas positivos, a radioterapia pós-operatória foi apenas no pescoço. Se o tumor primário apresentou fator adverso e o linfonodo sentinela apresentou extensão extra-capsular ou múltiplos linfonodos sentinelas positivos, a radioterapia pós-operatória foi no primário e no pescoço.
Resultados
O tempo de seguimento pós-operatório variou de um mês a dezoito meses, com média de oito meses. A taxa de recidiva cervical global foi de 4% (1/25). A taxa de recidiva categorizada pelo estadiamento patológico está discriminada na tabela abaixo.
|
Tabela 1: Recorrência cervical segundo estadiamento patológico | |
|
Estádio |
(%) |
|
I |
0/4 (0) |
|
II |
0/10 (0) |
|
III |
0/7 (0) |
|
IV |
1/4 (25) |
Em cada paciente foi detectado pelo menos 1 LS, com uma média de 6 LS e, no máximo, 24 LS por paciente. Sete pacientes (28%) apresentaram LS comprometidos por CEC, sendo seis classificados como N1 e um como N2.
Quatorze pacientes foram encaminhados para radioterapia adjuvante, seja por fatores adversos do tumor primário ou por múltiplos linfonodos sentinela acometidos.
A técnica de biópsia de LS
As taxas de recorrência cervical global de 4% e em estádio IV de 25% estão dentro do esperado quando comparadas às taxas de recorrência em pacientes submetidos ao tratamento convencional, no caso o esvaziamento cervical eletivo. Byers e Medina encontraram uma taxa de recorrência cervical global de 9% e em estádio IV de 18%, em 234 pacientes com tumores de cavidade oral e orofaringe, com pescoço clinicamente negativo, submetidos ao esvaziamento supra-omo-hióideo eletivo45.
As taxas de recorrência cervical do presente estudo devem-se à recorrência observada em um paciente que apresentou cinco linfonodos sentinela comprometidos por neoplasia. Esse paciente foi encaminhado para realizar radioterapia adjuvante mas iniciou o procedimento quatro meses após a cirurgia. Diversos estudos verificaram que um atraso no início da radioterapia pós-operatória está relacionado a um aumento na taxa de recidiva tumoral e, quando indicada, a radioterapia deve ser iniciada dentro de seis semanas após a cirurgia46-49.
De acordo com um estudo onde foi realizado meta-análise sobre LS em cabeça e pescoço, sua utilização seria segura como método de estadiamento44. Devido à pequena taxa de falso negativo poder-se-ia realizar a ressecção do tumor primário, especialmente nos tumores iniciais de boca, com remoção dos LS para estadiamento e proceder ao ELET apenas quando estes LS forem histopatologicamente comprometidos por CEC. Dessa forma, pode-se poupar da realização de ELET os pacientes com LS negativos ao exame, com diminuição considerável da morbidade cirúrgica e dos custos.
Estudos mais recentes apontam que o método da pesquisa e biópsia de linfonodo sentinela detecta praticamente todos os linfonodos metastáticos, quando todos os linfonodos captantes são removidos e, dessa forma, a realização apenas da pesquisa e remoção dos linfonodos sentinelas, mesmo quando eles são positivos, parece ser segura33,34. Esta metodologia seria adequada para não necessitar reoperar o paciente com esvaziamento cervical caso o linfonodo sentinela seja positivo histopatologicamente para metástase.
Assim, baseado no conceito de se operar um pescoço clinicamente negativo apenas quando o risco de metástases ocultas for maior que 20%, talvez a remoção apenas dos linfonodos sentinelas, mesmo que eles sejam histopatologicamente positivos, se justifique, já que até agora, após o procedimento, o risco de recorrência cervical seria de apenas 3% a 5%33,34,39, taxa essa menor que a observada na recorrência pós esvaziamento cervical supraomohióideo e radical40,41,42.
Foi observado neste estudo, apesar do seguimento pequeno, que a técnica de remoção apenas do LS parece ser segura. Os pacientes serão seguidos rigorosamente dentro de protocolo padronizado descrito anteriormente e dados serão reavaliados de forma prospectiva. Em estudo anterior com 35 pacientes em nossa instituição, foi observado que houve nove pacientes com LS histopatologicamente positivos, e nesses pacientes, todas as metástases foram removidas com a técnica do LS, após a remoção de todos LS captantes e os esvaziamentos cervicais eletivos subseqüentes, realizados após a remoção do LS, também foram todos sem metástases, semelhantemente a estudos anteriores33,34.
Este estudo propõe uma nova abordagem no tratamento do pescoço clinicamente negativo, em pacientes portadores de câncer de cabeça e pescoço. A biópsia do LS não acrescenta riscos ou prejuízos para os sujeitos da pesquisa quando comparadados aos riscos que estariam expostos se fossem submetidos ao tratamento convencional, no caso o esvaziamento cervical. Além disso, é um estudo de grande impacto social, devido a alta prevalência do câncer de cabeça e pescoço na população. Somente o CEC de cavidade oral, o mais prevalente em cabeça e pescoço, ocupa o quinto lugar entre as neoplasias mais prevalentes na população masculina brasileira.
Conclusões
O método da pesquisa e biópsia de linfonodo sentinela é promissor no tratamento do pescoço
Houve 28% de pacientes (7/25) com metástases linfáticas em LS neste estudo e a taxa global de recidiva cervical foi de 4% (1/25).
É necessário um tempo maior de seguimento, com um número maior de pacientes, para alcançar resultados conclusivos e significativos, que permitam consolidar o método como opção de tratamento seletivo do pescoço
1. Shah JP,
2.
3. Shah JP. Patterns of cervical lymph node metastasis from squamous cell carcinoma of the upper aerodigestive tract. Am J Surg 1990, 160:405-9.
4. O'brien CJ. A selective approach to neck dissection for mucosal squamous cell carcinoma. Aust. N Z J Surg 1993, 64:236-41.
5. Kowalski LP, Magrin J, Waksman G, Santo GFE, Lopes MEF, Paula RP, Pereira RN,.Torloni H. Supraomohyoid neck dissection in the treatment of head and neck tumors: survival results in 212 cases. Arch Otolaryngol Head Neck Surg 1993, 119:958-63.
6. Atula TS, Grénman R, Varpula MJ, Kurki TJI, Klemi P. Palpation, ultrasound, and ultrasound guided fine-needle aspiration cytology in the assessment of cervical lymph node status in head and neck cancer patients. Head Neck 1996, 18:545-51.
7. Braams JW, Pruim J, Freling NJM, Nikkels PGJ, Roodenburg JLM, Boering G, Vaalburg W, Vermey A. Detection of lymph node metastases of squamous cell cancer of the head and neck with FDG-PET and MRI. J Nucl Med 1995, 36:211-16.
8. Don DM, Anzai Y, Lufkin RB, Fu Y, Calcaterra TC. Evaluation of cervical lymph node metastases in squamous cell carcinoma of the head and neck. Laryngoscope 1995, 105:669-74.
9. Mcguirt WF, Williams DW, Keyes Jr JW, Greven KM, Watson Jr NE, Geisinger KR, Cappellari JO. A comparative diagnostic study of head and neck nodal metastases using Positron Emission Tomography. Laryngoscope 1995, 105:373-75.
10. Merrit RM, Willians MF, James TH, Porubsky ES. A meta-analysis comparing computed tomography with physical examination. Arch Otolaryngol Head Neck Surg 1997, 123:149-52.
11. Woolgar JA, Beirne JC, Vaughan ED, Lewis-Jones HG, Scott J, Brown JS. Correlation of histopathologic findings with clinical and radiologic assessments of cervicallymph node metastases in oral cancer. Int J Oral Maxillofac Surg 1995; 24:30-37.
12. Morton DL, Wen DR, Wong JH et al. Technical details of intraoperative lymphatic mapping for early stage mela- noma. Arch Surg 1992;127:392-399.
13. Alex JC, Krag DN. Gamma-probe guided localization of lymph nodes. Surg Oncol 1993;2:137-143.
14. Reintgen D, Cruse CW, Wells K et al. The orderly pro- gression of melanoma nodal metastases. Ann Surg 1994; 220:759-767.
15. Ambrosch P, Kron M, Fischer G, Brinck U. Micrometastases in carcinoma of the upper aerodigestive tract: detection,risk of metastasizing,and prognostic value of depth of invasion. Head Neck 1995; 17:473-479.
16. Mohit-Tarabatai MA , Sobel HJ, Rush BF, Mashberg A. Relation of thickness of floor of mouth stage I and II cancers to regional metastasis. Am J Surg 1986 152:351-353.
17. Spiro RH, Huvos AG, Wong GY, Spiro JD. Predictive value of tumor thickness in squamous cell carcinoma confined to tongue and floor of the mouth. Am J Surg 1986; 152: 345-350.
18. Koch WM, Choti MA, Civelek C, Eisele DW, Saunders JR. Gamma probe directed biopsy of the sentinel node in oral squamous cell carcinoma. Arch. Otolaryngol. Head Neck Surg 1998; 124:455-459.
19. Shoaib T, Soutar DS, Prosser JE, Dunaway DJ, Gray HW, McCurrach GM, Bessent RG, Robertson AG, Oliver R, MacDonald DG. A suggested method for sentinel node biopsy in squamous cell carcinoma of the head and neck. Head Neck 1999;21:728-733
20. Stoeckli SJ, Steinert H, Pfaltz M, Schmid S.Is there a role for positron emission tomography with 18F-fluorodeoxyglucose in the initial staging of nodal negative oral and oropharyngeal squamous cell carcinoma.Head Neck 2002; 24(4):345-9
21. Werner JA, Dünne AA, Ramaswamy A, Brandt D, Külkens C, Folz BJ, Moll R, Lippert BMThe sentinel node concept in head and neck squamous cell carcinoma:a critical analysis in 100 patients. Laryngorhinootologie 2002; 81(1):31-9.
22. Nieuwenhuis EJ, Castelijns JA, Pijpers R, van den Brekel MW, Brakenhoff RH, van der WaalI, Snow GB, Leemans CR.Wait-and-see policy for the N0 neck in early-stage oral and oropharyngeal squamous cell carcinoma using ultrasonography-guided cytology: is there a role for identification of the sentinel node?. Head Neck 2002; 24(3):282-9.
23. Altinyollar H, Berberoglu U, Celen O. Lymphatic mapping and sentinel lymph node biopsy in squamous cell carcinoma of the lower lip.Eur J Surg Oncol 2002; 28(1):72-4.
24. Fang J,Wei X, Li S.Sentinel lymph node biopsy in head and neck cancer patients. Zhonghua Zhong Liu Za Zhi 2001; 23(5): 431-3.
25. Mozzillo N, Chiesa F, Botti G, Caracò C, Lastoria S, Giugliano G, Mazzarol G, Paganelli G, Ionna F. Sentinel node biopsy in head and neck cancer. Ann Surg Oncol 2001; 8(9Suppl):103S-105S.
26. Dünne AA, Külkens C, Ramaswamy A, Folz BJ, Brandt D, Lippert BM, Behr T, Moll R, Werner J. AValue of sentinel lymphonodectomy in head and neck cancer patients without evidence of lymphogenic metastatic disease.Auris Nasus Larynx 2001; 28(4):339-44.
27. Kovács AF, Acker P, Berner U, Risse JH. Sentinel lymph node excision. Treatment method of the N0 neck in patients with oral and oropharyngeal carcinoma. HNO 2001; 49(8):646-53.
28. Stoeckli SJ, Steinert H, Pfaltz M, Schmid S. Sentinel lymph node evaluation in squamous cell carcinoma of the head and neck. Otolaryngol Head Neck Surg 2001; 125(3):221-6.
29.
30. Zitsch RP;,Todd DW, Renner GJ, Singh A.Intraoperative radiolymphoscintigraphy for detection of occult nodal metastasis in patients with head and neck squamous cell carcinoma.Otolaryngol Head Neck Surg 2000; 122(5):662-6.
31. Alex JC, Sasaki CT, Krag DN, Wenig B, Pyle PB.Sentinel lymph node radiolocalization in head and neck squamous cell carcinoma. Laryngoscope 2000; 110(
32. Höft S, Maune S, Muhle C, Brenner W, Czech N, Kampen W-U et al. Sentinel lymph-node biopsy in head and neck cancer. British J Cancer 2004;91:124-128.
33. Werner JA, Dünne AA, Ramaswany A, Dalchow C, Behr T, Moll R et al. The sentinel node concept in head and neck cancer: solution for the controversies in the N0 neck? Head Neck 2004,26:603-611.
34. Tschopp L, Nuyens M, Stauffer E, Krause T, Zbären P. The value of frozen section analysis of the sentinel lymph node in clinically N0 squamous cell carcinoma of the oral cavity and oropharynx. Otolaryngol Head Neck Surg 2005,132:99-102.
35. Hart RD, Nasser JG, Trites JR, Taylor SM, Bullock M, Barnes D. Sentinel lymph node biopsy in N0 squamous cell carcinoma of the oral cavity and oropharynx. Arch Otolaryngol Head Neck Surg 2005,131:34-38.
36. Ross GL, Shoaib T, Soutar DS, MacDonald DG, Camilleri IG, Bessent RG et al. The first international conference on sentinel node biopsy in mucosal head and neck cancer and adoption of a multicenter trial protocol. Ann Surg Oncol 2002, 9:406-410.
37. Ross GL, Soutar DS, MacDonald DG, Shoaib T, Camilleri IG, Roberton AG et al. Sentinel node biopsy in head and neck cancer: preliminary results of a multicenter trial. Ann Surg Oncol 2004,11: 690-696.
38. Kosuda S, Kusano S, Kohno N, Ohno Y, Tanabe T, Kitahara S, Tamai S. Feasibility and cost-efectiveness of sentinel lymph node radiolocalization in stage N0 head and neck cancer. Arch Otolaryngol Head Neck Surg 2003;129:1105-1109.
39. Kovács AF, Landes CA, Hamscho N, Risse JH, Berner U, Menzel C. Sentinel node biopsy as staging tool in a multimodality treatment approach to cancer of oral cavity and the oropharynx. Otolaryngol Head Neck Surg 2005,132:570-576.
40. Spiro RH, Morgan GJ, Strong EW, Shah JP. Supraomohyoid neck dissection. Am J Surg 1996; 172 : 651-653 .
41. Chone CT, Silva AR, Altemani A, Crespo AN, Werner RS. Regional recurrence of supraomohyoid neck dissection. Arch Otolaryngol Head Neck Surg 2003,129: 54-58.
42. Strong EW. Preoperative radiation and radical neck dissection. Surg Clin North Am 1969; 49: 271-276.
43. Colletier PJ, Garden AS, Morrison WH, Goepfert H, Geara F, Ang KK. Postoperative radiation for squamous cell carcinoma metastatic to cervical lymph nodes from an unknown primary site: outcomes and patterns of failure. Head Neck 1998;20:674-681
44. Paleri V, Rees G, Arullendran P, Shoaib T; Krishman S. Sentinel node biopsy in squamous cell cancer of the oral cavity and oral pharynx: a diagnostic meta-analysis. Head Neck 2005;27:739-47.
45. Medina JE, Byers RM. Supraomohyoid neck dissection: rationale, indications, and surgical technique. Head Neck 1989;11(2):111-22.
46. Dietl B, Schafer C, Kolbl O. The prognostic value of time parameters in adjuvant radiotherapy of head and neck cancer. A retrospective analysis of 138 patients. Strahlenther Onkol 2005;181(12):800-9.
47. Huang J, Barbera L, Brouwers M, Browman G, Mackillop WJ. Does delay in starting treatment affect the outcomes of radiotherapy? A systematic review. J Clin Oncol 2003;21(3):555-63.
48. Muriel VP, Tejada MR, de Dios Luna del Castillo J. Time-dose-response relationships in postoperatively irradiated patients with head and neck squamous cell carcinomas. Radiother Oncol. 2001 Aug;60(2):137-45.
49. Isaacs JH Jr, Stiles WA, Cassisi NJ, Million RR, Parsons JT. Postoperative radiation of open head and neck wounds-updated. Head Neck 1997;19(3):194-9.
Figura 1
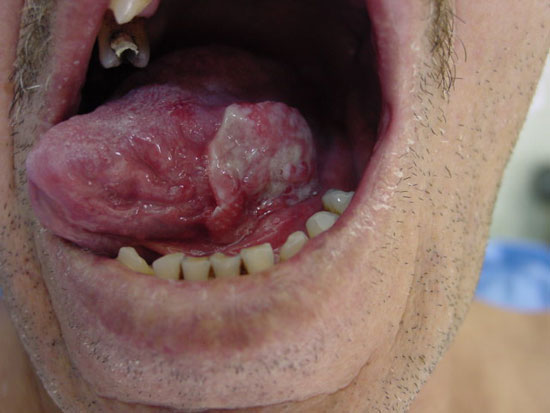
Lesão tumoral em bordo lateral de língua onde foi injetado o radiofármaco
Figura 2
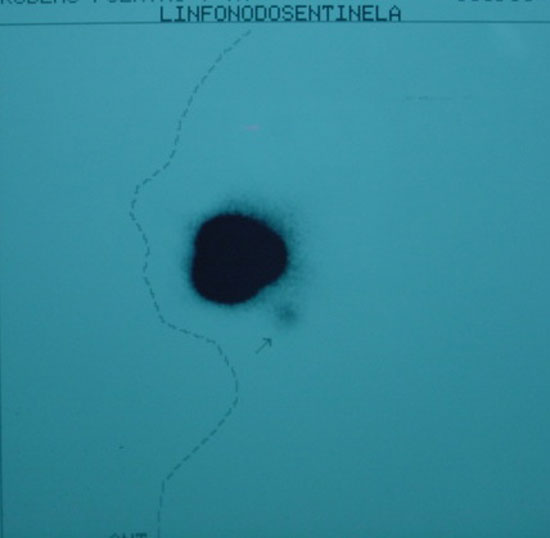
Linfocintilografia em projeção lateral com linfonodo sentinela em seta pequena
Figura 3
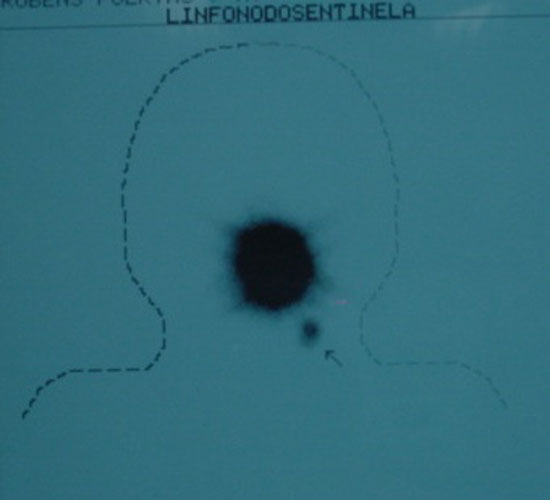
Linfocintilografia em projeção ântero-posterior com linfonodo sentinela em seta pequena
Figura 4
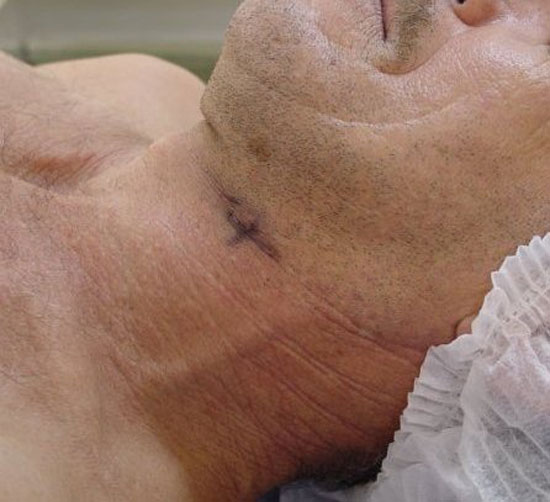
Projeção do linfonodo sentinela marcado na pele
Figura 5

Probe manual
Figura 6
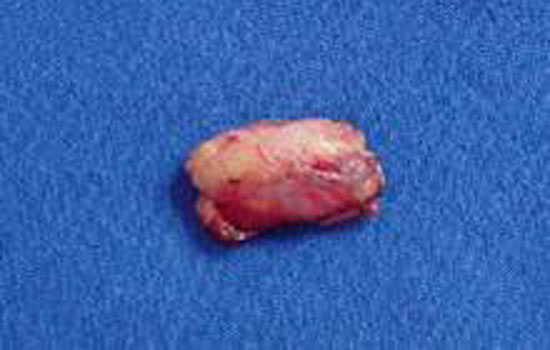
Linfonodo sentinela dissecado