



Trabalho Clínico
Comparação de colesteatomas adquiridos entre pacientes pediátricos e adultos, através da análise imunoistoquímica com os marcadores CD31, MMP2 e MMP9
Comparison of acquired cholesteatoma in adult and pediatric patients using CD31, MMP2 and MMP9 markers for immunohistochemistry analysis
Autores:
Cristina Dornelles (Mestre em Ciências Médicas - Pediatria Doutorando do Programa de Pós-Graduação em Ciências Médicas: Pediatria - UFRGS) Bióloga no Centro de Otite Média do Brasil
Luíse Meurer (Doutora em Gastroenterologia) Professora Adjunta do Departamento de Patologia da Universidade Federal do Rio Grande do Sul
Sady Selaimen da Costa (Doutor em Cirurgia) Professor Associado do Departamento de Oftalmologia e Otorrinoalringologia da Universidade Federal do Rio Grande do Sul
Letícia Petersen Schmidt Rosito (Mestre em Ciências Médicas: Cirurgia) Médica Otorrinolaringologista no Hospital de Clínicas de Porto Alegre
Sabrina Lima Alves (Acadêmica de Medicina) Acadêmica de Medicina na Universidade Federal do Rio Grande do Sul
Andréia Argenta (Acadêmica de Medicina) Acadêmica de Medicina na Universidade Federal do Rio Grande do Sul - Bolsista CNPq no Centro de Otite Média do Brasil
Andrei Roberto da Silva (Médico) Residente de Otorrinolaringologia USP
Palavras-Chave
colesteatoma, perimatriz, inflamação
Resumo
Introdução: A quantificação da angiogênese e das colagenases pode ser útil na avaliação do comportamento dos colesteatomas, como marcadores de sua agressividade. Objetivo: correlacionar os marcadores CD31, MMP2 e MMP9 com espessura da perimatriz, grau histológico de inflamação e idade do paciente. Método: Delineamento transversal. Material fixado em formol a 10%, preparadas cinco lâminas, de cada amostra, por técnicas histológicas habituais, observados: número médio de vasos sangüíneos, marcação com MMP2 e MMP9, número de células na matriz, espessura e inflamação na perimatriz. Análise dos dados foi através coeficiente de Spearman, testes de Mann Whitney e exato de Fisher, com significância menor ou igual a 0,05. Resultados: A amostra contou com 120 colesteatomas. Número médio de vasos sangüíneos 5(0 a 10), sem diferença entre os grupos(P=0,070). A MMP2 citoplasmática foi de 0(0 a 2), encontramos diferença entre os grupos(P=0,014). Os resultados para MMP2 nuclear foi de 0(0 a 1)(P=0,050). A MMP9 foi de 2(0 a 4), com diferença entre os grupos(P=0,050). Ao correlacionarmos o número médio de vasos sangüíneos e das metaloproteinases com o número médio de camadas celulares da matriz, com a espessura da perimatriz e com o grau histológico de inflamação encontramos correlações fortes, somente a MMP2 citoplasmática apresentou correlação com a idade do paciente. Conclusões: A expressão aumentada de metaloproteinases possibilita, aos colesteatomas pediátricos, maior grau de infiltração e de erosão óssea. Os colesteatomas pediátricos, apresentam um grau inflamatório mais exacerbado, produzem mais metaloproteinases e são mais agressivos que os colesteatomas adultos.
Keywords
cholesteatoma, perimatrix, inflammation
Abstract
Introduction: To evaluate the aggressivity of cholesteatomas, it can be useful to quantify angiogenesis and collagenase activity. Objective: to correlate the presence of CD31, MMP2 and MMP9 IHQ markers with perimatrix thickness, histological inflammation and patient age. Methods: Cross-sectional study. Tissue samples were fixed in 10% formaldehyde. Five slides from each sample were prepared using standard histology techniques. Slides were analyzed according to average number of blood vessels, MMP2 and MMP9 positivity, number of cells in the matrix, and thickness and inflammation of the perimatrix. Data was analyzed using Spearman's coefficient, Mann Whitney and Fisher's exact tests, with p values ≤0.05 considered significant. Results: 120 cholesteatomas were analyzed. The average number of blood vessels was 5 (0-10), with no difference between the groups (p=0.070). Cytoplasmic MMP2 positivity was null (0-2), with a significant difference between the groups (p=0.014). Nuclear MMP2 positivity was also null (0-1) (p=0.050). MMP9 positivity was 2 (0-4) (p=0.050). Strong correlations were found between the average number of blood vessels and metaloproteinases and the average number of matrix cell layers, and between the thickness of the perimatrix and the degree of inflammation. However, only cytoplasmic MMP2 positivity correlated with patient age. Conclusion: Increased metaloproteinase expression in pediatric cholesteatomas enables greater infiltration and bone erosion than in adult cholesteatomas.
Instituição: Universidade Federal do Rio Grande do Sul Programa de Pós-Graduação em Ciências Médicas Pediatria Serviços de Otorrinolaringologia e Patologia do Hospital de Clínicas de Porto Alegre
Suporte Financeiro: Grupo de Pesquisa e Pós-Graduação do Hospital de Clínicas de Porto Alegre Pró-Reitoria de Pesquisa da Universidade Federal doi Rio Grande do Sul
Introdução
O colesteatoma pode ser considerado como uma desordem no controle do crescimento celular, compreendendo uma série de complexos e dinâmicos eventos, os quais envolvem componentes celulares e extracelulares1. Os mecanismos que explicariam o seu crescimento, bem como seu grau de erosão óssea ainda estão em investigação2.
Existem controvérsias se o comportamento do colesteatoma difere entre crianças e adultos. Sheehy3, Tos4 e Edelstein5 acreditam que o colesteatoma infantil é menos expansivo, o que levaria a uma incidência menor de complicações. Por outro lado, Galsscock6, Ruah7, Bujia8, Palva9 e Sudhoff10 consideram que o colesteatoma adquirido na infância é mais agressivo e tem crescimento mais extenso. Para Smythe e colaboradores11, os colesteatomas pediátricos apresentam comportamento tão diverso dos colesteatomas adultos que deveriam ser consideradas doenças distintas.
Quaranta e colaboradores12 observaram que a perimatriz dos colesteatomas adquiridos, na infância, é mais rica em elementos inflamatórios mononucleares do que quando
Estudos histológicos realizados por Dornelles e colaboradores1,13,14, identificaram uma correlação inversa entre a espessura da perimatriz dos colesteatomas com idade do paciente à data da cirurgia, porém uma correlação direta entre a espessura e o grau histológico de inflamação na perimatriz. Esses achados sugerem que a perimatriz é mais espessa e possui um processo inflamatório mais exacerbado nos colesteatomas de pacientes pediátricos. Nos trabalhos de Dornelles e colaboradores1,13,14, foram utilizadas variáveis semi-quantitativas para determinar o grau histológico de inflamação. Uma medida quantitativa e, portanto mais precisa, da inflamação é a quantificação do grau de angiogênese, que pode ser realizada através da contagem de vasos sangüíneos na perimatriz, por imunoistoquímica com o marcador CD 3115. Sabe-se que o crescimento do colesteatoma requer angiogênese no tecido conjuntivo da perimatriz16. A angiogênese é fundamental para o desenvolvimento normal e a homeostasia; em sua forma fisiológica é essencial ao crescimento tecidual e à cicatrização de feridas17.
Outras enzimas envolvidas no processo de angiogênese são as metaloproteinases (MMP). As MMP estão relacionadas com a progressão de tumores, incluindo crescimento, invasão, metástase, além da angiogênese. Bernal-Sprekelsen e colaboradores18, através de métodos imunoistoquímicos, perceberam que metaloproteinases poderiam explicar parte das atividades destrutiva e proliferativa do colesteatoma, tais como a destruição dos ossículos e outras partes do osso temporal..
Segundo Wilmoth e colaboradores19 as MMP são conhecidas por participar da fisiologia normal do metabolismo do colágeno, mas também estão associadas com a absorção patológica da matriz extracelular em processos inflamatórios crônicos que ocorrem na pele, em tumores e suas metástases. A atividade das MMP é regulada por inibidores de metaloproteinases e a interrupção desta harmonia, pode desencadear um processo patológico. A figura 1 mostra um esquema da produção expressão e açãodas metaloproteinases nos colesteatomas.
A quantificação da angiogênese e das colagenases pode ser útil na avaliação do comportamento dos colesteatomas, como marcadores de sua agressividade. Sendo assim, este trabalho tem por objetivo analisar, imunoistoquimicamente, a perimatriz dos colesteatomas adquiridos de crianças e adultos, com os marcadores CD31, MMP2 e MMP9, bem como correlacionar estes achados com a espessura da perimatriz, com o grau histológico de inflamação e com a idade do paciente à cirurgia.
Método
Esse trabalho foi aprovado, em suas questões éticas e metodológicas, pelo Grupo de Pesquisa e Pós-Graduação, em 2004, sob o número 04-416. Todos os pacientes, que aceitaram participar dessa pesquisa, assinaram Termo de Consentimento Livre Informado, para a utilização, anônima dos dados, em publicações científicas. A obtenção ou não do consentimento informado não influenciou no tratamento dos pacientes. Sua metodologia enquadra-se em um estudo transversal comparativo e contemporâneo.
Os pacientes incluídos foram provenientes do Ambulatório de Otite Média Crônica (AOMC). A inclusão dos pacientes obedeceu aos seguintes critérios:
1. Diagnóstico de Otite Média Crônica Colesteatomatosa;
2. Presença de matriz e perimatriz no colesteatoma coletado.
E a exclusão foram:
1. Diagnóstico de colesteatoma congênito;
2. Material inadequado para o processamento em imunoistoquímica.
O material foi coletado pelo cirurgião otologista, imediatamente fixado em formol a 10% e processado pelas técnicas histológicas habituais, com inclusão
As lâminas foram coradas em Hematoxilina-Eosina (HE) e Picrossírios (Sirius Red) e analisadas em microscópio óptico (Figura 2). Notar, na figura 2, que o contraste obtido na segunda coloração é bem maior, pois nela as fibras de colágeno coram-se em bordô, o que facilita a diferenciação da espessura a ser medida. Cortes representativos da perimatriz do colesteatoma foram submetidos à técnica de imonuistoquímica utilizada na rotina do Serviço de Patologia, a qual consiste na desparafinização e reidratação, recuperação antigênica, inativação de peroxidase endógena e bloqueio das reações inespecíficas.
O anticorpo anti-CD31 primário (clone JC7OA, Dako Cytomation, Carpinteria, CA, USA) foi encubado por 12 horas, a quatro graus Celsius, na diluição 1:40, seguido de aplicação do complexo estreptavidina-biotina-peroxidase (LSAB, Dako) e revelação com diaminobenzidina tetraidroclorido (Kit DAB, Dako).
O anticorpo anti-MMP2 (72kDa Collagennase IV, Chemicon Internacional, USA) e o anticorpo anti-MMP9 (clone 9D4.2, Chemicon Internacional, USA) foram incubados por 72 horas, a quatro graus Celsius, na diluição 1:40, seguido de aplicação do complexo estreptavidina-biotina-peroxidase (LSAB, Dako) e revelação com diaminobenzidina tetraidroclorido (Kit DAB, Dako).
A leitura das lâminas foi realizada sob microscopia óptica com aumento de 200 vezes, por duas observadoras independentes (sendo uma delas professora do Departamento de Patologia da FAMED-UFRGS e segunda a própria pesquisadora). Todas as lâminas passaram por uma leitura "cega" e controlada pela pesquisadora.
O número médio de vasos sangüíneos na perimatriz (marcados pelo anticorpo anti-CD31), foi coletado de maneira contínua, obtida pela contagem de pontos de Chalkley, onde uma grade, contendo 25 pontos, é colocada sobre a imagem digitalizada e são contados todos os pontos que coincidam com os vasos marcadeos (Figura 3). Foram realizadas de duas a cinco imagens, dependendo do tamanho dos colesteatomas, com o número de vasos contados em cada imagem foi obtida a média. As áreas da perimatriz com óbvio tecido de granulação foram evitadas na captura das imagens. A leitura das lâminas foi realizada por duas observadoras independentes (uma aluna do Departamento de Patologia da FAMED-UFRGS e segunda a própria pesquisadora), a variável final foi a média de todas as leituras realizadas em cada lâmina.
A imunoreatividade das metaloproteinases foi observada na matriz dos colesteatomas, sendo que a MMP9 no citoplasma das células do epitélio e a MMP2 tanto no citoplasma quanto no núcleo.
Observou-se a intensidade de coloração da MMP2 e da MMP9, sendo resultado expresso em 0, 1, 2 e 3, de acordo com a intensidade de coloração das metaloproteinases (ausente, discreto, moderado, acentuado, respectivamente).
Além de estimar o percentual de material que havia sido corado, numa escala que variou de zero (nada) a 100% (todo o material corado). A variável final a ser analisada, estatisticamente, foi o resultado do produto entre a intensidade de coloração e o percentual de material corado, utilizado de forma dicotômica, ou seja, quando os percentuais variavam de 0 a 50% entravam como fator multiplicador igual a um, de 51 a 100% a intensidade era multiplicada por dois.
O grau histológico de inflamação foi coletado de forma ordinal, com valores de zero a três, sendo 0 = ausente, 1 = discreto, 2 = moderado e 3 = acentuado, sendo caracterizado pela intensidade da permeação da perimatriz por linfócitos, neutrófilos, plasmócitos e macrófagos20.
O número médio de camadas de células na matriz foi coletado de forma quantitativa, com a contagem de camadas de células da matriz, em cinco campos distintos da lâmina, realizando a média destas para obter a estatística a ser testada.
A espessura da perimatriz foi obtida através de análise de imagens computadorizadas utilizando o software ImagePro Plus Media Cybernetics (Figura 4). De cada amostra foram realizadas 20 medidas da espessura da perimatriz, as quais foram sumarizadas pela média sendo estas as estatísticas utilizadas para as comparações apresentadas.
Para os dados descritivos foram utilizadas tabelas de freqüência. Para a análise estatística foi utilizado o coeficiente de Spearman na análise da correlação do número médio de vasos sangüíneos e da quantificação das metaloproteinases com o número médio de camadas de células na matriz, com o grau histológico de inflamação, com a espessura da perimatriz e com a idade do paciente à data da cirurgia. O coeficiente de Pearson foi utilizado para verificar a correção entre a idade e o grau histológico de inflamação na perimatriz. Para a comparação do número médio de vasos sangüíneos e da quantificação das metaloproteinases, entre os grupos, foi utlizado o teste Mann Whitney. A análise foi realizada no software SPSS 10.0 for Windows. Foram considerados como estatisticamente significativos os valores de P menores que 0,05.
Resultados
1 - Dados Epidemiológicos
A amostra contou com 120 colesteatomas, sendo distribuídos igualmente entre os grupos pediátrico e adulto (pediátricos até 18 anos e adultos com mais de 18 anos); bem como a distribuição de gênero foi igual nos dois grupos. A média ± desvio padrão da idade dos pacientes à data da cirurgia foi de 24,99 ± 16,80 anos. O grupo pediátrico, apresentou média de idade igual a 11,75 ± 3,48 anos, sendo de 38,02 ± 14,31 anos no grupo adulto.
2 - Achados histológicos
Os colesteatomas 120 incluídos nessa amostra apresentaram-se, ao microscópio óptico, como uma formação cística, revestida por epitélio escamoso estratificado e queratinizado, a chamada matriz, assentada sobre uma rede inflamatória de tecido conjuntivo denso com espessura variável, a perimatriz. O conteúdo cístico, por sua vez, consistia de lamelas de queratina. Na figura 5, podemos ver um exemplo bastante representativo da constituição histológica dos colesteatomas adquiridos.
A espessura variável apareceu tanto quando observamos colesteatomas provenientes de diferentes pacientes, quanto no material do mesmo indivíduo. Um mesmo espécime apresentou regiões de espessura bastante delicadas até áreas muito espessas. No grupo total apresentou uma mediana de 81 micrômetros, tendo como valor mínimo zero e valor máximo 1269. Quando a medida da espessura da perimatriz foi estratificada por idade, apresentou, no grupo pediátrico, uma mediana de 104 com valor mínimo igual a zero e valor máximo de 1269 e no grupo adulto, uma mediana de 51, tendo como valor mínimo zero e valor máximo 870.
Em 50% das amostras o grau histológico de inflamação na perimatriz foi classificado como de moderada a acentuado. Ao aplicarmos o coeficiente de correlação de Spearman entre o grau histológico de inflamação e a espessura da perimatriz encontramos correlações, significativas, com magnitudes de moderadas a fortes.
Ao correlacionarmos o número médio de camadas de células epiteliais com a espessura da perimatriz encontramos correlações, de moderadas a fortes.
Ao utilizarmos o coeficiente de Spearman com a idade e o grau histológico de inflamação na perimatriz foi encontrada correlação.
3 - Achados imunoistoquímicos
Dos 120 colesteatomas analisados, 30 tiveram de ser excluídos desta parte da análise, por não apresentarem condições para o processamento imunoistoquímico.
O número médio de vasos sangüíneos (Figura 6) foi de 5 (0 a 10). No grupo pediátrico foi igual a 5,5 (0,5 a 11), e no grupo adulto foi de 0 (0 a 8). Ao compararmos o número médio de vasos sangüíneos entre os grupos, através do teste Mann-Whitney, não encontramos diferença estatisticamente significativa (P=0,070).
A mediana da MMP 2 citoplasmática (Figura 7) foi de 0 (0 a 2). No grupo pediátrico foi igual a 1 (0 a 2,5), e no grupo adulto de 0 (0 a 1). Ao compararmos a quantidade de MMP2 citoplasmática entre os grupos, através do teste Mann-Whitney, encontramos diferença estatisticamente significativa (P=0,014).
Os resultados para MMP2 nuclear (Figura 8) apresentaram semelhantes: mediana grupo geral foi de 0 (0 a 1); no grupo pediátrico foi igual a 1 (0,5 a 1), e no grupo adulto de 0 (0 a 1). Ao compararmos a quantidade de MMP2 citoplasmática entre os grupos, através do teste Mann-Whitney, encontramos diferença estatisticamente significativa (P=0,044).
A mediana da MMP 9 (Figura 9) foi de 1 (0 a 4). No grupo pediátrico foi igual a 2 (0 a 4), e no grupo adulto de 0 (0 a 4). Ao compararmos a quantidade de MMP9 entre os grupos, através do teste Mann-Whitney, encontramos diferença estatisticamente significativa (P=0,050).
A tabela 1 apresenta a comparação das variáveis, entre os grupos pediátrico e adulto, através dos testes de Mann-Whitney e exato de Fisher.
Tabela 1: Comparação das variáveis estudas entre os grupos Pediátrico e Adulto
|
Variável |
Geral |
Pediátrico |
Adulto |
Valor P |
|
Espessura (n=120) |
81 (34 a 217) |
104 (47 a 243) |
51 (18 a 179) |
0,0451 |
|
Matriz (n=120) |
6 (5 a 9) |
6,5 (5 a 9) |
6 (5 a 9) |
0,7211 |
|
Número de Vasos: CD31(n=90) |
5 (0 a 10) |
5,5 (0,5 a 11) |
0 (0 a 8) |
0,0701 |
|
MMP2 citoplasmática (n=90) |
0 (0 a 2) |
1 (0 a 2,5) |
0 (0 a 1) |
0,0141 |
|
MMP2 nuclear (n=90) |
0 (0 a 1) |
1 (0,5 a 1) |
0 (0 a 1) |
0,0441 |
|
MMP9 (n=90) |
1 (0 a 4) |
2 (0 a 4) |
0 (0 a 4) |
0,0501 |
|
Hiperplasia (n=120) |
39 (34,5%) |
17 (33,3%) |
19 (32,2%) |
0,9882 |
|
Epitélio Delimitante (n=120) |
25 (22,1%) |
17 (28,3%) |
7 (11,9%) |
0,0372 |
|
Fibrose (n=120) |
75 (61,3%) |
39 (65,0%) |
36 (61,0%) |
0,6682 |
|
Granuloma (n=120) |
16 (14,3%) |
8 (13,3%) |
8 (14,5%) |
0,9992 |
|
Mann-Whitney1, Exato de Fisher2 |
|
|
|
|
Ao correlacionarmos o número médio de vasos sangüíneos e das metaloproteinases, entre si, e com o número médio de camadas celulares da matriz, com a espessura da perimatriz e com o grau histológico de inflamação encontramos correlações fortes, porém somente a MMP2 citoplasmática apresentou correlação com a idade do paciente à data da cirurgia (Tabela 2).
Tabela 2: Correlações encontradas entre as variáveis estudadas
|
|
Idade |
Espessura |
Matriz |
Inflamação |
CD31 |
MMP2 c |
MMP2 n |
MMP9 |
|
Idade |
_____ |
-0,256 (0,008) |
-0,010 (0,919) |
-0,225 (0,020) |
-0,164 (0,160) |
-0,248 (0,027) |
-0,139 (0,180) |
-0,154 (0,173) |
|
Espessura |
-0,256 (0,008) |
_____ |
|
0,642 (<0,0001) |
0,742 (<0,0001) |
0,465 (<0,0001) |
0,414 (<0,0001) |
0,643 (<0,0001) |
|
Matriz |
-0,010 (0,919) |
0,439 (<0,0001) |
_____ |
0,330 (<0,0001) |
0,473 (<0,0001) |
0,302 (<0,0001) |
0,183 (0,077) |
0,300 (0,007) |
|
Inflamação |
-0,225 (0,020) |
0,642 (<0,0001) |
0,330 (<0,0001) |
_____ |
0,617 (<0,0001) |
0,444 (<0,0001) |
0,398 (<0,0001) |
0,504 (<0,0001) |
|
CD31 |
-0,164 (0,160) |
0,742 (<0,0001) |
0,473 (<0,0001) |
0,617 (<0,0001) |
_____ |
0,539 (<0,0001) |
0,515 (<0,0001) |
0,850 (<0,0001) |
|
MMP2 c |
-0,248 (0,027) |
0,465 (<0,0001) |
0,302 (<0,0001) |
0,444 (<0,0001) |
0,539 (<0,0001) |
_____ |
0,908 (<0,0001) |
0,664 (<0,0001) |
|
MMP2 n |
-0,139 (0,180) |
0,414 (<0,0001) |
0,183 (0,077) |
0,398 (<0,0001) |
0,515 (<0,0001) |
0,908 (<0,0001) |
_____ |
0,548 (<0,0001) |
|
MMP9 |
-0,154 (0,173) |
0,643 (<0,0001) |
0,300 (0,007) |
0,504 (<0,0001) |
0,850 (<0,0001) |
0,664 (<0,0001) |
0,548 (<0,0001) |
_____ |
|
Idade= idade do paciente à data da cirurgia, em anos; Espessura= espessura da perimatriz, em micrômetros; Matriz= número médio de camadas celulares da matriz; Inflamação= grau histológico de inflamação; CD31= número médio de vasos sanguíneos na perimatriz; MMP2 c= reatividade da metaloproteinase 2 no citoplasma das células da matriz; MMP2 n= reatividade da metaloproteinase 2 no núcleo das células da matriz; MMP9= reatividade da metaloproteinase 9 no citoplasma das células da matriz; Coeficiente de Correlação de Spearman (Valor P) | ||||||||
Discussão
Dornelles1 fez uma analogia da perimatriz com um "campo de batalha", onde ocorreria a disputa entre o colesteatoma e os tecidos adjacentes da mucosa da caixa timpânica, pelo território da orelha média. Com a expansão do colesteatoma, a inflamação aumentaria produzindo mais elementos da cascata inflamatória. Ainda nesse trabalho1, a autora sugere que é nos processos bioquímicos, que acontecem na perimatriz, que residiria a agressividade dos colesteatomas.
Analisando nossos estudos prévios1,13,14 podemos sugerir duas hipóteses para as diferenças de espessura da perimatriz, em colesteatomas adquiridos, levando-se em conta que essa é formada por colágeno e células inflamatórias21. Uma perimatriz mais espessa poderia ser conseqüência de uma maior quantidade de fibras colágenas e, conseqüentemente, de uma menor ação da enzima colagenase; ou a espessura poderia dever-se ao processo inflamatório acentuado.
Como, em nossos estudos prévios1,13,14, a análise do grau inflamatório foi realizada através de uma variável semiquantitativa, neste estudo buscamos aumentar a precisão da análise empregando dados quantitativos obtidos por imunoistoquímica, com anti-CD 31. Os presentes achados confirmaram a existência de correlação entre o tamanho da perimatriz e seu grau histológico de inflamação, pois quanto maior a espessura maior foi o grau de angiogênese encontrado.
Porém, não conseguimos confirmar os achados de correlação da inflamação histológica, através da angiogênese, com a idade do paciente à data da cirurgia.No entanto, apesar de não encontramos diferença estatística podemos observar que, no grupo pediátrico, o número médio de vasos sangüíneos na perimatriz é bem maior do que no adulto.
Neste ponto, ainda resta-nos a questão da quantidade de fibras de colágeno na perimatriz, dado que estudamos através das enzimas que degradam esta proteína, as colagenases ou metaloproteinases. Em 1998, Banerjee e colaboradores22, demonstraram que as MMP 2 e 9, encontravam-se presentes no colesteatoma. Em 2001, Bernal Sprekelsen e colaboradores18 perceberam que as metaloproteinases e o fator de crescimento básico de fibroblastos, poderiam explicar atividades destrutivas e proliferativas do colesteatoma. No mesmo ano, Zhu e colaboradores23, em estudo experimental, demonstraram que a desordem entre metaloproteinases e seus inibidores, foi uma das razões pela absorção óssea causada por colesteatoma de orelha média. Em 2003, Wilmoth e colaboradores19, observaram, também em estudo experimental, que membranas timpânicas colocadas em cultura com toxinas de bactérias, expressaram maior quantidade de MMP. Parece-nos, portanto que colesteatomas, estimulados por fatores infecciosos, produzem mais dessas enzimas que degradam fibras de colágeno.
Sabemos que as MMP são enzimas proteolíticas capazes de degradar componentes conectivos dos tecidos, característica que está associada com a capacidade de infiltração e invasão em tecidos adjacentes.
No presente estudo pudemos demonstrar que as metaloproteinases estão com expressão aumentada em colesteatomas com perimatriz mais espessa e com um maior grau histológico de inflamação, fato que nos leva a sugerir que a espessura da perimatriz está associada ao processo inflamatório e não à quantidade de fibras colágenas de sua estrutura; levando-se em conta que a produção de metaloproteinases é estimulada pelo processo inflamatório e também por que estas enzimas degradam colágeno. Também pudemos mostrar que as metaloproteinases (MMP 2 citoplasmática, MMP 2 nuclear e MMP 9) apresentaram-se com expressão aumentada nos colesteatomas pediátricos.
Cabe, neste momento, ressaltar que a MMP2 citoplasmática também estava correlacionada, inversamente, com a idade do paciente à data da cirurgia, ou seja, quanto menor a idade do paciente maior é a expressão dessa proteína.
Em processos biológicos normais, as MMP são responsáveis pela homeostase do tecido ósseo, apresentando-se expressa em maior quantidade em doenças inflamatórias osteolíticas. Através dos resultados, por nós encontrados, podemos sugerir que os colesteatomas pediátricos possuam um maior poder de invasão e erosão, em conseqüência da maior expressão de metaloproteinases, do que os colesteatomas em pacientes adultos.
Em uma análise global dos resultados desse trabalho, podemos então voltar ao termo citado no início desta discussão, o "campo de batalha" e, agora, afirmar que é nessa estrutura do colesteatoma onde são desencadeados os gatilhos da erosão óssea, marca registrada da otite média crônica colesteatomatosa. Ao lembramos que os colesteatomas de pacientes pediátricos possuem uma perimatriz mais espessa que os de pacientes adultos, podemos afirmar que a otite média crônica colesteatomatosa, quando em crianças, é mais agressiva.
Conclusões
A perimatriz de colesteatomas pediátricos é mais espessa do que a de adultos.
O número médio de vasos sangüíneos está fortemente correlacionado com a quantidade de metaloproteinases, com o número médio de camadas celulares da matriz, com a espessura da perimatriz, com o grau histológico de inflamação.
A expressão das metaloproteinases é maior nos colesteatomas de pacientes pediátricos, fato que poderia justificar um aumento no seu poder de infiltração e de erosão óssea.
Os colesteatomas pediátricos apresentarem uma perimatriz mais espessa, possuem um maior grau inflamatório e produzem mais metaloproteinases, fatores estes, que combinados, poderiam conferir-lhe uma agressividade maior do que os colesteatomas adultos.
Referências Bibliográficas
1. Dornelles CD. Colesteatomas Adquiridos: Análise Comparativa da Perimatriz entre Pacientes Pediátricos e Adultos [dissertação]. Porto Alegre, UFRGS, 2004.
2. Cruz O e Costa SS. Otologia Clínica e Cirúrgica. Ed. Revinter, 1999.
3. Sheehy JL. Management of cholesteatoma in children. Adv. Oto-Rinolaryng, 1978; 23: 58-64.
4. Tos M. Treatment of cholesteatoma in children: A long-term study of results. J Otol. 1983; 4: 189-97.
5.
6. Glasscock ME, Dickins JFE, Wiet R. Cholesteatoma in children. Laryngoscope 1981; 91:1743-53.
7. Ruah CB, Schachem PA, Paparella MM, Zelterman D. Mechanisms of retraction pocket formation in the pediatric tympanic membrane. Arch. Otolaryngol Head Neck Surg. 1992; 118(12): 1298-1305.
8. Bujia J, Holly A, Antoli-Candela F, Tapia MG. Immunobiological peculiarities of cholesteatoma in children: quantification of epithelial proliferation by MIB1. Laryngoscope 1996; 106(7): 865-8.
9. Palva A, Karma P, Kärjä J. Cholesteatoma in children. Arch Otolaryngol. 1997; 103(2): 74-7.
10. Sudhoff H, Dazert S, Gonzales AM, Borkowski G, Park SY, Baird A, et all. Angiogenesis and angiogenic growth factors in middle ear cholesteatoma. The Am. J. of Otol. 2000; 21: 793-8.
11. Smythe JL, Brachman D, Grahm M. Complications of cholesteatoma: A report on 1.024 cases. In: Swartz J D. Colesteatomas of the middle ear. Diagnosis, Etiology and Complications. Radiol Clin North Am 1984;
12. Quaranta A, Resta L, Santangelo A. Otomastoid cholesteatoma in children: histopathological findings. Int J. Pediatric Otorhinolaryngol. 1986; 12(2): 121-6.
13. Dornelles CD, Costa SS, Meurer L, Schweiger C. Comparação da espessura da perimatriz, de colesteatomas adquiridos, entre pacientes pediátricos e adultos. Rev. Bras. de ORL 2005; 71(6): 792-7.
14. Dornelles CD, Costa SS, Meurer L, Schweiger C. Descrição histológica de colesteatomas adquiridos: comparação entre amostras de crianças e de adultos. Rev. Bras. de ORL 2006; 72 (5): 641-8.
15. Meurer L. Densidade microvascular e expressão imunoistoquímica de p21: associação com sobrevida em pacientes submetidos à cirurgia por carcionama epidermóide de esôfago [tese]. Porto Alegre, UFRGS, 2003.
16. Milewski C. Role of perimatrix fibroblast in development of acquire middle ear cholesteatoma. A hypothesis. HNO 1998; 46(5): 494-501.
17. Folkman J. Tumor angiogenesis. In: Mendelson JHP, Israel MA, Liotta LA, editor. The molecular basis of cancer.
18. Bernal-Sprekelsen M, Ebmeyer J, Anonopoulos A, Borkowiski G, Sudhoff H. Alteraciones de la membrana basal en el colesteatoma de oído medio.- Acta Otorrinolaringol Esp, 2001 May; 52(4):330-5.
19. Wilmoth JG, Schultz GS, Antonelli PJ. Tympanic membrane metalloproteinase inflammatory response. - Otolaryngol Head Neck Surg, 2003; 129(6): 647- 54.
20. Baak JPA. Manual of quantitative pathology in cancer diagnosis and prognosis. Springer-Verlag, 1991.
21. Lim DJ e Saunders WE. Acquired cholesteatoma: light and electron microscopic observations. Ann Otol. 1972; 81: 2-12.
22. Banerjee AR, James R, Narula AA. Matrix metalloproteinase-2 and matrix metalloproteinase-9 in cholesteatoma and deep meatal skin. Clin Otolaryngol, 1998 Aug; 23(4):345-7.
23. Zhu W, Xie Y, Wang P. Expression of matrix metalloproteinase 2,
Figura 1

Diagrama esquemático dos locais de produção, de expressão e de ação das metaloproteinases nos colesteatomas adquiridos
Figura 2
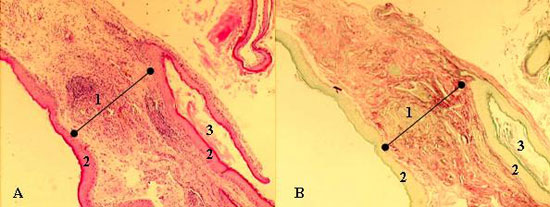
Imagem histológica de colesteatoma em hematoxilina-eosina (A) e picrossírios (B) (1 - Perimatriz, 2 - Matriz, 3 - Conteúdo Cístico)
Figura 3

Imagem representativa de colesteatoma com CD 31, apresentando a grade para medida
Figura 4
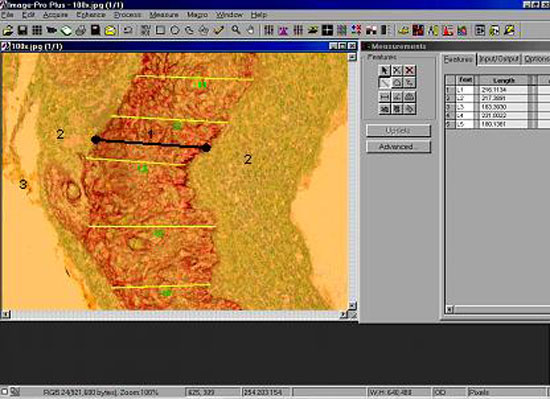
Imagem do Image Pro-Plus com técnica de medida da espessura (1 - Perimatriz, 2 - Matriz, 3 - Conteúdo Cístico)
Figura 5
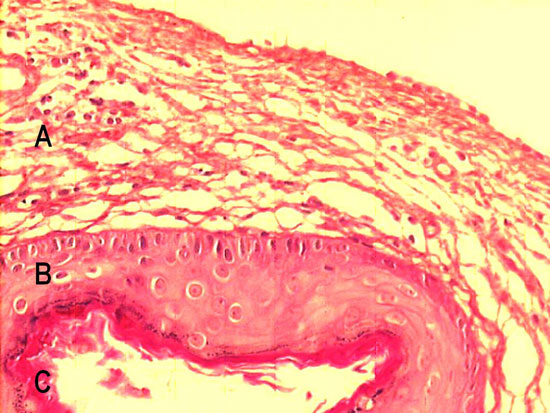
Colesteatoma representativo, ilustrando seus constituintes histológicos (A - Perimatriz, B - Matriz, C- Conteúdo Cístico)
Figura 6

Colesteatoma imunocorados com marcado com CD 31 (seta)
Figura 7
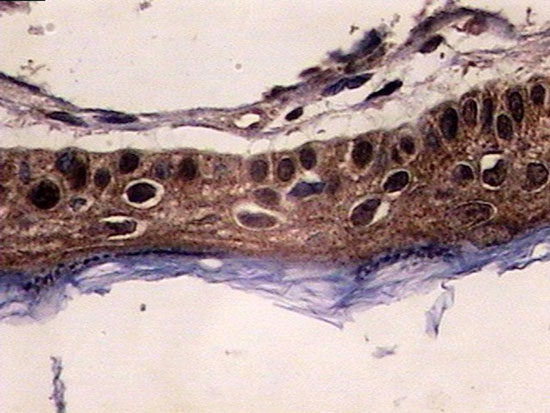
Colesteatoma imunocorados com MMP 2 citoplasmática
Figura 8
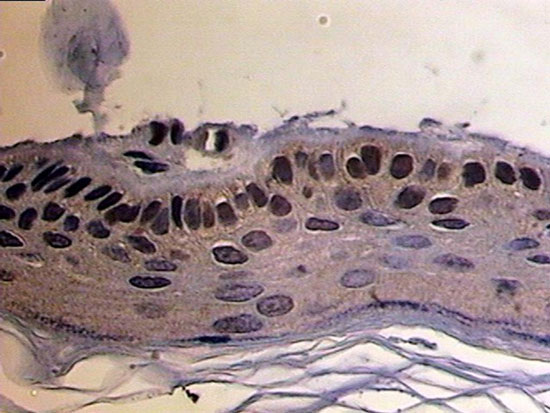
Colesteatoma marcado com MMP 2 nuclear
Figura 9
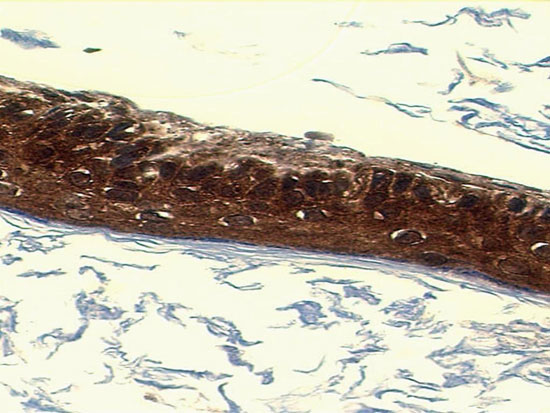
Colesteatoma marcado com MMP 9