Artigo publicado no Caderno de Debates da RBORL:
Vol.71 ed.4 de Julho - Agosto em 2005 (da página 25 à 31) |
 |
| Autor: Paula A. L. Silveira1, Marco A.F.G. Belfort2, Andy O. Vicente3, Marcos L. Antunes4, Oswaldo L. M. Cruze, Norma O. Penido5 |
 |
 |
| Relato de Caso |
| Síndrome do aqueduto vestibular alargado: revisão da literatura e análise de 5 casos |
|
 |
INTRODUÇÃO
O aqueduto vestibular é um canal ósseo na cápsula ótica que contém o ducto endolinfático (conexão entre o saco endolinfático e o labirinto vestibular e por meio do ducto reuniens, conecta-se com o ducto coclear). Ele se origina da parede medial do vestíbulo e estende-se posteriormente por cerca de um centímetro, desembocando na região posterior da pirâmide petrosa, dentro da fossa craniana posterior. Não se encontra completamente desenvolvido ao nascimento, ao contrário do restante da orelha interna, mas expande-se rapidamente (acompanhando o crescimento da fossa posterior), até atingir o tamanho adulto por volta dos 4 anos.1
O saco endolinfático parece participar da regulação do volume endolinfático e sua composição iônica. Apresenta endolinfa com concentração protéica e hiperosmolaridade maiores que o restante do labirinto membranoso.1,2
O aqueduto vestibular alargado é a anomalia congênita mais comum da orelha interna detectada em exames de diagnóstico por imagem. Sua associação com perda auditiva e sintomas vestibulares tem sido relatada há mais de 20 anos.2
Valvassori e Clemis descreveram em 1978 a presença de aqueduto vestibular anormalmente alargado em 1,5% de 3700 tomografias de orelha interna. Os achados eram associados com outras anomalias radiologicamente identificáveis em 60% dos casos, sugerindo possível parada no desenvolvimento das estruturas da orelha interna. Tal achado usualmente se associava à perda auditiva congênita ou precocemente adquirida, de natureza neurossensorial ou mista. Sintomas vestibulares podem estar presentes.4
Em vários estudos para caracterização da síndrome, o alargamento bilateral do aqueduto vestibular tem sido observado em 59 a 94%, com predomínio feminino variando de 60 a 66%. A perda auditiva é identificada na infância, com progressão em 46 a 65% dos pacientes5, não confirmando publicações iniciais que sugeriam que a perda auditiva era congênita, não-progressiva e não-flutuante.2 Um componente condutivo adicional pode ser visto em 15 a 25% dos pacientes.5 A progressão da perda pode ser súbita ou flutuante com curva audiométrica descendente, freqüentemente associada a traumas insignificantes de cabeça.2,5 Existem descrições de perda auditiva após infecção viral com febre alta.6
A causa da perda auditiva permanece controversa, particularmente no que se refere à perda súbita relacionada a pequenos traumas de cabeça. Existem teorias a respeito da formação de metabólitos tóxicos, ruptura da homeostase endolinfática, fístulas intracocleares, fístula perilinfática, refluxo dos fluidos hiperosmolares do saco endolinfático para a cóclea por uma ampla patência do ducto endolinfático, transmissão de forças hidráulicas do saco endolinfático para a cóclea devido à redução de resistência pelo alargamento do aqueduto, onde as estruturas (saco e sistema ductal endolinfático) podem estar anormalmente alargadas.2,5 A súbita flutuação da pressão do LCR pode comprimir o envelope de dura que envolve o saco endolinfático, expelindo seu líquido hiperosmótico, que refluiria em direção ao giro basal da cóclea, para o ducto coclear, através do ducto reuniens, em função do alargamento do ducto endolinfático. Deste modo, espera-se que o dano maior ocorra no neuroepitélio da porção basal do ducto coclear, produzindo uma perda neurossensorial em altas freqüências.
Em casos relatados de surdez neurossorial súbita, o ponto de lesão foi a junção do ducto reuniens e ducto coclear. A membrana de Reissner encontrava-se anormalmente abaulada neste ponto, sugerindo que esta região seja especialmente vulnerável a súbitas modificações da pressão do sistema endolinfático. Este achado poderia ser explicado pela súbita modificação da pressão osmótica nesta área, resultando numa distensão súbita da membrana com ruptura celular.2
Inicialmente, o diagnóstico era feito por politomografia que foi substituído pela tomografia computadorizada de alta resolução. A melhor projeção para visibilização do aqueduto vestibular pela CT é lateral e lateral modificada. Os autores obtêm a imagem de CT de alta resolução com cortes axiais de 1,5mm do osso temporal, com reconstrução sagital e para axial ao longo do eixo do aqueduto vestibular. A não-visibilização do aqueduto não significa que ele não esteja presente. Ele é considerado alargado quando seu diâmetro ântero-posterior é de 1,5mm ou mais.7 A TC é o exame de eleição para diagnóstico radiológico de Síndrome do Aqueduto Vestibular Alargado (SAVA). A RM apresentava uso limitado pela perda de sinal devido à interface aéreo-óssea intrínseca do osso temporal. Com o uso de novas técnicas, obtiveram-se melhores detalhes do labirinto membranoso da orelha interna, inclusive através de cortes mais finos. Enquanto a CT só mostra imagens do labirinto ósseo, a RM tem permitido delinear-se o labirinto membranoso.8
A Ressonância Magnética tem avançado em demonstrar as características anatômicas da síndrome5, encontrando-se hipersinal em T2 evidente na fossa posterior, anterior ao seio sigmóide e posterior ao meato acústico interno (MAI), consistente com a localização do ducto e saco endolinfático.6 O saco endolinfático aparece isointenso em T1 e T2. A pulsação do cérebro gera discreta diminuição do sinal do líquor em T2, gerando imagem em T2 do saco endolinfático de sinal um pouco maior que do líquor, por estar mais protegido das pulsações cerebrais. A localização do saco na fossa posterior, adjacente ao seio sigmóide e posterior ao MAI gera a suspeita de SAVA, embora a RM não mostre bem o ducto endolinfático. É importante não confundir o diagnóstico da SAVA com outras condições patológicas, principalmente, schwannoma vestibular que se acentuaria após injeção de contraste. Se a anomalia óssea não é reconhecida, o saco endolinfático alargado pode ser confundido com o líquor ao redor do hemisfério cerebelar e então, a confirmação da SAVA pode ser obtida com CT de cortes finos.6
A experiência cirúrgica para pacientes com SAVA é limitada. Exploração da orelha média para fístulas foi realizada em 2 pacientes com história de surdez neurossensorial súbita após TCE mínimo por Levenson et al. e não demonstrou alterações, e muitos meses após a cirurgia, a audição estava parcialmente recuperada em médias e baixas freqüências, embora a perda em altas freqüências se mostrou permanente. Um caso de paciente de 30 anos com surdez súbita unilateral após prática de esporte com exploração de orelha média negativa para fístulas foi submetido imediatamente após a descompressão do saco endolinfático, sem retorno da audição, concordando com Emmet que não obteve melhora da audição em 4 casos de descompressão em SAVA2. Um shunt endolinfático até o espaço subaracnóideo realizado em 7 orelhas para tentar estabilizar a perda auditiva demonstrou no pós-operatório imediato de 4 pacientes queda repentina da audição.
Baseado nos achados de Hirsch de compressão do saco endolinfático com resolução de vertigem episódica e zumbido, Wilson et al. propuseram a obliteração do saco endolinfático para controlar a perda auditiva neurossensorial progressiva em pacientes com SAVA. A obliteração cirúrgica foi realizada por via transmastoídea em 7 orelhas de 6 pacientes, com RM de controle com 6 meses ou mais de pós-operatório não evidenciando patência do saco endolinfático e aqueduto vestibular, com audição estável num período médio de 3,2 anos (6 meses a 6 anos) em 6 orelhas e progressão da perda mantida em uma orelha, sugerindo que a obliteração cirúrgica do saco endolinfático possa estabilizar a audição em pacientes com SAVA e perda progressiva da audição.
Os resultados desfavoráveis da cirurgia do saco endolinfático nestes pacientes com alargamento do aqueduto vestibular talvez sejam decorrentes de alteração súbita da dinâmica e composição dos fluidos da orelha interna, pela abertura do saco grandemente dilatado. Ausência de eficácia semelhante e persistente tem sido observada atualmente nas cirurgias do saco endolinfático em outras má-formações de orelha interna. Por esta experiência, Jackler e De La Cruz abandonaram o procedimento do saco endolinfático com objetivo de estabilização da audição em pacientes com aqueduto vestibular alargado.9 Provavelmente os pacientes que tiveram perda profunda dentre os operados tenham ainda nervo viável o suficiente para permitir algum benefício com estimulação elétrica da orelha interna.9 Welling et al., numa série de 10 pacientes, 5 dos quais com perda maior que 25dB após a oclusão do aqueduto vestibular alargado, não evidenciando benefícios na preservação auditiva. Isto serve de alerta para o potencial de severa perda auditiva neurossensorial após a oclusão cirúrgica do aqueduto vestibular.
O objetivo do presente trabalho é descrever o diagnóstico e evolução de 5 pacientes portadores de SAVA confirmados através de tomografia computadorizada de ossos temporais no serviço de Otorrinolaringologia da UNIFESP/ EPM - Hospital São Paulo, no período de janeiro de 2001 a junho de 2003.
RELATO DE CASOS CLÍNICOS
Caso 1
RP, 9 anos, masculino, branco. Hipoacusia há 6 meses notada pelos pais que relatavam que a criança estava mais distraída e ouvindo televisão mais alto. Negavam trauma crânio encefálico (TCE).
Antecedentes pessoais: Nascido a termo de parto cesáreo, sem intercorrências. Desenvolvimento neuropsicomotor (DNPM) dentro da normalidade. Talassemia minor sem anemia; uso de ácido fólico diariamente. Rinite alérgica. Audiometrias aos 6 e 7 anos: normais.
Antecedentes familiares: Família paterna com talassemia minor, inclusive pai e irmã. Irmã com Displasia de Mondini e retardo da aquisição de fala importante; uso de Aparelho de Amplificação Sonora Individual (AASI) bilateral retroauricular. Pai e mãe: audição normal.
Exame físico geral e otorrinolaringológico (ORL): Membrana timpânica íntegra bilateral; prega nasal transversa bilateral, conchas nasais hipertróficas e pálidas. O restante, dentro da normalidade.
Exames complementares: Audiometria e imitanciometria: disacusia neurossensorial moderada severa à direita e profunda à esquerda, com ausência de reflexo estapediano e curva timpanométrica tipo A. Otoemissões (produto de distorção): ausentes. Tomografia Computadorizada (TC) de ossos temporais em corte axial: aqueduto vestibular alargado bilateralmente, sem outras alterações do labirinto ósseo (Figura 1). Ressonância Magnética (RM) de orelha interna e ângulo ponto cerebelar: em T2, sinais sugestivos de dilatação do aqueduto vestibular bilateral (Figura 2).
Conduta: Orientações para evitar esportes de contato, esforço físico e quedas ou TCEs. Encaminhado para protetização auditiva e aprendizado de leitura labial com melhora na comunicação e boa adaptação de AASI retroauricular bilateral.
Evolução: Audiometria de controle 2 e 6 meses após constatação da perda auditiva, mantendo mesmos limiares audiométricos, e apresentando melhora do rendimento escolar.
Caso 2
RBSB, 7anos, masculino, branco. Mãe referia que, imediatamente após contusão leve de nariz, o paciente passou a se queixar de diminuição de audição à direita.
Antecedentes pessoais: criança portadora de deficiência auditiva bilateral de causa desconhecida, aparentemente estável, percebida pela mãe desde os primeiros meses de vida, porém só sendo diagnosticada aos 4 anos de idade, com adaptação de AASI retroauricular bilateral. Audiometria desta época: disacusia neurossensorial moderada-severa à direita e profunda à esquerda, com curva timpanométrica tipo a e ausência de reflexos estapedianos.
Antecedentes familiares: negava surdez ou má-formações congênitas.
Exame físico geral e ORL: sem alterações.
Exames complementares: Audiometria e imitanciometria 1 dia após trauma: disacusia neurossensorial profunda bilateral com curva A e ausência de reflexos. TC ossos temporais: aqueduto vestibular alargado bilateralmente; sem sinais de fratura ou de conteúdo de partes moles em orelha média (Figuras 3 e 4).
Conduta: Prednisona 1mg/kg/dia por 15 dias. Orientações para evitar esportes de contato ou TCE. Teste de descarga do perclorato de potássio positiva.
Evolução: Audiometria de controle 1 mês após: melhora dos limiares à direita, retornando à condição de disacusia neurossensorial moderada-severa à direita prévia ao TCE e mantendo disacusia neurossensorial profunda à esquerda.
Caso 3
RPS, 8 anos, masculino, pardo. Após TCE leve (queda da própria altura), mãe refere que paciente passou a não responder mais a estímulos sonoros. Negava hematomas, perda da consciência.
Antecedentes pessoais: Hipoacusia desde a infância, de causa desconhecida, não investigada previamente. Baixo rendimento escolar. Atraso da aquisição da linguagem. Nascido de parto normal, a termo, sem intercorrências neonatais.
Antecedentes familiares: nega surdez na família.
Exame físico geral e ORL: normal.
Exames complementares: Audiometria e imitanciometria: disacusia neurossensorial profunda bilateral sem reflexos e curva C à timpanometria (Figura 5). TC de ossos temporais: evidência de dilatação de aqueduto vestibular bilateralmente, sem outras má-formações de labirinto ósseo.
Conduta: Prednisolona 1mg/kg/dia por 15 dias. Orientações para evitar TCE.
Evolução: audiometria 3 meses após queda com mesmo padrão de perda auditiva. Encaminhado para avaliação fonoaudiológica no intuito de protetização e fonoterapia.
Caso 4
EM, 10 anos, masculino, branco. Perda auditiva progressiva desde os 4 anos de idade, com uso de AASI bilateral sem diagnóstico etiológico estabelecido. Após TCE leve (queda da cama) há 3 meses, piora importante da audição. Encaminhado para avaliação otorrinolaringológica por solicitação escolar.
Exame físico normal. Audiometria e imitanciometria: disacusia neurossensorial bilateral severa à Esquerda (SRT=65dB) e moderada-severa à Direita (SRT=50dB).
RM orelha interna em T2, cortes axiais: evidências de aqueduto vestibular alargado (Figura 6).
Caso 5
HSC, 7anos, feminino, branca. Mãe percebeu que criança sempre foi muito quieta desde 1 ano de idade, mas só foi feito diagnóstico definitivo de deficiência auditiva aos 3 anos, quando a criança foi submetida a adenoamigdalectomia e colocação de tubo de ventilação bilateral, com discreta melhora da hipoacusia que se manteve estável desde então, sem flutuação ou piora abrupta.
Antecedentes pessoais: parto cesáreo de gemelares univitelinas a termo, sem complicações. Pré-natal sem intercorrências. Sem infecções na infância.
Antecedentes familiares: sem disacusias ou consangüinidade na família.
Exame físico: membrana timpânica translúcida e íntegra bilateralmente. Amigdalectomizada. Sem alterações sindrômicas ou neurológicas.
Audiometria com disacusia neurossensorial bilateral profunda em agudos (em rampa) com discriminação de 72% à direita e 76% à esquerda. SRT de 55dB à direita e 45dB à esquerda. Imitanciometria com curva C à direita e As à esquerda; ausência de reflexos bilateralmente
ABR com aumento da latência de P1 à direita e de P3 e P5 à esquerda, com limiares a 90dB SPL (60 dB HL) à direita e a 100 dB SPL (70 dB HL) à esquerda. Emissões Otoacústicas por produto de distorção ausente em ambas as orelhas.
Paciente encaminhada para protetização, seguindo orientações para permanecer próximo à professora na escola tradicional, evitar ruído na sala de aula, proteção quanto a traumatismos cranianos leves. Apresentando bom desempenho escolar, aquisição de fala e linguagem adequadas e sem dificuldade na escrita.
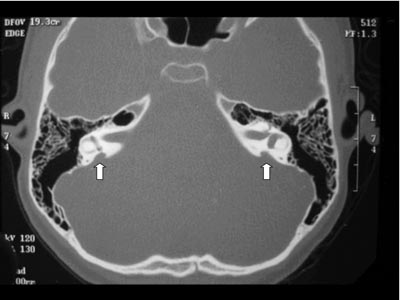 Figura 1. Tomografia Computadorizada (TC) de ossos temporais em corte axial com aqueduto vestibular alargado bilateralmente. 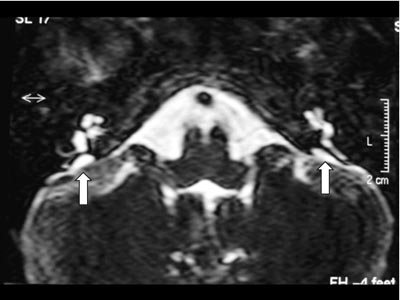 Figura 2. Ressonância Magnética (RM) de orelha interna e ângulo ponto cerebelar em T2 com sinais sugestivos de dilatação do aqueduto vestibular bilateralmente. 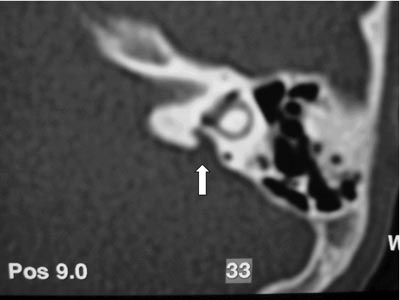 Figura 3. TC de osso temporal à esquerda com aqueduto vestibular alargado. 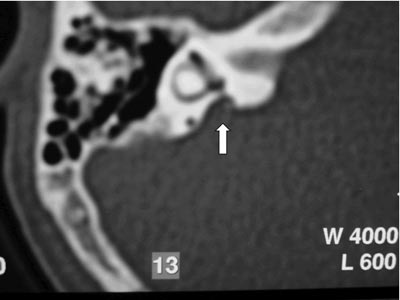 Figura 4. TC de osso temporal à direita com aqueduto vestibular alargado. 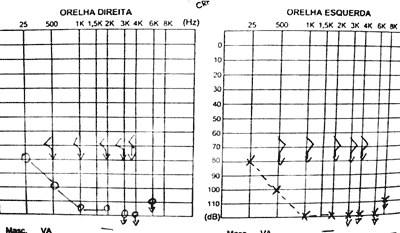 Figura 5. Audiometria tonal com disacusia neurossensorial profunda bilateralmente. 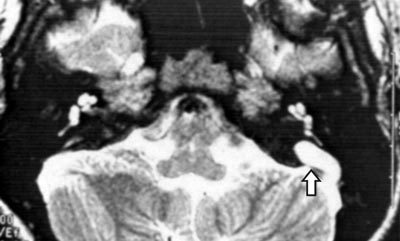 Figura 6. RM de orelha interna e ângulo ponto cerebelar em T2, corte axial com evidência de aqueduto vestibular alargado.
DISCUSSÃO
Quatro dos 5 pacientes acompanhados no nosso serviço eram do sexo masculino, contrariando algumas estatísticas que apresentam predomínio de sexo feminino.5
A perda auditiva súbita se deu na infância nos 4 meninos, com idade média de 8,5 anos (7 a 10 anos) e em 3 dos 4 casos foi precipitada por traumatismo crânio-encefálico leve identificado na história. Crianças com audição normal e aqueduto vestibular alargado têm risco maior de surdez súbita.2 Apenas o paciente do 1o caso não apresentava história de hipoacusia durante toda a infância no momento do diagnóstico da SAVA. Esses dados coincidem com os da literatura chamando a atenção para perda neurossensorial precoce com agravamento através de TCEs (leves) confirmados.
O exame físico era normal em todos os casos e nenhum dos pacientes apresentava sintomas vestibulares associados ao quadro. Os sintomas vestibulares podem ser visto na minoria dos pacientes, mais freqüentes em adultos.5
Apenas o caso 2, cuja perda auditiva foi precipitada por traumatismo nasal, apresentou retorno da audição aos limiares anteriores, pelo menos no período de evolução avaliado, após instituição de corticoterapia, embora mantendo disacusia moderada-severa à direita.
O diagnóstico final de SAVA foi estabelecido através de exame de imagem: tomografia computadorizada e/ou ressonância magnética. Todos os nossos casos apresentavam aqueduto dilatado bilateralmente, embora a perda auditiva nos casos 1 e 4 fosse assimétrica, e por não ser tão profunda, permitia melhor adaptação e benefício com o uso de AASI.
O corticóide foi administrado nos caso onde o evento do trauma era recente e bem evidente, visando-se o benefício antiinflamatório.
As orientações gerais incluíam evitar esportes de contato e situações que pudessem provocar traumatismos cranianos, adaptação de prótese auditiva quando possível, encaminhamento para escolas especiais para deficientes auditivos para incentivar a leitura labial preferencialmente, devido à possibilidade de progressão da perda auditiva e audiometrias seriadas para monitorar a evolução dos limiares audiométricos.
As avaliações realizadas pela genética nos pacientes não identificaram etiologias ou síndromes associadas à dilatação do aqueduto vestibular bilateral. No intuito de melhor esclarecer a perda auditiva da irmã do paciente do caso 1, portadora de disacusia neurossensorial profunda bilateral, foi solicitada TC de ossos temporais, devido às possíveis associações entre má-formações de orelha interna e avaliar a existência de má-formações hereditárias, identificando-se displasia de Mondini como causa da perda auditiva, sem associação de aqueduto vestibular alargado.4 No caso 5, a irmã gêmea univitelina da paciente foi submetida a audiometria e imitanciometria, apresentando resultados dentro da faixa de normalidade.
Outras anormalidades associadas ao aqueduto vestibular alargado, vistas por Vasvassori e Clemis, foram o vestíbulo alargado e globoso em 25 dos 30 casos, a dilatação da extremidade ampular dos canais semicirculares lateral e superior e em apenas 8 casos associação com má-formação coclear de Mondini e Mondini-Alexander.4
Em 42 orelhas de 21 crianças com surdez congênitas com má-formação de orelha interna, avaliadas por Wsterhof et al., candidatas a implante coclear, em estudos com tomografia computadorizada e ressonância magnética para análise de anormalidades anatômicas de orelha interna e nervo vestíbulo-coclear, foi encontrado o aqueduto vestibular alargado em 21% das orelhas (9/42). Concordando com a literatura, o aqueduto alargado foi encontrado isolado em 2 pacientes, bilateralmente. Os outros 5 pacientes (56%) apresentavam associação com hipoplasia coclear, variantes de Mondini e má-formação de Mondini.10
Apenas o paciente do caso 2 conseguiu a realização do teste do perclorato neste período de avaliação. Este teste foi solicitado pela pesquisa de associação entre alteração gênica da Síndrome de Pendred e a transmissão autossômica recessiva da SAVA. Esta síndrome foi descrita pela primeira vez em 1896 por Pendred11, e caracteriza-se por manifestar-se de forma autossômica recessiva, podendo responder por 10% das perdas auditivas hereditárias. As alterações tiroideanas são variáveis, e o bócio em geral surge na segunda década sendo comum somente aumento de tireoglobulina sérica como alteração hormonal. O diagnóstico é feito através do teste do perclorato de potássio, que não é 100% sensível. Recentemente foi descrito que mutações no gene PDS do cromossomo 7q31 foram identificadas na Síndrome de Pendred. Esta mesma mutação também foi encontrada em famílias com perda neurossensorial não-sindrômica com SAVA, o que sugere que mutações do gene PDS podem causar má-formações de orelha interna11. O teste da descarga do perclorato foi positivo. Apesar das provas de função tireoideana serem normais, sem bócio, ele pode pré-estimar um hipotireoidismo sub-clínico que virá se manifestar após, na adolescência, ou mesmo um outro extremo do espectro com perda auditiva não-sindrômica, que neste caso estaria associada à SAVA.
COMENTÁRIOS FINAIS
Dentre as inúmeras causas de disacusia rapidamente progressiva ou de manifestação súbita na infância precoce ou na adolescência, cabe ao otorrinolaringologista, durante a investigação diagnóstica, buscar o possível diagnóstico de SAVA que é uma má-formação de orelha interna freqüente e talvez subdiagnosticada. Sua identificação é feita a partir da queixa de disacusia (geralmente após traumatismos cranianos leves) comprovada audiometricamente quando possível, por exames radiológicos (tomografia computadorizada ou ressonância magnética), cabendo ao otorrinolaringologista e também ao radiologista estarem atentos às má-formações de labirinto ósseo e membranoso passíveis de identificação em exames por imagem. Após o diagnóstico, a conduta é conservadora, no intuito de melhorar audição restante, evitar traumatismos cranianos leves (e conseqüente piora dos limiares auditivos), realizar enriquecimento sonoro, aumentar as pistas auditivas e indicar o implante coclear quando necessário.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Belenky WM, Madgy DN, Leider JS, Becker CJ, Hotaling AJ. The enlarged vestibular aqueduct syndrome (EVA Syndrome). ENT J 1993; 72(11): 746-51.
2. Levenson MJ, Parisier SC, Jacobs M, Edelstein D. The large vestibular aqueduct Syndrome in Children. Arch Otolaryngol Head Neck Surg 1989; 115: 54-8.
3. Bento RF, Lessa MM, Castilho AM, Sanchez TG, Gebrim ES, Brito Neto RV, Miniti A. Síndrome do Aqueduto Vestibular Alargado: relato de 3 casos e revisão da literatura. Arq otorrinolaringol 2001; 5(1): 26-30.
4. Valvassori GE, Clemis JD; The large vestibular aqueduct Syndrome. Laryngoscope 1978; 88: 723-8.
5. Wilson DF, Hodgson RS, Talbot JM. Endolymphatic sac obliteration for large vestibular aqueduct syndrome. Am J Otol 1997; 18: 101-7.
6. Hirsch BE, Weissman JL, Curtin HD, Kamerer DB. Magnetic Resonance Imaging of the large vestibular aqueduct. Arch Otolaryngol Head Neck Surg 1992; 118: 1124-7.
7. Mafee MF, Selis JE, Yannias DA, Valvassori GE, Pruzansky S, Applebaum EL, Capek V. Congenital sensorineural hearing loss. Radiology 1984; 150: 427-34.
8. Harnsberger HR, Dahlen RT, Sheelton C, Gray SD, Parkin JL. Advanced techniques in magnetic resonance imaging in the evaluation of the large endolymphatic duct and sac syndrome. Laryngoscope 1995; 105: 1037-42.
9. Jackler RK, De La Cruz A. The large vestibular aqueduct syndrome. Laryngoscope 1989; 99: 1238-43.
10. Wsterhof JP, Rademaker J, Weber BP, Becker H. Congenital malformations of the inner ear and the vestibulocochlear nerve in children with sensorial hearing loss: evaluation with CT and MRI. J Comput Assist Tomogr 2001; 25(5): 719-26.
11. Iwasaki S, Usami S, Abe S, Isoda H, Watanabe T, Hoshino T. Long-term Audiological Feature in Pendred Syndrome Caused by PDS Mutation. Arch Otolaryngol Head Neck Surg; 2001; 127: 705-8.
12. Nowak KC, Messner AH. Isolated large vestibular aqueduct syndrome in a family. Ann Otol Rhinol Laryngol 2000; 109: 40-4.
13. Abe S, Usami SI, Shinkawa H. Three familial cases of hearing loss associated with enlargement of the vestibular aqueduct. Ann Otol Rhinol Laryngol 1997; 106: 1063-9.
14. Tong KA, Harnsberger HR, Dahlen RT, Carey JC, Ward K. Large vestibular aqueduct syndrome: a genetic disease? AJR 1997; 168: 1097-101.
15. Welling DB, Slater PW, Martyn MD, Antonelli PJ, Gantz BJ, Luxford WM, Shelton C. Sensorineural hearing loss after occlusion of the enlarged vestibular aqueduct. Am J Otol 1999; 20: 338-43.
11 Médica especializanda do 3º ano de Otorrinolaringologia da UNIFESP/EPM.
2 Médico residente do 2º ano de Otorrinolaringologia da UNIFESP/EPM.
3 Mestre em otorrinolaringologia pela UNIFESP/EPM.
4 Doutor em Otorrinolaringologia pela UNIFESP/EPM e Livre-docente em Otorrinolaringologia pela USP. Professor visitante da Disciplina de
Otorrinolaringologia Pediátrica da UNIFESP/EPM. Chefe da área cirúrgica do setor de Otologia.
5 Professora afiliada doutora do Departamento de Otorrinolaringologia da UNIFESP/EPM. Chefe da área clínica do setor de Otologia.
Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da UNIFESP/EPM.
Endereço para correspondência: Rua João Pereira Porto 652 Freguesia do Ó 02804-120 São Paulo SP.
Tel (0xx11) 3975-6532 ou 9567-7543 - E-mail: paulalorenzon@uol.com.br
Trabalho apresentado em painel no III Congresso Triológico de Otorrinolaringologia no Rio de Janeiro de 8 a 11 de outubro de 2003.
Artigo recebido em 16 de dezembro de 2003. Artigo aceito em 17 de junho de 2004.
|
|
 |
 |
Todos os direitos reservados © Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico Facial
Av. Indianópolis, 740 - Moema - São Paulo - SP - Brasil - Fone: (11) 5052.9515 |
 |
 |
|