INTRODUÇÃONo Brasil, Rizzo et al. (1995) encontraram prevalência de 32% para a rinite alérgica em estudo que abrangeu três regiões do país. Em estudo cooperativo internacional1, também conduzido no Brasil, a prevalência variou de 7,9% em Curitiba a 31,8% em São Paulo. A condução deste estudo em Itabira2, interior de Minas Gerais, demonstrou prevalência de 9,3% entre 6 e 7 anos e 11,2% entre 13 e 14 anos. Os principais aeroalérgenos responsáveis pela rinite alérgica são os ácaros, fungos, pólens, epitélios e salivas de animais3,4. As moléculas dos aeroalérgenos são geralmente hidrossolúveis e facilmente se dispersam no ar, mas sua composição exata ainda é desconhecida (geralmente compostos de carboidratos e proteínas). Apresentam a capacidade de penetrar nas mucosas e para reagir com os anticorpos da classe IgE ligados a mastócitos necessitam de complexidade molecular para desencadear uma série de reações que resultam nos sintomas alérgicos. O diagnóstico da rinite alérgica na maioria das situações é clínico, mas, às vezes, é necessária a realização de citologia nasal e teste cutâneo para o diagnóstico diferencial com outras rinites (eosinofílica não alérgica, vasomotora, irritativa, ocupacional, associadas às doenças sistêmicas)5. O Prick Test é o teste cutâneo mais comumente empregado devido à facilidade na sua realização, baixa ocorrência de efeitos adversos (risco próximo a 0,05%), além de não ser doloroso para o paciente. O teste cutâneo é muito importante no diagnóstico diferencial das doenças nasais e a determinação do padrão de sensibilização da população com o objetivo de promover medidas de redução de exposição se constitui importante fundamento para o tratamento adequado da rinite alérgica.
MATERIAL E MÉTODOCom o objetivo de determinar a freqüência de positividade no teste cutâneo para aeroalérgenos específicos, avaliamos os prontuários de 398 pacientes com sintomas nasais sugestivos de alergia ou outras queixas otorrinolaringológicas que necessitavam deste teste para esclarecimento diagnóstico. Os pacientes selecionados eram de uma clínica de otorrinolaringologia da cidade de Sete Lagoas, referência para uma região com cerca de 500.000 habitantes, no interior de Minas Gerais (a 70 Km de Belo Horizonte).
Esta pesquisa acompanha os padrões éticos da Declaração de Helsinki.
Foram considerados critérios de exclusão para a realização do teste: lesões cutâneas na superfície volar do antebraço (eczema, feridas, prurigo, dermografismo, outras) e história pregressa de choque anafilático. Os anti-histamínicos clássicos eram suspensos por 5 dias e os da nova geração por 7 dias. O astemizol era suspenso por 6 semanas antes do teste. Avaliava-se o uso de corticóide tópico ou sistêmico por tempo prolongado (> 7 dias). Os antidepressivos tricíclicos eram suspensos 7 dias antes e os antagonistas H2, interrompidos 1 dia antes do teste6.
TÉCNICA DO "PRICK TEST"
Explica-se ao paciente toda a rotina do exame e os objetivos de sua realização. A superfície volar medial do antebraço é avaliada para excluir lesões dérmicas e procede-se à limpeza com álcool 70%. Colocam-se os extratos de alérgenos (gota única), utilizando-se o conta-gotas, a uma distância de aproximadamente 2 cm, em seqüência pré-deteminada (1ª fila: histamina, poeira doméstica, dermatofagóide, pêlo de cão, pêlo de gato, pêlo de carneiro, e 2ª fila: diluente do extrato, pena de pássaros, gramíneas, mofo, flores). Utiliza-se um PUNTOR®: (dispositivo plástico que limita o grau de penetração na pele) para cada alérgeno. Após 3 minutos, retira-se o excesso de extrato com papel toalha, evitando-se contaminar os testes vizinhos. Faz-se leitura 15 a 20 minutos após a puntura. Na ausência de pápula no teste com o diluente do extrato, a presença de pápulas com diâmetro maior ou igual a 3 mm indica teste positivo.
Foram utilizados extratos alergênicos produzidos pelo laboratório MERK do Brasil: poeira doméstica (5000PNU/ ml), Dermatophagoides pteronyssimus (1500PNU/ ml), pêlo de cão (5000PNU/ ml), pêlo de gato (5000PNU/ ml), pêlo de carneiro (5000PNU/ ml), gramíneas, fungo I (A. alternata - C. herbarum - C. globosum) (5000PNU/ ml), flores (10000PNU/ ml) e pena de periquito (5000PNU/ ml).
ANÁLISE ESTATÍSTICA
O banco de dados foi digitalizado através do software EPI-INFO 6.0 e sua consistência e análise através do software SPSS 8.0.
RESULTADOSAvaliamos a freqüência de positividade em testes cutâneos para aeroalérgenos em 398 pacientes com sintomas otorrinolaringológicos. Apenas quatro crianças (1%) estavam com 2 anos e 14 pacientes (4,2%) com mais de 60 anos (Tabela 1).
A freqüência de positividade cutânea envolvendo todas as faixas etárias, grupo de 2 a 13 anos e outro com pacientes maiores de 50 anos está demonstrada no Gráfico 1. A poeira doméstica (74,9%), o dermatofagóide (58,4%) e o mofo (36,5%) foram os alérgenos mais freqüentes, seguidos do pêlo de cão (32,7%), gramínea (22,4%), pêlo de gato (16,9%), penas (16,4%) e pêlo de carneiro (15,6%). Apenas 3,5% com positividade para pena de periquito e 1,5% para flores. 39 pacientes (9,8%) apresentaram teste cutâneo negativo. 10 pacientes (2,5%) apresentaram reação ao extrato da solução e 8 (2%) não reagiram à histamina. Não foram encontradas complicações à aplicação do teste.
Tabela 1. Estatística descritiva da idade
ESTATÍSTICA IDADE
Média - 23,2
Mediana - 18
Desvio Padrão - 17
Idade mínima - 2
Idade máxima - 78
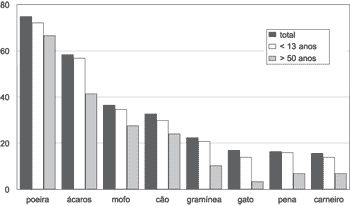
Gráfico 1. Frequência (%) da positividade cutânea total e por grupos de idade
O achado de IgE específica contra determinado antígeno indica sensibilização a ele, nem sempre coincidindo com a presença da doença, sendo necessária a interação entre múltiplos fatores para seu desenvolvimento. Os testes cutâneos devem ser realizados no contexto da história clínica, sendo de grande validade por sua simplicidade, rapidez, baixo custo e alta sensibilidade. O Prick Test é positivo em 10 a 15% dos indivíduos sem sintomas, que eventualmente podem vir a apresentar sintomas da doença alérgica com o decorrer dos anos. A criança assintomática com teste cutâneo positivo tem risco de 50% de desenvolver rinite durante os próximos 5 anos. Estes testes têm um importante valor educativo, pois o paciente pode visualizar claramente a resposta alérgica, reforçando a informação verbal, ajudando-os a avaliarem a causa de sua alergia. Estes testes deveriam ser realizados antes de considerar medidas drásticas, como a remoção do animal de estimação da família. A imunoterapia não deveria ser implementada sem a evidência do teste cutâneo como suporte.
O RAST ou outros testes sorológicos podem ser indicados no caso de não haver tolerância por parte do paciente ao teste cutâneo, em pacientes com dermografismo, dermatite grave, uso de medicamentos que possam influenciar na resposta cutânea à reação antígeno-anticorpo, na necessidade de teste confirmatório e em indivíduos que apresentem risco de reações graves aos alérgenos em estudo. A medida de IgE específica sérica é o mais importante método "in vitro" para o diagnóstico de hipersensibilidade mediada por IgE, mas tem-se mostrado menos sensível que os testes cutâneos. Os testes sorológicos têm custo mais elevado, falta de resultados imediatos e não trazem informação adicional quando comparados aos testes cutâneos.
A poeira doméstica (74,9%) e o Dermatophagoides pteronyssimus (58,4%) foram os mais freqüentes alérgenos identificados em nosso estudo. Os ácaros são os principais componentes alergênicos da poeira domiciliar, existindo mais de 300 espécies que fazem parte desta poeira7. Pertencem a uma subclasse de aracnídeos, medem cerca de 100 a 300 milímetros, sendo suas fezes o mais importante alérgeno. Os dermatofagóides ("ácaros de cama") são organismos de vida livre que se alimentam de pele descamada, que se soltam sobretudo na cama e também em roupas, em almofadas, bichos de pelúcia e bonecas de pano. Os fungos e outras substâncias ricas em proteínas também servem como alimentos. A prevalência de ácaros é maior em áreas e casas úmidas. As condições ideais de desenvolvimento dos ácaros são uma umidade relativa de 80% e temperatura superior a 20ºC. Se a umidade cair abaixo de 50%, os ácaros ressecarão e morrerão. As proteínas eliminadas nas fezes dos ácaros são os principais alérgenos causadores dos sintomas alérgicos8.
Oliveira et al. (1994) relatam que o principal alérgeno envolvido no desencadeamento de crises asmáticas é a poeira domiciliar. Segundo Castro (1997), 85% dos pacientes com alergia respiratória relatavam o agravamento de suas crises em contato com poeira doméstica e neste mesmo estudo, encontraram-se provas imunoalérgicas de leitura imediata positiva para 80% dos pacientes e os antígenos principais foram: Dermatophagoides pteronyssimus, Dermatophagoides farinae e Blomia tropicalis. No Brasil, estudos epidemiológicos vêm demonstrando a prevalência de duas espécies de ácaros: o Dermatophagoides pteronyssinus9-11 e a Blomia tropicalis12, que se modificam dependendo das condições climáticas, da umidade, da temperatura e dos fatores nutricionais do ambiente. Arruda et al. (1991), em São Paulo, demonstraram a positividade cutânea para B. tropicalis em 78% dos casos e para D. pteronyssimus em 77%. No sul do Brasil, onde existe um clima sazonal e característico, verificou-se grande presença dos ácaros: Dermatophagoides pteronyssimus, Blomia tropicalis, Tyrophagus putrescentiae e Cheyletus mallacensis13. Em Belo Horizonte os mais frequentes foram D. farinae, G. domesticus e o D. pteronyssinus14. Em recente estudo realizado em Belo Horizonte com crianças portadoras de sintomas alérgicos, Marques (1998) encontrou 86% de positividade para ácaros. A positividade isolada foi: D. pteronyssinus (78%), D. farinae (74%), B. tropicalis (64%), E. maynei (47,3%), L. destructor (36%), T. putrescentiae (31%) e G. domesticus (23,3%). Estudo realizado no Serviço de Otorrinolaringologia do Hospital das Clínicas (HC) -UFMG15, com mesmo extrato alergênico utilizado em nossa pesquisa, encontrou a seguinte positividade: 49,4% para D. pteronyssinus e 64,8% para poeira domiciliar. Os achados dos estudos citados e os resultados da nossa pesquisa demonstram a importância da poeira doméstica e do Dermatophagoides pteronyssimus na fisiopatologia da rinite alérgica em nosso meio.
No Brasil, a freqüência de testes positivos para fungos varia de 2,2% a 33%16, já em nossa pesquisa, realizada em Minas Gerais, o mofo (36,5%) foi um alérgeno muito freqüente. Em Belo Horizonte, Marques (1998) encontrou positividade de 26% para fungos (Alternaria e Hormodendrum). No estudo realizado no HC-UFMG17, a positividade para fungos foi de 6,6%. Esta parcela da população alérgica aos fungos se deve à exposição contínua e ao problema das casas mal construídas ("síndrome da casa doente"). Os fungos dependem de material animal ou vegetal para sua nutrição e uma elevada umidade relativa do ar é essencial para o seu desenvolvimento, enquanto o tempo ensolarado favorece a liberação de esporos. Apesar de não ocorrer uma forte correlação entre os testes cutâneos, RAST e testes de estimulação brônquica, o papel dos fungos na produção da alergia respiratória está bem estabelecido. Geralmente os causadores da asma são os esporos, porém outras partículas (inclusive os micélios), podem ter atividade alergênica. Diferentes espécies de fungos podem causar alergias em diferentes regimes de temperatura e umidade, existindo uma reatividade cruzada importante entre as espécies pertencentes ao mesmo gênero. Em Belo Horizonte, segundo Faria (1997), os gêneros mais constantes na atmosfera foram: Cladosporium, Penicillium e Aspergillus.
Cerca de 20 a 30% dos pacientes com asma ou rinite alérgica apresentam testes cutâneos positivos para pêlo de cão e os mesmos valores para pêlo de gato4. Em Belo Horizonte18, para epitélio de gato foram encontrados valores de positividade de 18% e para pêlo de cão de 12,7% (casos) e 9,1% (controles), não demonstrando diferença estatisticamente significativa (p= 0,561). Em nossa pesquisa a freqüência de positividade para o pêlo de cão foi de 32,7% e pêlo de gato de 16,9%. No HC-UFMG15 encontrou-se uma menor freqüência de positividade para pêlo de cão (3,3%) e para pêlo de gato (6,6%). Os pêlos não são considerados alérgenos importantes, pois não são solúveis em água e não flutuam. As proteínas da saliva, urina e ácaros ligados aos pêlos, entretanto, são considerados alérgenos importantes. As crianças podem levar em suas roupas alérgenos de animais em quantidades suficientes para desencadear sintomas alérgicos em colegas sensibilizados19,20. As mobílias e as paredes do domicílio também preservam os alérgenos por tempo considerável, mesmo após a remoção do gato21. Penas (16,4%) e pêlo de carneiro/lã (15,6%) também são considerados antígenos animais. As penas das aves apresentam um papel duvidoso no desencadeamento da alergia, mas sua contaminação por ácaros e fungos pode explicar sua ação, tal como acontece com os produtos manufaturados da lã.
CONCLUSÃOOs testes cutâneos devem ser realizados no contexto da história clínica e auxiliam na conscientização do paciente alérgico. Este estudo demonstrou que a poeira doméstica, o dermatofagóide e o mofo são os alérgenos mais freqüentes, seguidos do pêlo de cão, penas, lã e pêlo de gato.
A determinação do padrão de sensibilização da população em uma determinada região é importante, pois torna possível a adoção de medidas direcionadas, que irão reduzir o contato com os aeroalérgenos mais freqüentes e conseqüentemente, as manifestações alérgicas.
AGRADECIMENTOOs autores agradecem ao Dr. Maurício Mattar pela importante contribuição.
REFERÊNCIAS BIBLIOGRÁFICA 1. Naspitz CK Epidemiology of allergic respiratory diseases in Brazil. In: Oehlinga K, Huerta López JG. Progress in allergy and clinical immunology; Proceedings of the XVIth International Congress of Allergology and Clinical Immunology. Cancún, Mexico: Hogrefe & Huber Publishers; 1997. 90-3.
2. Werneck GAF. Prevalência e fatores de risco para asma e outras doenças alérgicas em escolares de Itabira, MG, Brasil (ISSAC Survey). Cidade do México, 1995 (Tese de Mestrado em Ciência da Saúde Ambiental - Escola Nacional de Saúde Pública do México).
3. Castro FFM. Rinite Alérgica - Modernas Abordagens para uma Clássica Questão. 1ª. São Paulo: Lemos Editorial e Gráficos; 1997. 295p.
4. Mygind N. Alergia. Um Texto Ilustrado. 1ª. Rio de Janeiro: Revinter; 1993. 481 p.
5. Jacobs RL Non-allergic chronic rhinitis syndromes. Immunol Allergy Chin North Am 1987; 7:93.
6. Miller J, Nelson HS. Suppression of immediate skin tests by ranitidine. J Allergy Clin Immunol 1989; 84:894-9.
7. Ledford DK. Indoor allergens. J Allergy Clin Immunol 1994; 94:327-30.
8. Greif Fl, Andersson M, Svensson J et al. Absorption across the nasal airway mucosa in house dust mite perennial allergic rhinitis. Clin Physiol and Functional Imaging 2002; 22(1): 55-7.
9. Fain A. Allergies respiratoires produites par un Acarien (Dematophagoides pteronyssinus) vivant dans les poussières des habitations. Bull Acad R Med Belg 1966; 6(6):479-500.
10. Negreiros EB, Filarid C, Tebyriça JN et al. Alergia ao pó de casa; estudo comparativo entre os extratos totais do pó de casa - Dermatophagoides pteronyssinus e Dermatophagoides farinae em pacientes do Rio de Janeiro. Folha Med 1975; 71:385-8.
11. Flechtmann CHW, Rosa AE. Estudo da fauna acarina da poeira domiciliar no Brasil. Rev Bras Alergia Imunol 1980; 2: 91-4.
12. Medeiros JRM, Figueiredo JP. Sensibilização a aeroalérgenos em indivíduos com asma brônquica e/ou rinite crônica em Salvador, Bahia. Rev Bras Alergia Imunopatol 1997; 20(4):143-54.
13. Rosario NA, Baggio D, Suzuki MM et al. Ácaros na poeira domiciliar em Curitiba. Rev Bras Alergia Imunopatol 1992; 15(5).
14. Moreira NS. Acarinos Pyroglyphidae e outros Sarcoptiformes em amostras de pó domiciliar em Belo Horizonte, MG. Belo Horizonte, 1975 (Tese de Mestrado em Zoologia e Parasitologia - Instituto de Ciências Biológicas da UFMG).
15. Gonçalves DU, Pedrosa BF, Viana LÍNGUA, Guimarães RE, Becker HMG, Becker CG. Citologia nasal no diagnóstico de rinite alérgica. Rev Bras de Otorrinolaringologia 1993; 59:272-5.
16. Faria A. Aspectos ecológicos e clínicos da flora micótica anemófila de Belo Horizonte. Belo Horizonte, 1997 (Tese de Doutorado em Microbiologia e Imunologia - Faculdade de Medicina da Universidade Federal de Minas Gerais).
17. Howarth P.H Allergic rhinitis: a rational choice of treatment. Respir Med 1989; 83: 179-188.
18. Marques MC. Sensibilização a aeroalérgenos em crianças e adolescentes com manifestações alérgicas respiratórias. Belo Horizonte, 1998. 127p (Dissertação de Mestrado - Fac. Medicina UFMG).
19. Munir AKM, Einarsson R, Shou D, et al Allergens in school dust: The amount of the major cat (Fel d l) and dog (Can f l) allergens in dust from Swedish school is high enough to cause perennial symptoms in most children with asthma who are sensitized to cat and dog. J Allergy Clin Immunol 1993; 91:1067-74.
20. Ronmark E, Perzanawski M, Lundback B et al. High levels of cat and dog allergens in schools in Northem Sweden - In Proceedings of XVIth International Congress of Allergology and Clinical Immunology. Cancún: Hogrefe & Huber Publishers; 1997.
21. Wood RA, Mudd KE, Eggleston PA. The distribution of cat and dust mite allergens on wall surfaces. J Allergy Clin Immunol 1992; 89:126-30.
1 Centro Mineiro de Otorrinolaringologia Pediátrica - Belo Horizonte MG.
Instituto de Otorrino de Sete Lagoas - Sete Lagoas MG.
Endereço para correspondência: Rua Joaquim Coura, 347 Bairro Santa Helena 35700-409 Sete Lagoas MG. Telefax (0xx31) 3772-2121 - E-mail: ricg@uai.com.br
Trabalho apresentado no I Congresso Triológico de Otorrinolaringologia, 14-18 de Novembro, 1999, São Paulo, Brasil.
Artigo recebido em 16 de maio de 2003. Artigo aceito em 25 de setembro de 2003.


