INTRODUÇÃOO carcinoma indiferenciado de glândulas salivares maiores é uma patologia rara, com incidência inferior a 1% dentre as neoplasias malignas desta estrutura anatômica. Foi descrito inicialmente por Helderman et al.1 (1962) e posteriormente correlacionada por vários autores com o vírus de Epstein Barr2-8.
A partir de 1992, a Organização Mundial de Saúde (OMS) classificou esta neoplasia em tipos pequenas células (£ 30 mm) e grandes células (>30 mm). Entretanto, não raramente, o carcinoma indiferenciado está associado a outras neoplasias glandulares ou epidermóides (microscopia óptica), e à presença ultra-estrutural e antigênica de diferenciação ductal, epidermóide e neuroendócrina (microscopia eletrônica e imunohistoquímica), muito embora estes achados em si não são obrigatoriamente sinalizadores de prognóstico destas neoplasias.
O Ki-67 é uma proteína não histônica9, com peso molecular aparente de 345 a 349 Kd, presente em todas as fases do ciclo de divisão celular (exceto Go), sendo sua denominação decorrente de sua identificação em Kiel (Alemanha) na 67ª placa de cultura tecidual, tratando-se de uma IgG1 de camundongo produzida contra uma fração nuclear da linhagem celular L428 da doença de Hodgkin10, alcançando sua maior expressão nas fases G2 e M11. Sendo um antígeno monoclonal, de vida média de uma hora12, o cromossomo 10 parece ser aquele envolvido na síntese protéica determinante deste antígeno no ciclo celular13,14. Assim, vários trabalhos referenciam o Ki-67 como protetor clínico do comportamento biológico das neoplasias malignas9, pois diagnostica a síntese do DNA da neoplasia com o aumento da marcação de células malignas com este antígeno11. Outro aspecto que merece ser ressaltado é a definição das margens cirúrgicas pelo Ki-67, pois demonstram a invasão tumoral por vezes não detectadas à microscopia óptica, sendo o aumento de sua positividade determinante de índices de mau prognóstico.
Vale ressaltar que a positividade do Ki-67 não é exclusiva das neoplasias malignas mas sim predominante em relação às benignas nos tecidos glandulares15,16, sendo o melhor marcador de transformação maligna, como, por exemplo, do carcinoma ex adenoma pleomórfico17.
Finalmente, foi salientada a positividade do Ki-67 em carcinomas glandulares pós-irradiação como marcadores de recidiva18, sendo tanto maior quanto a malignidade da neoplasia19,20.
Desta forma, pretendemos entender a evolução e o prognóstico do carcinoma indiferenciado das glândulas salivares maiores através do estabelecimento da correlação estatística de variáveis histopatológicas e imunohistoquímicas, com o marcador de proliferação Ki-67 através da utilização do Ki-67 clone (MIB-1).
MATERIAL E MÉTODONos Departamentos de Cirurgia de Cabeça e Pescoço, Otorrinolaringologia e Anatomia Patológica (1977 a 2000), foram revisados histologicamente blocos parafinados de 26 pacientes portadores de carcinomas indiferenciados de glândulas salivares maiores (parótida e submandibular), tratados através da cirurgia isolada ou associada à radioterapia. Os blocos selecionados foram recortados (espessura 5m), corados pela técnica histoquímica Hematoxilina-Eosina (HE), sendo avaliados à microscopia óptica segundo os critérios da OMS (1992), havendo confirmação histológica quanto ao critério morfológico em apenas 11 casos.
Na avaliação imunohistoquímica, foram empregados painel de anticorpos de citoqueratinas (AE1, AE3, 35B11 e 35B12), Antígeno de Membrana Epitelial (EMA), proteína S-100, Vimentina, Antígeno Leucocitário Comum (ALC) e Cromogranina, através do método de recuperação e amplificação antigênica empregando o anticorpo multivalente (Avitina-Biotina-Peroxidase) em diluições variáveis, visando confirmação de histogênese epitelial das células neoplásicas, aliado à exclusão dos diagnósticos diferenciais, inerentes às neoplasias com pouco grau de diferenciação (Melanomas, Linfomas Não-Hodgkin e Sarcomas).
Quanto à avaliação da proliferação celular, esta foi realizada de duas formas: a primeira através da contagem mitótica, feitas em 10 campos de maior aumento (CGA), após coloração pela HE (aumento 400x), sendo excluídos os casos não idealmente representados. Na segunda, a avaliação imunohistoquímica da proliferação celular, utilizamos o anticorpo monoclonal anti-antígeno nuclear Ki-67 (Dalso) clone MIB-1, em diluição de 1/50 (Foto 1). Para o controle das reações imunohistoquímicas, foram utilizados cortes de glândula salivar maior fixados em formol e incluídos em parafina. Como critério de positividade para Ki-67, foram feitos cortes histológicos de amídalas com marcação de linfócitos centroblásticos em centros germinativos, com nucléolos positivos quando corados em castanho (Foto 2). A quantificação da positividade do clone MIB-1 (Ki-67) foi feita através da contagem da ocorrência de núcleos positivos em 500 a 1000 células de cada caso, havendo grande rigidez na seleção de áreas consideradas positivas e negativas, sendo excluídas as duvidosas (Foto 3). Nas neoplasias idealmente representadas, a lâmina foi dividida em quadrantes e percorrida segundo uma barra grega, de modo a fornecer um número equivalente de células das diferentes áreas do fragmento.
Para o tratamento estatístico, todas as variáveis foram analisadas utilizando-se o programa estatístico GrafhPad Instat, versão 3.0 e GraphPad Prism, versão 3.0. Na determinação da influência de variáveis paramétricas e não paramétricas dos parâmetros clínicos, demográficos, anatomopatológico foram realizados respectivamente pelos testes t de Student, Fisher, ANOVA e Qui-quadrado, com correção de Yates (p < 0,05).
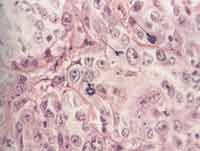
Foto 1. Corte histológico do carcinoma indiferenciado do tipo grandes células das glândulas salivares maiores, corado em (HE), com destaque para figuras de mitose (400x).
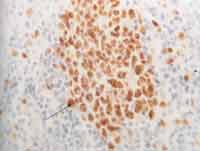
Foto 2. Corte histológico de tecido amigdalino, com destaque para células linfóides do centro germinativo (cetroblastos e centrócitos) corados em castanho, após imunohistoquímica a positiva para anticorpo Ki-67 clone MIB-1, usada como controle (400x).
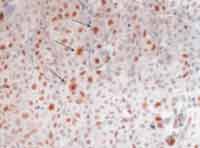
Foto 3. Corte histológico do carcinoma indiferenciado tipo grandes células das glândulas salivares maiores, com destaque para células neoplásicas, coradas em castanho, após reação imunohistoquímica positiva para o anticorpo Ki-67 clone MIB-1 (250x)
Os resultados demonstraram a inexistência de diferenças estatisticamente significativas entre os gêneros masculino (63,64%) e o feminino (36,36%) decorrente da pequena casuística (p > 0,05), embora tenha ocorrido predomínio da raça branca em 91,00% dos pacientes (p<0,01), com idade média amostral de 69-11,4 anos (Tabela 1).
Com relação ao sítio primário, a glândula parótida predominou significativamente em relação à submandibular (relação de 10:1), na proporção de 90,9% para 9,1% (teste de Student com p < 0,01). Todavia não houve diferença entre o lado D e o E (54.5% e 36,4% respectivamente), dados estes analisados pelo teste do qui-quadrado (p > 0,05). No que diz respeito ao tempo de evolução da queixa clínica inicial ao diagnóstico, este foi de 4,3 ± 0,6 mês (Tabela 2). Quanto ao tamanho da lesão (mensurado o tumor em cm), não houve diferenças significativas entre os diferentes intervalos (Tabela 3).
Quanto à relação do parâmetro pT da classificação TNM, avaliação histopatológica e a incidência, embora não houvesse diferenças significantes através do teste do Qui-quadrado (p<0,05), houve predomínio numérico de lesões pT2 (2 a 4 cms) - (Tabela 4).
Na mensuração do índice mitótico, em 10 campos de grande aumento (400X), segundo o perfil imunohistoquímico de marcação positiva para citoqueratinas de alto e baixo pesos moleculares, as lâminas foram coradas pela hematoxilina e eosina, não havendo evidência de significância estatística através do teste t de Student e ANOVA (p>0,05) com perfis imunohistoquímicos (I, II, II e geral) - (Tabela 5).
Quanto ao índice de imunomarcação do Ki-67 (Clone MIB-1) medido em percentagem de positividade em 1000 células, não houve diferença significativa dos perfis I, II e III das citoqueratinas quando avaliadas através dos testes t de Student e ANOVA (Tabela 6).
Quanto à relação entre os parâmetros do índice mitótico de imunoproliferação celular do Ki-67 (Clone MIB-1) em função do perfil imunohistoquímico de marcação positiva com citoqueratinas de alto e baixos pesos moleculares, não houve diferenças significantes (teste t de Student e ANOVA para p>0,05). Todavia, a exiguidade da amostra não possibilitou avaliação estatística entre as variáveis índices mitótico/índice de imunoproliferação do Ki-67 nos grupos Perfil IPX II (n=2), sendo somente possível nos grupos Perfil IPX Geral, Perfil IPX I e Perfil IPX III (Tabela 7).
Tabela 1. Variáveis demográficas em 11 pacientes com carcinoma indiferenciado do tipo grande células.
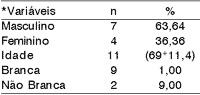
* Teste t de Student (p<0,01)
Tabela 2. Distribuição de variáveis clínicas em 11 casos de carcinoma indiferenciado do tipo grande células das glândulas salivares maiores.

*Os dados foram analisados através do teste Qui 2 (p< 0,05) em relação à predominância de topografia primária da lesão.
Tabela 3. Diâmetro da lesão versus tamanho da neoplasia maligna
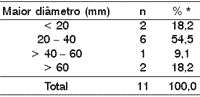
* Os dados forma analisados pelo teste qui-quadrado (p < 0,05)
Tabela 4. Relação entre pT e as neoplasias malignas
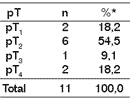
* Dados analisados pelo teste do qui-quadrado (p< 0,05)
Tabela 5. Índice mitótico dos carcinomas indiferenciados de glândulas salivares tipo grandes células segundo o perfil imunohistoquímico de marcação positiva para citoqueratinas de alto e baixo pesos moleculares.
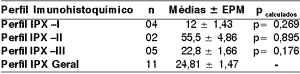
Os valores foram avaliados através do teste t de Student (p> 0,05). Os resultados foram expressos em média ± epm do índice mitótico
Perfil IPX I: positividade para citoqueratinas de alto e baixo pesos moleculares, além do coquetel de citoqueratinas AE1AE3.
Perfil IPX II: positividade exclusiva para citoqueratinas de baixo pesos moleculares.
Perfil IPX III: positividade exclusiva para citoqueratinas de alto peso moleculares.
Perfil IPX Geral: todos os casos
Tabela 6. Índice de imunomarcação do Ki 67, segundo o perfil imunohistoquímico de citoqueratinas de alto e baixo pesos moleculares em carcinomas indiferenciados tipo grandes células de glândulas salivares maiores.
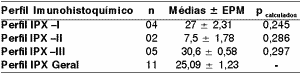
Os dados forma avaliados através do teste t de Student (p > 0,05)
Os resultados foram expressos em médias de imunopositividade para o Ki -67 em 1000 células (médias ± epm) dos casos analisados.
Perfil IPX I: positividade para citoqueratinas de alto e baixo pesos moleculares, além do coquetel de citoqueratinas AE1AE3.
Perfil IPX II: positividade exclusiva para citoqueratinas de baixo pesos moleculares.
Perfil IPX III: positividade exclusiva para citoqueratinas de alto pesos moleculares.
Perfil IPX Geral: todos os casos
Tabela 7. Distribuição por intervalos de classes do marcador de imunoproliferação celular Ki 67, segundo o perfil imunohistoquímico de diferenciação.
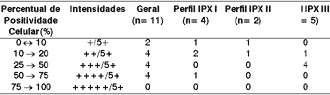
Os dados foram analisados através do teste do Qui2 (p> 0,05).
Perfil IPX I: positividade para citoqueratinas de alto e baixo pesos moleculares, além do coquetel de citoqueratinas AE1AE3.
Perfil IPX II: positividade exclusiva para citoqueratinas de baixo pesos moleculares.
Perfil IPX III: positividade exclusiva para citoqueratinas de alto peso moleculares.
Perfil IPX Geral: todos os casos
Os carcinomas indiferenciados de glândula salivar maior, pela sua raridade, não possibilitam uma boa classificação prognóstica à luz dos conceitos morfológicos atuais, sendo necessária sua associação com critérios do perfil imunohistoquímico e do marcador de imunoproliferação celular Ki-67 (Clone MIB-1) para sua sub-classificação21,22. Assim, torna-se possível distinguir estes tumores em padrões de citoqueratinas de alto e/ou baixo pesos moleculares, sinalizando para a diferenciação imunohistoquímica bidirecional do tipo mucoepidermóide em 4 casos (Perfil IPX I), de diferenciação ductal/glandular em 2 casos (Perfil IPX II) e diferenciação epidermóide em 5 casos (Perfil IPX III).
Quanto aos perfis imunohistoquímico de marcação para citoqueratinas de alto e/ou baixo pesos moleculares, frente aos parâmetros índice mitótico e índice de imunoproliferação celular Ki-67, observamos uma média geral do grupo de 24,81 mitoses em 10/CGA, com erro padrão da média (EPM) de 1,47, e índice de positividade Ki 67 de 25,09 ± 1,23 (EPM), sendo que o perfil IPX I (padrão bidirecional de marcação tipo mucoepidermóide) de 12 mitoses em 10/ CGA e 27 ± 2,31 (EPM) índice Ki-67, o perfil IPX II (diferenciação epidermóide, ductal/glandular) com 22,8 mitoses em 10/CGA e 30,6 ± 0,58 (EPM) de índice de imunomarcação do Ki-67.
Diante da presença de neoplasias indiferenciadas, o Ki-67 é o melhor marcador de proliferação celular atualmente disponível23. Todavia, como não marca as células em G0, ao marcar o comportamento de crescimento populacional, permite estabelecer uma relação direta com o prognóstico, o qual deverá, de toda a forma, ser acrescido daquelas células (Go) não marcadas. Todavia, enquanto obtivemos um índice de marcação de 25,09% nas neoplasias indiferencidas, outros autores16 referem valores menores para neoplasias diferenciadas como 14% para o carcinoma epidermóide, 13,6% para o adenocístico. Isto permite prever a utilização do marcador como diagnóstico de diferenciação entre benignos e malignos, nos pacientes onde a dúvida persiste, em situações que a histopatologia não consegue diferenciá-los pela metodologia habitualmente empregada como a macroscopia óptica. Vale salientar que o emprego do Ki-67 poderia impactar no prognóstico das neoplasias pouco diferenciadas ou em lesões displásicas, onde o grau de indiferenciação e de displasia seriam determinantes do prognóstico destas neoplasias quanto à sua malignidade e ao comportamento ao longo do seguimento destes pacientes submetidos à cirurgia isolada ou associada à radioterapia. Todavia, seriam necessárias amostras de pacientes em número suficientes que permitissem diferenciar padrões de citoqueratinas de alto ou baixo peso molecular, os índices mitóticos, bem como o de imunoproliferação do Ki-67.
CONCLUSÃOA sub-classificação imunohistoquímica de positividade para citoqueratinas não apresentou diferenças estatisticamente significativas em relação aos índices mitóticos e o índice de imunoproliferação celular (Ki-67), não acrescentando variável de importância preditiva do comportamento biológico deste tumor, face à modalidade histogênica de diferenciação, necessitando novos estudos com casuísticas mais significantes do ponto de vista numérico.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Hilderman WC, Gordon JS, Large HL Jr. Malignant lymphoepitelial leson with carcinomatosous component apparently arising in parotid gland: a malignant counterpart of benign lymphoepithelial lesion? Cancer 1962; 15:606:10.
2. Zur Hausen H, Schullte-Holthausen H, Klein G, Henle W, Henle G, Clifford P, et al. EBV DNA in biopsies of Burkitt´s tumors and anaplastic carcinomas of the nasopharynx. Nature 1970; 228:1056-8.
3. Saemundsen AK, Albeck H, Hansen JPH, Nielsen NH, Anvret M, Henle W et al. Epstein - Barr virus in nasopharyngeal and salivary gland carcinomas of Grenland Eskimoes. Br J Cancer 1982; 46:721-8.
4. Nagao T, Ishida Y, Sugano I, Tajima Y, Matsuzaki O, Hino T et al. Epstein-Barr virus-associated undifferentiated carcinoma with lymphoid stroma of salivary gland in japanese patients. Cancer 1996; 78:695-703.
5. Huang DP, NG HK, Ho YH, Chan KM. Epstein-Barr virus (EBV - associated undifferentiated carcinoma of the parotid gland. Histopathology 1988; 13:509-17.
6. Hamilton-Dutoit SJ, Therkildsen MH, Nielsen NH, Jensen H, Hansen JPH, Pallesen G. Undifferentiated carcinoma of the salivary gland in Greenlandic eskimos: demonstration of Epstein-Barr virus DNA by in situ nucleid acid hybridization. Hum Pathol 1991; 22:811-5.
7. Chen Cl, Ween WN, Chen JY, Hsu HC. Detection of Epstein- Barr virus genome in nasopharyngeal carcinoma by in situ DNA hybridization. Intervirology 1993; 36:91-8.
8. Iezzoni JC, Gaffey MJ, Weiss LM. The role of Epstein-Barr virus in lymphoepithelioma like carcinomas. Am J Clin Pathol 1995; 103:308-15.
9. Gerdes J; Schlueter CLL, Duchrow M, Wohlenberg C, Gerlach C, Stahmer I, Kloth S, Brandt E, Flad H. Immunobiochemical and molecular biologic characterization of the cell proliferation-associated nuclear antigen that is defined by monoclonal antibody Ki-67. Am J Pathol 1991; 238:867-73.
10. Brownw DC, Gatter KC. Monoclonal antibody Ki-67: its use in histopathology. Histopathology 1990; 17: 489-503.
11. Sasaki K, Murakami T, Kawasaki M, Takahashi M. The cell cycle associated a change of the Ki-67 nuclear antigen expression. J Cell Phisiol 1987; 133:579-84.
12. Bruno S, Darzynkiewikz Z. Cell cycle dependent expression and stability of the nuclear protein detected by Ki-67 antibody in HL-60 cells. Cell Prolif 1992; 25: 31-40.
13. Garrido MC, Cordell JL, Becker MHG, Key G, Gerdes J, Jones M, Gatter KC, Majon DY. Monoclonal antibody JC1. New reagent for studying cell proliferation. J Clin Pathol 1992; 45:860-5.
14. Key G, Petersen JL, Becker MHG, Duchrow M, Schlüter C, Askaa J, Gerdes J. New antiserum against Ki-67 antigen suitable for double immunostaining of parinf wax sections. J Clin Pathol 1993; 46:1080-4.
15. Giannoni C, El Naggar EK, Ordonez NG, Austin J, Luna MA, Baakis JG. C-erbB-2/neu oncogene and Ki-67 analysis in the assessment of palatal salivary gland neoplasms. Otolaryngol Head Neck Surg 1995; 112:391-8.
16. Murakami M, Ohtani I; Hojo H, Wakasa H. Immunohistochemical evaluation with Ki-67: na application to salivary gland tumours. J Laryngol Otol 1992; 106:35-8.
17. Cooper MP, Braakhuis BJM, de Vries N, Van Dongen GAMS, Nauta JJP, Snow GB. A painel of biomarkers of carcinomarkers of carcinogenesis of the upper aerodigestive tract as potential intermediate andpoints in chemopreventions trials. Cancer 1993; 71:825-30.
18. Valente G, Orecchia R, Gandolfo S, Araudo M, Ragona R, Kerin S, Palestro G. Na Ki-67 immunostaining predict response to radiotherapy in oral squamous cell carcinoma? J Clin Pathol 1994, 47:109-12.
19. Vargas H, Sudilovsky D, Kaplan MJ, Regezi JA, Weidner N. Mixed tumor, polymorphous low grade adenocarcinoma and Adenoid Cystic Carcinoma of the salivary gland. Pathogenic implications and differential diagnose by Ki-67 (MIB1), Bcl1, and S-100 imunohistochemistry. App Imunohistoch 1997, 5:8-16.
20. Lazzaro B, Cleveland D. P53 and Ki-67 antigen expression in small oral biopsy specimens of salivary gland tumors. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 89:613-7.
21. Ellis GL, et al. Atlas of Tumor Pathology: Tumors of Salivary Glands, Armed forces Institute of Pathology, Washington, D.C, Third series, 1996.
22. Toyosawa S, Ohnishi A, Ito R. Small cell undifferentiated carcinoma of the submandibular gland: Imunohistochemical evidence of myoepithelial, basal and luminal cell features. Pathology International 1999; 49:887-92.
23. Alves VAF. Manual de Imunohistoquímica. São Paulo: Sociedade Brasileira de Patologia; 1999.
1 Mestre em Ciências da Saúde, do Hospital Heliópolis, Hosphel, São Paulo, Brasil.
2 Patologista do Hospital Heliópolis, Hosphel, São Paulo.
3 Coordenador do Curso de Pós-Graduação do Hospital Heliópolis, Hosphel, São Paulo
Trabalho realizado pelos Departamentos de Cirurgia de Cabeça e Pescoço/ Otorrinolaringologia e Anatomia Patológica do Hospital Heliópolis, Hosphel, São Paulo, Brasil.
Endereço para Correspondência: Prof. Dr. Abrão Rapoport - Rua Iramaia, 136 Jd. Europa 01450-020 São Paulo. - Tel (0xx11) 289-6229 / 287-4347 - E-mail: cpgcp.hosphel@attglobal.net
Artigo recebido em 17 de fevereiro de 2003. Artigo aceito em 07 de julho de 2003.


