INTRODUÇÃOA perda de audição no início da vida pode afetar o desenvolvimento da comunicação de uma criança e interferir em vários outros aspectos, como cognitivo, psicossocial, acadêmico, dentre outros.
1,2 O consenso é que uma estimulação auditiva adequada a partir do início da vida é necessária para o desenvolvimento normal da fala.
3-6 A recepção total do sinal acústico pelo córtex auditivo possibilita que este passe por alterações devido ao fenômeno de plasticidade neuronal. Essas alterações e reorganizações possibilitam o desenvolvimento da capacidade de discriminar sons que atingem o sistema nervoso auditivo central (SNAC), possibilitando o aprendizado gradual da linguagem oral.
7-9 Considerando o dano causado pela perda auditiva neurossensorial bilateral severa a profunda em crianças durante o desenvolvimento das habilidades auditivas e de linguagem oral, há uma necessidade de fornecer a capacidade de conhecer e reconhecer o universo sonoro.
Para crianças com deficiência auditiva que não possuem benefícios significativos com o uso de um aparelho de amplificação sonora individual (AASI), o implante coclear (IC) tem mostrado ser um recurso clínico efetivo para intervenção. Esse dispositivo eletrônico tem como objetivo substituir parcialmente a função do órgão sensorial da audição por meio da estimulação direta das fibras do nervo auditivo, melhorando a qualidade de vida de adultos e crianças.
10,11 A fim de fornecer o benefício máximo para as crianças - possibilitando o desenvolvimento das habilidades auditivas e linguagem oral - é importante que a estimulação do IC seja iniciada em um período sensível, preferencialmente até três anos de idade, para que a maturação do SNAC possa ocorrer adequadamente.
12-14 Alguns autores explicam esse fenômeno afirmando que, apesar de as camadas mais profundas do córtex serem submetidas a processos de maturação mesmo na ausência de estimulação, as camadas mais superficiais do córtex precisam de estimulação para desenvolvimento adequado.
15 Após esse período sensível, podem ocorrer alterações significativas com relação à plasticidade sináptica, resultando em conectividade anormal entre as células neuronais, a desintegração funcional e a imaturidade das áreas corticais auditivas, bem como a possibilidade de que algumas áreas desenvolvam funções não auditivas, causando anormalidades da reestruturação da função cognitiva.
16 Para verificar as alterações no SNAC durante seu desenvolvimento, as técnicas objetivas atuais conseguem demonstrar de forma precisa os benefícios do uso efetivo do IC no processo de maturação do córtex. Os potenciais evocados auditivos de longa latência (PEALL) surgiram como um procedimento capaz de medir objetivamente o grau de desenvolvimento e os limites de plasticidade da via auditiva central por meio da análise de mudanças na morfologia e nos valores de latência dos componentes P1-N1-P2.
13,17 A onda P1 dos PEALL foi estabelecida como um biomarcador para avaliar a maturação do sistema auditivo central em crianças. Assim, essas medidas podem ajudar a verificar a eficácia da reabilitação desse sistema em crianças utilizando AASI ou IC.
17 Considerando que o desenvolvimento e a organização das vias auditivas centrais estão intimamente relacionados a uma experiência auditiva efetiva e adequada, o uso efetivo dos PEALL como um procedimento capaz de refletir principalmente a atividade das regiões do tálamo e córtex parece ser válida para determinar a integridade da via auditiva e monitorar alterações neuropsicológicas na população com perda de audição após a intervenção e a estimulação auditiva pelo IC.
18-22 Vários estudos associam resultados de testes eletrofisiológicos dos PEALL com avaliações comportamentais, que indicam que a redução do tempo de latência do P1 está associada à melhora dos comportamentos comunicativos (vocalização);
4 da percepção da fala;
11 e também das habilidades da fala e linguagem de crianças.
20 Contudo, não está claro como as alterações ocorrem no SNAC. Pergunta-se se há mudanças nos valores do tempo de latência do componente P1 após um curto período de estimulação auditiva por meio de implante coclear.
OBJETIVOAnalisar a maturação das vias auditivas centrais em crianças com perda de audição após três meses de estimulação auditiva, por meio de implante coclear.
MÉTODOS
Projeto do estudo e aspectos éticosEssa investigação consistiu de um estudo caso-controle com crianças com deficiência auditiva usuárias de IC. O grupo de estudo (GE) foi composto de cinco crianças com perda auditiva neurossensorial bilateral, que receberam indicação cirúrgica para uso de IC como uma intervenção no processo de habilitação auditiva. O grupo controle (GC) foi constituído de cinco crianças com audição normal pareadas por idade cronológica para crianças no GE.
O estudo foi aprovado pelo comitê de ética da instituição sob o processo número 0319/11. Os procedimentos foram realizados após os pais ou responsáveis terem assinado o formulário de consentimento.
CARACTERÍSTICAS DAS AMOSTRAS
Grupo estudoOs critérios de inclusão estabelecidos para o GE foram: crianças com idade máxima de quatro anos de idade; com perda auditiva neurossensorial bilateral severa/profunda; sem benefícios com aparelhos de amplificação sonora individual; incluídos no programa de implante coclear; com o adequado uso do dispositivo (de acordo com o registro de mapeamento); inserção total dos eletrodos; uso diário do dispositivo por 8 horas ou mais; e que não utilizam um aparelhos de amplificação sonora individual na orelha contralateral. Os critérios de exclusão foram: crianças com comprometimento neurológico ou cognitivo ou qualquer outro comprometimento que possa prejudicar o desenvolvimento auditivo ou da linguagem.
O GE foi composto de cinco crianças com implantes cocleares (três meninos e duas meninas) com faixa etária de dois anos e três meses no momento da ativação do IC (mínimo de nove meses e máximo de três anos e seis meses). As crianças eram residentes de São Paulo, todas apresentaram perda de audição neurossensorial bilateral severa e/ou profunda e estavam aguardando ativação dos eletrodos do implante coclear no período entre maio de 2012 e setembro de 2012.
A tabela 1 mostra as características e especificações de cada participante do GE.
As crianças do GE foram pareadas às do GC por idade cronológica, para que os resultados obtidos após três meses de uso do IC pudessem ser comparados com os observados em crianças com audição normal na mesma faixa etária. O critério utilizado para parear as crianças foi uma diferença de quatro meses entre as crianças do grupo estudo e do grupo controle.
A análise estatística não mostrou nenhuma diferença para idade e sexo. O teste de Mann-Whitney indica que não há diferença na idade média entre os grupos (média do GE = 27,8 ± 13,03; média do GC = 27,8 ± 12,60; U = 12,0, z = - 0,104, p = 0,917). O teste exato de Fisher não indica diferença na distribuição por sexo entre os grupos (p = 0,524), apesar de haver mais crianças do gênero masculino no GE (60%) e crianças do gênero feminino no GC (80%).
Grupo controleOs critérios de inclusão estabelecidos para o GC foram: crianças com idade máxima de quatro anos; sem perda de audição (curva timpanométrica tipo A, reflexos e limiares de recepção auditiva e de fala inferiores ou iguais a 15 dB); e sem comprometimentos no desenvolvimento neurológico, motor ou de linguagem.
O GC foi composto de cinco crianças (um menino e quatro meninas) com idade média de dois anos e três meses (mínimo de 11 meses e máximo de três anos e dois meses). Os participantes do GC são caracterizados na Tabela 2.
As crianças desse grupo foram submetidas à avaliação auditiva antes da avaliação eletrofisiológica para descartar qualquer tipo de deficiência auditiva. O mesmo foi composto de: audiometria tonal, logoaudiometria (Limiar de Recepção de Fala - SRT), bem como imitanciometria com pesquisa do reflexo acústico.
PROCEDIMENTOSAs crianças foram convidadas a participar do estudo por uma carta-convite entregue a seus pais ou responsáveis ou por telefone.
Foi feita uma entrevista com os pais ou responsáveis no GE na Clínica de Audiologia do Departamento a fim de obter informações sobre: idade, escolaridade, lado do implante, aparelhos de amplificação sonora individual, etiologia da perda de audição e resultados da última audiometria realizada na instituição.
A avaliação dos PEALL foi realizada em uma sala acusticamente tratada com a criança em estado de alerta, confortavelmente sentada em uma cadeira reclinável. Elas foram orientadas e incentivadas a assistir um teatro de fantoches ou filme sem som durante o procedimento. Antes de iniciar o procedimento, verificou-se o funcionamento do IC: bateria, programa, microfone.
Foi utilizado o equipamento
Smart EP USB Jr Intelligent Hearing Systems (IHS 5020), que fornece dois canais de estimulação. O canal A visa captar os potenciais evocados auditivos de longa latência no ouvido direito, e o canal B no ouvido esquerdo. Em ambos, o eletrodo ativo foi posicionado no Cz conectado na entrada (+) do pré-amplificador e o eletrodo de referência foi posicionado no lóbulo da orelha do IC e conectado na entrada (-). O eletrodo terra foi posicionado em Fpz e conectado na posição terra.
Os eletrodos foram posicionados com pasta condutora para eletroencefalograma (EEG) da marca Tem 20
TM após limpeza da pele com gel abrasivo para EEG da marca NUPREP. O nível de impedância dos eletrodos aceito para o procedimento foi entre 1 e 3 K ohms.
A estimulação acústica foi apresentada em sistema de campo sonoro com alto-falantes posicionados em um ângulo de 90º azimute e 40 cm distante do lado implantado das crianças do GE. O mesmo procedimento foi utilizado com crianças do grupo controle; a apresentação de estímulos foi feita no lado com melhores limiares audiométricos. Para indivíduos com limiares audiométricos simétricos, optamos por apresentar estímulos no lado direito. Duas amostras foram coletadas de cada indivíduo para confirmar os resultados.
Quanto aos parâmetros de estimulação, os PEALL foram registrados com a estimulação da fala das sílabas/ba/, apresentadas com intervalos interestímulos de 500 ms, na intensidade de 70 dBNA e taxa de apresentação de 1,9 estímulos por segundo. Os parâmetros descritos abaixo também foram utilizados durante o registro: filtro passa-banda de 1 a 30 Hz, ganho de 100.000, média de 512 estímulos e janela de análise da resposta 100 ms pré-estímulo e 500 ms pós-estímulo.
A análise dos dados consistiu de uma avaliação dos valores do tempo de latência do componente P1, representado em milissegundos, antes e três meses após o uso do IC. Os achados foram comparados aos obtidos com crianças do GC.
RESULTADOS
Grupo controleOs valores do tempo de latência do componente P1 de crianças ouvintes variaram entre 123 ms e 140 ms (crianças com 35 e 10 meses, respectivamente) (tabela 3 e fig. 1).
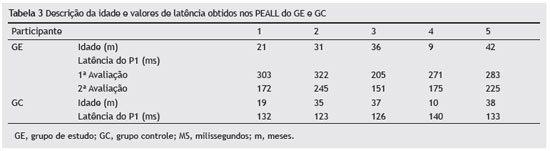
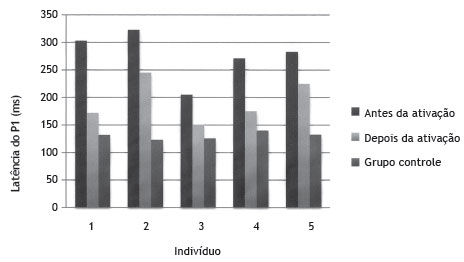
Figura 1 Valores de latência do componente P1 antes e depois da ativação dos eletrodos de implante coclear do grupo de estudo em comparação ao grupo controle.
Após três meses de uso do IC, foi observada uma redução na latência dos PEALL em todos os participantes.
A primeira criança avaliada foi diagnosticada com um ano de idade e utilizou aparelhos de amplificação sonora individual por nove meses. Os limiares de audição obtidos em campo livre com o dispositivo foram 85 e 80 dB para frequências entre 250 e 500 Hz, respectivamente. Três meses após a cirurgia, os limiares audiométricos na orelha com implante variaram entre 55 e 70 dB em frequências de 0,25 a 2 KHz. No registro dos PEALL antes da ativação, a latência da onda P1 foi observada em 303 ms. Após três meses de uso do IC, foi observada uma redução na latência do componente P1, registrada em 172 ms.
A segunda criança avaliada foi diagnosticada com três meses de idade e fez uso de aparelhos de amplificação sonora individual com um ano de idade. A audiometria tonal pré-cirúrgica em campo aberto utilizou aparelhos de amplificação sonora individual revelou respostas entre 70 e 100 dB para frequências de 0,25 a 2 KHz na orelha direita. Três meses após a cirurgia, os dados da avaliação audiológica mostraram as respostas da orelha com implante entre 45 e 65 dB em frequências de 0,25 a 4 KHz. Houve uma redução na latência na avaliação de potenciais de longa latência, com valores de 322 e 245 ms na ativação pré e pós, respectivamente.
A terceira criança foi diagnosticada com um ano e oito meses de idade após meningite aos 11 meses de idade, e utilizou aparelhos de amplificação sonora individual bilateral por dez meses. Os resultados audiométricos com o aparelho de amplificação sonora individual na orelha esquerda mostraram respostas de 80 e 90 dB para frequências de 250 e 500 Hz, respectivamente. Três meses após a cirurgia, o paciente detectou sons da fala em intensidade média. Os dados inicialmente mostraram o componente P1 dos PEALL em 205 ms. Após estimulação por meio de implante coclear, esse componente foi observado em 151 ms.
A quarta criança foi diagnosticada no primeiro mês de nascimento, com etiologia desconhecida. Após fazer uso de aparelhos de amplificação sonora individual bilateral por seis meses, a criança foi submetida à cirurgia do IC aos nove meses de idade. Os resultados da audiometria em campo aberto com aparelhos de amplificação sonora individual foram 80 dB para a frequência de 250 Hz bilateralmente. Após três meses de uso do IC, esses valores ficaram entre 30 e 50 dB para frequências de 500 a 4000 Hz no ouvido esquerdo. Houve uma redução na latência na avaliação de potenciais de longa latência, com valores de 271 e 175 ms na ativação pré e pós, respectivamente.
A última criança foi diagnosticada aos dois anos de idade sem etiologia definida de perda de audição. Essa criança fez uso de aparelhos de amplificação sonora individual bilateralmente por um ano e um mês, quando foi submetido à cirurgia. Os resultados audiométricos com o aparelho de amplificação sonora individual em campo aberto mostraram respostas no ouvido esquerdo de 55 para frequências de 0,25 a 1 e Hz. Três meses após a cirurgia, foram observadas respostas em 50 e 60 dB para frequências 250 e 500 Hz, respectivamente. Os registros dos PEALL inicialmente mostraram o componente P1 em 283 ms. Após três meses de uso do IC, a latência desse componente foi observada em 225 ms.
Foi observada uma redução nos valores de latência do componente P1 em todos os participantes deste estudo após três meses de estimulação por meio de IC. Os valores de latência do P1 foram efetivamente mais próximos dos valores encontrados em crianças com audição normal da mesma idade, conforme mostrado na tabela 3 e figura 1. As crianças do GC também foram reavaliadas após um intervalo de três meses da primeira avaliação; contudo, não houve diferenças na latência entre os dois registros.
DISCUSSÃOConsiderando a maturação do SNAC em crianças que recebem IC, a finalidade deste estudo foi investigar as mudanças nos valores de latência do componente P1 observadas nos PEALL antes de três meses depois da ativação dos eletrodos.
O componente P1 - onda positiva gerada pela atividade do circuito tálamo-cortical na estimulação de sons - é uma medida capaz de refletir alterações no SNAC decorrentes da plasticidade neuronal, um fenômeno essencial para o desenvolvimento de habilidades auditivas e da linguagem.
16-18 Em crianças com IC, essas mudanças podem ser observadas como a estimulação elétrica que fornece melhor funcionalidade das conexões sinápticas com aumento gradual na taxa de transmissão neural sináptica e sincronização. Essas alterações corticais possibilitam uma redução gradual na latência do componente P1 - um fenômeno observado neste estudo -, corroborando com os achados descritos na literatura que avaliaram crianças em condições semelhantes.
5,16,19,23 Há vários estudos publicados que sugerem uma rápida mudança nesse tempo de latência, principalmente em crianças que receberam implante precocemente. Alguns autores observaram que essas crianças atingiram os valores de latência do componente P1 esperados para sua respectiva idade três meses após o implante;
5,23 outros relataram essas mudanças entre três e seis meses;
21 outros estudos mostraram mudanças após quatro meses de uso do IC;
22 e há ainda os que observaram mudanças após seis a oito meses.
16,19 Neste último estudo, os resultados mostraram que as crianças que receberam IC precocemente mostraram um rápido desenvolvimento do SNAC, com alterações na morfologia da forma de onda, bem como na latência do componente P1: uma semana após o implante, a latência do P1 apresentou redução de aproximadamente 100 ms, mostrando resultados semelhantes à audição de recém-nascidos ouvintes normais, e após seis a oito meses de uso, esse valor atingiu a faixa normal para crianças com a mesma idade. Os resultados também mostram que crianças com implante tardio mostraram morfologia da onda anormal e lenta redução no tempo de latência.
19 Essa redução no tempo de latência do componente P1 com relação à ativação de acordo com a idade está relacionada à existência de um período sensível no qual a estimulação auditiva deve ser iniciada para obtenção de um grau mais elevado de eficácia clínica. Assim, como visto na literatura, crianças que receberem estimulação por meio do IC antes dos três anos e cinco meses de idade atingem rapidamente os valores de normalidade esperados. Os que recebem IC tardiamente apresentam um desenvolvimento diferente do SNAC do que o observado em crianças com audição normal.
11,19,23,24 Não foi possível acompanhar, neste estudo, as modificações do SNAC por um período superior a três meses de uso do IC em um grupo maior de crianças. Contudo, uma avaliação longitudinal dessas crianças por um período superior a 12 meses com mais indivíduos acompanharia como as estruturas do SNAC são modificadas após um tempo maior de uso do IC. Também seria possível verificar o alinhamento dos parâmetros de registro dos PEALL encontrados em crianças que receberam implante em comparação aos observados em crianças com audição normal com a mesma idade.
Considerando que a análise desse componente parece estar relacionada aos resultados de percepção da fala obtidos após ativação do IC, o uso dessas medidas eletrofisiológicas associadas à avaliação comportamental das habilidades auditivas pode contribuir para um melhor entendimento dos resultados da intervenção. Vários estudos destacam a análise do componente P1 como um biomarcador que, associada a testes comportamentais, pode fornecer informações sobre o processo evolutivo de reabilitação e, consequentemente, sugere prognóstico.
5,16,20,21,22,25 Nesse sentido, a avaliação longitudinal dessas crianças é fundamental para que as mudanças no SNAC de crianças com IC possam ser avaliadas no longo prazo e comparadas ao desenvolvimento do SNAC de crianças com audição normal. Estudos com amostras maiores e com maior tempo de observação são necessários para um melhor entendimento das alterações no SNAC.
Portanto, verificamos a possibilidade de uso dos PEALL como um biomarcador do SNAC que consegue registrar as alterações causadas por estimulação elétrica por meio do IC após três meses de seu uso.
CONCLUSÃOOs resultados deste estudo caso-controle indicou uma redução nos valores de latência do P1 nos PEALL em crianças com quatro anos de idade, após três meses de ativação do implante coclear.
Os valores do tempo de latência do componente P1 de crianças que fazem uso de implante coclear por mais de três meses são maiores que os de crianças ouvintes.
FINANCIAMENTOFundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP).
CONFLITOS DE INTERESSEOs autores declaram não haver conflitos de interesses.
REFERÊNCIAS1. Mendes BCA, Barzaghi L. Percepção e produção da fala e deficiência auditiva. In: Bevilacqua MC. [et al.]. Tratado de audiologia. São Paulo: Santos; 2011. p.653-69.
2. Bento RF, Brito Neto R, Castilho AM, Gómez VG, Giorgi SB, Guedes MC. Resultados auditivos com o IC multicanal em pacientes submetidos a cirurgia no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo. Rev Bras Otorrinolaringol. 2004;70:632-7.
3. Maurer J, Collet L, Pelster H, Truy E, Gallégo S. Auditory late cortical response and speech recognition in digisonic cochlear implant users. Laryngoscope. 2002;112:2220-4.
4. Boéchat EM. Plasticidade e amplificação. In: Fernandes FDM, Mendes BCA, Nava, ALPGP, eds. Tratado de fonoaudilogia.2nd edition. São Paulo: Roca; 2010. p.160-8.
5. Sharma A, Tobey E, Dorman M, Bharadwaj S, Martin K, Gilley P, et al. Central auditory maturation and babbling development in infants with cochlear implants. Arch Otolaryngol Head Neck Surg. 2004;130:511-6.
6. Thai-Van H, Veuillet E, Norena A, Guiraud J, Collet L. Plasticity of tonotopic maps in humans: influence of hearing loss, hearing aids and cochlear implants. Acta Oto-Laryngologica. 2010;130:333-7.
7. Moret ALM, Bevilacqua MC, Costa AO. IC: audição e linguagem em crianças deficientes auditivas pré-linguais. Pró-Fono Rev Atual. Cient. 2007;19:295-304.
8. Bevilacqua MC, Costa AO, Carvalho ACM, Moret ALM. IC. In: Fernandes FDM, Mendes BCA, Nava ALPGP, eds. Tratado de fonoaudilogia. 2nd edition. São Paulo: Roca; 2010. p. 220-31.
9. Clark GM. Cochlear implants: fundamentals & applications. New York: Springer; 2003. p. 830.
10. Sharma A, Dorman M. Central auditory development in children with cochlear implants: clinical implications. Møller A, ed. Cochlear and brainstem implants. Adv Otorhinolaryngol. 2006;64:66-88.
11. Sharma A, Nash AA, Dorman M. Cortical development, plasticity and re-organization in children with cochlear implants. J Comm Disord. 2009;42:272-9.
12. Fallon JB, Irvine DRF, Shepherd RK. Neural prostheses and brain plasticity. J Neural Eng. 2009;6:065008.
13. Eggermont JJ, Ponton CW. Auditory-evoked potential studies of cortical maturation in normal hearing and implanted children: correlations with changes in structure and speech perception. Acta Otolaryngol. 2003;123:249-52.
14. Kral A, Sharma A. Developmental neuroplasticity after cochlear implantation. Trends Neurosci. 2012;35:111-22.
15. Nash A, Sharma A, Martin K, Biever A. Clinical applications of the p1 cortical auditory evoked potential (CAEP) biomarker. In: Seewald R, Bamford J, eds.; 2007. p. 43-9.
16. Sharma A, Dorman M, Spahr J. Rapid development of cortical auditory evoked potentials after early cochlear implantation. Neuro Report. 2002;13:1365-8.
17. Jang JH, Jang HK, Kim SE, Oh SH, Chang SO, Lee JH. Analysis of P1 latency in normal hearing and profound sensorineural hearing loss. Clin Exp Otorhinolaryn. 2010;3:194-8.
18. Ventura LMP. Maturação do sistema auditivo em crianças ouvintes normais: potenciais evocados auditivos de longa latência. 2008. Dissertação de mestrado. Faculdade de Odontologia de Bauru, Universidade de São Paulo: Bauru; 2008.
19. Sharma A, Dorman M, Kral A. The influence of a sensitive period on central auditory development in children with unilateral and bilateral cochlear implants. Hear Res. 2005a;203:134-43.
20. Sharma A, Martin K, Roland P, Bauer P, Sweeney MH, Gilley P, et al. P1 latency as a biomarker for central auditory development in children with hearing impairment. J Am Acad Audiol. 2005b;16:564-73.
21. Bauer PW, Sharma A, Martin K, Dorman M. Central auditory development in children with bilateral cochlear implants. Arch Otolaryngol Head Neck Surg. 2006;132:1133-6.
22. Dorman MF, Sharma A, Gilley PM, Martin K, Roland P. Central auditory development: evidence from CAEP measurements in children fit with cochlear implants. J Comm Disord. 2007;40:284-94.
23. Sharma A, Gilley PM, Martin K, Roland P, Bauer P, Dorman M. Simultaneous versus sequential bilateral implantation in young children: effects on central auditory system development and plasticity. Audiol Med. 2007;5:218-23.
24. Gilley PM, Sharma A, Dorman MF. Cortical reorganization in children with cochlear implants. Brain Res. 2008;1239:56-65.
25. Dinces E, Chobot-Rhodd J, Sussman E. Behavioral and electrophysiological measures of auditory change detection in children following late cochlear implantation: a preliminary study. Int J Pediatr Otorhinolaryngol. 2009;73:843-51.
1. Ciências da Reabilitação, Faculdade de Medicina da Universidade de São Paulo (USP), São Paulo, SP, Brasil
2. Ciências de Fisiopatologia Experimental, Faculdade de Medicina da Universidade de São Paulo (USP), São Paulo, SP, Brasil
3. Divisão de Otorrinolaringologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (USP), São Paulo, SP, Brasil
4. Departamento de Oftalmologia e Otorrinolaringologia da Faculdade de Medicina da Universidade de São Paulo (USP), São Paulo, SP, Brasil
5. Departamento de Fisioterapia, Fonoaudiologia e Terapia Ocupacional da Faculdade de Medicina da Universidade de São Paulo (USP), São Paulo, SP, Brasil
Autor para correspondência.
L.A.F. Silva
E-mail:
liliane.fagundes@usp.brRecebido em 17 de maio de 2013.
Aceito em 7 de novembro de 2013.
* Instituição: Departamento de Fisioterapia, Fonoaudiologia e Terapia Ocupacional e no Departamento de Otorrinolaringologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil.


