INTRODUÇÃOAs indicações dos enxertos externos de dorso de nariz seriam elevar a raiz nasal e o ângulo nasofrontal, principalmente em casos de ossos curtos e próprios do nariz, e para camuflar um defeito em terço médio de dorso médio de dorso.
1 Os materiais mais indicados para o suporte do dorso nasal devem apresentar resistência adequada, persistência no volume e forma, além de disponibilidade e habilidade suficientes para mimetizar o contorno natural do dorso.
2-4 Inúmeros materiais têm sido propostos para serem utilizados na reconstrução nasal, porém, atualmente, não há consenso sobre qual deles é o melhor. Os implantes são divididos em quatro categorias: enxertos autólogos, homólogos, heterólogos e aloplásticos.
5 Os enxertos autólogos são aqueles obtidos de diferentes localizações do corpo do próprio paciente e utilizados para a reconstrução nasal, e são, basicamente, os ósseos e cartilaginosos. Os ósseos podem ser obtidos da crista ilíaca, dos arcos costais, da tíbia, da calota craniana e da ulna. Os cartilaginosos podem ser obtidos do próprio septo nasal e da concha auricular para a reconstrução dos defeitos menores, e da cartilagem costal para a reconstrução dos defeitos nasais maiores.
6 Os enxertos homólogos são obtidos de outros indivíduos da mesma espécie do receptor, e incluem cartilagem ou osso tanto de cadáver como de pacientes submetidos a outras cirurgias e, posteriormente, tratados de forma a se evitar contaminações, para serem utilizados em outros indivíduos da mesma espécie.
7 Já os enxertos heterólogos são obtidos de indivíduos de espécies diferentes do receptor, sendo o mais utilizado na reconstrução nasal os de cartilagem bovina.
8 Os diferentes tipos de enxertos possuem vantagens e desvantagens. Os enxertos autólogos têm a vantagem de serem biocompatíveis e de apresentarem pouca reabsorção; porém, podem sofrer deformação se forem cartilaginosos, o que pode ocorrer mesmo tardiamente.
9 Os materiais aloplásticos possuem a vantagem de apresentar variados tamanhos e formatos, podendo ser esculpidos ou remodelados no próprio ato cirúrgico.
8 Hoje em dia existem inúmeros deles no mercado, tais como silicone, malha de Mersilene
®, polietileno, Silastic
®, metil-metacrilato, malha de Supramid
®, Teflon
®, Proplast
®, hidroxiapatita e Gore-Tex
®.
8 Dentre os tecidos autólogos, o cartilaginoso apresenta algumas particularidades, principalmente devido à sua baixa antigenicidade, o que faz com que a viabilidade do enxerto esteja intimamente associada com a maior sobrevivência e maior adaptação dos condrócitos ao sítio receptor. Sua nutrição ocorre pelo contato direto com os nutrientes do leito de implante; em virtude disso, não necessita de suprimento vascular para manter sua estrutura funcional. E, quando comparado com o osso, o tecido cartilaginoso apresenta uma taxa de absorção menor e pode ser facilmente moldado ou esculpido.
A cartilagem auricular é do tipo elástica, semelhante à hialina, porém inclui, além de fibrilas de colágeno (principalmente as do tipo II), uma abundante rede de fibras elásticas contínuas com as do pericôndrio. As cartilagens elásticas são especialmente adaptadas para resistir a flexões repetidas. Estas crescem por aposição e são menos sujeitas a processos degenerativos do que a hialina. Diferentemente desta última, a matriz da cartilagem elástica não se calcifica, exceto como parte do processo regenerativo.
10 O objetivo deste estudo foi comparar experimentalmente as reações inflamatórias no decorrer do tempo de cartilagens auriculares envolvidas ou não com Gelfoam
®, quando enxertadas no dorso nasal de coelhos.
REVISÃO DA LITERATURAApresentaremos aqui uma síntese dos textos levantados de forma cronológica e as propriedades do Gelfoam
® contidas em bula, regulamentadas pela Anvisa,
11 além de algumas particularidades sobre os biomateriais.
Cottle
12 foi o primeiro autor a introduzir o uso da cartilagem prensada para a reconstrução do contorno nasal.
O enxerto para o osso do nariz pode ser retirado do vômer, lâmina perpendicular do etmoide, conchas nasais e processo frontal da maxila, segundo Kosteck.
13 Peynègre et al.
14 utilizaram um enxerto "misto" composto de pó de osso misturado com cola tissular (Tissucol
®) e reforçado com Surgicel
®, para corrigir irregularidades do dorso nasal. O enxerto era colocado e posicionado entre as estruturas de suporte osteocartilaginosas e a pele, com bons resultados estéticos.
Guerrerosantos,
15 em seus estudos, utilizou a cartilagem da concha auricular para aumento de dorso nasal em rinoplastias, preconizando a manutenção do pericôndrio da superfície posterior preso ao enxerto.
Já Jovanovic e Berghaus
16 acham a concha auricular o transplante quase ideal, pelos seguintes motivos: 1) a obtenção do material é um procedimento de baixo risco, rápido e pode ser feito sob anestesia local; 2) a cartilagem conchal é estável o suficiente para produzir suporte e elástica o suficiente para produzir contornos; 3) é fácil de modelar; 4) tem pouca tendência a deslocamento; 5) não ocorre absorção; 6) não há rejeição ou infecção.
Sheen
17 considera que a cartilagem de orelha aplica-se bem para dorso cartilaginoso, ponta e estenose vestibular. É um material maleável, mas não tão firme. Não é absorvida com o tempo. Não deve ser utilizada quando o suporte estrutural é mandatório (como no caso de
struts columelares,
spreader grafts).
Em um estudo de cinco anos realizado por Mitz e Maladry,
18 no qual utilizaram enxertos cartilaginosos auriculares obtidos da região da escafa para a reconstrução do dorso nasal ou das cartilagens laterais inferiores, os resultados apresentados foram moderados quanto à reabsorção.
Leaf
19 advoga que o autoenxerto de sistema músculo aponeurótico subcutâneo (SMAS) pode ser utilizado para correção de deformidades do dorso do nariz, durante cirurgia associada de ritidectomia, em que normalmente uma porção dele é ressecada.
Segundo Sheen,
20 uma das mais temidas complicações é a infecção, sendo que o maior índice de infecções após enxertia ocorre quando se utiliza cartilagem de orelha em rinoplastias primárias, e por bactérias gram-negativas da orelha externa, e este diminuiu de 15% para 0,5% após cuidados intraoperatórios, tais como embebição do enxerto em solução com lincomicina ou garamicina, fechamento cuidadoso das incisões, incisões menores, troca de material estéril após obtenção do enxerto de outro campo cirúrgico ou antes da colocação do implante.
Patrocínio e Patrocínio
21 relataram que o uso do autoenxerto de cartilagem auricular apresenta as seguintes vantagens: possui o segundo campo operatório em estreita relação com o primeiro; faz-se sob anestesia local; tem pequena morbidade; e mínimo encurvamento, deslocamento ou extrusão. A quantidade limitada de cartilagem, o tempo cirúrgico adicional e o campo operatório diferente, que requer incisões separadas, são algumas das desvantagens dessa técnica, além de uma possível deformidade cosmética da orelha. Pode também reconstruir as cartilagens alares.
Gurlek et al.
22 advogam que o uso do corneto inferior apresenta-se favorável para a reconstrução do nariz em sela, pois é de fácil obtenção, baixo custo, pronto para ser usado, sem reabsorção em longo prazo e não é necessária uma área doadora secundária, além de aumentar a passagem de ar, prevenindo, assim, uma possível obstrução.
Com os resultados encontrados, o autor concluiu que o enxerto cartilaginoso autólogo fresco não amassado foi superior aos enxertos cartilaginosos homólogos e autólogos preservados em álcool a 70% e não amassados, sendo que estes dois apresentaram resultados histológicos equivalentes entre si. Os enxertos na forma amassada apresentaram resultados inferiores em relação aos não amassados.
A incidência de condrite e pericondrite na área doadora de enxerto auricular foi estudada extensamente por Kaplan e Cook, em 2004,
23 que avaliaram 341 casos de reconstrução de nariz e orelha. Os procedimentos constituíram-se de enxertos de pele total provenientes da concha auricular, enxertos de pele total em conjunto com cartilagem conchal e retalhos locais de nariz ou orelha utilizando cartilagem conchal ou de anti-hélix. Quando o pericôndrio era acometido, os autores utilizavam antibióticos profiláticos com cobertura para pseudomonas sp. Esses pacientes foram acompanhados por 12 semanas com os seguintes resultados: presença de condrite inflamatória em 5,6% e ausência de casos de condrite supurativa.
Çelik et al.
24 utilizaram enxertias ósseas temporoparietais associadas à cartilaginosa auricular em mais de 60 pacientes com deformidades do dorso nasal, sendo estas interpostas e unidas com Spongostan
®, apresentando bons resultados.
Sabe-se da larga utilização do Gelfoam
® nas cirurgias otológicas e, agora também em cirurgias laringológicas: Pontes e Vieira
25 o utilizaram para correção em uma cantora que apresentava insuficiência glótica por atrofia de prega vocal. O Gelfoam
® foi hidratado com solução fisiológica até formar uma solução pastosa e, em seguida, aplicado por via percutânea e transluminar em consultório com, segundo os autores, resultados positivos, permitindo que a paciente retornasse a suas atividades e concluísse o trabalho até sua absorção progressiva.
Em um trabalho realizado por Costa et al.
26 foram utilizados 15 coelhos, com o objetivo de comparar o uso do butil-2-cianoacrilato, mistura gelatina-resorcina-formaldeído (GRF) e sutura na estabilização de enxertos de cartilagem em coelho. Nas orelhas dos animais foram ressecados seis enxertos de cartilagem, fixados no periósteo da calvária e unidos dois a dois com sutura, GRF e cianoacrilato; a mistura gelatina-resorcina-formaldeído mostrou ser um método de estabilização de enxertos de cartilagem em coelhos superior ao butil-2-cianoacrilato em todas as fixações, e à sutura na fixação cartilagem-osso. Em futuros estudos clínicos pode-se comprovar a eficácia e segurança deste adesivo também em rinoplastias.
Já Espinosa et al.
27 prefere utilizar enxertos de fáscia lata homóloga de banco de órgãos já tratados para elevação de dorso nasal em casos de rinoplastia secundária.
Pochat et al.
1 apresentaram uma série de 12 pacientes operados entre um período de 14 meses, submetidos à rinoplastia para correção de deformidades estéticas e funcionais, sendo que, durante os procedimentos, foram utilizados enxertos autólogos de cartilagens do septo, concha auricular e costela. Os enxertos mais utilizados foram os
strut grafts (100%),
spreader grafts (92%), alar
contour grafts (58%) e lateral crural
strut grafts (33%). Os autores não observaram casos de sofrimento ou cicatrizes patológicas. Porém, foram notadas algumas complicações nas áreas doadoras: um caso de hematoma em orelha, um de cicatriz hipertrófica em tórax e dois casos de pústulas em mucosa septal. O resultado estético foi satisfatório para os pacientes em 92% dos casos, enquanto, do ponto de vista funcional, em 58% dos casos houve melhora na qualidade da respiração e, em 42%, a função se manteve inalterada. Com essa amostragem e dados, estes mesmos autores concluíram que a utilização de enxertos autógenos de cartilagem se mostrou efetiva no tratamento das deformidades estéticas e funcionais, proporcionando suporte adequado ao esqueleto osteocartilaginoso e às válvulas internas e externas nasais, com índice de complicações aceitáveis e pequena morbidade das áreas doadoras.
Tostes et al.
28 realizaram um estudo com sete pacientes submetidos a implantes de Gore-Tex
® visando o preenchimento do dorso nasal, quando foram acompanhados por um período de dois a cinco anos. Desses sete indivíduos, cinco foram rinoplastia primária e duas rinoplastia secundárias. Exorrinoplastia foi realizada em cinco casos, endorrinoplastia, em 1, e, no outro, foi feita incisão sobre cicatriz traumática em dorso nasal. O implante com Gore-Tex
® foi confeccionado manualmente, sendo cortado em lâminas progressivamente menos largas, de modo a formar uma pirâmide, e estabilizados com pontos de fio absorvível. Segundo os autores, todos obtiveram satisfação estética e funcional, com ótimos resultados quando comparados com as documentações fotográficas de pré e pós-operatórias.
Souza
29 realizou um trabalho experimental com o objetivo de comparar a utilização de cartilagem auricular e septal quanto a aspectos de absorção, granulação e inflamação quando enxertados em dorso nasal de coelhos. Em seu estudo, o autor se propôs a comparar os dois tipos de cartilagem no dorso nasal dos coelhos. Foram estudados 28 coelhos por um seguimento de até seis meses, sendo que a metade para cada tipo de cartilagem. Após este seguimento, os coelhos foram sacrificados e realizados estudos morfológicos e histológicos com reabsorção dos enxertos na maioria dos coelhos, independentemente do sítio doador, não havendo diferença estatística que justifique a distinção das cartilagens. Porém, o que mais chamou a atenção neste estudo foi a substituição dos tecidos enxertados em tecidos fibroadiposo, ósseo ou fibroso.
Gelfoam®Gelfoam
® é uma substância composta por uma esponja estéril de gelatina absorvível de pele de animais. Quando implantada em tecidos, é completamente absorvida dentro de quatro a seis semanas, sem acarretar formação excessiva de tecido cicatricial. Quando aplicada em áreas hemorrágicas da mucosa vaginal, retal, nasal ou da pele, se liquefaz completamente dentro de dois a cinco dias. É preparada com uma solução de gelatina especialmente tratada e purificada, aquecida até alcançar a porosidade adequada, sendo depois seca, cortada, embalada, selada e esterilizada sob calor seco.
30 É indicado em procedimentos cirúrgicos para auxiliar na obtenção de hemostasia nos seguintes campos da cirurgia: neurocirurgia, ginecologia, ortopedia, urologia, cirurgias abdominais e anorretais; e na área de otorrinolaringologia é usada tanto na otologia quanto na laringologia e rinologia.
30 É contraindicado no fechamento de incisões de pele, pois pode interferir na cicatrização, e também não deve ser empregado para debelar hemorragias do pós-parto ou menorragias. Também não é recomendada na presença de infecções e compartimentos intravascular, por risco de embolias.
30BiomateriaisA Agência Nacional de Vigilância Sanitária
11 define como biomateriais os materiais sintéticos ou naturais, sólidos ou, às vezes líquidos, utilizados em dispositivos médicos.
Segundo Amorim,
31 quando uma substância é implantada no organismo ocorre uma reação universal, inicialmente com a formação de tecido inflamatório composto de células de exsudato sanguíneo e desenvolvimento de tecido inflamatório, com acúmulo de biopolímeros de tecido conjuntivo extracelular da matriz. O processo completa-se com a formação de tecido fibroso rico em colágeno, levando à reparação anatômica e biomecânica do defeito. Esses resultados dependerão de algumas características próprias do material, como porosidade, textura da superfície, consistência e propriedades físico-químicas.
MATERIAIS E MÉTODOS
MateriaisForam utilizados, para a pesquisa, 30 coelhos adultos da raça
New Zealand, com peso aproximado de 4 kg, Gelfoam
® estéril, fio mononylon 3.0, Xilocaina
® com adrenalina 1:200.000, Clorexidina
® aquosa, lâmina de bisturi número 15, caixa cirúrgica de rinosseptoplastia composta de pinça, porta-agulha, tesoura, aspirador descolador, compasso cirúrgico, afastador tipo Alfrish, seringa e agulha de insulina.
Seleção e tamanho da amostraOs coelhos foram distribuídos aleatoriamente por meio de sorteio realizado com moeda, sendo divididos em dois grupos: Grupo sem Gelfoam
®, constituído por 15 coelhos; e Grupo Gelfoam
® constituído por 15 coelhos. O próximo passo foi dividir em três subgrupos, a saber:
Grupo 1: 10 coelhos seguidos por sete dias após procedimento, sendo cinco com cartilagem auricular e cinco com cartilagem auricular envolta com Gelfoam®.
Grupo 2: 10 coelhos seguidos por 30 dias após procedimento, Sendo cinco com cartilagem auricular e cinco com cartilagem auricular envolta com Gelfoam®.
Grupo 3: 10 coelhos seguidos por 60 dias após procedimento, Sendo cinco com cartilagem auricular e cinco com cartilagem auricular envolta com Gelfoam®.
Procedimento cirúrgicoApós aprovação no Comitê de Ética em Experimentação Animal número 030/10, os procedimentos cirúrgicos foram realizados de acordo com os princípios éticos na experimentação animal, postuladas pelo Código Brasileiro de Experimentação em Animais (COBEA).
Os procedimentos cirúrgicos foram realizados com os coelhos sob anestesia geral, utilizando-se Zoletil
® (Tiletamina associado à Zolazepan) e Nilperidol
® (Fentanila associado à Droperidol) e mantidos sob ventilação espontânea, em decúbito ventral.
A cartilagem auricular foi adquirida após infiltração de anestésico com vasoconstritor (fig. 1); uma incisão em formato retangular aproximadamente 3 cm de extensão foi confeccionada na pele do pavilhão auricular após dissecção do subcutâneo e pericôndrio (fig. 2).
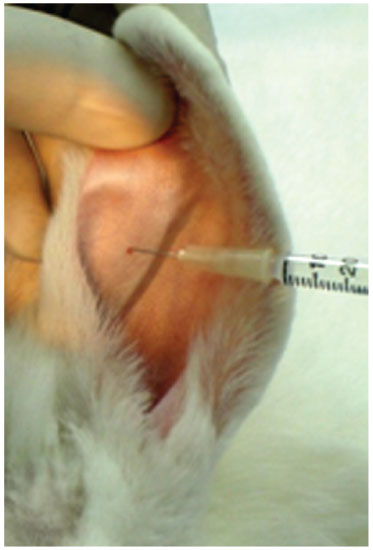
Figura 1 Infiltração na orelha com lidocaína 2%, com vasoconstritor norepinefrina, na concentração 1:200.000 (Xylocaína
®).
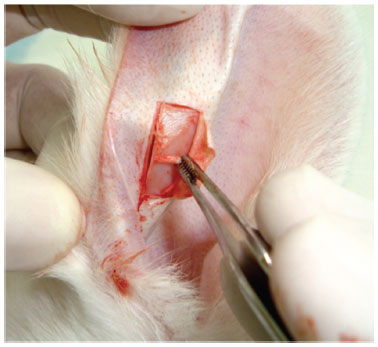
Figura 2 Incisões horizontais já realizadas com pele rebatida e realização de remoção do pericôndrio.
Para colocação do enxerto no dorso nasal foi feita uma infiltração na região interocular e, em seguida, realizada uma incisão centralizada com cerca de 1 cm de extensão horizontal (fig. 3). Um túnel subperiosteal de 3 cm de extensão por 1 cm de largura foi realizado da região interocular até a ponta nasal, para que servisse como uma bolsa para o depósito do enxerto.
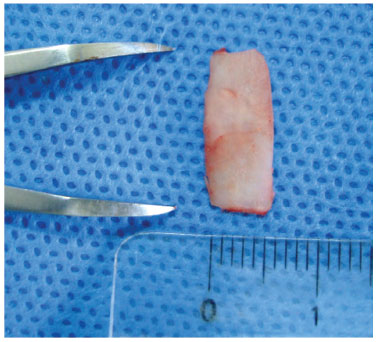
Figura 3 Confecção de uma tira de cartilagem de 0,5 cm de largura medida com compasso cirúrgico sem Gelfoam
®.
Depois de estabelecido o local de colocação do enxerto, uma tira de 1,5 cm de comprimento e 0,5 cm de largura foi desenhada e recortada da cartilagem auricular, medida com compasso cirúrgico para colocação na bolsa de enxertia sobre o dorso nasal, sendo que metade envolta sem Gelfoam
® (fig. 4) e metade com Gelfoam
® (fig. 5).
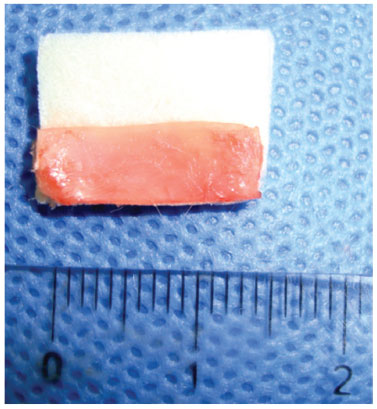
Figura 4 Confecção de uma tira de cartilagem de 1,5 cm de comprimento medida com compasso cirúrgico com Gelfoam
®.
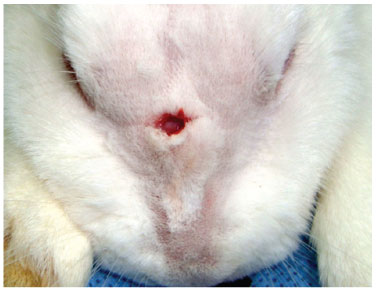
Figura 5 Incisão centralizada, com cerca de 1 cm de extensão.
Após a inserção da tira de cartilagem na bolsa (fig. 6), um ponto de sutura com fio nylon 3.0 foi aplicado na incisão supraciliar e no local de coletagem do pavilhão auricular, e o procedimento foi encerrado.
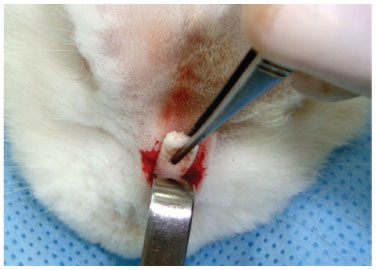
Figura 6 Túnel subperiosteal de cerca 3 cm de extensão por 1 cm de largura, com inserção da cartilagem com o Gelfoam
®.
Os coelhos foram mantidos em subgrupos nas mesmas condições de cuidados diários prévios ao tratamento por sete, 30 e 60 dias, quando foram sacrificados e submetidos à análise histopatológica da peça cirúrgica.
Para o sacrifício ao final do tempo de seguimento, os coelhos foram novamente anestesiados e receberam tiopental sódico EV (dose 40 mg/kg). Após o sacrifício, a mesoestrutura facial foi removida em bloco para estudo histológico.
Os coelhos foram avaliados por parâmetros clínicos que pudessem, indiretamente, avaliar as condições de tolerabilidade, tais como desconforto geral e de respiração. Os parâmetros avaliados foram: quantidade de alimentos ingeridos, variação do peso do coelho, temperatura, frequência respiratória e presença de sangramento nasal. Todos os coelhos foram pesados antes do procedimento e diariamente até seu sacrifício. A quantidade de alimentos ingeridos foi controlada diariamente em gramas. A temperatura auricular, em graus Celsius, foi mensurada duas vezes ao dia. A frequência respiratória foi verificada duas vezes ao dia.
As mesoestruturas faciais dos animais foram dissecadas e fixadas em solução de formol a 10% e enviada ao laboratório de anatomopatologia para análise com um patologista experiente.
Avaliação histológicaAs mesoestruturas faciais dos animais ficaram cinco dias em solução de ácido nítrico a 5% para descalcificação. Uma vez descalcificadas, foram feitos cortes seriados transversais do nariz ao crânio a cada 5 mm. As fatias foram em seguida desidratadas, clarificadas e incluídas em parafina. Após inclusão em blocos de parafina, os espécimes foram cortados em micrótomo com espessura média de 5µm.
Os cortes foram submetidos à coloração com hematoxilina-eosina e os padrões de resposta tecidual foram avaliados histologicamente em: presença de neovascularização, tecido de granulação, inflamação aguda (neutrófilos, eosinófilos e fibrina) e inflamação crônica (fibroblastos, macrófagos, linfócitos, histiócitos plasmócidos). As lâminas foram analisadas por um único patologista, de maneira cega, quanto ao grupo a que espécime pertencia, e classificadas em graus por critérios qualitativo e semiquantitativo. Dessa maneira, os padrões de resposta tecidual (figs. 7 e 8) forma analisados em em leve (+); moderado (++) e intenso (+++).
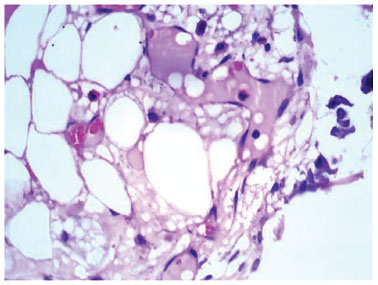
Figura 7 Fotomicrografia em microscopia óptica com células inflamatórias agudas. Coloração: Hematoxilina e eosina. Aumento de 100×.
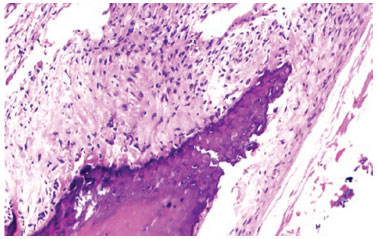
Figura 8 Fotomicrografia em microscopia óptica com células inflamatórias crônicas. Coloração: Hematoxilina e eosina. Aumento de 40×.
Para comparar a neovascularização, a formação do tecido de granulação e a presença de inflamação aguda e crônica entre os grupos, utilizamos os testes Qui-quadrado ou exato de Fisher. O nível de significância adotado é de 5% (0,05).
RESULTADOSNenhum dos coelhos apresentou qualquer intercorrência cirúrgica ou pós-operatória.
A grande maioria teve uma discreta perda de peso no primeiro dia após o procedimento, evoluindo posteriormente com ganho de peso progressivo, o que era esperado para o período.
Para quantificar a intensidade dos parâmetros histopatolóicos analisados, foi utilizado o formato em cruzes, onde uma cruz (+) foi considerada leve, duas cruzes (++)moderada e três, (+++) intensa.
A tabela 1 mostra a média do peso dos coelhos dos dois grupos antes e depois do procedimento cirúrgico.
A figura 9 mostra que não houve diferença estatística em relação à presença de neovascularização no grupo sem Gelfoam
® e no com Gelfoam
®, em relação aos testes Qui-quadrado ou exato de Fisher, onde o nível de significância adotado é de 5% (0,05).
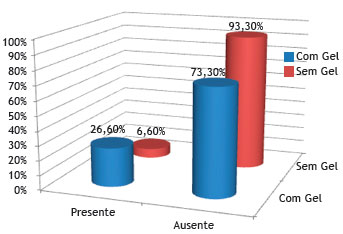
Figura 9 Porcentagem de coelhos que apresentaram ou não neovascularização, nos grupos controle (sem Gelfoam
®) e experimental (com Gelfoam
®).
A figura 10 mostra que não houve diferença estatística em relação à presença de tecido de granulação no grupo sem Gelfoam
® e no com Gelfoam
®, em relação aos testes Qui-quadrado ou exato de Fisher, onde o nível de significância adotado é de 5 % (0,05).
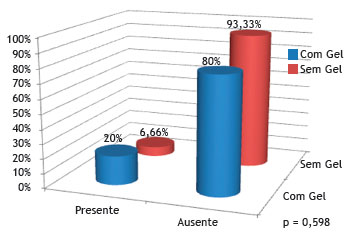
Figura 10 Porcentagem de coelhos que apresentaram ou não tecido de granulação, nos grupos controle (sem Gelfoam
®) e experimental (com Gelfoam
®).
A figura 11 mostra que não houve diferença estatística em relação à presença de processo inflamatório agudo no grupo sem Gelfoam
® e no com Gelfoam
®, em relação aos testes Qui-quadrado ou exato de Fisher, onde o nível de significância adotado é de 5 % (0,05).
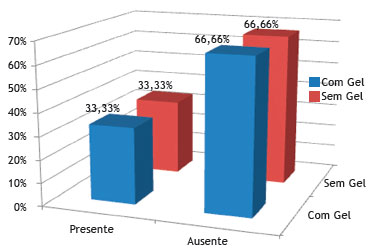
Figura 11 Porcentagem de coelhos que apresentaram ou não processo inflamatório agudo, nos grupos controle (sem Gelfoam
®) e experimental (com Gelfoam
®).
A figura 12 mostra que não houve diferença estatística em relação á presença de processo inflamatório crônico no grupo sem Gelfoam
® e no com Gelfoam
®, em relação aos testes Qui-quadrado ou exato de Fisher, onde o nível de significância adotado é de 5 % (0,05).
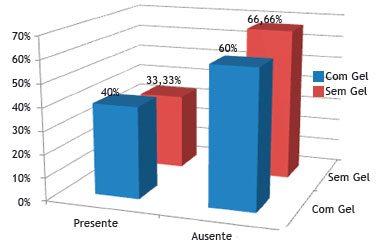
Figura 12 Porcentagem de coelhos que apresentaram ou não processo inflamatório crônico, nos grupos controle (sem Gelfoam
®) e experimental (com Gelfoam
®).
Dentre as várias opções de enxerto para reconstrução nasal, em nosso trabalho, optamos pela cartilagem auricular, considerando, principalmente, situações em que não se tem mais como adquirir a cartilagem septal, especialmente nos casos de rinoplastia secundária e perfurações septais amplas por motivos diversos (iatrogenia, traumas, consequências de hematomas septais, doenças granulomatosas, usuários de cocaína, entre outras).
O grande número de técnicas cirúrgicas descritas para reconstruções de dorso nasal na literatura, assim como a quantidade de materiais que podem ser utilizados, sugere que a melhor técnica ainda permanece controversa.
O escolha do Gelfoam
® se deu pelo fato de nós, otorrinolaringologistas, já termos uma certa prática e facilidade do seu manuseio, especialmente em cirurgias otológicas e, em alguns casos, laringológicas. O tempo determinado em nossa pesquisa foi determinado em virtude de, na bula do biomaterial, constar que, caso esteja em contato com sangue, este se dissolverá em torno de dois a cinco dias, mas quando em contato com tecido pode ficar entre quatro a seis semanas. Como em nosso experimento não há presença de sangramento abundante, resolvemos testá-lo quanto ao tecido cicatricial em sete, 30 e 60 dias. Além do mais, sabemos que existe um grau de absorção do material enxertado, e o intuito do trabalho foi colocar despertar uma expectativa em torno da formação de mais tecido cicatricial na área receptora.
Os enxertos e implantes mais utilizados na atualidade incluem: cartilagem e ossos autógenos, que, apesar de serem os preferidos, nem sempre estão disponíveis, devido a cirurgias prévias na região afetada ou dificuldade técnica de obtenção. Além disso, o desconforto e a possibilidade de complicações na área doadora são fatores relevantes. Os materiais sintéticos ou aloplásticos também não estão isentos de problemas, podendo ocorrer infecção e extrusão do enxerto. Para testar um possível novo composto de enxertia nasal, lançamos mão de estudo experimental, nos quais os animais utilizados foram coelhos.
Para o desenvolvimento do modelo de reconstrução do dorso nasal de coelhos com e sem Gelfoam
®, foram escolhidos os coelhos da raça
New Zealand, por possuírem área doadora de cartilagem auricular abundante nessa região. Outra vantagem é o porte do animal, o que possibilita seu manuseio, transporte, alojamento e manutenção em gaiolas pequenas, ao contrário das necessidades exigidas por animais de porte maior, o que dificultaria o estudo.
Devido à sua característica dócil, a manipulação do animal durante as etapas pré-operatória, operatória e pós-operatória foi simples, não demandando cuidados de maior complexidade. A fim de reduzir as possibilidades de infecções, todos os animais foram submetidos a uma antissepsia rigorosa.
O pesquisador se preocupou em deixar todos os enxertos de cartilagem sem a presença do pericôndrio, para quem sabe, no futuro, podermos comparar, em uma possível tese de doutorado, com a presença de pericôndrio, respeitando 1,5 cm de comprimento e 0,5 cm de largura, sendo que as mesmas medidas foram propostas para o Gelfoam
®.
Alguns autores relatam a utilização de diversos e diferentes enxertos para a correção do nariz em sela provenientes de locais distantes, como fáscia lata,
27 osso temporoparietal,
24 corneto inferior,
23 sistema músculo aponeurótico subcutâneo (SMAS)
19, sem levar em consideração os inúmeros enxertos aloplásticos, como descritos por Sheen,
17 Costa et al.
26 e Tostes et al.
28 Apesar das vantagens associadas ao uso da cartilagem auricular como área doadora, alguns cirurgiões são relutantes em usá-la, devido à preocupação com potencial de complicações infecciosas durante a manipulação da cartilagem. A isquemia tecidual poderia levar ao desenvolvimento de condrite supurativa. A necrose que se seguiria poderia produzir repercussões estéticas, psicológicas e médico legais.
23 Felizmente, em nosso estudo, não tivemos qualquer intercorrência nesta parte, pois houve uma grande preocupação com assepsia e antissepsia, além do uso de antibiótico profilático, o mesmo encontrado nos trabalhos de Jovanovic e Berghaus
16 e Souza.
29 A frequência de complicações na área doadora auricular, associadas à manipulação de pele e cartilagem durante os procedimentos reconstrutivos, é mínima, quando uma técnica estéril e delicada e o uso de antibióticos profiláticos apropriados são utilizados, segundo Patrocinio e Patrocinio
21 e Kaplan e Cook.
23 Sobre a presença de neovascularização, que nada mais é que uma nova formação da trama vascular, somente um coelho do grupo sem Gelfoam
® a apresentou; já no grupo com Gelfoam
®, 20% deles apresentaram presença de trama vascular. Somente os coelhos do grupo I e II apresentaram neovascularização, ainda que de forma leve e moderada.
O aparecimento de células gigantes caracteriza a reação de granulação. No grupo com Gelfoam
®, por sua vez, pouco mais de 20% apareceram com tecido de granulação. Em nenhum dos animais do grupo III notamos presença de tecido de granulação, porém foram observados todos os níveis de intensidade no grupo I, e apenas de forma leve em dois coelhos do grupo II.
Esse achado, em que somente os grupos de sete e 30 dias apresentaram presença de neovascularização e tecido de granulação, se deve ao fato de ser uma parte evolutiva de resposta inflamatória que costuma aparecer e desaparecer na mesma época e, no decorrer do tempo, diminui gradativamente, até desaparecer por completo, sendo esse o motivo de, nos exames histopatológicos do grupo de 60 dias, não se encontrar mais a presença de neovascularização ou tecido de granulação.
O processo inflamatório agudo se mostrou igual em ambos os grupos com cinco coelhos para cada lado; já no processo inflamatório crônico encontramos cinco coelhos no grupo controle e seis no grupo experimental. Houve a presença, em todos os três grupos, de reação inflamatória aguda, mas apenas no grupo I foi identificado um coelho da forma intensa. O mesmo se deu no quesito de reação inflamatória crônica; todavia, nenhum dos animais evoluiu para a forma intensa, ficando apenas na leve e moderada.
O pesquisador não foi o primeiro a utilizar algum tipo de biomaterial em associação a um enxerto autólogo para correção de dorso nasal. Em 1990, Peynègre et al.
14 misturaram osso com Tissucol
® e reforçaram com Surgicel
®, para corrigir irregularidades do dorso nasal. Os autores Çelik et al.
24 utilizaram pedaços de osso temporoparietal associados com cartilagem auricular interposta e unidas com Spongostam
®, também para correção de nariz em sela.
Em nosso estudo, optamos por deixar o enxerto sem o pericôndrio, assim como Souza,
29 o que não aconteceu nos estudos de Guerrerosantos,
15 que preconizava o pericôndrio preso ao enxerto, e Gurlek et al.,
23 que deixavam o osso do corneto inferior com seu periósteo intacto para correções de nariz em sela.
O pesquisador preferiu usar um pedaço inteiro do enxerto, o que também foi encontrado em outros trabalhos, como os de Sheen
17 e Souza;
29 porém, alguns autores como Cottle,
15 preferem o uso da forma amassada.
Doner et al.
10 avaliaram que o melhor material para fixação do enxerto seria o cianoacrilato em vez da sutura; já Costa et al.
26 compararam, para a estabilização do enxerto, o butil-2-cianoacrilato, mistura gelatina resorcina-formaldeído (GRF) e sutura. Porém, em nosso estudo, optamos por não fixar os enxertos, sendo o mesmo encontrado em outros trabalhos de outros autores, como Peynégre et al.,
14 Gurlek et al.
22 e Souza.
29 Como considerações finais, sabe-se que as técnicas de enxertia aumentaram a possibilidade de atuação do cirurgião e a expectativa de sucesso nas rinoplastias. Quando consideradas as indicações com relação ao tipo de enxerto e local para sua utilização, além das características individuais do paciente, estes se constituem em excelente recurso para preenchimento ou modificação do arcabouço nasal. Porém, o bom senso nos orienta a intervir o mínimo necessário para um bom resultado pelo maior período possível.
CONCLUSÕESNão houve diferença estatisticamente significante entre os grupos com e sem Gelfoam
® com relação à neovascularização e à formação de tecido de granulação, embora os grupos I e II, que continham Gelfoam
®, apresentaram maior tendência para essas alterações.
Em relação aos processo inflamatórios agudo e crônico, também não houve diferença estatisticamente significante entre os dois grupos.
Não encontramos vantagens no uso do Gelfoam
® envolta na cartilagem para este estudo.
CONFLITOS DE INTERESSEOs autores declaram não haver conflitos de interesse.
REFERÊNCIAS1. Pochat VD, Alonso N, Meneses JVL. Avaliação funcional e estética da rinoplastia com enxertos cartilaginosos. Rev Bras Cir Plást. 2010;25:260-70.
2. Jackson IT, Smith J, Mixter RC. Nasal bone grafting using split skull grafts. Ann Plast Surg. 1983;11:533-40.
3. Frodel JL, Lawrence JM, Quatela VC, Weinstein GS. Calvarial bone graft harvest: techniques, considerations and morbidity. Arch Otolaryngol Head Neck Surg. 1993;119:17-23.
4. Cheney ML, Glicklich RE. The use of calvarial bone in nasal reconstruction. Arch Otolaryngol Head Neck Surg. 1995;643-8
5. Vuyk HD, Adamson PA. Biomaterials in rhinoplasty. Clin Otolaryngol. 1998;23:209-17.
6. Daniel RK. Rhinoplasty and rib grafts: evolving a flexible operative technique. Plast Reconst Surg. 1994;94:597-609
7. Ersek RA, Dalerm AG. Processed irradied bovine cartilage for nasal reconstruction. Ann Plast Surg.1988;20:540-6.
8. Mitre IE. Emprego de enxertos autólogos e homólogos em rinoplastias reconstrutivas e estéticas. Tese (Doutorado). São Paulo: Faculdade de Ciências Médicas da Santa Casa de São Paulo; 1997.
9. Staindl O. Therapy of saddle nose. Laryngol Rhinol Otol. 1983;62:348-55.
10. Doner F, Sari I, Ozturk AR, Karasen M, Bitirem M, Sutbeyaz Y. The auricular cartilage graft fixation with butyl-2cyanocrylate. Turk J Med Sci. 1998;28:285-90.
11. Agência Nacional de Vigilância Sanitária. Título do documento. Brasília, DF, 2005
12. Cottle MH. Nasal surgery in children. Ear Nose Throat Monthly. 1951;30:32-8.
13. Kosteck JL. Correction of saddle nose deformity with a turn-over hump segment procedure (case report). Plast Reconstr Surg.1966;38:372-5.
14. Peynègre R, Bossard B, Gilain L, Delacour I, Laccourreye O, Coste A, et al. Le griffon de poudre dos amalgame et arme dans La correction de l'arête nasale. Ann Oto-laryngol.1990;107:71-5.
15. Guerrerosantos J. Nose and paranasal argumentatiom: autogenous, fascia, and cartilage. Clin Plast Surg. 1991;18:65-86.
16. Jovanovic S, Berghaus A. Autogenous auricular concha cartilage transplant in corrective rhinoplasty. Practical hints and critical remarks. Rhinology. 1991;29:273-9.
17. Sheen JH. Tip graft: a 20-year retrospective. Plast Reconstr Surg. 1993;91:48.
18. Mitz V, Maladry D. Intérêt du prélèvement du scapha au cours dês rhinoplasties secondaires. Ann Chir Plast Esthét. 1996;41:68-74.
19. Leaf N. SMAS autografts for the nasal dorsum. Plast Recontr Surg. 1996;97:1249-52.
20. Sheen JH, Sheen AP. Aesthetic Rhinoplasty, 2nd ed. St Louis: Quality Medical Publishing;1998 (reprint of 1987 ed.).
21. Patrocínio LG, Patrocinio JA. Atualização em enxertos na rinoplastia. Braz J Otorhinolaryngol. 2001;67:394-402.
22. Gurlek A, Askar I, Bilen BT, Aydogan H, Fariz A, Alaybeyoglu N. The use of lower turbinate bone graft in the treatment of saddle nose deformities. Aesthetic Plast Surg. 2002;26:407-12.
23. Kaplan AL, Cook JL. The incidence of chondritis e perichondritis associated with surgical manipulation of auricular cartilage. Dermatol Surg. 2004;30:58-62.
24. Çelik M, Haliloglu T, Bayçin N. Bone chips and diced cartilage: an anatomically adopted graft for the nasal dorsum. Aesthetic Plast Surg. 2004;28:8-12.
25. Pontes PAL, Vieira VP. Aplicações de Gelfoam
® como tratamento de emergência na insuficiência glótica em cantora. Braz J Otorhinolaryngol. 2004;70:410-4.
26. Costa HJZR, Pereira CSB, Costa MP, Fabri FSSS, Lancelotti CLP, Dolci JEL. Estudo experimental comparativo entre o butil-2-cianoacrilato, a mistura gelatina-resorcina-formaldeído e sutura na estabilização de enxertos de cartilagem em coelhos. Braz J Otorhinolaryngol. 2006;72:61-70.
27. Espinosa JA, Jaramilo R. Fascia Homologa de banco en rinoplastia: reporte de casos. Acta Otorr Cir Cabeza y Cuello. 2007;35:88-92.
28. Tostes ROG, Ferreira FPM, Junior JCCGA, Lima JCSA, Almeida PN, Meira AAM, et al. Uso do Gore-tex
® para preenchimento do dorso nasal em rinoplastias. Rev Bras Cir Plast. 2011;26:461-5.
29. Souza LO. Estudo experimental e comparativo da utilização da cartilagem septal e auricular no dorso nasal de coelhos. Tese (Mestrado) São Paulo: Faculdade de Ciências Médicas da Santa Casa de São Paulo; 2012.
30. Bula do Gelfoam
® Pharmacia & Upjohn Co. EUA.
31. Amorim WL. Estudo experimental da resposta tecidual a presença de celulose produzida por acetobacter xylinum. Tese (Doutorado). São Paulo: Faculdade de Ciências Médicas da Santa Casa de São Paulo; 2007.
1. Universidade de Graz, Áustria
2. Faculdade de Ciências Médicas, Santa Casa de São Paulo, São Paulo, SP, Brasil
B.S.R. Silva
E-mail:
brenosimoes21@yahoo.com.brRecebido em 9 de janeiro de 2013.
Aceito em 10 de novembro de 2013.
* Trabalho realizado no Hospital Santa Casa de São Paulo, São Paulo, SP, Brasil.


