INTRODUÇÃOA rinite pode ser classificada em dois grupos: alérgico e não alérgico. O grupo não alérgico inclui rinite hormonal na qual as alterações inflamatórias na mucosa nasal estão associadas a níveis hormonais elevados, como estados de hiperestrogenismo ocorrendo durante a gravidez, menstruação ou quando em uso de contracepção hormonal.
1-3 A rinite hormonal tem sido o foco de ensaios clínicos desde o século XIX quando vários autores publicaram estudos correlacionando alterações hormonais a sintomas nasais. Alguns autores
4-7 realizaram pesquisas experimentais mostrando as alterações histológicas e histoquímicas na mucosa nasal em resposta a alterações na concentração de estrogênio no soro.
Vários ensaios clínicos
8-16 revelaram uma correlação entre aumento do estrogênio no soro e sintomas nasais ou alterações inflamatórias na mucosa nasal em exames clínicos e laboratoriais. Por outro lado, autores como Mabry,
17 Ellegard,
18,19 Bende e Gredmark,
20 e Salaroli et al.,
21 não conseguiram confirmar essa correlação.
Toppozada et al.
22-24 observaram alterações histológicas e histoquímicas na mucosa nasal humana de mulheres grávidas e daquelas que faziam uso de pílulas anticoncepcionais, em comparação a um grupo de controle. Caruso et al.
12 e Nappi et al.
25 observaram que a vagina e o epitélio respiratório nasal apresentaram os mesmos aspectos histológicos nas respectivas fases do ciclo menstrual e durante a menopausa.
Os primeiros receptores de estrogênio a serem descritos, chamados alfa (RE-alfa) foram isolados por Elwood Jensen em 1958. Em 1996, Enmark e Gustafsson
26 descobriram um segundo tipo de receptor, chamado beta (RE-beta). Teorias propostas sobre as funções fisiológicas dessas duas isoformas envolvem uma ação seletiva de estrogênio em diferentes tecidos.
Assim, pesquisas sobre os dois subtipos de receptores em uma gama de diferentes órgãos e tecidos tem sido realizadas. O RE-beta foi encontrado em próstata, ovários, testículos, útero, hipófise, bexiga, pulmão, glândulas salivares, mucosa oral, timo, glândulas suprarrenais, trato olfatório, sistema nervoso central, coração, rins e células do sistema imunológico.
27 O RE-alfa foi encontrado em concentrações mais elevadas no útero, vagina e mama;
28 contudo, poucos estudos investigam os receptores de estrogênio na mucosa nasal.
A mucosa das conchas nasais inferiores em mulheres com rinopatia crônica foi investigada por imuno-histoquímica para os receptores de estrogênio, tendo sido detectados no citoplasma de células do epitélio glandular.
29,30 Millas
31 utilizou a imuno-histoquímica para estudar os receptores de estrogênio alfa e beta na mucosa das conchas nasais inferiores de indivíduos normais. Todos os 11 casos estudados (cinco mulheres e seis homens) apresentaram receptores de estrogênio alfa e beta (predominantemente ER-beta) no citoplasma de células do epitélio glandular da lâmina própria. Shirasaki et al.
32 observaram receptores alfa nos núcleos de mastócitos e receptores beta nos núcleos de células do epitélio glandular da lâmina própria em indivíduos com rinopatia crônica.
Ainda há controvérsias sobre o local e a função dos receptores de estrogênio na mucosa nasal. Millas et al.
33 associaram a influência dos contraceptivos orais sobre a distribuição e a densidade dos receptores de estrogênio na mucosa nasal de mulheres e descobriram que as que faziam uso de pílulas anticoncepcionais apresentavam um número menor de receptores na lâmina própria.
A expressão dos receptores nas células é dinâmica e regulada principalmente pela concentração de seus ligantes cognatos. Relatos de Jensen e Gorski que descrevem a regulação da concentração dos receptores de estrogênio observaram que o tratamento com esse hormônio levou a um aumento nos receptores citosólicos de estrogênio (RE) com base na redução na ligação específica ao 17-beta estradiol. Considerando que os receptores são os fatores determinantes fundamentais da ação de vários hormônios nas células-alvo e que a evidência aponta para uma possível atividade do estrogênio na mucosa nasal, o mecanismo de regulação para baixo (
down-regulation) pode explicar o fato de que, em geral, as mulheres não apresentam efeitos hormonais significativos no nariz quando há alteração significativa em seus hormônios sexuais.
Inversamente, podemos propor uma hipótese em que os mecanismos que regulam a expressão dos receptores estão ausentes e sua concentração continua estável, mesmo durante uma concentração hormonal elevada, levando possivelmente a sintomas estrogênicos locais na mucosa nasal. Nosso objetivo foi verificar se a elevação nos níveis circulantes de estrogênio influencia a concentração dos receptores de estrogênio na mucosa nasal de cobaias.
MATERIAIS E MÉTODOS Foi realizado um estudo prospectivo de amostras da mucosa nasal de 30 cobaias adultos pesando entre 300 g e 400 g.
Os procedimentos foram realizados de acordo com os regulamentos do Comitê de Ética em Pesquisa da Unidade de Técnica Cirúrgica Experimental e cumpriu as normas previstas na Lei Federal nº 1153/95, bem como os princípios éticos na experimentação estabelecidos pelo Colégio Brasileiro de Experimentação Animal (COBEA).
ProcedimentosOs procedimentos cirúrgicos foram realizados com anestesia de 125 mg/5 mL de cloridrato de tiletamina e 125 mg/5 mL de cloridrato de zolazepam em uma dose de 0,4 mL/kg mais citrato de fentanila + droperidol. As cobaias foram submetidas a biópsia de material colhido da mucosa nasal esquerda utilizando uma pinça de biópsia, obtendo fragmentos medindo aproximadamente 2 x 2 x 2 mm. Após a coleta, todos os fragmentos foram imediatamente imersos em formalina tamponada a 4% e enviados para processamento histológico.
As cobaias receberam 0,5 mL de cipionato de estradiol, solução estéril, 2 mg/mL (E.C.P.
TM, Pfizer) intraperitoneal, diariamente por 30 dias. As cobaias receberam ração e água
ad libitum. Após esses trinta dias de terapia hormonal, as cobaias foram sacrificadas sob anestesia por injeção de uma dose letal de cloreto de potássio e submetidas à exposição e remoção da mucosa nasal da concha média contralateral ao local da biópsia inicial.
Análise imuno-histoquímica
As amostras de tecido foram submetidas à imersão sequencial em formalina tamponada por 1 hora, imersão em álcool absoluto (seis vezes em recipientes diferentes cada uma por 1 hora), imersão em xilol (quatro vezes em recipientes diferentes cada uma por 1 hora) e imersão em parafina líquida (duas vezes em recipientes diferentes cada uma por 1 hora). Posteriormente, as amostras foram embebidas em parafina líquida. Os blocos de parafina dos dois momentos foram enviados para o Rodent Histopathology Core do Departamento de Patologia da Faculdade de Medicina de Harvard, Boston, EUA, onde os blocos foram cortados em pedaços de 4 µm de espessura e montados em lâminas eletricamente carregadas, com cada lâmina contendo dois pedaços. As lâminas foram então enviadas para o laboratório de patologia do Brigham and Women Hospital, Boston, EUA, para realização do processamento imuno-histoquímico. Nesse procedimento, as lâminas foram submetidas ao processo de desparafinação por imersão por 10 minutos em Hemo-De
TM (Scientific Safety Solvents, Texas, EUA) seguida de imersão em seis recipientes diferentes de álcool absoluto. O bloqueio da peroxidase endógena foi então feito por imersão em uma solução 30% de peróxido de hidrogênio a 3% e 70% de álcool absoluto. As lâminas foram então lavadas em água corrente por 3 minutos.
Foi realizada então recuperação antigênica por imersão em uma solução tamponada de citrato pH 6 pré-aquecida a 25º C por 30 minutos. Os cortes foram delimitados utilizando uma caneta Pap Pen
TM (SciTek Laboratories). As lâminas foram deixadas por 1 minuto em um recipiente contendo 500 mL de PBS com 10 mL de BRU 1%. Após remoção dessa solução, o anticorpo primário não marcado H222 foi aplicado (marcador de RE-alfa e RE-beta) para receptores de estrogênio em uma concentração final de 5 µg/mL e submetido a incubação de um dia para o outro a 4º C em uma câmara úmida. Após incubação, as lâminas foram lavadas com PBS para remoção de restos de anticorpo primário e então reimersas em solução PBS/BRU 1% por 10 minutos. Os pedaços foram incubados com um anticorpo secundário Mouse Envision+
TM (DakoCytomation, Glostrup, Dinamarca) por 30 minutos, lavados novamente com PBS e imersos em solução PBS/BRU 1% por 10 minutos. Os cortes foram então incubados em uma solução de DAB+
TM (DakoCytomation), 1 gota por mL de tampão por 10 minutos; após remoção da incubação, as lâminas foram lavadas em água corrente, contrastadas com hematoxilina de Mayer (1,5 minutos), lavadas novamente, submetidas a água de Scott (1 minuto) e lavadas novamente em água corrente. Os cortes foram então desidratados, secados e montados com lamínulas.
As lâminas foram analisadas em pares, comparando as imagens obtidas antes e depois da terapia hormonal por meio da análise de densidade óptica relativa (RODTM).
A ROD é um programa de software para avaliação quantitativa da imagem, que estima a quantidade de agregados sólidos em uma única imagem bidimensional após devida calibragem para uma espessura vertical conhecida (lâmina imuno-histoquímica) (fig. 1). A metodologia reduz a subjetividade das observações e possibilita a determinação numérica do tecido manchado, facilitando a comparação em pares. Para cada amostra, 4 lâminas separadas pré e pós-terapia foram avaliadas e o resultado médio foi utilizado.
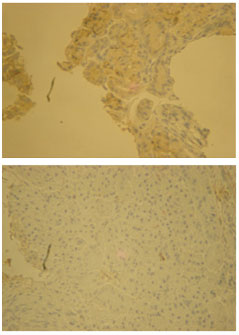
Figura 1 Estudo imuno-histoquímico de receptores de estrogênio antes (A) e depois (B) da terapia hormonal (40X).
Os resultados foram comparados utilizando o teste T pareado paramétrico (terapia pré e pós-hormonal).
A análise do grupo pareado produziu os resultados expostos na tabela 1.
Os animais 16 e 19 não apresentaram glândulas em seus respectivos cortes histológicos, ao passo que as lâminas pós-terapia do animal 23 foram perdidas.
Análise estatísticaO teste t de Student paramétrico foi realizado utilizando os resultados da ROD das amostras de 19 animais a partir das lâminas pré e pós-terapia. Os grupos eram estatisticamente diferentes, e o pré-tratamento mostrou um número maior de receptores que o pós-tratamento.
DISCUSSÃO Com base nas observações clínicas, vários estudos indicam uma correlação entre alterações hormonais e obstrução nasal. A "rinite hormonal" é citada em vários livros didáticos de Otorrinolaringologia, e seu mecanismo fisiopatológico subjacente continua desconhecido.
Vários estudos indicaram a atividade dos hormônios sexuais femininos na mucosa nasal. Postula-se que em situações de aumento dos níveis de hormônio no soro (estrogênio), há um estímulo que aumenta a expressão de seus receptores,
34 levando a alterações na densidade e na localização desses receptores.
Em nosso estudo, observamos a influência da administração de estradiol sobre a expressão dos receptores de estrogênio na mucosa nasal de cobaias.
Nesta pesquisa, tivemos que lidar com alguns problemas, incluindo fragmentação excessiva do tecido no grupo tratamento pré-estrogênio, que era mais propenso devido à técnica de coleta de tecido utilizada. Coletamos as amostras com uma pequena pinça de biópsia introduzida na cavidade nasal. Consequentemente, o local exato da coleta do tecido não foi preciso, e o mecanismo de ação do instrumento (segurar e puxar) também pode ter levado à dilaceração excessiva do tecido, comprovada nas lâminas pela ausência de continuidade e qualidade. Além disso, essa técnica possibilitou a coleta de apenas pequenas quantidades de material, reduzindo a qualidade dos cortes histológicos. O grupo tratamento pós-estrogênio, por outro lado, apresentou cortes histológicos com maior qualidade, pois as amostras de tecido foram obtidas após exposição cirúrgica completa da cavidade nasal, possibilitando a coleta de maiores quantidades de tecido por meio de corte com uma lâmina afiada. Contudo, a fragmentação do tecido não comprometeu a representação das glândulas nas lâminas pré-tratamento, que mostraram um bom nível de coloração imuno-histoquímica.
A adequação da coloração imuno-histoquímica também pode ser considerada, pois a ausência de atividade do anticorpo primário (H222, anticorpo não marcado para os receptores de estrogênio específicos das amostras das cobaias) impediu a avaliação da atividade dos anticorpos, pois não foi possível obter lâminas de controle positivas e negativas. Vale relembrar que o anticorpo H222, específico para as amostras das cobaias e fornecendo uma coloração não marcada de receptores de estrogênio, não mais se encontra comercialmente disponível. Geoffrey Greene, que desenvolveu o anticorpo H222 em associação com a empresa Abbott, ofereceu o material utilizado neste estudo.
A redução significativa dos receptores de estrogênio encontrada em animais pós-tratamento sugere a existência de um mecanismo de
feedback negativo acionado pelos níveis hormonais plasmáticos excessivos. Essa relação é pouco discutida na literatura no que diz respeito aos casos de alteração hormonal relacionada a reatividade nasal durante instabilidade hormonal, como nos períodos pré-menstrual, de gravidez e de menopausa.
A expressão e a estabilidade do receptor de estrogênio (ER) são resultado de um processo completo modulado por estrogênios e antiestrogênios. Essa regulação parece ser resultado de dois mecanismos reguladores diferentes. Primeiramente, a exposição ao estrogênio leva a uma rápida queda no nível de mRNA e das proteínas responsáveis pela produção de RE. Em segundo lugar, a exposição ao estrogênio leva a um aumento no nível estável de mRNA.
35 Esses mecanismos podem não estar presentes em mulheres com sintomas de rinite hormonal, resultando na persistência do nível do receptor mesmo na presença excessiva de estrogênio.
Uma abordagem para determinar o impacto de estrogênio em excesso pode ser feita avaliando o impacto da reposição hormonal em concentração de receptor de estrogênio na mucosa nasal de mulheres após a menopausa.
Por outro lado, a relação negativa entre o estrogênio utilizado e o número de receptores de estrogênio na mucosa nasal indica uma possível utilidade do tratamento tópico na administração da rinite com um componente glandular significativo, rinorreia e edema nasal.
CONCLUSÃO Há uma redução significativa na expressão dos receptores de estrogênio na mucosa nasal de animais que recebem estradiol por trinta dias.
CONFLITOS DE INTERESSE Os autores declaram não haver conflitos de interesse.
REFERÊNCIAS 1. Scadding GK. Non-allergic rhinitis: diagnosis and management. Curr Opin Allergy Clin Immunol. 2001;1:15-20.
2. Settipane RA, Lieberman P. Update on nonallergic rhinitis. Ann Allergy Asthma Immunol. 2001;86:494-507.
3. Garay R. Mechanisms of vasomotor rhinitis. Allergy. 2004;59:S4-10.
4. Brittebo EB. Localization of oestradiol in the rat nasal mucosa. Acta Pharmacol Toxicol Copenh. 1985;57:285-90.
5. Li N. Effect of over dose sex hormone on rabbit's nasal mucosa. Zhonghua Er Bi Yan Hou Ke Za Zhi. 1991;26:85-7.
6. Zhao XJ, McKerr G, Dong Z, Higgins CA, Carson J, Yang ZQ, et al. Expression of oestrogen and progesterone receptors by mast cellas alone, but nor lymphocytes, macrophages or other immune cells in human upper airways. Thorax. 2001;56:205-11.
7. Dong Z, Zhu J, Sun S. Effect of the purariae-isofiavones on estrogen level in normal and ovariectomized rats. Lin Chuang Er Bi Yan Hou Ke Za Zhi. 1998;12:174-6.
8. Lorenzen I, Schiff M. Vascular connective tissue under the influence of oestrogens. 3. Effect of oestrogens on experimental arteriosclerosis. Morphological and biochemical studies. Acta Endocrinol Copenh. 1968;57:457-64.
9. Schreiber U. Vasomotoric rhinitis as an adverse effect of hormonal contraception. HNO. 1973;21(6):180-1.
10. Armengot M, Basterra J, Marco J. Nasal mucociliary function during the menstrual cycle in healthy women. Rev Laryngol Otol Rhinol. 1990;111:107-9.
11. Haeggstrom A, Ostberg B, Stjerna P, Graf P, Hallen H. Nasal mucosal swelling and reactivity during a menstrual cycle. ORL J Otorhinolaryngol Relat Spec. 2000;62:39-42.
12. Caruso S, Grillo C, Agnello C, Maiolino L, Intelisano G. Serra AA. prospective study evidencing rhinomanometric and olfactometric outcomes in women taking oral contraceptives. Hum Reprod. 2001;16:2288-94.
13. Grillo C, La Mantia I, Triolo C, Scollo A, La Boria A, Intelisano G, et al. Rhinomanometric and olfactometric variations throughout the menstrual cycle. Am Otol Rhinol Laryngol. 2001;110:785-9.
14. Navarrete-Palacios E, Hudson R, Reyes-Guerrero G, Guevara-Guzman R. Correlation between cytological characteristics of the nasal epithelium and the menstrual cycle. Arch Otolaryngol Head Neck Surg. 2003;129:460-3.
15. Philpott CM, Conboy P, Al-Azzawi F, Murty G. Nasal physiological changes during pregnancy. Clin Otolaryngol. 2004;29:343-51.
16. Philpott CM, El-Alami M, Murty GE. The effect of the steroid sex hormones on the nasal airway during the normal menstrual cycle. Clin Otolaryngol. 2004;29:138-42.
17. Mabry RL. Rhinitis of pregnancy. South Med J. 1986;79:965-71.
18. Ellegard EK, The etiology and management of pregnancy rhinitis. Am J Respir Med. 2003;2:469-75.
19. Ellegard EK. Clinical and pathogenetic characteristics of pregnancy rhinitis. Clin Rev Allergy Immunol. 2004;26:149-59.
20. Bende M, Gredmark T. Nasal stuffiness during pregnancy. Laryngoscope. 1999;109:1108-10.
21. Salaroli AF, Fernandez OO, Morandi V, R Júnior LA, Ruston CR, Schmidt JM, et al. Influencia ou não dos anticoncepcionais orais na rinite alergica. J Bras Med. 2001;81:31-4.
22. Toppozada H. The human nasal mucosa in the menopause. J Laryngol Otol. 1988;102:314-8.
23. Toppozada H, Michaels L, Toppozada M, El-Ghazzawi I, Talaat A, Elwany S. The human nasal mucosa in the menstrual cycle. J Laryngol Otol. 1981;95:1237-47.
24. Toppozada H, Michaels L, Toppozada M, El-Ghazzawi I, Talaat A, Elwany S. The human respiratory nasal mucosa in pregnancy. J Laryngol Otol. 1982;96:613-26.
25. Nappi C, Sardo AS, Guerra G, Bifulco G, Testa D, Di Carlo C. Functional and morphologic evaluation of the nasal mucosa before and after hormone therapy in postmenopausal women with nasal symptoms. Fert Steril. 2003;80:669-71.
26. Enmark E, Gustafsson JA. Oestrogen receptors - an overview. J Intern Med. 1999;246:133-8.
27. Ozawa H. Steroid hormones, their receptors and neuroendocrine system. J Nihon Med Sch. 2005;72:316-25.
28. Pavao M, Traish AM. Estrogen receptor antibodies: specifity and utility in detection, localization and analyses of estrogen receptor alpha and beta. Steroids. 2001;66:1-6.
29. Bowser C, Riederer A. Detection of progesterone receptors in connective tissue cells of the lower nasal turbinates in women. Laryngorhinootologie. 2001;80(4):182-6.
30. Balbani APS. Ação do estrógeno e progesterona na mucosa nasal humana: avaliação do transporte mucociliar nasal de sacarina e pesquisa de receptores hormonais através de método imunohistoquímico. [thesis]. Faculdade de Medicas da Universidade de São Paulo: São Paulo; 2001.
31. Millas I. Pesquisa da presença de receptores p/estrógeno tipos Alfa e Beta na mucosa de conchas nasais inferiores através de método imuno-histoquímico. [thesis]. Faculdade de Ciências Médicas da Santa Casa de São Paulo: São Paulo; 2006.
32. Shirasaki H, Watanabe K, Kanaizumi E, Konno N, Sato J, Narita S, et al. Expression and localization of steroid receptors in human nasal mucosa. Acta Otolaryngol. 2004;124:958-63.
33. Millas I, Liquidato BM, Buck HdeS, Barros MD, Paes RA, Dolci JE. Evaluation of estrogenic receptors in the nasal mucosa of women taking oral contraceptives. Contraception. 2011;83:571-7.
34. Levin ER. Minireview: Extranuclear steroid receptors: roles in modulation of cell functions. Mol Endocrinol. 2011;25:377-84.
35. Katzenellenbogen BS, Choi I, Delage-Mourroux R, Ediger TR, Martini PG, Montano M, et al. Molecular mechanisms of estrogen action: selective ligands and receptor pharmacology. J Steroid Biochem Mol Biol. 2000;74:279-85.
Santa Casa de São Paulo, Faculdade de Medicina, São Paulo, SP, Brasil
Autor para correspondência.
L. Silva
E-mail:
leosilva@uol.com.brRecebido em 29 de março de 2013.
Aceito em 12 de outubro de 2013.


