INTRODUÇÃOPolipose nasossinusal (PNS) ou rinossinusite crônica com polipose nasal é uma afecção inflamatória crônica das cavidades nasais e paranasais
1,2 que afeta de 1% a 4% da população e que apresenta clara associação com asma, sensibilidade a aspirina e fibrose cística
3.
Os pacientes com PNS tipicamente apresentam obstrução nasal, rinorreia, hipósmia e redução na qualidade de vida
3,4. Ainda que a polipose pareça ser uma manifestação da inflamação crônica da mucosa dos seios nasais/paranasais em pacientes alérgicos e não alérgicos, a patogenia da polipose nasal ainda é desconhecida
5,6, apesar de provavelmente se tratar de uma doença multifatorial associada a vários fatores etiológicos, com inflamação crônica persistente como fator de indubitável preponderância independente da etiologia
5. A inflamação crônica da mucosa representa um desafio para a Otorrinolaringologia.
O diagnóstico da PNS é confirmado por endoscopia nasal ou tomografia computadorizada (TC)
1. Apesar do grande impacto sobre a qualidade de vida
7, na literatura não há preocupação em torno dos biomarcadores envolvidos na patogenia da polipose nasal e de suas possíveis contribuições ao prognóstico da PNS.
Por mais de duas décadas, imunologistas têm utilizado o paradigma Th1/Th2 para explicar a maioria dos fenômenos associados à imunidade adaptativa. As células Th17 foram recentemente descritas como uma linhagem distinta que não compartilha as vias do desenvolvimento das células Th1 ou Th2. Shen et al.sugeriram que o desequilíbrio entre Treg/Th17 pode desempenhar um papel importante no desenvolvimento da PNS e que atopia pode agravar a PNS
8. Em outro estudo, Shen et al. sugeriram que a IL-17A teria um importante papel na PNS, demonstrando que a expressão de IL-17A estava significativamente regulada para cima em pacientes com PNS e era mais grave em pacientes atópicos com PNS
9.
Pouca atenção tem sido dada ao papel da IL-17A em doenças autoimunes e distúrbios crônicos inflamatórios, mas evidências indicam que a expressão de IL-17A em doenças dermatológicas inflamatórias crônicas, incluindo psoríase e dermatite atópica
10, está associada a pior evolução clínica da doença
10,11.
Considerando a falta de entendimento sobre o mecanismo que deflagra a inflamação e prejudica o desenvolvimento de novos tratamentos para a afecção, e a importância da caracterização dos mediadores inflamatórios envolvidos na patogenia da PNS, o presente estudo pretende investigar a expressão de IL-17A na PNS e verificar se tal expressão serve como marcador para prognóstico pior.
MÉTODO
População do estudoO presente estudo longitudinal prospectivo avaliou 25 pacientes com polipose nasossinusal submetidos à cirurgia para ressecção de pólipos. Pacientes sem polipose nasossinusal identificável por TC ou endoscopia nasal foram excluídos do estudo. Todos os indivíduos foram submetidos à avaliação clínica otorrinolaringológica com endoscopia nasal, tomografia computadorizada, avaliação pulmonar funcional (espirometria) e teste cutâneo por puntura no pré-operatório. As tomografias pré-operatórias foram avaliadas segundo a classificação de Kennedy para nível de acometimento por PNS
10. Todos os pacientes foram investigados para alergia e histórico positivo para asma. Os indivíduos foram divididos em dois grupos: atópicos (positivos para teste cutâneo por puntura) e não atópicos (negativos para teste cutâneo por puntura). O teste cutâneo por puntura foi executado com 10 extratos: histamina (controle positivo), soro fisiológico (controle negativo),
D. pteronyssinus, D. farinae, Blomia tropicalis, Felix domesticus, Canis familiars, P. Americana, Aspergillus fumigatus e
Alternaria alternate. Respostas positivas foram consideradas para halos três milímetros maiores dos que dos controles negativos.
Os pacientes com PNS foram divididos em histórico positivo ou negativo para asma, confirmada por meio de espirometria. O presente estudo foi aprovado pelo Comitê de Ética em Pesquisa sob o protocolo 0711/11 em 06/02/11. Todos os pacientes incluídos no estudo assinaram termos de consentimento informado.
Imuno-histoquímicaApós a cirurgia de ressecção, os pólipos foram submetidos a exame por imuno-histoquímica. Seções de quatro micra foram obtidas a partir de peças incluídas em parafina. O sistema de detecção
Universal HRP-Polymer MACH 4 (
Biocare Medical, Concord, CA, USA) foi utilizado. Em resumo, após a lavagem das seções em soro fisiológico tamponado com fosfato com 0,1% saponina, as peroxidases endógenas foram inibidas com H
2O
2. As amostras foram inicialmente incubadas com anticorpos específicos ou irrelevantes por uma hora em temperatura ambiente e subsequentemente em solução com
MACH 4 Mouse Probe por 15 minutos. Diaminobenzidina mais um cromógeno-substrato foram utilizados na promoção da fixação dos anticorpos. Anticorpos monoclonais específicos MEM-G/2 (Exbio, Praga, República Tcheca) reconhecem a cadeia pesada livre do anti-IL-17 (
Santa Cruz Biotechnology, Santa Cruz, Califórnia, EUA). Um anticorpo idêntico isótipo IgG1 antidesmina utilizado simultaneamente com cada amostra serviu de controle negativo.
Avaliação das seções coradasA análise imuno-histoquímica foi executada em tecido polipoide. A imunorreatividade foi classificada por método semiquantitativo por meio da avaliação do percentual de células positivas. Os pontos de corte para a determinação da positividade da IL-17A detectada por imuno-histoquímica foram obtidos pela análise das Curvas de Características de Operação do Receptor (ROC). A análise das curvas ROC foi executada para expressão de IL-17A. Todas as seções foram analisadas por microscopia óptica com campos de alta potência (x400) por examinadores cegados para as amostras.
Análise estatísticaFoi produzida a curva ROC para o desempenho da coloração na determinação do ponto de corte para expressão de IL-17A. Os escores da coloração por imuno-histoquímica foram comparados com o teste U de Mann-Whitney e as correlações dos escores foram testadas pela análise do coeficiente de correlação de Spearman. Análises comparativas entre grupos foram realizadas pelo teste exato de Fisher bicaudal. Significância estatística foi considerada para
p-valores inferiores a 0,05. Todas as análises estatísticas foram realizadas com o programa
GraphPad Instat (versão 5.0).
RESULTADOS
Achados Clínicos e EpidemiológicosOs resultados incluíram 25 pacientes com polipose nasossinusal submetidos à endoscopia nasal e tomografias computadorizadas para confirmar a presença de doença. O grupo continha 13 (52%) homens e 12 (48%) mulheres com idades entre 35 e 83 anos (média: 48,8 anos). Os pacientes foram divididos em dois grupos: um com 13 indivíduos negativos para o teste cutâneo por puntura (grupo de não atópicos) e outro com 12 pacientes positivos para o teste cutâneo por puntura (grupo de atópicos). Do total, 17 apresentavam asma.
Por meio da avaliação das imagens de TC, os pacientes foram classificados segundo o critério de Kennedy para grau de PNS (Gráfico 1). A maioria foi classificada como grau II.
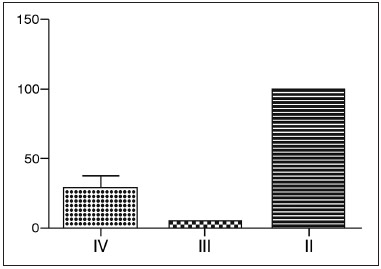
Gráfico 1. Classificação de Kennedy de pacientes com PNS - A maioria dos pacientes foi classificada como grau II; a maioria dos pacientes tinha doença etmoidal bilateral com comprometimento de um seio paranasal.
Expressão de IL-17A foi observada em células epiteliais e, principalmente, em células inflamatórias infiltrativas.
Na análise da curva ROC, o ponto de corte para resultados positivos foi 50% ou maior (AUC = 0,892;
p < 0,0001, IC 95%: 0,665 a 0,986), considerando que IL-17A foi detectada em 12 das 19 peças avaliadas (63,1%).
O número de células positivas para IL-17A foi maior nos pólipos nasais de pacientes atópicos em comparação aos não atópicos (
p = 0,0128, RR = 0,33, IC 95%: 0,1497 a 0,7421). Contudo, não foram observadas diferenças estatisticamente significativas entre pacientes asmáticos e não asmáticos (
p > 0,05) (Gráfico 2).
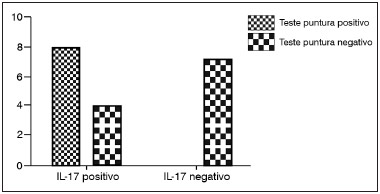
Gráfico 2. Expressão de IL-17 e resultados do teste cutâneo por puntura - O número de células positivas para IL-17 foi maior nos pólipos nasais de pacientes atópicos em comparação aos pacientes não atópicos.
A PNS é uma afecção inflamatória crônica associada à piora substancial da qualidade de vida, redução da produtividade ocupacional e consideráveis custos de tratamento
7,12. Apesar da contribuição de pesquisas recentes para o melhor entendimento da fisiopatologia desta afecção crônica das vias aéreas, a patogenia da PNS ainda permanece pouco compreendida. A PNS parece ser multifatorial, tendo sido associada a afecções como atopia, asma, fibrose cística, sensibilidade à aspirina e rinossinusite crônica
13-15.
Um diverso espectro de alterações envolvendo padrões de linfócitos T, perfis de citocinas, produção de IgE, micro-organismos e distúrbios do sistema imunológico deve estar associado à patogenia da PNS
16,17. Em tal contexto, o presente estudo avaliou a expressão de IL-17A na PNS.
Esta análise demonstrou que expressão de IL-17A foi identificada em 12 pacientes com PNS. Curiosamente, a expressão de IL-17A tendeu a ser significativamente mais frequente em pacientes positivos no teste cutâneo por puntura ou, em outras palavras, pacientes atópicos (
p = 0,0128).
Em concordância com o presente estudo, um modelo experimental demonstrou que a ausência de IL-17 em camundongos compromete o desenvolvimento da reação de hipersensibilidade de contato, reforçando a importância de tais células na sensibilidade de contato
18. Estudos sugerem que a IL-17A produzida pelas células induzem a produção de citocinas pró-inflamatórias (tais como IL-1, IL-6 e TNF-α), quimiocinas (CXCL1, CXCL2, CXCL5 e CXCL8) e moléculas de adesão (ICAM-1 e VCAM-1) pelas células epiteliais e endoteliais, levando assim ao recrutamento de células inflamatórias e à interação dessas células com o epitélio
19. Assim, a IL-17 aumenta o processo inflamatório local
20.
Baseado no resultados do presente estudo, é possível especular que a expressão de IL-17A na PNS pode contribuir com o aumento da suscetibilidade para atopia na PNS, fator agravante da afecção.
CONCLUSÃOOs resultados do presente estudo, indicam que a IL-17A pode desempenhar importante papel na patologia da polipose nasossinusal. Após considerarem as propriedades inflamatórias da IL-17A, os autores sugerem que a IL-17A poderia elevar a suscetibilidade a atopia e PNS.
REFERÊNCIAS1. Souza BB, Serra MF, Dorgam JV, Sarreta SM, Melo VR, Anselmo-Lima WT. Polipose nasossinusal: doença inflamatória crônica evolutiva? Rev Bras Otorrinolaringol. 2003;69(3):318-25. DOI:
http://dx.doi.org/10.1590/S0034-29920030003000042. Pawankar R. Nasal polyposis: an update: editorial review. Curr Opin Allergy Clin Immunol. 2003;3(1):1-6. DOI:
http://dx.doi.org/10.1097/00130832-200302000-000013. Bernstein JM, Gorfien J, Noble B. Role of allergy in nasal polyposis: a review. Otolaryngol Head Neck Surg. 1995;113(6):724-32. PMID: 7501384 DOI:
http://dx.doi.org/10.1016/S0194-5998(95)70012-94. Newton JR, Ah-See KW. A review of nasal polyposis. Ther Clin Risk Manag. 2008;4(2):507-12.
5. Jamal A, Marant AGD. Atopy and nasal polyposis. J Laryngol Otol. 1987;101:355-8. DOI:
http://dx.doi.org/10.1017/S0022-21510010177X6. Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2012. Rhinol Suppl. 2012;(23):3 p preceding table of contents, 1-298.
7. Radenne F, Lamblin C, Vandezande LM, Tillie-Leblond I, Darras J, Tonnel AB, et al. Quality of life in nasal polyposis. J Allergy Clin Immunol. 1999;104(1):79-84. PMID: 10400843 DOI:
http://dx.doi.org/10.1016/S0091-6749(99)70117-X8. Ryan MW, Davis LS. T cells in chronic rhinosinusitis with nasal polyposis. Curr Opin Otolaryngol Head Neck Surg. 2010;18(3):200-5. DOI:
http://dx.doi.org/10.1097/MOO.0b013e32833820829. Bernstein JM, Ballow M, Rich G, Allen C, Swanson M, Dmochowski J. Lymphocyte subpopulations and cytokines in nasal polyps: is there a local immune system in the nasal polyp? Otolaryngol Head Neck Surg. 2004;130(5):526-35. DOI:
http://dx.doi.org/10.1016/j.otohns.2003.12.02210. Zhao Y, Yang J, Gao YD, Guo W. Th17 immunity in patients with allergic asthma. Int Arch Allergy Immunol. 2010;151(4):297-307. PMID: 19844129 DOI:
http://dx.doi.org/10.1159/00025043811. Molet SM, Hamid QA, Hamilos DL. IL-11 and IL-17 expression in nasal polyps: relationship to collagen deposition and suppression by intranasal fluticasone propionate. Laryngoscope. 2003;113(10):1803-12. PMID: 14520110 DOI:
http://dx.doi.org/10.1097/00005537-200310000-0002712. Lund VJ, Kennedy DW. Staging for rhinosinusitis. Otolaryngol Head Neck Surg. 1997;117(3 Pt 2):S35-40.
13. Gliklich RE, Metson R. Effect of sinus surgery on quality of life. Otolaryngol Head Neck Surg. 1997;117(1):12-7. PMID: 9230316 DOI:
http://dx.doi.org/10.1016/S0194-5998(97)70199-214. Rinia AB, Kostamo K, Ebbens FA, van Drunen CM, Fokkens WJ. Nasal polyposis: a cellular-based approach to answering questions. Allergy. 2007;62(4):348-58. PMID: 17362244 DOI:
http://dx.doi.org/10.1111/j.1398-9995.2007.01323.x15. Picado C. Nasal Polyposis. Clin Exp Allergy. 2001;1(2):163-5. DOI:
http://dx.doi.org/10.1046/j.1472-9725.2001.00032.x16. Malagutti N, Aimoni C, Balboni A, Stignani M, Melchiorri L, Borin M, et al. Decreased production of human leukocyte antigen G molecules in sinonasal polyposis. Am J Rhinol. 2008;22(5):468-73. DOI:
http://dx.doi.org/10.2500/ajr.2008.22.321017. Wastowski IJ, Sampaio-Barros PD, Amstalden EM, Palomino GM, Marques-Neto JF, Crispim JC, et al. HLA-G expression in the skin of patients with systemic sclerosis. J Rheumatol. 2009;36(6):1230-4 PMID: 19369464
18. Zhao Y, Balato A, Fishelevich R, Chapoval A, Mann DL, Gaspari AA. Th17/Tc17 infiltration and associated cytokine gene expression in elicitation phase of allergic contact dermatitis. Br J Dermatol. 2009;161(6):1301-6. PMID: 19785613 DOI:
http://dx.doi.org/10.1111/j.1365-2133.2009.09400.x19. Albanesi C, Cavani A, Girolomoni G. IL-17 is produced by nickel-specific T lymphocytes and regulates ICAM-1 expression and chemokine production in human keratinocytes: synergistic or antagonist effects with IFN-gamma and TNF-alpha. J Immunol. 1999;162(1):494-502. PMID: 9886425
20. Kebir H, Kreymborg K, Ifergan I, Dodelet-Devillers A, Cayrol R, Bernard M, et al. Human TH17 lymphocytes promote blood-brain barrier disruption and central nervous system inflammation. Nat Med. 2007;13(10):1173-5. DOI:
http://dx.doi.org/10.1038/nm16511. Doutorado (Professora adjunta da Universidade Federal de Goiás)
2. Doutorado (Professora da Universidade Estadual de Goiás)
3. Mestrado (Professor da Pontifícia Universidade Católica de Goiás)
4. Acadêmica de Medicina da Pontifícia Universidade Católica de Goiás
5. Acadêmica da Pontifícia Universidade Católica de Goiás
6. Médico, Doutorado (Professora da Universidade Federal de São Paulo)
Universidade Federal de São Paulo (UNIFESP).
Endereço para correspondência:
Thaís Gomes Abrahão Elias
Rua T-27, qd. 31, lt. 10/11, apto. 603, Condomínio Residencial Glaysson. Setor Bueno
Goiânia - GO. Brasil. CEP: 74210-030.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 3 de março de 2013. cod. 10799.
Artigo aceito em 29 de junho de 2013.


