INTRODUÇÃOO potencial miogênico evocado vestibular (VEMP) é considerado um exame complementar para a avaliação da função vestibular, especificamente do sáculo, nervo vestibular inferior e/ou núcleo vestibular
1-6.
As respostas são captadas na musculatura cervical, por meio de eletrodos de superfície. O traçado obtido por estimulação sonora é constituído por dois complexos de ondas bifásicas: p13 e n23
1,7-11. Em relação ao tipo de estímulo utilizado, pode-se obter o VEMP por meio de estimulação acústica por via aérea, por via óssea e estimulação galvânica
4.
As características das respostas dependem do tipo de estímulo e frequência aplicados. Os estímulos sonoros utilizados podem ser do tipo
tone burst11-15 ou
clicks16,17. Frequências baixas promovem respostas mais homogêneas, sendo mais efetiva a frequência de 500 Hz
6,12,18-20. A resposta é analisada pela seleção dos picos e avaliação das amplitudes e latências
21,22.
Em relação à prática clínica, o VEMP apresenta diversas características favoráveis a sua utilização: é um exame objetivo, não invasivo, de fácil execução, de baixo custo, rápido e não traz desconforto para o paciente
3,14. Porém, ainda não há consenso relacionado à padronização para obtenção desse potencial, sendo grande a heterogeneidade dos protocolos utilizados
23. A taxa de estimulação mais recorrente e mais utilizada é 5 Hz; contudo, taxas maiores, se confiáveis, deixariam o protocolo exame mais rápido.
Com isso, tem-se como objetivo verificar qual a maior taxa de estímulos possível (e confiável) na obtenção do VEMP.
MÉTODOO estudo foi aprovado pelo Comitê de Ética em Pesquisa, mediante o Parecer nº 990/09. Todos os participantes assinaram o Termo de Consentimento Livre e Esclarecido para a participação na pesquisa.
Fizeram parte do estudo 18 indivíduos (36 orelhas), que foram selecionados considerando-se os seguintes critérios de inclusão: idades entre 18 e 35 anos e limiares auditivos iguais ou inferiores a 20 dBNA com diferenças entre as orelhas, por frequência, iguais ou inferiores a 10 dB. O número de participantes foi obtido utilizando-se o cálculo do tamanho da amostra para médias de população infinita, com parâmetro de erro alfa igual a 0,05, desvio-padrão de 9 µV e erro tolerável de 3 µV.
Foram excluídos aqueles que apresentavam exposição a ruído ocupacional ou de lazer, cirurgias na orelha média e/ou interna, mais de três infecções de orelha externa e/ou média no ano corrente, uso de medicação ototóxica, presença de alterações sistêmicas que poderiam contribuir para afecções cócleo-vestibulares, como diabetes, hipertensão arterial, alterações hormonais e presença de zumbido, vertigens, tonturas ou outras alterações cócleo-vestibulares.
Inicialmente, foi aplicado um questionário para a triagem dos participantes. Logo após, foram realizados os seguintes procedimentos: otoscopia, audiometria tonal liminar e VEMP.
Para o registro dos potenciais, foram utilizados eletrodos de superfície colocados sobre a pele, após limpeza prévia da mesma, sendo o eletrodo positivo localizado no terço médio do músculo esternocleidomastóideo (ECM) ipsilateral à estimulação, enquanto o eletrodo negativo foi posicionado na altura do tendão do músculo, logo acima da clavícula, e o eletrodo terra, na linha média frontal. Para obtenção do registro no músculo ECM, o paciente permaneceu sentado, com rotação lateral máxima de cabeça para o lado contralateral ao estímulo.
No exame de VEMP, foram promediados 200 estímulos
tone burst na frequência de 500 Hz, variando a taxa de estimulação em 5,1, 10,2, 20,4 e 40,8 estímulos/s na intensidade de 95 dBNAn, apresentados por meio de fones de inserção ER-A3. Utilizando-se um filtro passa banda configurado entre 5 e 1000 Hz, com exibição de 10 a 25 µV por divisão. As taxas de estimulação não foram números inteiros para que os potenciais não fossem adquiridos em fase com a frequência da rede elétrica, que no Brasil é 60 Hz
24,25. Os registros foram realizados em janelas de 40 ms por apresentar tempo suficiente para englobar todas as respostas
14,15.
Para realizar a interpretação dos achados, as respostas foram analisadas por meio da morfologia, demarcando-se as ondas p13 e n23 pelas latências dos primeiros picos positivo e negativo por dois autores/avaliadores. As discrepâncias apresentadas pelos autores/avaliadores foram esclarecidas por um terceiro autor/avaliador.
Método estatísticoOs dados foram tabulados e processados pelo aplicativo para microcomputador
Predictive Analytics SoftWare (PASW
®Statistics) versão 17.0. Para a descrição dos dados, fez-se uso da apresentação tabular e gráfica das médias, dos desvios-padrão e dos percentis.
A normalidade das amostras, quanto às latências e amplitudes das ondas p13 e n23, foi observada utilizando-se o teste de Kolmogorov-Smirnov. Para a comparação entre as taxas de estimulação (5,1, 10,2, 20,4 e 40,8 estímulos/s), no que se refere às latências e amplitudes das ondas do VEMP, foram utilizados os testes ANOVA, com comparação entre os pares por meio do teste de Tukey, e Kruskal Wallis, a depender das amostras apresentarem curva normal ou não normal, respectivamente. Para aprofundar a análise das amplitudes, foi utilizado o teste de Mann-Whitney com a finalidade de comparar as taxas de estimulação e verificar se ocorre ou não diferença estatisticamente significativa entre as mesmas. Os valores foram considerados significativos para
p < 0,05 e o valor do erro beta admitido foi de 0,1.
RESULTADOSA amostra estudada foi composta por 18 indivíduos (36 orelhas), sendo 12 do gênero feminino (24 orelhas) e seis do gênero masculino (12 orelhas). Verificou-se faixa etária entre 21 e 27 anos, média de idade de 23,03 anos e desvio-padrão de 1,33 anos.
O VEMP foi registrado, por meio da estimulação e captação unilateral, com morfologia adequada, em 100% das orelhas utilizando a taxa de estimulação de 5,1 estímulos/s; em 96,87% com 10,2 estímulos/s; em 86,11% com 20,4 estímulos/s e em 72,22% com 40,8 estímulos/s, com estímulo
tone burst na frequência de 500 Hz.
A normalidade das amostras, quanto às latências e amplitudes, foi observada utilizando-se o teste de Kolmogorov-Smirnov; entretanto, não foi constatada distribuição normal para a latência de p13 quando utilizadas as taxas de estimulação de 10,2 e 40,8 estímulos/s. Por esse motivo, testes não paramétricos tiveram que ser utilizados.
No traçado do exame, foi realizada marcação das ondas, determinando-se as latências e amplitudes absolutas de p13 e n23. A Tabela 1 apresenta dados referentes a esses parâmetros por taxa de estimulação, independente das orelhas.
Como pode ser observado na Tabela 1, no que concerne aos parâmetros de p13e n23, as latências se mantiveram constantes e as amplitudes foram progressivamente reduzidas com o aumento da taxa de estimulação. Contudo, não houve diferença estatisticamente significativa entre os parâmetros simultaneamente, quando aplicados os testes ANOVA e Kruskal-Wallis.
A análise das amplitudes foi aprofundada, comparando-se as taxas de estimulação entre si. O teste de Mann-Whitney revelou, para a onda p13, diferenças estatisticamente significativas entre 5,1 e 20,4 estímulos/s (
p = 0,03) e entre 5,1 e 40,8 estímulos/s (
p = 0,01). Para a onda n23, a amplitude foi estatisticamente diferente apenas entre 5,1 e 40,8 estímulos/s (
p = 0,02), não apresentando significância para 5,1 e 20,4 estímulos/s (
p = 0,06).
No Gráfico 1, pode ser observada a comparação entre as amplitudes de acordo com a taxa de estimulação utilizada.
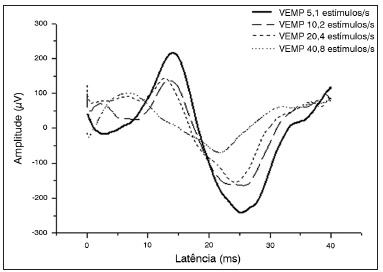
Gráfico 1. Comparação entre as amplitudes de acordo com a taxa de estimulação utilizada.
As respostas obtidas nessa amostra demonstraram que é possível registrar de forma consistente as ondas p13 e n23, no domínio do tempo, em todas as taxas de estimulação utilizadas e apresentaram resultados similares a outros estudos
15,26.
Comparando os parâmetros do VEMP com a literatura, observaram-se resultados similares quanto aos valores de latência e amplitude para a taxa de 5,1 estímulos/s
6,27. Com relação às demais taxas de estimulação, estudos referem que a latência e a amplitude tendem a diminuir com o aumento da taxa de estimulação, não concordando com o presente estudo em termos de latência
15,26.
A literatura justifica o decréscimo da amplitude com o aumento da taxa de estimulação através de uma possível fadiga no músculo ECM durante o período de teste, pois o exame necessita que o indivíduo apresente uma contração eficiente para obtenção de um bom registro do potencial. Assim, quanto maior o tempo de exposição ao teste, menor será a amplitude
27. Outros relatam que diminuição da amplitude seja consequência da habituação do reflexo, pois a alta taxa de disparo provoca uma exaustão nas células sensoriais, necessitando de maior tempo para ativar o primeiro neurônio
28-30. Entretanto, para evitar cansaço do indivíduo sob teste e, consequentemente, fadiga do músculo ECM, a presente pesquisa solicitou que o paciente descansasse durante 1 minuto entre cada captação do exame - ou seja, para cada taxa de estimulação, com a finalidade de evitar fadiga da musculatura e habituação do reflexo.
Quando comparadas as taxas de estimulação de 5,1 estímulos/s com a de 10,2 estímulos/s, pode-se constatar ausência de diferença estatisticamente significativas para o parâmetro latência, concordando com alguns estudos
15,26. No entanto, a maioria dos profissionais escolhe a taxa de 5 estímulos/s para a realização do exame, pois possibilita a captação de respostas mais consistentes e facilita a identificação do traçado
26.
Por fim, existem indícios que a taxa de repetição de 10,2 estímulos/s para uso clínico seja mais adequada, por produzir uma morfologia adequada, com mesma identificação do traçado e uma amplitude sem diferença estatisticamente significativa, quando comparada à taxa de 5 estímulos/s, e que ainda pode ser observada a olho nu. Além disso, um exame realizado com uma taxa de 10,2 estímulos/s reduz o desconforto da captação, pois diminui o tempo de teste
15. Contudo, ainda será necessário um estudo com uma amostra maior para a confirmação do ajuste sugerido para o protocolo do exame.
CONCLUSÃOConclui-se que a maior taxa de estimulação confiável é a de 10,2 estímulos/s, para a amostra do presente estudo.
REFERÊNCIAS1. Damen MMJ. Vestibular evoked myogenic potential (VEMP). Clinical application of the threshold. Medical Engineering. Eindhoven: Technische Universiteit Eindhoven; 2007.
2. Pollak L, Kushnir M, Stryjer R. Diagnostic value of vestibular evoked myogenic potentials in cerebellar and lower-brainstem strokes. Neurophysiol Clin. 2006;36(4):227-33. DOI:
http://dx.doi.org/10.1016/j.neucli.2006.08.014 3. Rauch SD. Vestibular evoked myogenic potentials. Curr Opin Otolaryngol Head Neck Surg. 2006;14(5):299-304. DOI:
http://dx.doi.org/10.1097/01.moo.0000244185.65022.01 4. Sazgar AA, Dortaj V, Akrami K, Akrami S, Karimi Yazdi AR. Saccular damage in patients with high-frequency sensorineural hearing loss. Eur Arch Otorhinolaryngol. 2006;263(7):608-13. PMID: 16625399 DOI:
http://dx.doi.org/10.1007/s00405-006-0038-6 5. Lütkenhöner B, Stoll W, Basel T Modeling the vestibular evoked myogenic potential. J Theor Biol. 2010;263(1):70-8. PMID: 19896953 DOI:
http://dx.doi.org/10.1016/j.jtbi.2009.10.036 6. Akin FW, Murnane OD, Panus PC, Caruthers SK, Wilkinson AE, Proffitt TM. The influence of voluntary tonic EMG level on the vestibular-evoked myogenic potential. J Rehabil Res Dev. 2004;41(3B):473-80. PMID: 15543465
7. Halmagyi GM, Colebatch JG, Curthoys IS. New tests of vestibular function. Baillieres Clin Neurol. 1994;3(3):485-500.
8. Hong SM, Park DC, Yeo SG, Cha CI. Vestibular evoked myogenic potentials in patients with benign paroxysmal positional vertigo involving each semicircular canal. Am J Otolaryngol. 2008;29(3):184-7. DOI:
http://dx.doi.org/10.1016/j.amjoto.2007.07.004 9. Pérez Guillén V, González García E, García Piñero A, Piqueras Del Rey A, Morera Pérez C, Pérez Garrigues H. Vestibular evoked myogenic potential: a contribution to the vestibular physiology and pathology knowledge. Quantitative patterns in healthy subjects. Acta Otorrinolaringol Esp. 2005;56(8):349-53. PMID: 16285433
10. Shimizu K, Murofushi T, Sakurai M, Halmagyi M. Vestibular evoked myogenic potentials in multiple sclerosis. J Neurol Neurosurg Psychiatry. 2000;69(2):276-7. PMID: 10960289 DOI:
http://dx.doi.org/10.1136/jnnp.69.2.276 11. Colebatch JG, Halmagyi GM. Vestibular evoked potentials in human neck muscles before and after unilateral vestibular deafferentation. Neurology. 1992;42(8):1635-6. DOI:
http://dx.doi.org/10.1212/WNL.42.8.1635 12. Burkard RF, Eggermont JJ, Don M, eds. Auditory evoked potentials: Basic principles and Clinical Application. Philadelphia: Lippincott Williams & Wilkins; 2007.
13. Timmer FC, Zhou G, Guinan JJ, Kujawa SG, Herrmann BS, Rauch SD. Vestibular evoked myogenic potential (VEMP) in patients with Ménière's disease with drop attacks. Laryngoscope. 2006;116(5):776-9. PMID: 16652086 DOI:
http://dx.doi.org/10.1097/01.mlg.0000205129.78600.27 14. Basta D, Todt I, Ernst A. Normative data for P1/N1-latencies of vestibular evoked myogenic potentials induced by air- or bone-conducted tone bursts. Clin Neurophysiol. 2005;116(9):2216-9. PMID: 16043396 DOI:
http://dx.doi.org/10.1016/j.clinph.2005.06.010 15. Sheykholeslami K, Habiby Kermany M, Kaga K. Frequency sensitivity range of the saccule to bone-conducted stimuli measured by vestibular evoked myogenic potentials. Hear Res. 2001;160(1-2):58-62. PMID: 11591491
16. Kelsch TA, Schaefer LA, Esquivel CR. Vestibular evoked myogenic potentials in young children: test parameters and normative data. Laryngoscope. 2006;116(6):895-900. PMID: 16735887 DOI:
http://dx.doi.org/10.1097/01.mlg.0000214664.97049.3e 17. Huang TW, Su HC, Cheng PW. Effect of click duration on vestibular-evoked myogenic potentials. Acta Otolaryngol. 2005;125(2):141-4. PMID: 15880943 DOI:
http://dx.doi.org/10.1080/00016480410016900 18. Cheng PW, Murofushi T. The effects of plateau time on vestibular-evoked myogenic potentials triggered by tone bursts. Acta Otolaryngol. 2001;121(8):935-8. PMID: 11813898 DOI:
http://dx.doi.org/10.1080/00016480127377 19. Cheng PW, Murofushi T. The effect of rise/fall time on vestibular-evoked myogenic potential triggered by short tone bursts. Acta Otolaryngol. 2001;121(6):696-9. PMID: 11678168 DOI:
http://dx.doi.org/10.1080/00016480152583638 20. Murofushi T, Matsuzaki M, Wu CH. Short tone burst-evoked myogenic potentials on the sternocleidomastoid muscle: are these potentials also of vestibular origin? Arch Otolaryngol Head Neck Surg. 1999;125(6):660-4. PMID: 10367923 DOI:
http://dx.doi.org/10.1001/archotol.125.6.660 21. Stapells DR. Current status of the auditory steady-state responser for estimating an infant`s audiogram. In: Seewald RC, Bamford J. A sound foundation through early amplification. Chicago: Ponak; 2005. p.43-59.
22. Picton TW, John MS, Dimitrijevic A, Purcell D. Human auditory steady-state responses. Int J Audiol. 2003;42(4):177-219. PMID: 12790346 DOI:
http://dx.doi.org/10.3109/14992020309101316 23. Felipe L, Kigman H, Gonçalves DH. Potencial evocado miogênico vestibular. Arq Int Otorrinolaringol. 2012;16(1):103-7. DOI:
http://dx.doi.org/10.7162/S1809-48722012000100015 24. Lins OG. Audiometria fisiológica tonal utilizando respostas de estado estável auditivas do tronco cerebral [Tese de Doutorado]. São Paulo: Universidade Federal de São Paulo, Escola Paulista de Medicina; 2002.
25. Pauli-Magnus D, Hoch G, Strenzke N, Anderson S, Jentsch TJ, Moser T. Detection and differentiation of sensorineural hearing loss in mice using auditory steady-state responses and transient auditory brainstem responses. Neuroscience. 2007;149(3):673-84. PMID: 17869440 DOI:
http://dx.doi.org/10.1016/j.neuroscience.2007.08.010 26. Wu CH, Murofushi T. The effect of click repetition rate on vestibular evoked myogenic potential. Acta Otolaryngol. 1999;119(1):29-32. DOI:
http://dx.doi.org/10.1080/00016489950181891 27. Oliveira AC. Estudo dos potenciais evocados miogênicos vestibulares de estado estável [Tese de doutorado]. Ribeirão Preto: Universidade de São Paulo: Faculdade de Medicina de Ribeirão Preto; 2010.
28. Murofushi T, Curthoys IS. Physiological and anatomical study of click-sensitive primary vestibular afferents in the guinea pig. Acta Otolaryngol. 1997;117(1):66-72. PMID: 9039484 DOI:
http://dx.doi.org/10.3109/00016489709117994 29. Murofushi T, Curthoys IS, Topple AN, Colebatch JG, Halmagyi GM. Responses of guinea pig primary vestibular neurons to clicks. Exp Brain Res. 1995;103(1):174-8. PMID: 7615033 DOI:
http://dx.doi.org/10.1007/BF00241975 30. Murofushi T, Curthoys IS, Gilchrist DP. Response of guinea pig vestibular nucleus neurons to clicks. Exp Brain Res. 1996;111(1):149-52. PMID: 8891646 DOI:
http://dx.doi.org/10.1007/BF00229565 1. Fonoaudióloga. Mestranda em Saúde da Comunicação Humana pela Universidade Federal de Pernambuco - UFPE
2. Doutor em Medicina (Neurologia) pela UNIFESP Professor Adjunto da Universidade Federal de Pernambuco - UFPE
3. Doutoranda em Neuropsiquiatria e Ciência do Comportamento. Professora Assistente da Universidade Estadual de Ciências da Saúde de Alagoas - UNCISAL
4. Doutor em Física aplicada à Medicina pela USP Professor Titular da Universidade Estadual de Ciências da Saúde de Alagoas - UNCISAL
Universidade Federal de Pernambuco - UFPE.
Endereço para correspondência:
Aline Tenório Lins Carnaúba
Av. Prof. Moraes Rego, nº 1235. Cidade Universitária
Recife - PE. Brasil. CEP: 50670-901
E-mail:
alinel_tenorio@hotmail.comEste artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 31 de agosto de 2012. cod. 10431.
Artigo aceito em 29 de maio de 2013.


