INTRODUÇÃOA laringomalácia é a anomalia congênita da laringe mais frequente, sendo responsável por cerca de 60% a 75% dos casos de estridor congênito
1-3. Embora sua etiopatogenia não esteja completamente elucidada, existe um colapso dos tecidos supraglóticos durante a inspiração
4,5, gerando um estridor inspiratório de alta frequência, exacerbado na posição supina, durante a alimentação, agitação e choro
6-8. Geralmente, este estridor surge nas duas primeiras semanas de vida, apresentando pico de incidência em torno de 6 meses, com resolução espontânea em cerca de 90% dos casos até o segundo ano de vida
9,10. Apesar da laringomalácia apresentar um curso benigno e autolimitado, 10% dos casos necessitam de intervenção, a fim de aliviar a obstrução respiratória
10,11.
No passado, a traqueostomia foi considerada a opção mais segura de manutenção da via aérea; no entanto, tornou-se um método obsoleto, em especial, nos últimos 20 anos, com o surgimento das técnicas endoscópicas minimamente invasivas. Apesar de alguns autores advogarem a hiomandibulopexia como forma de tratamento para a laringomalácia grave, a maioria das operações realizadas atualmente compreendem procedimentos endoscópicos na região supraglótica, as chamadas supraglotoplastias
11-13.
Essas técnicas podem ser subdivididas de acordo com a região anatômica abordada. Denominamos ariepiglotoplastia quando a mucosa da prega ariepiglótica é incisada; da mesma maneira, denominamos aritenoidoplastia e epiglotoplastia, respectivamente, quando as mucosas supra-aritenoídeas e epiglótica são ressecadas. Outras variantes descritas são a epiglotopexia, que corresponde à fixação da face lingual da epiglote à base da língua, e a epiglotectomia, que corresponde à ressecção da cartilagem epiglote
14.
A definição dos casos de laringomalácia grave se baseia nos seguintes critérios clínicos: apneia, cianose, insuficiência ventilatória,
cor pulmonale, dificuldade de alimentação, baixo desenvolvimento pôndero-estatural e refluxo gastroesofágico incontrolável são indicadores de gravidade, sendo critérios de intervenção cirúrgica
10,13,15,16.
O objetivo deste estudo é descrever a experiência adquirida pelos autores no tratamento cirúrgico dos pacientes com laringomalácia grave avaliados na UTI pediátrica de hospital terciário.
MÉTODOEstudo de coorte histórica longitudinal, com revisão de prontuários e registro cirúrgico em vídeo de 11 pacientes com laringomalácia grave, submetidos à supraglotoplastia entre janeiro de 2003 a abril de 2012.
Os prontuários e a documentação em vídeo dos procedimentos foram obtidos no serviço de arquivo médico hospitalar. Foram avaliados dados referentes à idade, gênero, sintomas, doenças associadas, técnica cirúrgica adotada, tempo de extubação, complicações cirúrgicas, tempo de internação e evolução clínica. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa, sob o número 151.689.
RESULTADOSOs 11 casos avaliados foram de laringomalácia grave, sendo nove (81,8%) pacientes do sexo masculino e dois (18,2%) do sexo feminino. Todas as crianças do estudo apresentavam estridor e desconforto respiratório, motivo principal da internação hospitalar, sendo avaliadas inicialmente em unidade de terapia intensiva.
O momento de intervenção cirúrgica variou de 1 a 12 meses de idade. Todos os pacientes foram submetidos à microlaringoscopia de suspensão, sendo realizada a supraglotoplastia, sob anestesia geral e intubação orotraqueal (Figuras 1 e 2 do caso número 3).

Figura 1. Aspecto intraoperatório de uma criança de 3 meses com laringomalácia, detalhe do encurtamento da prega ariepiglótica.
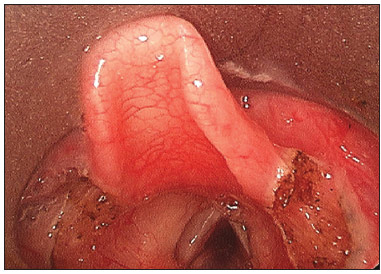
Figura 2. Aspecto após ariepiglotoplastia com laser de CO
2.
No pós-operatório, todos os pacientes foram monitorados em unidade de terapia intensiva. Cinco pacientes foram extubados após um período de 48 horas, quatro no pós-operatório imediato e dois casos apresentaram extubação após 3 e 9 dias, respectivamente.
Em apenas um dos pacientes (9,1%) submetido à ariepiglotoplastia a frio e extubado no pós-operatório imediato, houve recorrência da obstrução respiratória, sendo necessária nova abordagem cirúrgica, empregando-se desta vez o laser de CO
2.
Não foram observados casos de complicações cirúrgicas. Todos os pacientes apresentaram melhora significativa do estridor e desconforto respiratório. Os dados como: idade, sexo, sinais/sintomas, afecções associadas, tratamento cirúrgico, tempo de extubação, tempo de internação e evolução clínica estão descritos na Tabela 1.
DISCUSSÃOEm concordância com a literatura médica, houve predominância dos casos de laringomalácia em pacientes do sexo masculino
2,17. O estridor inspiratório foi considerado o sintoma mais importante da doença, sendo observado em todos os pacientes
1,6.
Na classificação pré-operatória da laringomalácia, nos baseamos no quadro clínico, ou seja, na gravidade da doença e não na classificação anatômica apresentada por Holinger & Konior
18. A maioria dos autores indica o procedimento nos casos de laringomalácia grave
1,2. Da mesma maneira, indicamos o procedimento cirúrgico após um conjunto de fatores, incluindo a dificuldade de desenvolvimento, de alimentação, presença de refluxo gastroesofágico importante e, sobretudo, pelas manifestações decorrentes da obstrução ventilatória.
Embora os resultados apontados na literatura sejam estatisticamente semelhantes com relação ao uso do laser de CO
2 e a técnica a frio
19, em nossa experiência o laser de CO
2 oferece menor risco de sangramento intraoperatório e edema pós-operatório nos casos de maior ressecção na área mucosa, como ocorre nas epiglotoplastias e aritenoidoplastias. Em todos os nossos pacientes, o resultado clínico foi favorável, independentemente da técnica e instrumental adotado. Destacamos ainda que não possuímos experiência no tratamento cirúrgico da laringomalácia por meio do laser de potássio-titânio-fosfato (KTP)
20 ou microdebridador
19, tecnologias sugeridas por alguns autores.
O primeiro estudo a analisar sistematicamente a supraglotoplastia unilateral foi publicado em 1995 por Kelly & Gray
21. Os autores obtiveram uma taxa de sucesso cirúrgico em 94% dos casos sem complicações maiores em um estudo envolvendo 18 pacientes. Apenas três pacientes necessitaram de abordagem da prega ariepiglótica bilateral. Loke et al.
19 realizaram a técnica bilateralmente em 33 pacientes, com a resolução completa do estridor em 22 casos (68,7%), parcial em sete pacientes (21,8%), reabordagem cirúrgica em dois pacientes e um paciente portador de múltiplas malformações foi submetido à traqueostomia. Considerando a taxa de 19% a 45% de revisão cirúrgica descrita na literatura
4, com um percentual ainda mais elevado nos casos de supraglotoplastia unilateral
8, adotamos a ariepiglotoplastia bilateral como procedimento de escolha em nossa instituição. Desta maneira, a epiglotoplastia e aritenoidoplastia ficam reservadas como método complementar à ariepiglotoplastia, quando essa de maneira isolada não é suficiente para a melhora da obstrução supraglótica.
As complicações das supraglotoplastias incluem sangramento, infecção, edema, aspiração, disfagia, estenose supraglótica, formação de sinéquia, insuficiência respiratória e óbito
2,4,14,22. Denoyelle et al.
5 reportaram um índice de complicação de 7,4% em 136 pacientes submetidos à supraglotoplastia bilateral, sendo que cinco pacientes desenvolveram estenose supraglótica. Embora esse risco tenha sido aventado, trabalhos atuais apontam, como principal fator de risco para a ocorrência de complicações, a ressecção excessiva de tecidos laríngeos e não a bilateralidade da ariepiglotoplastia
23. Nenhuma complicação maior foi descrita em nosso estudo.
Schroeder et al.
24 alertam que o risco de aspiração líquida durante a fase faríngea da deglutição é mais comum em pacientes submetidos à supraglotoplastia com laser de CO
2, sendo o principal fator de risco a presença de aspiração pré-operatória. Em nosso estudo, apenas um paciente submetido à ariepiglotoplastia com epiglotoplastia apresentou quadro transitório de aspiração, com melhora após medida conservadora.
Em revisão de 84 casos, O'Donnell et al.
25 concluíram que a maioria dos pacientes submetidos à ariepiglotoplastia para tratamento de laringomalácia encontram-se aptos para retornar ao domicílio após pernoite hospitalar. Não adotamos esta recomendação, acreditando ser prudente o seguimento dos pacientes em unidade de terapia intensiva por um período mínimo de 24 horas, mesmo em casos de extubação logo ao término da cirurgia. Isso possibilita maior suporte em eventuais casos de obstrução da via respiratória e menor ansiedade por parte dos familiares.
Toynton et al.
11 reportaram uma incidência de 47% e Friedman et al.
26 incidência de 65% de lesões sincrônicas de via aérea, especialmente em pacientes com laringomalácia grave submetidos à supraglotoplastia, sendo esta uma das possíveis causas de falência ao tratamento. Apesar desse índice ser bastante considerável, não generalizamos o uso da broncoscopia como forma diagnóstica, sendo um exame de exceção. Nosso diagnóstico está fundamentado nos achados clínicos e nasofibrolaringoscópicos. Não foram observados casos de lesões sincrônicas em nossos pacientes.
Finalmente, o diagnóstico da laringomalácia não é comumente observado na população geral, ficando restrito, na maioria das vezes, ao nível terciário de atendimento
11, com resolução espontânea na maioria dos casos
27-30. A taxa de sucesso da supraglotoplastia descrita na literatura varia de 38% a 100%
4. Em nossa casuística, a melhora clínica significativa de todos pacientes submetidos ao tratamento cirúrgico garantiu uma taxa de sucesso em 100% dos casos.
CONCLUSÃOA supraglotoplastia mostrou-se um procedimento eficaz no tratamento da obstrução respiratória, aumentando o lúmen da laringe. Devido a sua alta resolubilidade e baixa taxa de complicação, mostra-se um procedimento seguro no tratamento das crianças portadoras de laringomalácia grave, garantindo a melhora clínica dos pacientes.
REFERÊNCIAS1. Valera FC, Tamashiro E, de Araújo MM, Sander HH, Küpper DS. Evaluation of the efficacy of supraglottoplasty in obstructive sleep apnea syndrome associated with severe laryngomalacia. Arch Otolaryngol Head Neck Surg. 2006;132(5):489-93. PMID: 16702563 DOI:
http://dx.doi.org/10.1001/archotol.132.5.489 2. Lee KS, Chen BN, Yang CC, Chen YC. CO2 laser supraglottoplasty for severe laryngomalacia: a study of symptomatic improvement. Int J Pediatr Otorhinolaryngol. 2007;71(6):889-95. PMID: 17416423 DOI:
http://dx.doi.org/10.1016/j.ijporl.2007.02.010 3. Bluestone CD, Healy GB, Cotton RT. Diagnosis of laryngomalacia is not enough! Arch Otolaryngol Head Neck Surg. 1996;122(12):1417-8.
4. Day KE, Discolo CM, Meier JD, Wolf BJ, Halstead LA, White DR. Risk Factors for Supraglottoplasty Failure. Otolaryngol Head Neck Surg. 2011; [Epub ahead of print].
5. Denoyelle F, Mondain M, Gresillon N, Roger G, Chaudre F, Garabedian EN. Failures and complications of supraglottoplasty in children. Arch Otolaryngol Head Neck Surg. 2003;129(10):1077-80. DOI:
http://dx.doi.org/10.1001/archotol.129.10.1077 6. Werner JA, Lippert BM, Dünne AA, Ankermann T, Folz BJ, Seyberth H. Epiglottopexy for the treatment of severe laryngomalacia. Eur Arch Otorhinolaryngol. 2002;259(9):459-64. PMID: 12386747
7. Richter GT, Thompson DM. The surgical management of laryngomalacia. Otolaryngol Clin North Am. 2008;41(5):837-64. DOI:
http://dx.doi.org/10.1016/j.otc.2008.04.011 8. Gandhi S, Oswal V, Thekedar P, Mishra P. Role of transoral CO(2) laser surgery for severe pediatric laryngomalacia. Eur Arch Otorhinolaryngol. 2011;268(10):1479-83. PMID: 21604072 DOI:
http://dx.doi.org/10.1007/s00405-011-1631-x 9. Senders CW, Navarrete EG. Laser supraglottoplasty for laryngomalacia: are specific anatomical defects more influential than associated anomalies on outcome? Int J Pediatr Otorhinolaryngol. 2001;57(3):235-44. PMID: 11223456 DOI:
http://dx.doi.org/10.1016/S0165-5876(00)00461-4 10. Zafereo ME, Taylor RJ, Pereira KD. Supraglottoplasty for laryngomalacia with obstructive sleep apnea. Laryngoscope. 2008;118(10):1873-7. PMID: 18641529 DOI:
http://dx.doi.org/10.1097/MLG.0b013e31817e7441 11. Toynton SC, Saunders MW, Bailey CM. Aryepiglottoplasty for laryngomalacia: 100 consecutive cases. J Laryngol Otol. 2001;115(1):35-8. DOI:
http://dx.doi.org/10.1258/0022215011906966 12. Dafico SR, Costa HO. Surgical treatment of laryngomalacia. ACTA ORL/Técnicas em Otorrinolaringologia. 2008;26(2):75-9.
13. Fraga JC, Schopf L, Volker V, Canani S. Endoscopic supraglottoplasty in children with severe laryngomalacia with and without neurological impairment. J Pediatr (Rio J). 2001;77(5):420-4. DOI:
http://dx.doi.org/10.2223/JPED.285 14. Bourolias C, Hajiioannou J, Sobol E, Velegrakis G, Helidonis E. Epiglottis reshaping using CO2 laser: a minimally invasive technique and its potent applications. Head Face Med. 2008;4:15. DOI:
http://dx.doi.org/10.1186/1746-160X-4-15 15. Schroeder JW Jr, Bhandarkar ND, Holinger LD. S Synchronous airway lesions and outcomes in infants with severe laryngomalacia requiring supraglottoplasty. Arch Otolaryngol Head Neck Surg. 2009;135(7):647-51. DOI:
http://dx.doi.org/10.1001/archoto.2009.73 16. Chan DK, Truong MT, Koltai PJ. Supraglottoplasty for occult laryngomalacia to improve obstructive sleep apnea syndrome. Arch Otolaryngol Head Neck Surg. 2012;138(1):50-4. DOI:
http://dx.doi.org/10.1001/archoto.2011.233 17. Avelino MA, Liriano RY, Fujita R, Pignatari S, Weckx LL. Treatment laryngomalacia: experience with 22 cases. Braz J Otorhinolaryngol. 2005;71(3):330-4. PMID: 16446937
18. Holinger LD, Konior RJ. Surgical management of severe laryngomalacia. Laryngocope. 1989;99(2):136-42.
19. Loke D, Ghosh S, Panarese A, Bull PD. Endoscopic division of the ary-epiglottic folds in severe laryngomalacia. Int J Pediatr Otorhinolaryngol. 2001;60(1):59-63. PMID: 11434955 DOI:
http://dx.doi.org/10.1016/S0165-5876(01)00515-8 20. Soong WJ, Shiao AS, Jeng MJ, Lee YS, Tsao PC, Yang CF, et al. Comparison between rigid and flexible laser supraglottoplasty in the treatment of severe laryngomalacia in infants. Int J Pediatr Otorhinolaryngol. 2011;75(6):824-9. PMID: 21513991 DOI:
http://dx.doi.org/10.1016/j.ijporl.2011.03.016 21. Reddy DK, Matt BH. Unilateral vs. bilateral supraglottoplasty for severe laryngomalacia in children. Arch Otolaryngol Head Neck Surg. 2001;127(6):694-9. PMID: 11405871 DOI:
http://dx.doi.org/10.1001/archotol.127.6.694 22. Fattah HA, Gaafar AH, Mandour ZM. Laryngomalacia: Diagnosis and management. Egypt J Ear Nose Throat Allied Sci. 2011;12(3):149-53. DOI:
http://dx.doi.org/10.1016/j.ejenta.2011.12.001 23. Thompson DM. Abnormal sensorimotor integrative function of the larynx in congenital laryngomalacia: a new theory of etiology. Laryngoscope. 2007;117(6 Pt Suppl 114):1-33.
24. Schroeder JW Jr, Thakkar KH, Poznanovic SA, Holinger LD. Aspiration following CO(2) laser-assisted supraglottoplasty. Int J Pediatr Otorhinolaryngol. 2008;72(7):985-90. DOI:
http://dx.doi.org/10.1016/j.ijporl.2008.03.007 25. O'Donnell S, Murphy J, Bew S, Knight LC. Aryepiglottoplasty for laryngomalacia: results and recommendations following a case series of 84. Int J Pediatr Otorhinolaryngol. 2007;71(8):1271-5. PMID: 17597233 DOI:
http://dx.doi.org/10.1016/j.ijporl.2007.05.00126. Sakakura K, Chikamatsu K, Toyoda M, Kaai M, Yasuoka Y, Furuya N. Congenital laryngeal anomalies presenting as chronic stridor: a retrospective study of 55 patients. Auris Nasus Larynx. 2008;35(4):527-33. PMID: 18262373 DOI:
http://dx.doi.org/10.1016/j.anl.2007.12.001 27. Martin JE, Howarth KE, Khodaei I, Karkanevatos A, Clarke RW. Aryepiglottoplasty for laryngomalacia: the Alder Hey experience. J Laryngol Otol. 2005;119(12):958-60. PMID: 16354358 DOI:
http://dx.doi.org/10.1258/002221505775010904 28. Ahmad SM, Soliman AM. Congenital anomalies of the larynx. Otolaryngol Clin North Am. 2007;40(1):177-91. DOI:
http://dx.doi.org/10.1016/j.otc.2006.10.004 29. Siou GS, Jeannon JP, Stafford FW. Acquired idiopathic laryngomalacia treated by laser aryepiglottoplasty. J Laryngol Otol. 2002;116(9):733-5. PMID: 12437813 DOI:
http://dx.doi.org/10.1258/002221502760238073 30. Manning SC, Inglis AF, Mouzakes J, Carron J, Perkins JA. Laryngeal anatomic differences in pediatric patients with severe laryngomalacia. Arch Otolaryngol Head Neck Surg. 2005;131(4):340-3. PMID: 15837904 DOI:
http://dx.doi.org/10.1001/archotol.131.4.340 1. Otorrinolaringologista (Diretor/Chefe)
2. Residente do Núcleo de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço de São Paulo
Núcleo de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço de São Paulo
Endereço para correspondência:
José Antonio Pinto
Al. dos Nhambiquaras, nº 159. Moema
São Paulo - SP. Brasil. CEP: 04090-010
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 20 de fevereiro de 2013. cod. 10784.
Artigo aceito em 14 de junho de 2013.


