INTRODUÇÃOA esclerose múltipla (EM) é uma afecção de provável origem autoimune, caracterizada por inflamação do sistema nervoso central, desmielinização e formação de gliose. A associação de fatores genéticos, imunológicos e infecciosos parece explicar o seu aparecimento. Afeta com mais frequência indivíduos jovens, especialmente mulheres da raça branca entre 20 e 40 anos de idade, sendo rara em asiáticos e negros e incomum além destes limites etários
1.
A distribuição desta doença no globo não é uniforme. Inglaterra, Nova Zelândia, norte dos Estados Unidos, sul do Canadá e da Austrália apresentam prevalência elevada, com mais de 30 doentes para cada 100.000 habitantes. O Brasil e os outros países da América do Sul possuem baixa prevalência, contudo, a mistura de raças com influência europeia gerou um aumento da prevalência nos estados de São Paulo e Minas Gerais, com índices ao redor de 18 pacientes para cada 100.000 habitantes
1.
Clinicamente, a EM caracteriza-se pela combinação variável de sintomas como fraqueza dos membros, alterações da marcha, distúrbios de sensibilidade, ataxia e alterações visuais. As crises de desmielinização mostram início insidioso ou abrupto e com gravidade variável, podendo apresentar desde sinais neurológicos muito tênues até alterações evidentes e limitantes. Os déficits podem sofrer remissão total ou apresentar sequelas e, com o decorrer do tempo, todos os pacientes tendem a mostrar restrições neurológicas progressivas. O tratamento para controle da doença é feito primordialmente com corticosteroides (usado principalmente nas crises) e com imunomoduladores
1,2.
Os distúrbios relacionados à deglutição, embora pouco investigados, podem fazer parte do quadro clínico. Estudos que investigam estas alterações mostram frequência variável de aparecimento, com pontuações situadas entre 10% e 100%, e que contribuem para a morbidade e mortalidade da doença
3-11.
A preocupação em se identificar os pacientes com esta alteração funcional e prevenir suas possíveis complicações estimulou pesquisas para detectar indicadores neurológicos que representassem o desempenho da deglutição. A associação entre a presença de disfagia e as escalas de classificação da EM (Formas Clínicas Evolutivas da Doença, Escala Ampliada de Incapacidade Funcional - EDSS [
Kurtzke Expanded Disability Status Scale] e Escala de Incapacidade Funcional por Sistemas - EIFS) tem sido relatada por alguns estudos, entretanto, não é observado consenso, havendo controvérsias em relação aos métodos e aos resultados obtidos
4-6,8,12-19.
A dificuldade em avaliar a deglutição de todos os pacientes com EM nos faz buscar aqueles com maior risco de apresentar disfagia, especialmente os mais suscetíveis à aspiração e ao desenvolvimento de infecção das vias aéreas inferiores. Com isso, o objetivo deste trabalho foi avaliar a prevalência da disfagia nos pacientes com EM e identificar os indicadores neurológicos que podem representar o desempenho da deglutição.
MÉTODONo período de janeiro de 2007 a maio de 2011, foram avaliados em hospital universitário terciário 120 pacientes (95 mulheres e 25 homens) portadores de EM. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos, com projeto nº 039/06.
A idade variou entre 17 e 65 anos, com média de 38,5 (mediana = 38; DP = 10,2). Os pacientes foram diagnosticados e classificados de acordo com as Formas Clínicas Evolutivas da doença, com a Escala de Incapacidade Funcional por Sistemas (EIFS) e com a Escala Ampliada de Incapacidade Funcional (EDSS -
Kurtzke Expanded Disability Status Scale). Foram excluídos do estudo pacientes que se encontravam em vigência de crise de desmielinização, com outras afecções neurológicas não associadas à EM, e com alterações anatômicas da cavidade oral, faringe e laringe que pudessem interferir na deglutição. Foram excluídos também pacientes com traqueostomia ou com antecedentes de submissão a este procedimento.
As Formas Clínicas Evolutivas da EM são divididas em forma remitente-recorrente (RR), em que o paciente apresenta surtos e remissões de déficit neurológico, em geral, com boa recuperação, forma primária progressiva (PP), em que a doença evolui desde o início com déficit neurológico lento e progressivo, e forma secundária progressiva (SP), inicialmente semelhante à forma remitente-recorrente, mas que, após algum tempo, torna-se progressiva
1. Do total de 120 pacientes, 79 (65,8%) apresentaram a forma RR, 35 (29,2%) a forma SP e seis (5%) a forma PP. As formas SP e PP, devido ao seu comportamento clínico semelhante, foram agrupadas e denominadas formas progressivas (FP).
A EIFS classifica o déficit de acordo com o sistema neurológico avaliado. São analisados os sistemas piramidal, sensorial, cerebelar, vesical, tronco encefálico, intestinal, visual, mental e outras disfunções
1. Observou-se disfunção piramidal em 108 pacientes (90%), disfunção sensorial em 76 (63,3%), disfunção cerebelar em 63 (52,5%), disfunção vesical em 54 (45%), disfunção do tronco encefálico em 42 (35%), disfunção intestinal em 41 (24,2%), disfunção visual em 34 (28,3%), disfunção mental em 21 (17,5%) e outras disfunções em 18 (15%).
A EDSS classifica os pacientes de acordo com sua incapacidade neurológica, levando em consideração a deambulação e a EIFS
1. A pontuação inicia em 0, que representa nenhuma incapacidade, e chega até 9,5, que representa incapacidade completa. O escore 10 é definido aos pacientes que foram a óbito. A avaliação pelo EDSS revelou que a pontuação variou de 0 a 9, com a média de 3,9 pontos (mediana = 3,5; DP = 2,5). Não foi avaliado neste estudo nenhum paciente com escore 9,5.
Após a classificação neurológica, os pacientes foram submetidos à videoendoscopia da deglutição (VED). Sua realização seguiu o protocolo descrito por Langmore et al.
20. Durante sua execução, os pacientes foram posicionados sentados na cadeira de exame otorrinolaringológica habitual, na cadeira de rodas ou no leito com elevação da cabeceira em 45 graus. O aparelho de fibronasofaringolaringoscopia foi introduzido pela fossa nasal mais ampla do paciente, sem o uso de vasoconstritores ou anestésicos tópicos para que não houvesse interferência na sensibilidade e na deglutição.
O equipamento utilizado para a realização do exame foi o fibronasofaringolaringoscópio flexível Pentax de 3,6 mm, microcâmera Storz DX-CAM NTSC modelo 202301 20, fonte de luz Machida modelo RG-2500, televisor LG de 21 polegadas, gravador de DVD LG modelo DR 4912B.
Durante este exame, foram administrados alimentos pastosos (10 ml em uma colher de sobremesa), líquidos (5 ml e 10 ml em uma seringa) e sólidos (pedaço de biscoito do tipo água e sal) corados com corante alimentar azul (corante de anilina) e na temperatura ambiente para que não houvesse estimulação térmica das regiões testadas durante o exame.
Uma escala clínico-funcional de achados fibronasofaringolaringoscópicos foi utilizada para determinar a gravidade da disfagia
21. Nesta classificação, as alterações encontradas devem ocorrer em pelo menos uma das consistências alimentares testadas:
Deglutição normal - contenção oral normal do alimento (ausência de escape de alimentos antes e após a fase faríngea da deglutição), ausência de estase alimentar, penetração laríngea ou aspiração traqueal;Disfagia leve - estase leve após deglutição (estase de alimentos que ocupou menos de um terço da região das valéculas epiglóticas e dos recessos pirifomes), ausência de penetração laríngea ou aspiração traqueal;Disfagia moderada - moderada estase alimentar após deglutição (estase de alimentos que ocupou cerca de dois terços da região das valéculas epiglóticas e dos recessos pirifomes), presença de penetração laríngea, porém sem aspiração traqueal;Disfagia grave - grande estase alimentar após a deglutição (estase de alimentos que ocupou totalmente a região das valéculas epiglóticas e dos recessos pirifomes) e presença de aspiração traqueal.
Após a caracterização quanto à gravidade da disfagia determinada pelos achados da VED, as informações foram correlacionadas com as formas clínicas da doença (RR e FP) e com as escalas de incapacidade funcional (EIFS e EDSS).
Esta pesquisa foi realizada com o uso da estatística descritiva, usando-se médias, medianas, desvios padrão e porcentagens. A comparação das diversas variáveis qualitativas foi realizada por meio do teste de Qui-quadrado de Pearson ou do teste exato de Fisher, dependendo dos valores esperados nas tabelas de contingência. Realizou-se a comparação das médias de pontuação do EDSS por meio do teste de Mann-Whitney e Kruskal-Wallis, usando-se o teste de Tukey HSD para as comparações entre os grupos (teste
post hoc). Para todos os testes estatísticos, adotou-se o nível de significância em 5%.
RESULTADOSA avaliação quanto ao desempenho da deglutição mostrou que 108 pacientes (90%) apresentaram alteração e apenas 12 (10%) exibiram normalidade nesta tarefa. Dos pacientes com alteração na deglutição, 49 (40,8%) apresentaram disfagia leve, 44 (36,7%) disfagia moderada e 15 (12,5%) disfagia grave.
A determinação da influência da forma clínica evolutiva da EM sobre o comportamento da deglutição foi realizada pela comparação entre esta variável e a gravidade da disfagia. Dos pacientes com disfagia grave, as formas progressivas (SP e PP) foram mais frequentes, enquanto a disfagia leve e moderada ocorreram mais frequentemente na forma RR (
p = 0,033) (Figura 1).
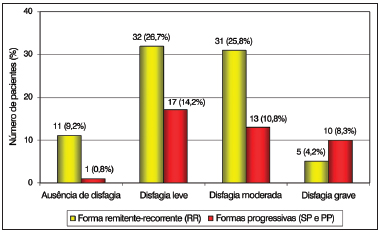
Figura 1. Distribuição dos pacientes de acordo com a gravidade da disfagia e as Formas Clínicas Evolutivas da Esclerose Múltipla.
Em relação à presença da disfagia e à incapacidade neurológica definida pela EIFS, observou-se associação estatisticamente significativa com a alteração da função cerebelar (
p < 0,05). A análise estratificada mostrou haver diferença estatisticamente significativa entre esta função cerebral em relação aos pacientes que apresentaram os graus leve, moderado e grave de disfagia. Os resultados encontram-se na Figura 2.
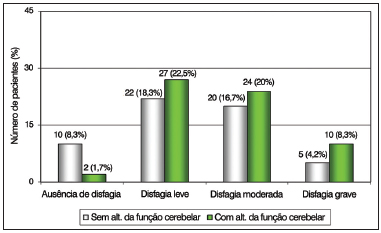
Figura 2. Distribuição dos pacientes de acordo com a gravidade da disfagia e as alterações na função cerebelar da Escala de Incapacidade Funcional por Sistemas (EIFS).
Observou-se, também, que apenas os pacientes com disfagia grave sofreram influência das alterações nas funções do tronco encefálico e na função mental e apresentaram-se em número significativamente maior (Figuras 3 e 4). As demais funções neurológicas não apresentaram associação estatisticamente significante com o grau da disfagia.
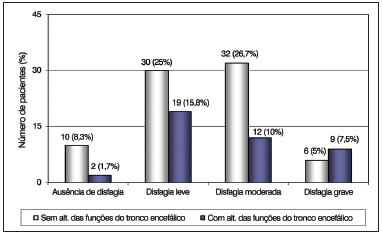
Figura 3. Distribuição dos pacientes de acordo com a gravidade da disfagia e as alterações na função do tronco encefálico da Escala de Incapacidade Funcional por Sistemas (EIFS).
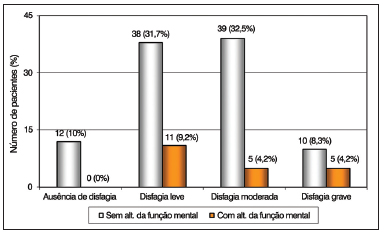
Figura 4. Distribuição dos pacientes de acordo com a gravidade da disfagia e as alterações na função mental da Escala de Incapacidade Funcional por Sistemas (EIFS).
O desempenho da deglutição também foi comparado com a pontuação do EDSS. Observamos que os pacientes com disfagia leve apresentaram pontuações mais baixas no EDSS, com média de 3,6 pontos (DP = 2,4). Os pacientes com disfagia moderada mostraram pontuações discretamente maiores, com média de 4,1 pontos (DP = 2,6), e os pacientes com disfagia grave exibiram as maiores pontuações, com média de 5,9 pontos (DP = 2,3). O teste de Kruskal-Wallis revelou diferença estatisticamente significativa na média de valores do EDSS segundo o grau da disfagia (
p = 0,007). O teste
post hoc evidenciou diferença entre os grupos de pacientes com disfagia grave
versus moderada (
p = 0,037) e disfagia grave
versus leve (
p = 0,005) (Figura 5).
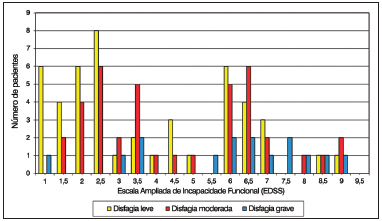
Figura 5. Distribuição dos pacientes de acordo com a gravidade da disfagia e a pontuação na Escala Ampliada de Incapacidade Funcional (EDSS).
A esclerose múltipla é uma doença que provoca déficits neurológicos progressivos, com modificações nos sistemas motores e sensoriais, e com potencial impacto funcional sobre a deglutição. Neste estudo, utilizamos a VED como método de avaliação, o que nos permitiu examinar pacientes restritos ao leito hospitalar, com déficit na locomoção e com alterações posturais
22-24. Esta forma de investigação possui plena concordância com o videodeglutograma (ou videofluoroscopia) e apresenta maior facilidade de execução, sem expor os pacientes à radiação
21,25-31.
A maior parte dos pacientes deste estudo (90%) mostrou distúrbios disfágicos que ocorreram durante a evolução da doença. Estes elevados índices concordam com os estudos de Miani et al., Abraham & Yun, Wiesner et al. e Terre-Boliart et al. e contrastam com os trabalhos que identificam a disfagia em valores que variam de 10% a 50%
3,5-11,16,18.
A necessidade em identificar os pacientes potencialmente propensos a apresentar quadros disfágicos levou alguns pesquisadores a estudar os fatores que representassem o desempenho desta tarefa. A pesquisa da influência do comportamento evolutivo da doença sobre o desempenho da deglutição mostrou que os pacientes com formas progressivas (SP e PP) apresentaram-se em número proporcionalmente maior de indivíduos com disfagia grave quando comparados aos pacientes RR. As formas progressivas, pelo seu comportamento mais destrutivo e permanente, provocam sequelas que levam a restrições mais intensas no desempenho da deglutição.
Além da comparação com as formas clínicas da EM, a associação da disfagia com as escalas de incapacidade (EIFS e EDSS) também têm sido utilizadas para inferir sobre o desempenho. A EIFS avalia sistemas neurais e estruturas encefálicas afetadas pela EM. As funções exercidas pelo sistema piramidal, cerebelo, tronco encefálico, sistema sensorial e áreas relacionadas com a atividade mental modificam a dinâmica da deglutição e podem causar mudanças drásticas no desempenho das estruturas faringolaríngeas. A função piramidal foi a mais frequentemente acometida entre os pacientes analisados neste e em outros estudos, entretanto, não mostrou associação significante com o aparecimento da disfagia. Em contrapartida, a função cerebelar, mental e do tronco encefálico mostraram índices significantes de influência, fato também observado por autores que realizaram investigação semelhante a esta pesquisa
4,5,8,10,12-16,18. Durante as atividades motoras, o cerebelo atua no sequenciamento muscular, coordenando a musculatura agonista e antagonista para que não haja a competição. Além disto, atua na antecipação dos movimentos a serem executados, armazenando a programação necessária para determinada tarefa. Este armazenamento se estende por toda a vida, e sempre que uma tarefa semelhante é executada, esta programação é reutilizada
32,33. Na deglutição, em que a sucessão de eventos relacionados à atividade muscular e à velocidade e força de contração são importantes para a propulsão adequada do alimento, mudanças na atividade cerebelar podem trazer grandes danos.
As funções do tronco cerebral e a função mental também provocaram influências, entretanto, sua ocorrência foi determinada apenas nos pacientes com disfagia grave. O tronco cerebral, detentor dos núcleos de controle da deglutição, e as estruturas cerebrais ligadas à função mental, localizadas predominantemente no lobo frontal e responsáveis pela iniciativa, julgamento, atenção e cognição, claramente interferem no desempenho desta atividade e podem provocar desajustes importantes
32,34.
A análise do EDSS também possibilita inferências sobre o desempenho da deglutição e pontuações mais elevadas nesta escala estão associadas a um maior comprometimento desta tarefa
6,10,15,17. Da mesma forma, neste estudo a média da pontuação do EDSS mostrou-se progressivamente maior conforme o agravamento da disfagia, sendo mais alta nos pacientes com disfagia classificada como grave. Estes achados discordaram dos encontrados por Abraham & Yun
4, que não observaram relação do EDSS com a gravidade da disfagia, fato que pode ter ocorrido pela casuística pequena deste estudo (13 pacientes). Entretanto, Abraham et al.
15 questionaram 538 pacientes e observaram que a gravidade da disfagia mostrou relação com a pontuação do EDSS. Nesta pesquisa, os quadros mais intensos de disfagia foram mais frequentes nos pacientes com maiores danos neurológicos e com maiores pontuações no EDSS.
Portanto, a observação das Formas Clínicas Evolutivas da doença, da avaliação da EIFS, em especial das funções neurológicas mentais, cerebelares e de tronco encefálico e da EDSS são úteis para inferir sobre possíveis alterações na deglutição e estimular a pesquisa do desempenho desta tarefa por métodos objetivos.
CONCLUSÃOOs distúrbios da deglutição avaliados pela videoendoscopia da deglutição ocorreram com elevada frequência neste grupo de pacientes com esclerose múltipla. As formas clínicas progressivas da doença (formas SP e PP), o acometimento das funções cerebelar, do tronco encefálico e mental na Escala de Incapacidade Funcional por Sistemas (EIFS) e as pontuações elevadas na Escala Ampliada de Incapacidade Funcional (EDSS) foram fatores indicadores relacionados à gravidade da disfagia destes doentes.
REFERÊNCIAS 1. Tilbery CP. Esclerose múltipla no Brasil: aspectos clínicos e terapêuticos. 1ª ed. São Paulo: Atheneu; 2005. 288p.
2. Miller JR. Esclerose múltipla. In: Rowland LP. Merrit tratado de neurologia. Rio de Janeiro: Guanabara Koogan; 2002. p.670-87.
3. Miani C, Bergamin AM, Passon P, Rugiu MG, Staffieri A. Videofluoroscopic study of deglutition in patients with multiple sclerosis. Acta Otorhinolaryngol Ital. 2000;20(5):343-6.
4. Abraham SS, Yun PT. Laryngopharyngeal dysmotility in multiple sclerosis. Dysphagia Winter. 2002;17(1):69-74.
http://dx.doi.org/10.1007/s00455-001-0103-7 5. Calcagno P, Ruoppolo G, Grasso MG, De Vincentiis M, Paolucci S. Dysphagia in multiple sclerosis - prevalence and prognostic factors. Acta Neurol Scand. 2002;105(1):40-3.
http://dx.doi.org/10.1034/j.16000404.2002.10062.x 6. De Pauw A, Dejaeger E, D'hooghe B, Carton H. Dysphagia in multiple sclerosis. Clin Neurol Neurosurg. 2002;104(4):345-51.
http://dx.doi.org/10.1016/S0303-8467(02)00053-77. Wiesner W, Wetzel SG, Kappos L, Hoshi MM, Witte U, Radue EW, et al. Swallowing abnormalities in multiple sclerosis: correlation between videofluoroscopy and subjective symptoms. Eur Radiol. 2002;12(4):789-92.
http://dx.doi.org/10.1007/s003300101086 8. Prosiegel M, Schelling A, Wagner-Sonntag E. Dysphagia and multiple sclerosis. Int MS J. 2004;11(1):22-31.
9. Terré-Boliart R, Orient-López F, Guevara-Espinosa D, Ramón-Rona S, Bernabeu-Guitart M, Clavé-Civit P. Oropharyngeal dysphagia in patients with multiple sclerosis. Rev Neurol. 2004;39(8):707-10.
10. Poorjavad M, Derakhshandeh F, Etemadifar M, Soleymani B, Minagar A, Maghzi AH. Oropharyngeal dysphagia in multiple sclerosis. Mult Scler. 2010;16(3):362-5.
http://dx.doi.org/10.1177/1352458509358089 11. Danesh-Sani SA, Rahimdoost A, Soltani M, Ghiyasi M, Haghdoost N, Sabzali-Zanjankhah S. Clinical assessment of orofacial manifestations in 500 patients with multiple sclerosis. J Oral Maxillofac Surg. 2013;71(2):290-4.
http://dx.doi.org/10.1016/j.joms.2012.05.008 12. Borucki SJ, Dietz MA, Simon G, Aisen ML. Videofluoroscopy in the evaluation of dysphagia in multiple sclerosis. Neurology. 1991;41(Suppl 1):427.
13. Hughes JC, Enderby PM, Langton Hewer R. Dysphagia and multiple sclerosis: a study and discussion of its nature and impact. Clin Rehabil. 1994;8(1):18-26.
http://dx.doi.org/10.1177/026921559400800103 14. Yorkston KM, Miller RM, Strand EA. Multiple sclerosis. In: Yorkstone KM, Miller RM, Strand EA. Management of speech and swallowing in degenerative disease. Texas: Communication Skill Builders; 1995. p.177-206.
15. Abraham S, Scheinberg LC, Smith CR, LaRocca NG. Neurological impairment and disability status in outpatients with multiple sclerosis reporting dysphagia symptomatology. J Neurol Rehabil. 1997;11(1):7-13.
http://dx.doi.org/10.1177/154596839701100102 16. Thomas FJ, Wiles CM. Dysphagia and nutritional status in multiple sclerosis. J Neurol. 1999;246(8):677-82.
http://dx.doi.org/10.1007/s004150050431 17. Rousseaux M, Pérennou D. Comfort care in severely disabled multiple sclerosis patients. J Neurol Sci. 2004;222(1-2):39-48.
http://dx.doi.org/10.1016/j.jns.2004.04.002 18. Gates J, Hartnell GG, Gramigna GD. Videofluoroscopy and swallowing studies for neurologic disease: a primer. Radiographics. 2006;26(1):e22.
http://dx.doi.org/10.1148/rg.e22 19. Marchese-Ragona R, Restivo DA, Marioni G, Ottaviano G, Masiero S, Staffieri A. Evaluation of swallowing disorders in multiple sclerosis. Neurol Sci. 2006;27(suppl 4): S335-7.
http://dx.doi.org/10.1007/s10072-006-0654-3 20. Langmore SE, Schatz K, Olsen N. Fiberoptic endoscopic examination of swallowing safety: a new procedure. Dysphagia. 1988;2(4):216-9.
http://dx.doi.org/10.1007/BF02414429 21. Macedo Filho ED, Gomes GF, Furkim AM. A deglutição normal. In: Macedo Filho ED, Gomes GF, Furkim AM. Manual de cuidados do paciente com disfagia. São Paulo: Lovise; 2000. p.17-27.
22. Spiegel JR, Selber JC, Creed J. A functional diagnosis of dysphagia using videoendoscopy. Ear Nose Throat J. 1998;77(8):628-32.
23. Broniatowski M, Sonies BC, Rubin JS, Bradshaw CR, Spiegel JR, Bastian RW, et al. Current evaluation and treatment of patients with swallowing disorders. Otolaryngol Head Neck Surg. 1999;120(4):464-73.
http://dx.doi.org/10.1053/hn.1999.v120.a93228 24. Ramsey DJ, Smithard DG, Kalra L. Early assessments of dysphagia and aspiration risk in acute stroke patients. Stroke. 2003;34(5):1252-7.
http://dx.doi.org/10.1161/01.STR.0000066309.06490.B8 25. Langmore SE, Schatz K, Olson N. Endoscopic and videofluoroscopic evaluations of swallowing and aspiration. Ann Otol Rhinol Laryngol. 1991;100(8):678-81.
26. Kaye GM, Zorowitz RD, Baredes S. Role of flexible laryngoscopy in evaluating aspiration. Ann Otol Rhinol Laryngol. 1997;106(8):705-9.
27. Wu CH, Hsiao TY, Chen JC, Chang YC, Lee SY. Evaluation of swallowing safety with fiberoptic endoscope: comparison with videofluoroscopic technique. Laryngoscope. 1997;107(3):396-401.
http://dx.doi.org/10.1097/00005537-199703000-00023 28. Leder SB, Sasaki CT, Burrell MI. Fiberoptic endoscopic evaluation of dysphagia to identify silent aspiration. Dysphagia. 1998;13(1):19-21.
http://dx.doi.org/10.1007/PL00009544 29. Manrique D. Avaliação otorrinolaringológica da deglutição. In: Furkin AM, Santini CS. Disfagias orofaríngeas. 1a ed. São Paulo: Pró-Fono; 1999. p.49-60.
30. Schröter-Morasch H, Bartolome G, Troppmann N, Ziegler W. Values and limitations of pharyngolaryngoscopy (transnasal, transoral) in patients with dysphagia. Folia Phoniatr Logop. 1999;51(4-5):172-82.
http://dx.doi.org/10.1159/000021495 31. Dória S, Abreu MAB, Buch R, Assumpção RA, Nico MAC, Ekcley CA, et al. Estudo comparativo da deglutição com nasofibrolaringoscopia e videodeglutograma em pacientes com acidente vascular cerebral. Rev Bras Otorrinolaringol. 2003;69(5):636-42.
http://dx.doi.org/10.1590/S0034-72992003000500008 32. Fernandes AMF. Estudos dos aspectos neurológicos do controle motor laríngeo [dissertação de mestrado]. São Paulo: Faculdade de Ciências Médicas da Santa Casa de São Paulo; 1999.
33. Suzuki M, Asada Y, Ito J, Hayashi K, Inoue H, Kitano H. Activation of cerebellum and basal ganglia on volitional swallowing detected by functional magnetic resonance imaging. Dysphagia. 2003;18(2):71-7.
http://dx.doi.org/10.1007/s00455-002-0088-x 34. Kern MK, Jaradeh S, Arndorfer RC, Shaker R. Cerebral cortical representation of reflexive and volitional swallowing in humans. Am J Physiol Gastrointest Liver Physiol. 2001;280(3):G354-60.
1. Professor Instrutor do Departamento de Otorrinolaringologia da Santa Casa de São Paulo. Mestre e Doutor em Medicina pela Faculdade de Ciências Médicas da Santa Casa de São Paulo.
2. Professor Instrutor do Departamento de Otorrinolaringologia da Santa Casa de São Paulo Mestre e Doutor pela Faculdade de Ciências Médicas da Santa Casa de São Paulo.
3. Professor Assistente do Departamento de Otorrinolaringologia da Santa Casa de São Paulo. Mestre e Doutor pela Faculdade de Ciências Médicas da Santa Casa de São Paulo.
4. Mestre em Neurociências pela Universidade Federal de São Paulo - Escola Paulista de Medicina Fonoaudióloga clínica - (Fonoaudióloga clínica).
5. Professor Titular do Departamento de Neurologia da Santa Casa de São Paulo.
Departamento de Otorrinolaringologia da Santa Casa de São Paulo.
Endereço para correspondência:
Alessandro Murano Ferré Fernandes
Departamento de Otorrinolaringologia
Rua Cesário Mota Júnior, nº 112, Pavilhão Conde de Lara, 4º andar, Vila Buarque
São Paulo - SP. Brasil. CEP: 01221-020
Tel: (11) 2176-7235. Fax: (11) 3222-8405
E-mail:
murano@uol.com.br Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 14 de outubro de 2012. cod. 10519.
Artigo aceito em 30 de abril de 2013.


