INTRODUÇÃOO termo neuropatia auditiva é utilizado para descrever a afecção de sujeitos, com faixa etária ampla, variando de crianças a adultos, compatíveis com os critérios diagnósticos que caracterizam funcionamento normal das células ciliadas externas cocleares e funcionamento anormal ou ausente do nervo auditivo; descrito como uma desordem auditiva que combina Emissões Otoacústicas (EOA) e/ou Microfonismo Coclear (MC) presentes com ausência ou dessincronia das ondas geradas no Potencial Evocado Auditivo de Tronco Encefálico (PEATE), o termo neuropatia auditiva foi utilizado pela primeira vez em um estudo realizado em 1996 para classificar um grupo de sujeitos que apresentavam sintomas auditivos, com função coclear normal, associada à disfunção do nervo coclear
1.
A terminologia espectro da neuropatia auditiva foi convencionada pelo consenso internacional, durante a Conferência de Desenvolvimento e Gestão de Identificação de Sujeitos com Neuropatia Auditiva, de junho de 2008
2. A mudança da nomenclatura deu-se devido a um estudo realizado em 2002 que demonstrou que em torno de metade das crianças com neuropatia auditiva tinham habilidade de percepção de fala igual às crianças com perda auditiva sensorioneural e apresentavam presença de respostas de potencial evocado cerebral, enquanto a outra metade das crianças tinha resultados insatisfatórios nos testes de percepção de fala e ausência de respostas de potencial evocado cerebral. Percebeu-se, pois, que o termo neuropatia auditiva descreve uma gama de transtornos que podem variar de dessincronia auditiva até uma neuropatia do nervo auditivo
3.
Os indivíduos com espectro da neuropatia auditiva (ENA) podem apresentar perda auditiva de leve a grave, uni ou bilateral, associada à dificuldade de discriminação vocal desproporcional a sua perda auditiva
4, com resultados audiológicos demonstrando grande variabilidade ao PEATE; de alteração grave da morfologia das ondas até ausência total de formação das ondas, refletindo, assim, uma natureza multifacetada e heterogênea da fisiopatologia dessa desordem auditiva
5. Estes sujeitos frequentemente escutam, mas não conseguem discriminar as palavras; isso ocorre devido à perda da sincronia neural das fibras do nervo vestibulococlear, que acarreta uma grave alteração na habilidade do processamento auditivo temporal, prejudicando muito a discriminação vocal
6.
A prevalência do ENA ainda é pouco conhecida
7 e apresenta estimativas com muita variabilidade, de 0,23%
8 a 15%
9 entre sujeitos com perda auditiva. Entretanto, a estimativa da prevalência do ENA, em estudo de pacientes com risco de perda auditiva, foi de 1,3%
10, assim como no estudo em crianças de risco para perda auditiva a prevalência do ENA encontrada foi de 0,94%
11. Outro estudo com crianças portadoras de perda auditiva apresentou prevalência de 5,1% a 15%
12. Nesta outra pesquisa, com pacientes com perda auditiva neurossensorial, a prevalência de ENA foi de 1,6%
13. Em estudo de uma população de recém-nascidos que falharam na triagem auditiva realizada com o uso do PEATE, obteve-se prevalência de ENA de 2,96%
14. Pacientes com ENA, muito frequentemente, requerem abordagens apropriadas para seus problemas auditivos, de comunicação e de linguagem, diferenciadas das abordagens usuais dos pacientes com perda auditiva periférica
11.
O sítio da lesão no ENA ainda não está bem estabelecido. Os sítios propostos de lesão incluem células ciliadas internas, a sinapse entre as células ciliadas internas e o nervo auditivo, os dendritos ou axônios neurais, aferência e eferência do nervo auditivo, neurônios do gânglio espiral ou anormalidades bioquímicas dos neurotransmissores
9,15,16.
O presente estudo teve o objetivo de identificar a prevalência do ENA em um grupo de sujeitos com perda auditiva neurossensorial de um serviço de saúde auditiva.
MÉTODOTrata-se de um estudo de coorte histórica com corte transversal, realizado em um serviço de saúde auditiva, aprovado pelo Comitê de Ética e Pesquisa, sob o número 190.328.
O estudo foi composto por um grupo de sujeitos com diagnóstico de perda auditiva neurossensorial (PANS) avaliados na unidade de audiologia, de 2010 a 2012. Os critérios de inclusão foram:
PANS;Otoscopia normal, caracterizando função de orelha média normal;Presença de emissões otoacústicas evocadas transientes e/ou microfonismo coclear na pesquisa de potenciais evocados auditivos de tronco encefálico;Ausência do reflexo acústico;Ausência das ondas do PEATE, ou alteração grave da morfologia das ondas;Exame de ressonância nuclear magnética cerebral normal que foi solicitado por nós a fim de excluir afecções retrococleares, que poderiam afetar as respostas no PEATE; estes foram realizados em diferentes serviços, por isso, utilizaram-se somente os laudos para fins de critérios de exclusão
Critérios de exclusão:
Sujeitos que apresentaram aos exames audiometria tonal e vocal perdas auditivas condutivas ou mistas;Sujeitos que não colaboraram com a realização dos exames;Sujeitos com afecções retrococleares detectadas à RNM.
Foram avaliados 2.292 sujeitos com diagnóstico de perda auditiva neurossensorial, com idade variando de 0 a 95 anos. Todos eles passaram pela avaliação completa, composta pelo exame otorrinolaringológico para determinar as condições do conduto auditivo externo e da membrana timpânica, por meio de otoscopia convencional; pela avaliação audiológica básica, composta pela imitanciometria, audiometria tonal limiar e audiometria vocal. Foram utilizados os equipamentos: Imitanciômetro AT-235 (
Interacoustics), Audiômetro AC-33 (
Interacoustics).
A avaliação das EOAs foi registrada com o equipamento Madsen Capela (
Otometrics). Para o registro das emissões otoacústicas evocadas por produto de distorção foram testadas as frequências de 700 a 8.000 Hz, e a intensidade do estímulo utilizado foi de L1 65 dBNPS e L2 de 55 dBNPS, mantidas fixas, e a razão entre as frequências de 1,22 (F2/F1 = 1,22); foi interpretado como presença de resposta nas frequências em que a relação sinal/ruído foi de 6 dB, e reprodutibilidade maior ou igual a 70% e estabilidade maior ou igual a 75%.
O PEATE e o MC foram avaliados usando o equipamento Chartr EP (
Otometrics), com uso de fone de inserção. No PEATE, o estímulo utilizado foi o click monoaural na intensidade de 100 dBNA inicialmente, por pelo menos duas vezes, para a confirmação da superposição das ondas. O espectro de frequência do estímulo foi entre 250 Hz e 8.000 Hz, com duração individual de 100 microssegundos, e polaridade condensada e rarefeita, com frequência de apresentação dos cliques de 27,7 estímulos por segundo, com janela de 12 ms. Caracterizando a ausência de formação das ondas no PEATE com estímulo de até 100 dBNA, ou alteração grave da morfologia das ondas do PEATE consistindo em baixa amplitude da onda V, somente com intensidade de 100 dBNA.
Durante a realização do PEATE, foi feito o registro do MC, utilizando-se cliques com polaridades invertidas (condensada e rarefeita). Com a presença do MC, inicialmente na intensidade de 100 dBNA, foi, então, pesquisada a intensidade, decrescendo-se de 20 em 20 até o nível mínimo de intensidade que o potencial pudesse ser verificado. As latências absolutas das ondas I, III e V foram mensuradas, mas apresentaram variabilidade de resultados devido à alteração da morfologia, amplitude e latência das mesmas, mas suas medidas não fazem parte do objetivo desse trabalho. Os exames de PEATE e EOAs foram realizados sem o uso de sedativos. A classificação de perda auditiva utilizada para a PANS foi a de Goodman
17.
RESULTADOSNeste estudo, do total de 2.292 sujeitos que tiveram diagnóstico de PANS, 27 (1,2%) (Gráfico 1) preencheram os critérios de inclusão para o diagnóstico de ENA, apresentando ausência ou anormalidade grave nas ondas do PEATE e EOAs e/ou MC normais, além de ressonância nuclear magnética cerebral normal. Todos os 27 sujeitos apresentaram ENA binaural.
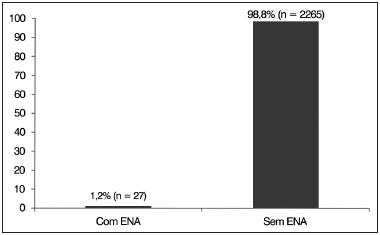
Gráfico 1. Distribuição percentual de sujeitos com espectro da neuropatia auditiva (ENA).
Destes 27 sujeitos, dez (37%) eram do gênero masculino, e 17 (63%) do gênero feminino (Gráfico 2).
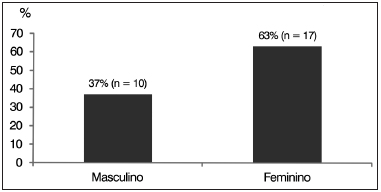
Gráfico 2. Distribuição percentual dos sujeitos com espectro da neuropatia auditiva (ENA) por gênero.
Em relação à distribuição por idade, foram encontrados quatro sujeitos (14,8%) entre 0 a 20 anos; nove sujeitos (33,4%) entre 21 a 40 anos; 12 sujeitos (44,4%) entre 41 e 60 anos e dois sujeitos (7,4%) acima de 60 anos (Gráfico 3).
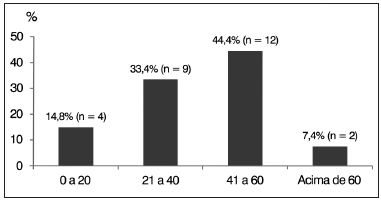
Gráfico 3. Distribuição percentual dos sujeitos com espectro da neuropatia auditiva (ENA) por faixa etária em anos.
Em relação ao grau da perda auditiva, detectada por meio da audiometria tonal e vocal, oito sujeitos (29,6%) apresentaram PANS leve; 15 sujeitos (55,5%) PANS moderada; dois sujeitos (7,4%) PANS grave; e dois sujeitos (7,5%) PANS profunda (Gráfico 4). Todos os sujeitos apresentaram ausência de reflexo estapediano à imitanciometria.
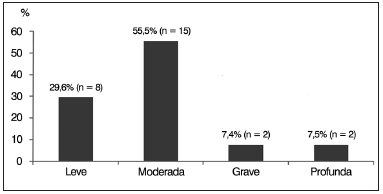
Gráfico 4. Distribuição percentual de sujeitos com espectro da neuropatia auditiva (ENA) segundo grau da perda auditiva.
Todos os 27 sujeitos com diagnóstico de ENA foram testados para a adaptação de aparelho de amplificação sonora individual (AASI) e foi obtido ganho funcional em três sujeitos (11,1%), e não houve ganho funcional em 24 sujeitos (88,9%) (Gráfico 5).
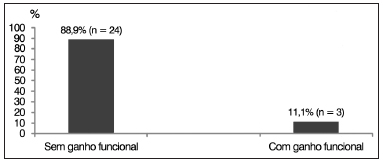
Gráfico 5. Distribuição percentual dos sujeitos com espectro da neuropatia auditiva (ENA) segundo ganho funcional pós-adaptação de AASI (Aparelho de Amplificação Sonora Individual).
O ENA é uma condição que pode ser encontrada em pacientes de todas as idades, adultos e crianças, que apresentem funcionamento normal das células ciliadas externas e função neural alterada
16, o que gera "incompatibilidade" entre os resultados, que revelam a alteração da sincronia neural do ENA. A associação dos testes audiológicos objetivos aos subjetivos é indispensável para o diagnóstico preciso, interferindo, desta forma, no prognóstico do ENA. Para isso, preconiza-se a utilização dos testes de audiometria tonal e vocal; medidas de imitância acústica; emissões otoacústicas; potencial evocado auditivo de tronco encefálico e do microfonismo coclear
18.
O microfonismo coclear pode ser avaliado utilizando-se o PEATE como método para diagnóstico do ENA, ou por meio da eletrococleografia. Estudo de sujeitos com ENA avaliou o uso da eletrococleografia extratimpânica (Ecog-Et) e do PEATE no diagnóstico diferencial do ENA e concluiu que a Ecog-Et permite uma análise mais detalhada da função coclear em relação ao PEATE
19.
O ENA é uma entidade clínica relativamente nova e ainda há poucas evidências científicas sobre sua incidência, prevalência, curso natural da doença e definições claras sobre opções terapêuticas
20.
A prevalência do ENA em sujeitos com PANS no nosso estudo foi de 1,2%. Na literatura, foram encontrados estudos com média de prevalência variando de 0,5% a 15%, no grupo de sujeitos com PANS
8-10. Em outro estudo, foi encontrada prevalência variando de 1,8% a 14% em crianças com perda auditiva
11,12. Outro estudo avaliando crianças com PANS encontrou prevalência de 5,1% de ENA
21.
Estudos conduzidos com população de adultos mostraram menor prevalência de ENA sendo que Lofti & Mehrkian
13 obtiveram 1,6%, Lee et al.
22 encontraram 2,5%; e Duman et al.
23, 4%.
No presente estudo, foi identificado o ENA em ampla faixa etária de pacientes, entretanto, houve maior concentração de adultos, que representaram 23 dos 27 sujeitos portadores de ENA.
O avanço do processo patológico do ENA e o fato de que os sujeitos com PANS que utilizam o AASI podem sofrer danos cocleares causados pela amplificação sonora, levando à lesão das células ciliadas cocleares normais, desaparecendo, então, as EOAs, dificultando o diagnóstico do ENA em sujeitos com diagnóstico tardio do ENA, mostra a alta relevância do MC na bateria de testes para diagnóstico do ENA
24.
Todos os sujeitos diagnosticados com ENA, no nosso estudo, preencheram os critérios de função coclear preservada, associada à alteração ou/à ausência de função do nervo auditivo, avaliados pelos exames de EOA e PEATE, respectivamente. Os resultados encontrados se mostraram compatíveis com os achados descritos pela literatura, no que diz respeito à distribuição por gênero, faixa etária e grau da perda auditiva
25-27. No presente estudo, dos 27 sujeitos com ENA apenas três (11,6%) apresentaram algum benefício quanto ao ganho de inserção com o uso do AASI, demonstrando resultados insatisfatórios com esta intervenção.
Quanto ao implante coclear (IC), este pode melhorar o resultado das ondas no exame de PEATE e levar a benefícios para a fala de sujeitos com ENA, após o implante
28, caracterizando-se como um recurso terapêutico eficaz para a melhoria das habilidades auditivas em mais de 90% dos sujeitos, ocorrendo compensação da alteração da sincronia neural decorrente do ENA, assim como melhora na percepção da fala nos pacientes com ENA e uso do IC
29,30.
O espectro da neuropatia auditiva não é uma afecção auditiva extremamente rara, logo a complementação da avaliação audiológica com os exames objetivos de EOA, MC e PEATE é essencial para a acurácia do diagnóstico do ENA, pois a presença do MC e ou EOA associada à ausência ou dessincronia das ondas do PEATE é o mais adequado critério para o seu diagnóstico.
Esta afecção ainda é um desafio, pois muitos fatores de sua patogênese e etiologia ainda não são claros, por isso, novos estudos são necessários para compreendermos melhor o ENA.
CONCLUSÃONa amostra deste trabalho, a prevalência do espectro da neuropatia auditiva entre sujeitos com perda auditiva neurossensorial foi de 1,2%, dado este concordante com a literatura.
AGRADECIMENTOSEsse trabalho recebeu apoio da Fundação de Amparo à Pesquisa e ao Desenvolvimento Científico e Tecnológico do Maranhão - FAPEMA.
REFERÊNCIAS 1. Starr A, Picton TW, Sininger Y, Hood LJ, Berlin CI. Auditory neuropathy. Brain 1996;119(Pt 3):741-53.
http://dx.doi.org/10.1093/brain/119.3.741 2. Pearce W, Martin RL. On auditory neuropathy, aka auditory neuropathy spectrum. Hear J. 2009;62(2):38-9.
3. Rance G, Cone-Wesson B, Wunderlich J, Dowell R. Speech perception and cortical event related potentials in children with auditory neuropathy. Ear Hear. 2002;23(3):239-53.
http://dx.doi.org/10.1097/00003446200206000-000084. Sinninger YS, Oba S. Patients with auditory neuropathy: who are they and what can hear? In: Sininger YS, Starr A (eds.). Auditory Neuropathy: a new perspective on hearing disorders. San Diego: Singular Thomson Learning; 2001. p.15-35.
5. Mo L, Yan F, Liu H, Han D, Zhang L. Audiological results in a group of children with auditory neuropathy spectrum disorder. ORL J Otorhinolaryngol Relat Spec. 2010;72(2):75-9.
http://dx.doi.org/10.1159/000297572 6. Zeng FG, Oba S, Garde S, Sininger Y, Starr A. Temporal and speech processing deficits in auditory neuropathy. Neuroreport. 1999;10(16):3429-35.
http://dx.doi.org/10.1097/00001756-19991108000031 7. Korver AM, van Zanten GA, Meuwese-Jongejeugd A, van Straaten HL, Oudesluys-Murphy AM. Auditory neuropathy in a low-risk population: a review of the literature. Int J Pediatr Otorhinolaryngol. 2012;76(12):1708-11.
http://dx.doi.org/10.1016/j.ijporl.2012.08.009 8. Tang TP, McPherson B, Yuen KC, Wong LL, Lee JS. Auditory neuropathy/auditory dys-synchrony in school children with hearing loss: frequency of occurrence. Int J Pediatr Otorhinolayngol. 2004;68(2):175-83.
http://dx.doi.org/10.1016/j.ijporl.2003.10.004 9. Mason JC, De Michele A, Stevens C, Ruth RA, Hashisaki GT. Cochlear implantation in patients with auditory neuropathy of varied etiologies. Laryngoscope. 2003;113(1):45-9.
http://dx.doi.org/10.1097/00005537200301000-00009 10. Kraus N, Ozdamar O, Stein L, Reed N. Absent auditory brain stem response: peripheral hearing loss or brain stem dysfunction? Laryngoscope. 1984;94(3):400-6.
http://dx.doi.org/10.1288/00005537198403000-00019 11. Foerst A, Beutner D, Lang-Roth R, Huttenbrink KB, von Wedel H, Walger M. Prevalence of auditory neuropathy/synaptopathy in a population of children with profound hearing loss. Int J Pediatr Otorhinolaryngol. 2006;70(8):1415-22.
http://dx.doi.org/10.1016/j.ijporl.2006.02.010 12. Madden C, Rutter M, Hilbert L, Greinwald JH Jr, Choo DI. Clinical and audiological features in auditory neuropathy. Arch Otolaryngol Head Neck Surg. 2002;128(9):1026-30.
13. Lotfi Y, Mehrkian S. The prevalence of auditory neuropathy in students with hearing impairment in Tehran, Iran. Arch Iran Med. 2007;10(2):233-5.
14. Maris M, Venstermans C, Boudewyns AN. Auditory neuropathy/ yssynchrony as a cause of failed neonatal hearing screening. Int J Pediatr Otorhinolaryngol. 2011;75(7):973-5.
http://dx.doi.org/10.1016/j.ijporl.2011.04.012 15. Starr A, Sininger YS, Pratt H. The varieties of auditory neuropathy. J Basic Clin Physiol Pharmacol. 2000;11(3):215-30.
http://dx.doi.org/10.1515/JBCPP.2000.11.3.215 16. Hood LJ. Auditory neuropathy: What is it and what can we do about it? Hear J. 1998;51(8):10-8.
17. Goodman A. Reference zero levels for pure-tone audiometers. ASHA.1965;7:262-73.
18. Hood LJ. A review of objective methods of evaluating auditory neural pathways. Laryngoscope. 1999;109(11):1745-8.
http://dx.doi.org/10.1097/00005537-199911000-00004 19. Anastasio ART, Alvarenga Kde F, Costa Filho OA. Extratympanic electrocochleography in the diagnosis of auditory neuropathy/auditory dyssynchrony. Braz J Otorhinolaryngol. 2008;74(1):132-6.
20. Mittal R, Ramesh AV, Panwar SS, Nilkanthan A, Nair S, Mehra PR. Auditory neuropathy spectrum disorder: its prevalence and audiological characteristics in an Indian tertiary care hospital. Int J Pediatr Otorhinolaryngol. 2012;76(9):1351-4.
http://dx.doi.org/10.1016/j.ijporl.2012.06.005 21. Bielecki I, Horbulewicz A, Wolan T. Prevalence and risk factors for auditory neuropathy spectrum disorder in a screened newborn population at risk for hearing loss. Int J Pediatr Otorhinolaryngol. 2012;76(11):1668-70.
http://dx.doi.org/10.1016/j.ijporl.2012.08.001 22. Lee JS, McPherson B, Yuen KC, Wong LL. Screening for auditory neuropathy in a school for hearing impaired children. Int J Pediatr Otorhinolaryngol. 2001;61(1):39-46.
http://dx.doi.org/10.1016/S01655876(01)00543-2 23. Duman K, Ayçiçek A, Sargin R, Kenar F, Yilmaz MD, Dereköy FS. Incidence of auditory neuropathy among the deaf school students. Int J Pediatr Otorhinolaryngol. 2008;72(7):1091-5.
http://dx.doi.org/10.1016/j.ijporl.2008.03.024 24. Sanyelbhaa Talaat H, Kabel AH, Samy H, Elbadry M. Prevalence of auditory neuropathy (AN) among infants and young children with severe to profound hearing loss. Int J Pediatr Otorhinolaryngol. 2009;73(7):937-9.
http://dx.doi.org/10.1016/j.ijporl.2009.03.009 25. Parra VM, Matas CG, Neves IF. Estudo de caso: neuropatia auditiva. Rev Bras Otorrinolaringol. 2003;69(2):283-8.
http://dx.doi.org/10.1590/S0034-72992003000200022 26. Berlin CI. Auditory neuropathy. Using OEAs and ABR from screening management. Sem Hear. 1999;20(4):307-15.
http://dx.doi.org/10.1055/s-0028-1082946 27. Hood LJ. Auditory neuropathy/auditory dys-synchrony: New insights. Hear J. 2002;55(2):10-8.
28. Colletti V, Carner M, Miorelli V, Guida M, Colletti L, Fiorino F. Cochlear implant failure: is an auditory brainstem implant the answer? Acta Otolaryngol. 2004;124(4):353-7.
http://dx.doi.org/10.1080/00016480410016441 29. Alvarenga KF, Amorim RB, Agostinho-Pesse RS, Costa OA, Nascimento LT, Bevilacqua MC. Speech perception and cortical auditory evoked potentials in cochlear implant users with auditory neuropathy spectrum disorders. Int J Pediatr Otorhinolaryngol. 2012;76(9):1332-8.
http://dx.doi.org/10.1016/j.ijporl.2012.06.001 30. Carvalho AC, Bevilacqua MC, Sameshima K, Costa Filho OA. Auditory neuropathy/Auditory dyssynchrony in children with Cochlear Implants. Braz J Otorhinolaryngol. 2011;77(4):481-7.
http://dx.doi.org/10.1590/S1808-86942011000400012 1. Doutoranda em Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto - USP - Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço - (Docente da Universidade Federal do Maranhão, no Centro de Ciências Sociais, Saúde e Tecnologia).
2. Doutora em Medicina, área Pediatria, pela Faculdade de Medicina de Ribeirão Preto (Docente, nível professor Doutor, junto ao Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto-USP).
Faculdade de Medicina de Ribeirão Preto - USP. Universidade Federal do Maranhão - UFMA.
Endereço para correspondência:
Myriam Lima Isaac/Rosimar Costa Penido
Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço. Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto-USP
Av. Bandeirantes, nº 3900, 12º andar. Monte Alegre
Ribeirão Preto - SP. Brasil. CEP: 14049-900
Email:
rosimarpenido@usp.brEste artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 30 de janeiro de 2013. cod. 10740.
Artigo aceito em 14 de abril de 2013.
Fundação de Amparo à Pesquisa e Desenvolvimento Científico e Tecnológico do Maranhão - FAPEMA.


