INTRODUÇÃOAs afecções inflamatórias do nariz e seios paranasais são o grupo de doenças mais prevalentes na população em geral. Estas doenças, como, por exemplo, as rinites alérgicas e não alérgicas, as rinossinusites agudas e crônicas, com e sem polipose nasal, causam acentuada queda da qualidade de vida dos pacientes afetados, gerando perdas significativas das atividades de trabalho, lazer e sociais em geral. Estes pacientes necessitam de tratamento específico e especializado.
As medicações tópicas nasais são de extrema importância no tratamento das doenças inflamatórias do nariz e seios paranasais, assim como também das doenças infecciosas das vias aéreas superiores. Embora algumas classes de medicamentos sejam usadas há décadas, novas moléculas têm sido disponibilizadas.
Devido à prevalência destas doenças, existe um gasto direto e indireto muito grande associado ao tratamento, principalmente nos de longa duração. O custo associado a eles não deve ser ignorado, e o uso correto destas drogas pode gerar gastos menores tanto para o paciente e sua família quanto para a saúde pública e sociedade.
O presente documento tem por objetivo esclarecer àqueles que tratam das doenças nasossinusais, tanto especialistas quanto generalistas, sobre as terapêuticas tópicas nasais. Por meio de uma revisão das evidências científicas, a Academia Brasileira de Rinologia vem proporcionar sua visão prática e atualizada sobre as medicações tópicas nasais mais utilizadas, excetuando-se as medicações que possuam antibióticos tópicos na sua formulação.
Corticosteroides tópicos intranasaisOs corticosteroides intranasais são efetivos para o tratamento de rinite alérgica, rinossinusite e polipose nasal1, além de serem eficazes em ampla gama das rinites não alérgicas, como a idiopática, vasomotora e gestacional2.
O aumento do conhecimento sobre a farmacologia dos receptores de glicocorticoides e dos corticosteroides (GCC) possibilitou o desenvolvimento de moléculas especificamente desenhadas para atingir uma atividade localizada e potente, com risco mínimo de efeitos sistêmicos3.
A introdução dos GCC administrados topicamente proporcionou grande melhora do tratamento das doenças das vias respiratórias superiores e inferiores. Sua eficácia clínica pode depender em parte da habilidade na redução da função e infiltração eosinofílica, por inibição da ativação e da viabilidade dos mesmos4-6. Também podem agir reduzindo a liberação de citocinas quimiotáticas na mucosa nasal e células epiteliais dos pólipos7. A potência destes efeitos é menor nos pólipos nasais do que na mucosa nasal, sugerindo que na polipose nasal exista uma resistência inflamatória induzida para o tratamento com esteroides8.
A ação biológica dos GCC é mediada por meio da ativação intracelular dos receptores de glicocorticoides9, que são expressos na maioria dos tecidos e células. Dois tipos de receptores foram identificados nos humanos, GR-alfa e GR-beta, os quais são originários do mesmo gene e que se dividem após a transcrição primária do receptor de glicocorticoide10. Ao se ligar ao hormônio, o GR-alfa aumenta a transcrição anti-inflamatória ou reprime a transcrição genética pró-inflamatória, e exerce a maioria dos efeitos anti-inflamatórios dos GCC por meio de interações proteicas entre os glicoreceptores e os fatores de transcrição, como a AP-1 e o NF-KB. O GR-beta não se liga aos esteroides, mas pode interferir com a função do GR-alfa. Devem existir vários mecanismos responsáveis pela resistência aos efeitos anti-inflamatórios dos GCC, incluindo uma expressão exagerada do GR-beta ou uma expressão diminuída do GR-alfa. Um aumento da expressão do GR-beta foi encontrado em pacientes com pólipos nasais11,12, enquanto uma
downregulation dos níveis de GR-alfa após tratamento com GCC13,14 também foi descrita como uma das possíveis explicações para o fenômeno da resistência secundária aos GCC15. Os efeitos anti-inflamatórios dos GCC podem, teoricamente, ser esperados nas rinossinusites alérgicas e não alérgicas, como, por exemplo, as infecciosas, assim como eosinofilia tecidual também é encontrada nas rinossinusites crônicas ou persistentes16.
Cada GCC tópico tem propriedades moleculares, farmacocinéticas e farmacodinâmicas únicas, que fazem com que as drogas tenham diferenças de ação. Por exemplo, o radical furoato confere aos GCC uma maior potência e seletividade ao receptor mineralocorticoide17. A ciclesonida é uma droga inativa, sendo convertida para o seu metabólito farmacologicamente ativo, a desisobutiril-ciclesonida pelas esterases das vias aéreas superiores e inferiores18. A ciclesonida e a budesonida, esta última apesar de não ser uma pró-droga, após a administração tópica também formam ésteres de ácidos graxos na mucosa nasal, o oleato e palmitato de budesonida, fato que contribui para sua retenção intracelular na mucosa nasal19. Os estudos farmacológicos sobre potência, utilizando apenas o critério de afinidade, geraram uma classificação para os GCC. Os GCC intranasais mais potentes são o furoato de mometasona, o furoato de fluticasona e o propionato de fluticasona20. As cadeias laterais dos ésteres de furoato e propionato proporcionaram a estas moléculas uma alta ação lipofílica, qualidade que pode facilitar a sua absorção pela mucosa nasal e posterior progressão através das fosfolipases de membrana das células. Estes compostos não demonstram absorção sistêmica relevante, com valores menores que 1%, conjuntamente com a ciclesonida21.
Os estudos mostram maiores taxas de absorção sistêmica nos GCC mais antigos, como o dipropionato de beclometasona, acetonido de triamcinolona e budesonida, com biodisponibilidade entre 34% a 49%. Entretanto, sabemos que os estudos de um ano com a mometasona, propionato de fluticasona e budesonida, que avaliaram os potenciais efeitos sistêmicos destas moléculas em crianças, não demonstraram efeitos adversos no eixo hipotálamo-hipófise-adrenal ou no seu crescimento. Em teoria, os medicamentos com menor biodisponibilidade seriam os de preferência, e se aproximam mais dos critérios farmacocinéticos e farmacológicos para a opção terapêutica ideal, mas, na prática, os estudos não confirmam esta diferença, que permanece apenas teórica22-26. Estas drogas são muito úteis no controle dos sintomas e, portanto, podem ser usadas de maneira crônica (Tabela 1).
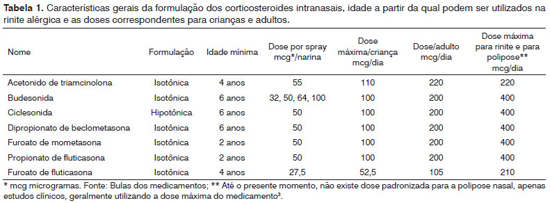
O uso do GCC tópico intranasal é efetivo para a rinite alérgica sazonal, perene, as rinites não alérgicas, inclusive a rinite chamada episódica, pois são medicamentos eficazes para todos os sintomas de rinite incluindo a congestão nasal.
O tempo de início de ação normalmente é maior que os dos anti-histamínicos orais ou intranasais, ocorrendo dentro de 12 horas, mas podendo começar em 3 a 4 horas em alguns pacientes após teste de provocação. Seu efeito pleno demora mais tempo para ser atingido.
Quando comparamos com outras classes de medicamentos, o GCC tópico é mais efetivo que a combinação de anti-histamínico oral e antileucotrieno para a rinite alérgica sazonal e perene. A eficácia é similar aos anti-histamínicos orais para sintomas oculares da rinite alérgica, sendo que o furoato de fluticasona é o mais estudado nos sintomas oculares em pacientes com rinoconjuntivite, mostrando eficácia significativa em comparação com placebo ou semelhante aos anti-histamínicos27,28.
Sem efeitos sistêmicos ou adversos em adultos, também não foram demonstrados efeitos no crescimento em crianças com rinite alérgica perene, nas doses recomendadas. Os efeitos adversos locais são mínimos, mas irritação nasal e sangramento podem ocorrer, assim como perfuração septal foi descrita, mas é extremamente rara. Em relação ao uso em crianças e gestantes, seu efeito é muito similar ao dos adultos. Entretanto, devido às potenciais consequências inesperadas nestas duas populações, deve-se ser mais criterioso na sua administração e prescrição.
Estudos com o uso dos GCC tópicos intranasais em crianças não mostraram efeitos adversos ou níveis de absorção sistêmicos significativos. Em gestantes, existe sempre a preocupação com o embrião, e a associação de fenda palatina, mas até agora não foram relatados efeitos teratogênicos, mas os estudos ainda são escassos. Portanto, deve-se analisar o risco benefício do uso destes medicamentos em gestantes. O único GCC intranasal categoria B do
Food and Drug Administration aprovado para o uso em gestantes é a budesonida29. Além disso, a recomendação é para que seja usada na menor dose possível e pelo menor tempo possível. Em relação ao glaucoma, existem relatos de pacientes com piora da pressão intraocultar com o uso de GCC intranasais. Entretanto, outros estudos não demonstram aparecimento de glaucoma em pacientes com uso crônico de mometasona e ciclesonida. Sugere-se acompanhamento oftalmológico em pacientes com glaucoma candidatos ao uso dos GCC tópicos intranasais até que o conhecimento sobre o tema avance.
Os estudos clínicos sugerem que não existem diferenças de eficácia entre os GCC intranasais, mas a grande maioria deles compara cada droga com o placebo, e são poucos os estudos comparativos entre as diferentes moléculas para avaliar a eficácia.
Tratamento das rinossinusites com gcc tópicosExistem várias indicações para o uso dos GCC tópicos intranasais, nas rinossinusites, desde as doenças agudas até as crônicas (Tabela 2).
Em relação às rinossinusites, há diversos estudos usando GCC tópicos isoladamente ou como medicações coadjuvantes. Existem estudos com a budesonida30-38, mometasona39,40, furoato de fluticasona, propionato de fluticasona41-47, dipropionato de beclometasona48-52 com melhora dos escores de sintomas, em conjunto com antibioticoterapia, com diferença significativa em outros critérios, como radiografias ou tomografias, ou
peak flow nasal e rinometria acústica ou rinomanometria. Existe um estudo mostrando redução significativa da sintomatologia na rinossinusite aguda perante o placebo e antibioticoterapia53.
Os GCC tópicos têm reconhecido efeito na polipose nasal e também nos sintomas associados como obstrução, secreção e espirros, contudo, é menor no olfato. Existe um alto nível de evidência para o efeito redutor do tamanho do pólipo.
Em relação à prevenção, existem evidências muito baixas para o efeito profilático dos GCC nasais na prevenção da rinossinusite aguda recorrente.
O conhecimento científico sobre os GCC, seus efeitos no receptor de glicocorticoides, e os processos de transcrição celular tem progredido, melhorando nosso entendimento sobre esta classe de medicamentos e sua utilização no tratamento.
Apesar desta quantidade de informação, as diferenças clínicas entre os diversos compostos individuais ainda não são claramente aparentes. Como classe, os GCC intranasais demonstram eficácia comparável no tratamento das doenças inflamatórias das vias aéreas superiores.
Os GCC atualmente comercializados chegam próximos a atingir as propriedades farmacocinéticas e farmacodinâmicas ideais para esta classe de medicação para uso tópico nasal, quais sejam:
1. Alta afinidade ao receptor, potência e especificidade à mucosa nasal;
2. Baixa biodisponibilidade sistêmica;
3. Alta taxa de depuração hepática e eliminação sistêmica rápida;
4. Dose única diária.
Entretanto, ainda existe uma procura para moléculas ainda melhores, mais ajustadas a estes critérios.
Anti-histamínicos tópicos nasaisAnti-histamínicos intranasais podem ser considerados para o uso como primeira linha no tratamento para rinite alérgica e não alérgica-não infecciosa54,55, sendo tão eficazes ou mais que os orais de segunda geração para o tratamento da rinite alérgica sazonal56,57, mas, geralmente, menos eficientes que os GCC intranasais para o tratamento da rinite alérgica58. Entretanto, estão associados a um efeito clinicamente significativo na congestão nasal59.
O único anti-histamínico intranasal atualmente disponível no nosso meio é a azelastina, que tem boa eficácia e um rápido início de ação60. A azelastina é aprovada para o tratamento da rinite alérgica sazonal e perene, tendo efeito sobre a congestão nasal, rinorreia, espirros e prurido nasal. Ela foi o primeiro anti-histamínico associado à redução clinicamente significativa da congestão nasal61, além de ser também o primeiro que demonstrou eficácia para a rinite não alérgica. Porém, devido à sua absorção sistêmica, os anti-histamínicos intranasais estão associados com sedação e podem inibir a reação histamínica na pele quando realizado o teste cutâneo1.
Muitos estudos demonstraram que a eficácia na rinite alérgica sazonal é superior ou igual aos anti-histamínicos orais de segunda geração59. Uma revisão sistemática de nove estudos aleatórios controlados comparando anti-histamínicos intranasais com GCC intranasais62 concluiu que os GCC intranasais são mais efetivos no controle dos sintomas nasais da rinite alérgica perene e sazonal. Pode existir benefício significativo com a combinação dos anti-histamínicos intranasais e dos GCC intranasais55, embora não seja usualmente utilizado.
A azelastina é formulada como uma solução aquosa em spray nasal com dose medida de 1 mg/ml. Recomenda-se o uso de sprays em cada narina duas vezes ao dia para pacientes acima de 12 anos. Para crianças a partir de 5 anos, a dose recomendada é a metade. O início de ação é de cerca de 15 minutos para uma significativa melhora clínica, fato que coloca a azelastina como indicação para seu uso no início da crise alérgica1.
Nos estudos clínicos com a azelastina, cerca 19% dos pacientes se queixam de gosto amargo e aproximadamente 11% dos pacientes referem sonolência1.
Os anti-histamínicos intranasais são absorvidos pelo trato gastrointestinal e por este motivo podem suprimir a resposta ao teste cutâneo por até 48 horas, no caso da azelastina63.
Cromoglicato dissódico intranasalO cromoglicato dissódico intranasal é eficaz para alguns pacientes na prevenção e tratamento da rinite alérgica sem associação com efeitos colaterais. Previne a reação imediata alérgica mais do que alivia os sintomas depois que a reação se iniciou64. É também usado para a manutenção do tratamento da rinite alérgica, com início de ação de 4 a 7 dias, porém, a ação completa pode levar semanas65. Para a rinite episódica, o uso imediatamente antes da exposição aos antígenos protege de 4 a 8 horas contra a resposta alérgica imediata66.
Seu mecanismo de ação é por meio da inibição da degranulação de mastócitos sensibilizados, consequentemente prevenindo a liberação dos mediadores da resposta alérgica imediata e da inflamação alérgica. Esta droga tem mecanismo de ação único, e sabe-se que não tem efeito broncodilatador, anti-histamínico ou ações anti-inflamatórias diretas67.
A solução em spray a 4% é indicada para o tratamento da rinite alérgica sazonal e perene. Quando usado para o tratamento dos sintomas de rinite alérgica sazonal, o cromoglicato deve ser iniciado o mais precocemente no início da estação alérgica. O efeito é normalmente notado de 4 a 7 dias após o início do tratamento. Entretanto, os casos mais graves ou os perenes precisam de cerca de duas semanas ou mais para efeito máximo. Os pacientes muito sintomáticos podem precisar de uma combinação com um anti-histamínico e/ou descongestionante durante os primeiros dias de tratamento, pela necessidade de um contato apropriado com a mucosa nasal para ser eficaz1. Em seguida, o tratamento deve ser continuado com uma dose de manutenção que seja efetiva para cada paciente pelo restante da temporada ou período de exposição.
O cromoglicato é eficaz no tratamento da rinite episódica, quando pode ocorrer uma antecipação do contato ou exposição ao alérgeno e, neste caso, parece que o seu início de ação é mais rápido. O efeito protetor do cromoglicato contra a provocação pelo antígeno no nariz persiste por 4 a 8 horas após o seu uso, possibilitando o tratamento preventivo quando a exposição é previsível, como em veterinários alérgicos, por exemplo.
Em estudos controlados, o cromoglicato foi superior ao placebo e, em um estudo duplo cego aleatório controlado com placebo em crianças de 2 a 5 anos, demonstrou alívio dos sintomas da rinite alérgica. Entretanto, em geral, o cromoglicato foi menos eficaz que os GCC intranasais e não foi adequadamente estudado em comparação com os antagonistas de leucotrienos e anti-histamínicos68-70.
O seu maior benefício é um forte perfil de segurança. Efeitos adversos são normalmente leves e locais, incluindo espirros e queimação, sem relatos de crostas ou perfuração septal. Não existem evidências clínicas de que o cromoglicato possa gerar uma
overdose.
Devido ao seu perfil de segurança excelente, sem interação significativa com outras drogas, o cromoglicato pode ser considerado e indicado em crianças pequenas e durante a gestação71,72, podendo ser uma alternativa de grande valia quando outras medicações em spray nasal são contraindicadas ou não toleradas pelos pacientes.
Em relação ao cromoglicato, a seleção correta dos pacientes é de crítica importância. Os artigos de revisão publicados descrevem o papel limitado do cromoglicato no tratamento e prevenção dos sintomas da rinite alérgica71. Não existe evidência de que o cromoglicato possa beneficiar pacientes com rinite não alérgica-não infecciosa (NARES) ou polipose nasal72.
Descongestionantes nasaisA congestão nasal é um dos sintomas que mais trazem desconforto ao paciente com rinite73. Os medicamentos com melhor efeito sobre este sintoma são os descongestionantes, que são drogas simpaticomiméticas que atuam diretamente sobre os vasos de capacitância das conchas nasais.
Dividem-se em orais (pseudoefedrina e fenilefrina) e tópicos intranasais (fenilefrina, nafazolina e oximetazolina), sendo que ambos podem produzir elevação da pressão sanguínea, agitação, cefaleia, ansiedade, insônia, tremores, palpitações, ressecamento da mucosa, retenção urinária em pacientes com hipertrofia prostática, agravamento de glaucoma e tireotoxicose2,74.
Os vasoconstrictores de aplicação tópica têm rápido início de ação, ao redor de 10 minutos. Contudo, se utilizados por mais de 5 a 10 dias poderão acarretar o aparecimento de um quadro de rinite denominado rinite medicamentosa, consequência de seu efeito rebote. A iniciativa ARIA (
Allergic Rhinits and Its Impact on Asthma) não recomenda seu uso em crianças com rinite alérgica, sendo que em adultos por no máximo até 5 dias2.
Deve-se ter cautela com a administração destes fármacos em pacientes que utilizam inibidores da monoamino oxidase (IMAO), anti-hipertensivos, digitálicos e levodopa.
Celulose inerteO pó de celulose é utilizado como espessante de diversas formulações líquidas para aplicação nasal. A celulose natural inerte recentemente ficou disponível no Brasil para uso em rinite.
Embora se saiba que apresenta efeito que dificulta o crescimento bacteriano, não se conhece seu exato mecanismo de ação na rinite alérgica. Acredita-se que quando aplicada sobre a mucosa nasal forme uma película gelatinosa sobre o epitélio. Como apresenta uma maior tensão superficial que o muco, representará uma barreira mais eficaz à penetração de antígenos, que não conseguirão alcançar as células efetoras. Com isto, não teria efeito nos sintomas, mas sim no processo alérgico como um todo, pois reduziria o estímulo ao desenvolvimento da cascata inflamatória alérgica75.
Um estudo avaliando seu efeito na rinite alérgica por pólens demonstrou que, no grupo que utilizou a celulose micronizada, a necessidade de medicação de resgate para o controle dos sintomas nasais foi significantemente menor76.
Além disto, em pacientes com rinite alérgica por ácaros da poeira doméstica seu uso reduziu os sintomas nasais em testes de provocação nasal a estes antígenos77.
Por não ser considerada medicação, a literatura médica científica é escassa, não sendo claros o seu mecanismo de ação, ação na barreira muco-ciliar e posologia.
Soluções salinasO uso de soluções salinas para higiene nasal é referida como recomendação pelos especialistas, porém seu efeito pode ser maior que apenas o de um tratamento coadjuvante1-3. São indicadas para pacientes com rinite alérgica, rinite não alérgica, quadros de rinossinusite aguda e crônica e até condições inespecíficas como a presença de secreção retro-nasal1-3.
Há anos orientamos nossos pacientes a aplicarem soluções de cloreto de sódio isotônicas, ou seja, à concentração de 0,9%. Na década de 90, iniciou-se o uso de soluções salinas hipertônicas cuja concentração de cloreto de sódio é 2% ou 3%. Inicialmente, eram indicadas no pós-operatório das cirurgias nasais, pois facilitavam a remoção de crostas. Recentemente, a literatura médica tem demonstrado que tais soluções também são úteis no controle dos sintomas nasais de pacientes com outras condições clínicas, como é o caso das rinites.
A lavagem nasal com solução salina isotônica é fácil de ser realizada e praticamente não apresenta efeitos clínicos adversos relevantes, sendo bem tolerada e benéfica78. Das queixas dos pacientes, a mais comum é a sensação de irritação local que pode, em certos casos, estar associada à sua concentração ou ao conservante do produto.
O cloreto de benzalcônio é uma substância surfactante composta por amônio quaternário utilizada para prevenir a contaminação bacteriana e preservar a atividade farmacológica de produtos para aplicação tópica nasal, ocular, auricular e cutânea. Sua ação se dá por meio dos efeitos de seus grupos hidrofóbicos e catiônicos sobre a membrana celular de bactérias que aumentam sua permeabilidade, portanto, apresentando ação bactericida79,80.
Estudos
in vitro demonstram que o efeito deletério do cloreto de benzalcônio na frequência de batimento ciliar diminui à medida que o pH cai. Este fato é notado com reduções de pH de 7,4 até 6,0. Como o pH do muco nasal situa-se entre 5,5 e 6,0, é possível supor que este fato interfira na correspondência direta dos resultados
in vitro para as condições fisiológicas das fossas nasais. Até o presente momento, não existem evidências concretas de que o cloreto de benzalcônio seja lesivo à barreira muco ciliar nasal humana
in vivo, contudo, sabe-se que pode ser responsável pelo gosto amargo de certas preparações nasais81,82.
As lavagens nasais com solução hipertônica (3%) mostraram-se seguras e seus efeitos adversos são mínimos. Descrevem-se na literatura alguns casos de irritação local, prurido, queimação, otalgia e sensação de pressão no rosto
83.
O exato mecanismo de ação pelo qual a lavagem nasal, com solução salina, atua permanece sendo foco de estudo. Algumas hipóteses são aventadas, como, por exemplo, ação mecânica de limpeza, capacidade para diluir o muco nasal, indução de rinorreia e atuação sobre a frequência ciliar e consequentemente no
cleareance83.
A aplicação de solução salina aumenta o movimento do muco em direção à rinofaringe por ação mecânica. A justificativa desta tese seria que os pacientes referem ser ela mais eficaz quando realizada de forma forçada, como quando aplicada com seringa, que de forma suave. Além disto, por meio da manobra forçada, as crostas formadas são umidificadas e removidas. Por fim, secreções espessas podem ficar menos viscosas, portanto, acelerando sua remoção84.
Nas doenças nasais, vários mediadores químicos inflamatórios são liberados, ficando dissolvidos no muco e atuando direta e indiretamente sobre a mucosa induzindo edema e alterações do batimento ciliar. A solução salina remove e/ou dilui os mediadores reduzindo o processo inflamatório local e, consequentemente, o edema. Observa-se redução dos níveis de histamina e de leucotrieno C
4 no lavado nasal de pacientes que utilizam solução salina hipertônica85. Além disto, a solução hipertônica, quando aplicada na mucosa nasal, é capaz de induzir a liberação de substância P de forma dose-dependente, sendo esta um importante neuropeptídio capaz de induzir rinorreia86.
O batimento ciliar é um mecanismo relevante na defesa do trato respiratório e sua redução está associada a doenças respiratórias, como rinite, rinossinusite, asma e otite média. Em indivíduos saudáveis, sem queixas nasais, o teste da sacarina (teste
in vivo) demonstra que a solução salina hipertônica (3%) melhora significativamente o batimento ciliar, o mesmo não ocorrendo com a solução isotônica87.
Estudos realizados
in vitro para avaliar a frequência de batimento ciliar mostram que ambas as soluções (isotônicas e hipertônicas) podem interferir. Células ciliadas da mucosa nasal
in vitro expostas a diferentes concentrações de solução salina (0,06%, 0,12%, 0,9%, 3,0% e 7,0%) não têm sua frequência de batimento ciliar alterada, a não ser nas concentrações hipertônicas88. Por outro lado, alguns autores observaram efeito negativo moderado sobre o batimento ciliar com solução isotônica. Ao utilizarem soluções com concentrações maiores (7% e 14%), encontraram uma abolição do batimento ciliar após 5 minutos, que era reversível apenas na solução a 7%89.
Um estudo
in vitro, ou seja, sem a proteção exercida pelo muco nasal, com cultura de células epiteliais nasais humanas comparou os efeitos de soluções hipotônica (0,3%), isotônica e hipertônica (3,0%) na secreção glandular e morfologia celular. As três soluções não apresentaram influência na secreção total de mucina. Contudo, tanto nas concentrações de 0,3% e 3,0% houve lesão epitelial, o que não se encontrou com a isotônica90.
Outro ponto interessante a respeito da higiene nasal realizada com lavagens refere-se ao pH da solução utilizada. Em ensaio duplo cego aleatório, soluções salinas hipertônicas, tamponadas (pH8) ou não, aumentaram significativamente o
clearance muco ciliar nasal, sem diferença estatística entre elas91.
No que tange à utilização de medicamentos tópicos, a tonicidade das soluções nasais influencia sua absorção. A biodisponibilidade de calcitonina aplicada no nariz por meio de solução hipotônica ou hipertônica é quatro a cinco vezes superior ao da formulação isotônica92. Da mesma forma, a ciclesonida tópica nasal, quando aplicada com solução hipotônica, tem sua concentração celular (desciclesonida) aumentada em relação a sua aplicação na forma isotônica93.
Existem três maneiras de se aplicar as soluções salinas. A mais simples utiliza a pressão negativa, onde se coloca a solução salina na palma da mão levando-a ao nariz e realizando uma inspiração forçada para introduzi-la nas fossas nasais. Outra é por meio da pressão positiva exercida por dispositivos que forcem a passagem da solução pelas fossas nasais como, por exemplo, a utilização de seringas e conta-gotas. Por fim, temos disponíveis no mercado aplicadores na forma de spray (jatos contínuos ou não), cujas vantagens incluem a facilidade de armazenar e transportar pelos pacientes94. Cada uma das técnicas tem suas vantagens e desvantagens, sendo muito importante levar em consideração a adesão do paciente.
A realização de tomografia computadorizada, após proceder-se à lavagem com solução salina e contraste iônico, demonstra que a penetração desta nos seios maxilares e etmoidais é maior com as técnicas de pressão positiva e negativa do que com o uso de sprays94. Da mesma forma, o estudo de fluxo aéreo pelas diferentes regiões das fossas nasais mostra que este é muito pequeno nos seios paranasais, que ficam protegidos pelo processo uncinato e concha média, corroborando para menor eficiência dos sprays nasais em alcançá-los95.
Vale ressaltar que tais técnicas se referem à aplicação de solução salina e não de medicamentos na forma de spray nasal. Para estes, recomenda-se ao paciente assoar gentilmente o nariz antes de utilizar a medicação tópica nasal, para facilitar sua entrada. Como nosso objetivo é que os produtos alcancem as conchas nasais, devemos instruí-los a direcionar a ponta do aplicador para a parede lateral das fossas nasais21. De uma maneira prática, orienta-se o paciente a aplicar a medicação na fossa nasal esquerda com a mão direita e vice-versa. Ao pressionar a válvula do aplicador, sugerimos que ele feche a narina contralateral com o dedo enquanto inspire gentilmente o ar durante a aplicação do jato96.
Embora a higiene nasal com solução salina seja recomendada por diversos consensos, a literatura sobre o assunto é pequena, portanto, mais ensaios clínicos e laboratoriais são necessários. Contudo, alguns pontos devem ser observados, como, por exemplo, não utilizar soluções geladas ou quentes. Como seu efeito sobre os sintomas nasais não é imediato, pode haver comprometimento da adesão pelo paciente, porém suas qualidades (custo, baixos efeitos adversos, etc.) justificam plenamente seu uso.
REFERÊNCIAS1. Wallace DV, Dykewicz MS, Bernstein DI, Blessing-Moore J, Cox L, Khan DA, et al.; Joint Task Force on Practice; American Academy of Allergy; Asthma & Immunology; American College of Allergy; Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. The diagnosis and management of rhinitis: an updated practice parameter. J Allergy Clin Immunol. 2008;122(2 Suppl):S1-84. http://dx.doi.org/10.1016/j.jaci.2008.06.003 PMid:18662584
2. Bousquet J, Khaltaev N, Cruz AA, Denburg J, Fokkens WJ, Togias A, et al.; World Health Organization; GA(2)LEN; AllerGen. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008;63 Suppl 86:8-160. http://dx.doi.org/10.1111/j.13989995.2007.01620.x PMid:18331513
3. Fokkens W, Lund V, Mullol J.; European Position Paper on Rhinosinusitis and Nasal Polyps group. European position paper on rhinosinusitis and nasal polyps 2007. Rhinol Suppl. 2007;(20):1-136. PMid:17844873
4. Mullol J, Xaubet A, López E, Roca-Ferrer J, Picado C. Comparative study of the effects of different glucocorticosteroids on eosinophil survival primed by cultured epithelial cell supernatants obtained from nasal mucosa and nasal polyps. Thorax. 1995;50(3):270-4. http://dx.doi.org/10.1136/thx.50.3.270 PMid:7660341 PMCid:1021191
5. Mullol J, Xaubet A, López E, Roca-Ferrer J, Carrión T, Roselló-Catafau J, et al. Effects of topical anti-inflammatory drugs on eosinophil survival primed by epithelial cells. Additive effect of glucocorticoids and nedocromil sodium. Med Clin (Barc). 1997;109(1):6-11.
6. Mullol J, López E, Roca-Ferrer J, Xaubet A, Pujols L, Fernàndez-Morata JC, et al. Effects of topical anti-inflammatory drugs on eosinophil survival primed by epithelial cells. Additive effect of glucocorticoids and nedocromil sodium. Clin Exp Allergy. 1997;27(12):1432-41. http://dx.doi.org/10.1111/j.1365-2222.1997.tb02988.x PMid:9433939
7. Mullol J, Roca-Ferrer J, Xaubet A, Raserra J, Picado C. Inhibition of GM-CSF secretion by topical corticosteroids and nedocromil sodium. A comparison study using nasal polyp epithelial cells. Respir Med. 2000;94(5):428-31. http://dx.doi.org/10.1053/rmed.1999.0756 PMid:10868704
8. Xaubet A, Mullol J, Roca-Ferrer J, Pujols L, Fuentes M, Pérez M, et al. Effect of budesonide and nedocromil sodium on IL-6 and IL-8 release from human nasal mucosa and polyp epithelial cells. Respir Med. 2001;95(5):408-14. http://dx.doi.org/10.1053/rmed.2001.1061 PMid:11392584
9. Leung DY, Bloom JW. Update on glucocorticoid action and resistance. J Allergy Clin Immunol. 2003;111(1):3-22. http://dx.doi.org/10.1067/mai.2003.97
10. Pujols L, Mullol J, Roca-Ferrer J, Torrego A, Xaubet A, Cidlowski JA, et al. Expression of glucocorticoid receptor alpha- and beta-isoforms in human cells and tissues. Am J Physiol Cell Physiol. 2002;283(4):1324-31.
11. Pujols L, Mullol J, Benítez P, Torrego A, Xaubet A, de Haro J, et al. Expression of the glucocorticoid receptor alpha and beta isoforms in human nasal mucosa and polyp epithelial cells. Respir Med. 2003;97(1):90-6. http://dx.doi.org/10.1053/rmed.2002.1406 PMid:12556018
12. Hamilos DL, Leung DY, Muro S, Kahn AM, Hamilos SS, Thawley SE, et al. GRbeta expression in nasal polyp inflammatory cells and its relationship to the anti-inflammatory effects of intranasal fluticasone. J Allergy Clin Immunol. 2001;108(1):59-68. http://dx.doi.org/10.1067/mai.2001.116428 PMid:11447383
13. Knutsson PU, Brönnegård M, Marcus C, Stierna P. Regulation of glucocorticoid receptor mRNA in nasal mucosa by local administration of fluticasone and budesonide. J Allergy Clin Immunol. 1996;97(2):655-61. http://dx.doi.org/10.1016/S0091-6749(96)70311-1
14. Pujols L, Mullol J, Pérez M, Roca-Ferrer J, Juan M, Xaubet A, et al. Expression of the human glucocorticoid receptor alpha and beta isoforms in human respiratory epithelial cells and their regulation by dexamethasone. Am J Respir Cell Mol Biol. 2001;24(1):49-57. http://dx.doi.org/10.1165/ajrcmb.24.1.4024 PMid:11152650
15. Valera FC, Queiroz R, Scrideli C, Tone LG, Anselmo-Lima WT. Evaluating budesonide efficacy in nasal polyposis and predicting the resistance to treatment. Clin Exp Allergy. 2009;39(1):81-8. http://dx.doi.org/10.1111/j.1365-2222.2008.03144.x PMid:19068102
16. Bhattacharyya N, Vyas DK, Fechner FP, Gliklich RE, Metson R. Tissue eosinophilia in chronic sinusitis: quantification techniques. Arch Otolaryngol Head Neck Surg. 2001;127(9):1102-5. PMid:11556861
17. Salter M, Biggadike K, Matthews JL, West MR, Haase MV, Farrow SN, et al. Pharmacological properties of the enhanced-affinity glucocorticoid fluticasone furoate in vitro and in an in vivo model of respiratory inflammatory disease. Am J Physiol Lung Cell Mol Physiol. 2007;293(3):L660-7. http://dx.doi.org/10.1152/ajplung.00108.2007 PMid:17575011
18. Dhillon S, Wagstaff AJ. Ciclesonide nasal spray: in allergic rhinitis. Drugs. 2008;68(6):875-83. http://dx.doi.org/10.2165/00003495200868060-00009
19. Petersen H, Kullberg A, Edsbäcker S, Greiff L. Nasal retention of budesonide and fluticasone in man: formation of airway mucosal budesonide-esters in vivo. Br J Clin Pharmacol. 2001;51(2):159-63. PMid:11259988 PMCid:2014447
20. Derendorf H, Meltzer EO. Molecular and clinical pharmacology of intranasal corticosteroids: clinical and therapeutic implications. Allergy. 2008;63(10):1292-300. http://dx.doi.org/10.1111/j.13989995.2008.01750.x PMid:18782107
21. Belvisi MG, Bundschuh DS, Stoeck M, Wicks S, Underwood S, Battram CH, et al. Preclinical profile of ciclesonide, a novel corticosteroid for the treatment of asthma. J Pharmacol Exp Ther. 2005;314(2):568-74. http://dx.doi.org/10.1124/jpet.105.085217 PMid:15878996
22. van Cauwenberge P, Bachert C, Passalacqua G, Bousquet J, Canonica GW, Durham SR, et al. Consensus statement on the treatment of allergic rhinitis. European Academy of Allergology and Clinical Immunology. Allergy. 2000;55(2):116-34. http://dx.doi.org/10.1034/j.1398-9995.2000.00526.x PMid:10726726
23. Rohatagi S, Hochhaus G, Mollmann H, Barth J, Galia E, Erdmann M, et al. Pharmacokinetic and pharmacodynamic evaluation of triamcinolone acetonide after intravenous, oral, and inhaled administration. J Clin Pharmacol. 1995;35(12):1187-93. http://dx.doi.org/10.1002/j.1552-4604.1995.tb04045.x PMid:8750370
24. Johnson M. Development of fluticasone propionate and comparison with other inhaled corticosteroids. J Allergy Clin Immunol. 1998;101(4 Pt 2):S434-9. http://dx.doi.org/10.1016/S0091-6749(98)70155-1
25. Nave R, Bethke TD, van Marle SP, Zech K. Pharmacokinetics of [14C]ciclesonide after oral and intravenous administration to healthy subjects. Clin Pharmacokinet. 2004;43(7):479-86. http://dx.doi.org/10.2165/00003088-200443070-00004 PMid:15139796
26. Daley-Yates PT, Richards HR. Pharmacokinetic (PK) and pharmacodynamic (PD) relationships for intranasal corticosteroids (INCS). J Allergy Clin Immunol. 2001;107(Suppl 2):S362-S374.
27. Kaiser HB, Naclerio RM, Given J, Toler TN, Ellsworth A, Philpot EE. Fluticasone furoate nasal spray: a single treatment option for the symptoms of seasonal allergic rhinitis. J Allergy Clin Immunol. 2007;119(6):1430-7. http://dx.doi.org/10.1016/j.jaci.2007.02.022 PMid:17418384
28. Martin BG, Ratner PH, Hampel FC, Andrews CP, Toler T, Wu W, et al. Optimal dose selection of fluticasone furoate nasal spray for the treatment of seasonal allergic rhinitis in adults and adolescents. Allergy Asthma Proc. 2007;28(2):216-25. http://dx.doi.org/10.2500/aap.2007.28.2983 PMid:17479608
29. Melvin TA, Patel AA. Pharmacotherapy for allergic rhinitis. Otolaryngol Clin North Am. 2011;44(3):727-39. http://dx.doi.org/10.1016/j.otc.2011.03.010 PMid:21621057
30. Lildholdt T, Rundcrantz H, Lindqvist N. Efficacy of topical corticosteroid powder for nasal polyps: a double-blind, placebo-controlled study of budesonide. Clin Otolaryngol Allied Sci. 1995;20(1):26-30. http://dx.doi.org/10.1111/j.1365-2273.1995.tb00007.x PMid:7788929
31. Qvarnberg Y, Kantola O, Salo J, Toivanen M, Valtonen H, Vuori E. Influence of topical steroid treatment on maxillary sinusitis. Rhinology. 1992;30(2):103-12. PMid:1411095
32. Barlan IB, Erkan E, Bakir M, Berrak S, Basaran MM. Intranasal budesonide spray as an adjunct to oral antibiotic therapy for acute sinusitis in children. Ann Allergy Asthma Immunol. 1997;78(6):598-601. http://dx.doi.org/10.1016/S1081-1206(10)63223-1
33. Lavigne F, Cameron L, Renzi PM, Planet JF, Christodoulopoulos P, Lamkioued B, et al. Intrasinus administration of topical budesonide to allergic patients with chronic rhinosinusitis following surgery. Laryngoscope. 2002;112(5):858-64. http://dx.doi.org/10.1097/00005537200205000-00015 PMid:12150618
34. Lund VJ, Black JH, Szabó LZ, Schrewelius C, Akerlund A. Efficacy and tolerability of budesonide aqueous nasal spray in chronic rhinosinusitis patients. Rhinology. 2004;42(2):57-62. PMid:15224630
35. Holopainen E, Grahne B, Malmberg H, Mäkinien J, Lindqvist N. Budesonide in the treatment of nasal polyposis. Eur J Respir Dis Suppl. 1982;122:221-8. PMid:6958488
36. Tos M, Svendstrup F, Arndal H, Orntoft S, Jakobsen J, Borum P, et al. Efficacy of an aqueous and a powder formulation of nasal budesonide compared in patients with nasal polyps. Am J Rhinol. 1998;12(3):183-9. http://dx.doi.org/10.2500/105065898781390217 PMid:9653476
37. Vendelo Johansen L, Illum P, Kristensen S, Winther L, Vang Petersen S, Synnerstad B. The effect of budesonide (Rhinocort) in the treatment of small and medium-sized nasal polyps. Clin Otolaryngol Allied Sci. 1993;18(6):524-7. http://dx.doi.org/10.1111/j.1365-2273.1993.tb00628.x PMid:8877234
38. Hartwig S, Lindén M, Laurent C, Vargö AK, Lindqvist N. Budesonide nasal spray as prophylactic treatment after polypectomy (a double blind clinical trial). J Laryngol Otol. 1988;102(2):148-51. http://dx.doi.org/10.1017/S0022215100104372 PMid:3279143
39. Meltzer EO, Charous BL, Busse WW, Zinreich SJ, Lorber RR, Danzig MR. Added relief in the treatment of acute recurrent sinusitis with adjunctive mometasone furoate nasal spray. The Nasonex Sinusitis Group. J Allergy Clin Immunol. 2000;106(4):630-7. http://dx.doi.org/10.1067/mai.2000.109056 PMid:11031332
40. Nayak AS, Settipane GA, Pedinoff A, Charous BL, Meltzer EO, Busse WW, et al.; Nasonex Sinusitis Group. Effective dose range of mometasone furoate nasal spray in the treatment of acute rhinosinusitis. Ann Allergy Asthma Immunol. 2002;89(3):271-8. http://dx.doi.org/10.1016/S1081-1206(10)61954-0
41. Dolor RJ, Witsell DL, Hellkamp AS, Williams JW Jr, Califf RM, Simel DL.; Ceftin and Flonase for Sinusitis (CAFFS) Investigators. Comparison of cefuroxime with or without intranasal fluticasone for the treatment of rhinosinusitis. The CAFFS Trial: a randomized controlled trial. JAMA. 2001;286(24):3097-105. http://dx.doi.org/10.1001/jama.286.24.3097 PMid:11754675
42. Parikh A, Scadding GK, Darby Y, Baker RC. Topical corticosteroids in chronic rhinosinusitis: a randomized, double-blind, placebo-controlled trial using fluticasone propionate aqueous nasal spray. Rhinology. 2001;39(2):75-9. PMid:11486442
43. Keith P, Nieminen J, Hollingworth K, Dolovich J. Efficacy and tolerability of fluticasone propionate nasal drops 400 microgram once daily compared with placebo for the treatment of bilateral polyposis in adults. Clin Exp Allergy. 2000;30(10):1460-8. http://dx.doi.org/10.1046/j.1365-2222.2000.00932.x PMid:10998024
44. Penttilä M, Poulsen P, Hollingworth K, Holmström M. Dose-related efficacy and tolerability of fluticasone propionate nasal drops 400 microg once daily and twice daily in the treatment of bilateral nasal polyposis: a placebo-controlled randomized study in adult patients. Clin Exp Allergy. 2000;30(1):94-102. http://dx.doi.org/10.1046/j.13652222.2000.00695.x PMid:10606936
45. Lund VJ, Flood J, Sykes AP, Richards DH. Effect of fluticasone in severe polyposis. Arch Otolaryngol Head Neck Surg. 1998;124(5):513-8. PMid:9604976
46. Dijkstra MD, Ebbens FA, Poublon RM, Fokkens WJ. Fluticasone propionate aqueous nasal spray does not influence the recurrence rate of chronic rhinosinusitis and nasal polyps 1 year after functional endoscopic sinus surgery. Clin Exp Allergy. 2004;34(9):1395-400. http://dx.doi.org/10.1111/j.1365-2222.2004.02044.x PMid:15347372
47. Puhakka T, Mäkelä MJ, Malmström K, Uhari M, Savolainen J, Terho EO, et al. The common cold: effects of intranasal fluticasone propionate treatment. J Allergy Clin Immunol. 1998;101(6 Pt 1):726-31. http://dx.doi.org/10.1016/S0091-6749(98)70301-X
48. Yamada K, Elliott WM, Brattsand R, Valeur A, Hogg JC, Hayashi S. Molecular mechanisms of decreased steroid responsiveness induced by latent adenoviral infection in allergic lung inflammation. J Allergy Clin Immunol. 2002;109(1):35-42. http://dx.doi.org/10.1067/mai.2002.120525 PMid:11799363
49. Mygind N, Pedersen CB, Prytz S, Sørensen H. Treatment of nasal polyps with intranasal beclomethasone dipropionate aerosol. Clin Allergy. 1975;5(2):159-64. http://dx.doi.org/10.1111/j.1365-2222.1975.tb01848.x PMid:1095246
50. Deuschl H, Drettner B. Nasal polyps treated by beclomethasone nasal aerosol. Rhinology. 1977;15(1):17-23. PMid:335482
51. Virolainen E, Puhakka H. The effect of intranasal beclomethasone dipropionate on the recurrence of nasal polyps after ethmoidectomy. Rhinology. 1980;18(1):9-18. PMid:6988929
52. Karlsson G, Rundcrantz H. A randomized trial of intranasal beclomethasone dipropionate after polypectomy. Rhinology. 1982;20(3):144-8. PMid:6753091
53. Meltzer EO, Bachert C, Staudinger H. Treating acute rhinosinusitis: comparing efficacy and safety of mometasone furoate nasal spray, amoxicillin, and placebo. J Allergy Clin Immunol. 2005;116(6):1289-95. http://dx.doi.org/10.1016/j.jaci.2005.08.044 PMid:16337461
54. Berger W, Hampel F Jr, Bernstein J, Shah S, Sacks H, Meltzer EO. Impact of azelastine nasal spray on symptoms and quality of life compared with cetirizine oral tablets in patients with seasonal allergic rhinitis. Ann Allergy Asthma Immunol. 2006;97(3):375-81. http://dx.doi.org/10.1016/S1081-1206(10)60804-6
55. Corren J, Storms W, Bernstein J, Berger W, Nayak A, Sacks H.; Azelastine Cetirizine Trial No. 1 (ACT 1) Study Group. Effectiveness of azelastine nasal spray compared with oral cetirizine in patients with seasonal allergic rhinitis. Clin Ther. 2005;27(5):543-53. http://dx.doi.org/10.1016/j.clinthera.2005.04.012 PMid:15978303
56. Horak F, Zieglmayer UP, Zieglmayer R, Kavina A, Marschall K, Munzel U, et al. Azelastine nasal spray and desloratadine tablets in pollen-induced seasonal allergic rhinitis: a pharmacodynamic study of onset of action and efficacy. Curr Med Res Opin. 2006;22(1):151-7. http://dx.doi.org/10.1185/030079906X80305 PMid:16393441
57. LaForce CF, Corren J, Wheeler WJ.; Berger WE; Rhinitis Study Group. Efficacy of azelastine nasal spray in seasonal allergic rhinitis patients who remain symptomatic after treatment with fexofenadine. Ann Allergy Asthma Immunol. 2004;93(2):154-9. http://dx.doi.org/10.1016/S1081-1206(10)61468-8
58. Ratner PH, Hampel F, Van Bavel J, Amar NJ, Daftary P, Wheeler W, et al. Combination therapy with azelastine hydrochloride nasal spray and fluticasone propionate nasal spray in the treatment of patients with seasonal allergic rhinitis. Ann Allergy Asthma Immunol. 2008;100(1):74-81. http://dx.doi.org/10.1016/S1081-1206(10)60408-5
59. Lee C, Corren J. Review of azelastine nasal spray in the treatment of allergic and non-allergic rhinitis. Expert Opin Pharmacother. 2007;8(5):701-9. http://dx.doi.org/10.1517/14656566.8.5.701 PMid:17376024
60. Patel P, Wilson D, D'Andrea C, Sacks H. Onset of action of azelastine nasal spray compared to mometasone nasal spray and placebo in patients with seasonal allergic rhinitis (SAR). J Allergy Clin Immunol. 2007;119(Suppl 1):144. http://dx.doi.org/10.1016/j.jaci.2006.11.501
61. Newson-Smith G, Powell M, Baehre M, Garnham SP, MacMahon MT. A placebo controlled study comparing the efficacy of intranasal azelastine and beclomethasone in the treatment of seasonal allergic rhinitis. Eur Arch Otorhinolaryngol. 1997;254(5):236-41. http://dx.doi.org/10.1007/BF00874095 PMid:9195148
62. Yáñez A, Rodrigo GJ. Intranasal corticosteroids versus topical H1 receptor antagonists for the treatment of allergic rhinitis: a systematic review with meta-analysis. Ann Allergy Asthma Immunol. 2002;89(5):479-84. http://dx.doi.org/10.1016/S1081-1206(10)62085-6
63. Pearlman DS, Grossman J, Meltzer EO. Histamine skin test reactivity following single and multiple doses of azelastine nasal spray in patients with seasonal allergic rhinitis. Ann Allergy Asthma Immunol. 2003;91(3):258-62. http://dx.doi.org/10.1016/S1081-1206(10)63527-2
64. Altounyan RE. Review of clinical activity and mode of action of sodium cromoglycate. Clin Allergy 1980;10(suppl):481-9.http://dx.doi.org/10.1111/j.1365-2222.1980.tb02162.x PMid:6821510
65. Cox JS, Beach JE, Blair AM, Clarke AJ, King J, Lee TB, et al. Disodium cromoglycate (Intal). Adv Drug Res. 1970;5:115-96. PMid:4099491
66. Pelikan Z, Snoek WJ, Booij-Noord H, Orie NG, de Vries K. Protective effect of disodium cromoglycate on the allergen provocation of the nasal mucosa. Ann Allergy. 1970;28(11):548-53. PMid:5000143
67. Storms W, Kaliner MA. Cromolyn sodium: fitting an old friend into current asthma treatment. J Asthma. 2005;42(2):79-89. http://dx.doi.org/10.1081/JAS-52017
68. Ratner PH, Meltzer EO, Byas L, Block EM. Randomized, double-blind, placebo-controlled evaluation of cromolyn sodium in the treatment of allergic rhinitis in young children. J Appl Res. 2001;1:100-9.
69. Meltzer EO; NasalCrom Study Group. Efficacy and patient satisfaction with cromolyn sodium nasal solution in the treatment of seasonal allergic rhinitis: a placebo-controlled study. Clin Ther. 2002;24(6):942-52. http://dx.doi.org/10.1016/S0149-2918(02)80009-1
70. Schatz M, Zeiger RS, Harden K, Hoffman CC, Chilingar L, Petitti D. The safety of asthma and allergy medications during pregnancy. J Allergy Clin Immunol. 1997;100(3):301-6. http://dx.doi.org/10.1016/ S0091-6749(97)70241-0
71. Kushnir NM. The role of decongestants, cromolyn, guafenesin, saline washes, capsaicin, leukotriene antagonists, and other treatments on rhinitis. Immunol Allergy Clin North Am. 2011;31(3):601-17. http://dx.doi.org/10.1016/j.iac.2011.05.008 PMid:21737044
72. Ratner PH, Ehrlich PM, Fineman SM, Meltzer EO, Skoner DP. Use of intranasal cromolyn sodium for allergic rhinitis. Mayo Clin Proc. 2002;77(4):350-4. http://dx.doi.org/10.4065/77.4.350 PMid:11936930
73. Neffen H, Mello JF Jr, Sole D, Naspitz CK, Dodero AE, Garza HL, et al. Nasal allergies in the Latin American population: results from the Allergies in Latin America survey. Allergy Asthma Proc. 2010;31 Suppl 1:S9-27. http://dx.doi.org/10.2500/aap.2010.31.3347 PMid:20557683
74. Brozek JL, Bousquet J, Baena-Cagnani CE, Bonini S, Canonica GW, Casale TB, et al.; Global Allergy and Asthma European Network; Grading of Recommendations Assessment, Development and Evaluation Working Group. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 revision. J Allergy Clin Immunol. 2010;126(3):466-76. http://dx.doi.org/10.1016/j.jaci.2010.06.047 PMid:20816182
75. Josling P, Steadman S. Use of cellulose powder for the treatment of seasonal allergic rhinitis. Adv Ther. 2003;20(4):213-9. http://dx.doi.org/10.1007/BF02850092
76. Emberlin JC, Lewis RA. A double blind, placebo controlled trial of inert cellulose powder for the relief of symptoms of hay fever in adults. Curr Med Res Opin. 2006;22(2):275-85. http://dx.doi.org/10.1185/030079906X80440 PMid:16466599
77. Emberlin JC, Lewis RA. A double blind, placebo-controlled cross over trial of cellulose powder by nasal provocation with Der p1 and Der f1. Curr Med Res Opin. 2007;23(10):2423-31. http://dx.doi.org/10.1185/030079907X231144 PMid:17767803
78. Harvey R, Hannan SA, Badia L, Scadding G. Nasal saline irrigations for the symptoms of chronic rhinosinusitis. Cochrane Database Syst Rev. 2007;18;(3):CD006394.
79. Marple B, Roland P, Benninger M. Safety review of benzalkonium chloride used as a preservative in intranasal solutions: an overview of conflicting data and opinions. Otolaryngol Head Neck Surg. 2004;130(1):131-41. http://dx.doi.org/10.1016/j.otohns.2003.07.005 PMid:14726922
80. Bernstein IL. Is the use of benzalkonium chloride as a preservative for nasal formulations a safety concern? A cautionary note based on compromised mucociliary transport. J Allergy Clin Immunol. 2000;105(1 Pt 1):39-44. http://dx.doi.org/10.1016/S00916749(00)90175-1
81. Meltzer EO. Formulation considerations of intranasal corticosteroids for the treatment of allergic rhinitis. Ann Allergy Asthma Immunol. 2007;98(1):12-21. http://dx.doi.org/10.1016/S1081-1206(10)60854-X
82. Heatley DG, McConnell KE, Kille TL, Leverson GE. Nasal irrigation for the alleviation of sinonasal symptoms. Otolaryngol Head Neck Surg. 2001;125(1):44-8. http://dx.doi.org/10.1067/mhn.2001.115909 PMid:11458213
83. Brown CL, Graham SM. Nasal irrigations: good or bad? Curr Opin Otolaryngol Head Neck Surg. 2004;12(1):9-13. http://dx.doi.org/10.1097/00020840-200402000-00004
84. Georgitis JW. Nasal hyperthermia and simple irrigation for perennial rhinitis. Changes in inflammatory mediators. Chest. 1994,106(5):1487-92. http://dx.doi.org/10.1378/chest.106.5.1487 PMid:7956408
85. Kim D, Baraniuk JN. Neural aspects of allergic rhinitis. Curr Opin Otolaryngol Head Neck Surg. 2007;15(4):268-73. http://dx.doi.org/10.1097/MOO.0b013e328259c372 PMid:17620902
86. Talbot AR, Herr TM, Parsons DS. Mucociliary clearance and buffered hypertonic saline solution. Laryngoscope. 1997;107(4):500-3. http://dx.doi.org/10.1097/00005537-199704000-00013 PMid:9111380
87. Min YG, Lee KS, Yun JB, Rhee CS, Rhyoo C, Koh YY, et al. Hypertonic saline decreases ciliary movement in human nasal epithelium in vitro. Otolaryngol Head Neck Surg. 2001;124(3):313-6. http://dx.doi.org/10.1067/mhn.2001.113145 PMid:11240998
88. Boek WM, Keleş N, Graamans K, Huizing EH. Physiologic and hypertonic saline solutions impair ciliary activity in vitro. Laryngoscope. 1999;109(3):396-9. http://dx.doi.org/10.1097/00005537-19990300000010 PMid:10089964
89. Kim CH, Hyun Song M, Eun Ahn Y, Lee JG, Yoon JH. Effect of hypo-, iso- and hypertonic saline irrigation on secretory mucins and morphology of cultured human nasal epithelial cells. Acta Otolaryngol. 2005;125(12):1296-300. http://dx.doi.org/10.1080/00016480510012381 PMid:16303677
90. Homer JJ, England RJ, Wilde AD, Harwood GR, Stafford ND. The effect of pH of douching solutions on mucociliary clearance. Clin Otolaryngol Allied Sci. 1999;24(4):312-5. http://dx.doi.org/10.1046/ j.1365-2273.1999.00265.x PMid:10472466
91. Yu S, Zhao Y, Wu F, Zhang X, Lü W, Zhang H, et al. Nasal insulin delivery in the chitosan solution: in vitro and in vivo studies. Int J Pharm. 2004;281(1-2):11-23. http://dx.doi.org/10.1016/j.ijpharm.2004.05.007 PMid:15288339
92. Wingertzahn MA, Sato H, Nave R, Nonaka T, Mochizuki T, Takahama S, et al. Comparison of nasal tissue concentrations in rabbits following administration of hypotonic and isotonic ciclesonide suspensions. J Allergy Clin Immunol. 2005;115(Suppl 2):S126. http://dx.doi.org/10.1016/j.jaci.2004.12.516
93. Olson DE, Rasgon BM, Hilsinger RL Jr. Radiographic comparison of three methods for nasal saline irrigation. Laryngoscope. 2002;112(8 Pt 1):1394-8. http://dx.doi.org/10.1097/00005537-200208000-00013 PMid:12172251
94. Benninger MS, Hadley JA, Osguthorpe JD, Marple BF, Leopold DA, Derebery MJ, et al. Techniques of intranasal steroid use. Otolaryngol Head Neck Surg. 2004;130(1):5-24. http://dx.doi.org/10.1016/j.otohns.2003.10.007 PMid:14726906
95. Mello Junior JF. Higiene nasal e soluções salinas. In: Sole D, Prado E, Mello Junior JF, editores. Rinite Alérgica: conhecendo melhor. 1a edição. São Paulo: Conexão editorial; 2010. p.218-25.
96. Xiong GX, Zhan JM, Jiang HY, Li JF, Rong LW, Xu G. Computational fluid dynamics simulation of air flow in the normal nasal cavity and paranasal sinuses. Am J Rhinol. 2008;22(5):477-82. http://dx.doi.org/10.2500/ajr.2008.22.3211 PMid:18954506
1. Professor Livre-docente pela Faculdade de Medicina da Universidade de São Paulo.
2. Professor Colaborador da Disciplina de Otorrinolaringologia da Universidade de São Paulo.
3. Doutor em Otorrinolaringologia Faculdade de Medicina da Universidade de São Paulo.
4. Profa. Associada da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo.
5. Mestre em Otorrinolaringologia e Doutor em Medicina - Universidade Federal de São Paulo.
6. Professor Coordenador do Programa de Residência Médica em Otorrinolaringologia da Universidade Federal do Rio Grande do Norte.
7. Doutor em Otorrinolaringologia Universidade Federal de São Paulo. Chefe do serviço de Otorrinolaringologia da Santa Casa da Misericórdia do Rio de Janeiro.
8. Doutora em Ciências pela FMUSP, Medica Colaboradora da Disciplina de Otorrinopediatria da Universidade Federal de São Paulo.
9. Doutor em Ciências pela Faculdade de Medicina da Universidade de São Paulo.
10. Professor Adjunto de Otorrinolaringologia da Faculdade de Medicina da Universidade Luterana do Brasil. Membro do Corpo Científico do Departamento de Otorrinolaringologia do Hospital Mount Sinai em Toronto, província de Ontário - Canadá.
11 .Professor Livre-docente pela Universidade Estadual do Rio de Janeiro.
12. Mestre em Otorrinolaringologia pela Universiade Federal do Rio de Janeiro. Professor Colaborador da Disciplina de Otorrinolaringologia da Faculdade de Ciências Médicas da Universidade Estadual do Rio de Janeiro.
13 .Chefe de Clínica do Serviço de Otorrinolaringologia da Policlínica de Botafogo - Rio de Janeiro.
14. Médico Otorrinolaringologista.
15. Professor Associado da Faculdade de Medicina da Universidade Federal de Minas Gerais. Professor Livre Docente da Universidade de São Paulo/Ribeirão Preto.
Endereço para correspondência:
João Ferreira de Mello Jr
Rua Dr. Eneas de Carvalho Aguiar, nº 255, 6º andar
São Paulo - SP. Brasil. CEP: 05403-000
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 30 de novembro de 2011. cod. 8928
Artigo aceito em 7 de outubro de 2012


