INTRODUÇÃONa antiguidade, materiais encontrados na natureza, tais como argila, madeira, chifre e couro de animais, ouro e prata, foram utilizados na tentativa de restaurar perdas de substância da face. Após a Revolução Industrial, em meados do século XVIII, novos materiais começaram a ser sintetizados e alguns, como o papel, parafina, plásticos, acrílicos e finalmente o silicone, passaram a ser utilizados na reconstrução protética das mutilações faciais1. As próteses eram coladas na face ou sustentadas em armações de óculos.
Antes de 1969, época da publicação dos trabalhos de Brånemark, tentativas de implantes que transfixavam a pele e se introduziam em ossos para serem usados como fixação de próteses tiveram resultados negativos, sendo expulsos por infecção em prazo máximo de 3 meses2.
A necessidade clínica por permanentes conexões percutâneas é encontrada não somente para retenção de próteses, mas também em nefrologia, cardiologia, neurologia, urologia, otolaringologia, cirurgia ortopédica, cirurgia plástica reconstrutiva e muitas outras disciplinas clínicas. Isso demonstra claramente a universal necessidade de desenvolver e estabelecer uma conexão percutânea permanente3.
Essa oportunidade surgiu a partir de 1965, com as pesquisas do Prof. P. I. Brånemark, que não conseguiu remover da estrutura óssea de cães uma cápsula de titânio, suporte de uma lente de aumento para observação da circulação sanguínea. Aparentemente, essa cápsula passou a formar um corpo único com o osso. Não tardou para que Brånemark iniciasse uma nova linha de pesquisa que levou aos conceitos revolucionários da osseointegração e se espalhou para várias áreas da medicina e da odontologia. A pesquisa na área odontológica, iniciada em 1965 e publicada em 1969, sobre os implantes de titânio ósseointegrados, visava à reposição de elementos dentários e permitiu uma fixação estável na estrutura óssea dos maxilares, transfixando a gengiva. Em 1977, após o acompanhamento de estudos clínicos durante 12 anos, o conceito de osseointegração foi aceito pelas autoridades médicas da Suécia. Nesse mesmo ano, esse conceito foi extrapolado para outras regiões da face, com o implante transfixando a pele e propiciando um excelente meio de retenção para aparelhos auditivos e próteses faciais. O primeiro caso clínico foi realizado em um indivíduo com problemas de audição, para a retenção de um aparelho auditivo externo. Em 1979, um segundo caso serviu de retenção para a orelha protética de um indivíduo com perda do pavilhão auricular por motivo de ressecção tumoral4,5. Em 1995, o conceito de ancoragem de próteses faciais foi também aceito pelo
Food and Drug Administration, nos Estados Unidos.
Com o advento da osseointegração, entretanto, observou-se uma série de limitações ao seu uso, ocorridas durante os primeiros anos de sua aplicação. Indivíduos portadores de diabete melitus, osteoporose, e, sobretudo, pacientes irradiados, passaram a ser desaconselhados para a implantação. A radioterapia foi originariamente considerada uma contraindicação para a instalação de implantes dentais osseointegrados, conforme publicado em consenso em 19886. Preocupados com os efeitos secundários que a irradiação provocava nos maxilares quando em dosagens superiores a 55 Gy, principalmente a osteoradionecrose, a mesma preocupação foi transferida automaticamente para os implantes extraorais7.
Embora o risco da osteoradionecrose contraindique o uso dos implantes como forma de tratamento de suporte para as próteses, o benefício que eles trazem para a reabilitação dos pacientes é enorme e não deve ser desprezado. Das perdas em pacientes irradiados, as regiões craniofaciais mais atingidas são percentualmente: osso frontal 50%, zigoma 20%, temporal 8%8.
A pobre condição da estrutura óssea, em geral modificada por efeitos de irradiação, pode dificultar a osseointegração. O mínimo trauma causado durante a perfuração óssea para a colocação de um implante pode ser um fator desencadeante para o início da osteoradionecrose, quando realizado muito próximo das sessões de radioterapia. Entretanto, esses efeitos podem ser superados aumentando-se o contato das estruturas ósseas com a superfície dos implantes. Originalmente, o implante extraoral apresentava uma superfície lisa e usinada, que ao longo do tempo foi sendo modificada pela necessidade de se conseguir um aumento do contato entre o osso e o implante. Essas modificações consistiram em jateamento com ácidos, anodização, modificações do desenho dos implantes, com a finalidade de ampliar a sua área externa. O efeito de radioterapia e a osteoporose nos pacientes idosos são citados como as principais causas de falência dos implantes. O estudo de 631 implantes instalados em 107 indivíduos irradiados, em um período de 25 anos, comparado com um grupo controle, mostrou que as falências dos implantes são mais altas após a radioterapia prévia. Altas falências após altas doses de radioterapia ou após longo tempo após irradiação. As regiões cranianas mais afetadas pela radioterapia foram o osso frontal, zigoma, mandíbula e maxila. A menor falência se deu na maxila9.
A oxigenação hiperbárica (HBO), entretanto, é aconselhada para se evitar a osteoradionecrose pós-radioterapia10. Estudos realizados na Universidade de Götemburg mostraram que o oxigênio sob condições hiperbáricas aumenta a angiogênese e o metabolismo, agindo como fator de crescimento e renovação do tecido ósseo. Do ponto de vista clínico, a HBO permite melhor osseointegração dos implantes em ossos irradiados; proteção contra a osteoradionecrose; redução de complicações cirúrgicas e aumento da cicatrização em tecidos irradiados.
Num estudo de revisão de casos ocorrido antes de 1968, foram encontrados índices de osteoradionecrose (ORN) de 11,8%, comparados com 5,4% após 1968. Essa diferença é atribuída ao fato de que muitas unidades de radioterapia trocaram seus aparelhos de orthovoltagem para megavoltagem e supervoltagem nesse período. Os resumos desta última década apontam para 2,1% o percentual de osteoradionecrose em pacientes previamente irradiados. Ao mesmo tempo, dentistas e radioterapeutas tornaram mais conscientes quanto aos riscos secundários da radioterapia, melhorando os cuidados bucais e evitando injeção de adrenalina nas cirurgias pós-radioterapia11.
Tecidos irradiados desenvolvem uma hipovascular-hipocelular-hipóxica tecidual que não revasculariza espontaneamente. Os resultados dos estudos de Marx et al.12 para demonstrar angiogênese após oxigenação normobárica mostraram que a mesma foi totalmente falha, sugerindo que o oxigênio neste caso é uma droga que requer pressão hiperbárica para gerar efeitos terapêuticos sobre tecidos irradiados com hipovascularidade. O nível indicado é de 2,4 atmosferas (ATA). O simples aumento do oxigênio disponível para o tecido celular não parece por si só ser estimulante para a angiogênese. O estímulo parece ser mais da pressão ao qual o oxigênio é submetido. O estímulo da angiogênese é mediado pelos macrófagos que migram e secretam uma variedade de mensagens bioquímicas, incluindo um fator de angiogênese quimiotática em resposta aos altos níveis de lactose que existe nos espaços do ferimento.
Considera-se a osteoradionecrose biologicamente como sendo um complexo de células mortas e a diminuição funcional celular provocada pela transferência de energia de radiação. Um estudo de 536 pacientes permitiu analisar e classificar três condições patofisiológicas para a osteoradionecrose: induzida por trauma inicial; induzida por trauma tardio; e espontânea. Os resultados permitiram estabelecer procedimentos recomendados para retardar a radiação por 21 dias após o ferimento dos tecidos; uma relativa contraindicação para ferir os tecidos durante o curso da radioterapia; uma recomendação para o uso da oxigenação hiperbárica antes do ferimento; e uma forte recomendação para promover higienização dos pacientes irradiados. O intervalo de tempo da irradiação para a cirurgia do implante tem sido considerado importante para a sobrevida dos implantes.
O tempo ideal ainda não foi estabelecido. Do ponto de vista dos indivíduos, a reabilitação imediata é importante e, portanto, quanto mais curto for o tempo entre irradiação e implantação, melhor. Do ponto de vista da biologia tumoral, de 1 a 3 anos após a cirurgia tumoral deverá ser transcorrido até a cirurgia do implante. Do ponto de vista radiobiológico, o ótimo tempo será quando as reações teciduais após radioterapia tenham declinado e a fase cicatricial tenha se estabelecido, isto são 2 a 4 meses após a radioterapia. Quando consideramos a redução de risco por trauma sobre os tecidos irradiados, o tempo ideal será de 6 meses a 1,5 anos após a irradiação13.
No Brasil, os implantes extraorais começaram a ser empregados como elemento de sustentação de próteses na reabilitação de mutilados da face a partir de 1995. Os implantes utilizados na época eram importados e representavam um alto custo para a reabilitação.
Neste estudo, analisamos 59 indivíduos mutilados pela cirurgia de tumores malignos, que receberam implantes extraorais para sustentação de próteses faciais. O nosso objetivo principal foi saber a percentagem de sucesso dos implantes fixados sobre ossos irradiados.
MÉTODOEste estudo foi aprovado pelo Comitê de Ética em Pesquisa em 9 de abril de 2010, sob número 0339/10.
Da análise retrospectiva dos prontuários de 59 indivíduos implantados e reabilitados foram extraídos os seguintes dados: identificação do paciente, instituição onde se realizou o procedimento, idade, gênero, comorbidades, motivo da deformidade, local da deformidade, tratamento cirúrgico, tratamento radioterápico, enxertos pré-implantes, aplicação de oxigenação hiperbárica (HBO) pré-implantes, sucesso da osseointegração.
Foram considerados como critério de inclusão todos os prontuários ou fichas clínicas de indivíduos tratados de tumor maligno e submetidos ao procedimento de fixação de implantes extraorais realizados pela equipe de 1995 a 2010.
Os dados pesquisados foram digitados em planilhas do Excel 2010 for Windows para o adequado armazenamento das informações. As analises estatísticas foram realizadas com o software
Statistical Package for the Social Sciences (SPSS) versão 19.0 para Windows e R-Program versão 2.11.0.
Para as variáveis de natureza quantitativa (numérica) foram calculadas algumas medidas resumo, como média, mediana, valores mínimo e máximo, desvios padrão. As variáveis de natureza qualitativa (categórica) foram analisadas por meio do cálculo de frequência absoluta e relativa (porcentagem).
As análises inferenciais empregadas com o título de confirmar ou refutar evidências encontradas na análise descritiva foram:
Teste de Exato de Fisher ou sua extensão para o estudo da associação entre avaliação final (sucesso e insucesso); tratamento radioterápico antes da instalação do implante (sim, não); dose utilizada no tratamento radioterápico (50 Gy, 60 Gy).Teste de Mann-Whitney (Siegel, 2006) na comparação da avaliação final (sucesso, insucesso) dos implantes.Análise de Sobrevida dos implantes e das próteses está representada pela curva de Kaplan Meyer.
RESULTADOSOs 59 indivíduos que fizeram parte desta pesquisa foram implantados pela mesma equipe profissional.
Foram considerados para análise os 59 casos de ressecção de tumores, cujos tipos celulares encontrados foram 35 (59,3%) carcinoma espinocelular, 15 (25,4%) carcinoma basocelular, dois (3,4%) melanoma, um (1,7%) carcinoma muco-epidermoide, um (1,7%) carcinoma basoespinocelular, um (1,7%) hemangioma, um (1,7%), rabdomiosarcoma um (1,7%), retinoblastoma, um (1,7%), adenocarcinoma e um (1,7%) schwannoma.
Nenhum dos indivíduos submeteu-se à aplicação de oxigenação hiperbárica (HBO).
Quatro (6,7%) indivíduos submeteram-se à quimioterapia, sendo um (1,7%) antes da fixação do implante e três após (5,0%).
Dos 59 indivíduos tratados de câncer, 14 (23,7%) foram irradiados, com doses de 50 Gy para sete indivíduos e 60 Gy para outros sete indivíduos. Quarenta e dois implantes foram instalados nesses 14 indivíduos previamente irradiados. Oito (19,0%) estavam localizados na região auricular, 34(81,0%) estavam localizados na região orbitária. Nenhum se localizava na região nasal. Desses 42 implantes somente dois (4,7%) não se osseointegraram (Tabela 1). A taxa de sucesso foi de 95,3% de implantes osseointegrados.
Quarenta e cinco (76,3%) dos indivíduos não foram irradiados (Tabela 2).
Os resultados inferenciais revelaram que a probabilidade esperada de sucesso dos implantes não está relacionada ao tratamento radioterápico pré (
p = 0,978). Conforme ilustra a Figura 1, as curvas estimadas de sucesso para indivíduos que se submeteram à radioterapia comparado com os que não se submeteram à radioterapia apresentam comportamento muito semelhante.
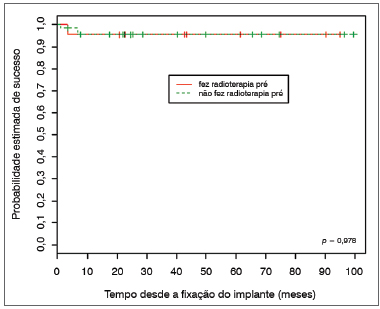
Figura 1. Probabilidade de sucesso dos implantes de acordo com a radioterapia.
Com o advento da osseointegração, atenção especial começou a ser dada aos indivíduos mutilados pela cirurgia do câncer pela possibilidade de se obter uma ancoragem rígida para suportar e reter próteses faciais.
Dos 59 indivíduos que participaram deste estudo, 41 eram do gênero masculino e 18 do gênero feminino.
Os 59 indivíduos tratados de câncer foram considerados neste estudo em razão da possível necessidade de terem sido tratados com radioterapia como elemento coadjuvante do tratamento cirúrgico. Quatorze (21,2%) dos indivíduos estudados foram submetidos a tratamento radioterápico antes da instalação dos implantes, em doses que variaram de 50 Gy para sete (50%) indivíduos e 60 Gy para outros sete (50%) indivíduos.
Embora a HBO seja fator importante para garantir maior possibilidade de osseointegração em indivíduos irradiados, sendo relatada como fator de estímulo à angiogênese e ao metabolismo, agindo como fator de crescimento e renovação do tecido ósseo, evitando a osteoradionecrose11,12, nenhum dos indivíduos submeteu-se à aplicação de HBO. Em nosso meio, sua aplicação tem sido difícil devido ao número limitado de câmaras hiperbáricas disponíveis e alto custo. De 42 implantes colocados em 14 indivíduos irradiados, apenas dois não se osseointegraram, resultando em uma taxa de sucesso de 95,3% (Tabela 1). De 122 implantes colocados em 45 indivíduos não irradiados, apenas seis não se osseointegraram, resultando no sucesso de 95,1% (Tabela 2). Esses índices são bastante próximos, conforme demonstrado na Figura 1.
Esses resultados são bastante coerentes com outros resultados já publicados na literatura14-17. Valores esses considerados bem melhores que os 10% de perdas registradas nos primeiros 20 anos da implantodontia extraoral. Podemos considerar que realmente houve evolução na implantodontia em indivíduos irradiados quanto aos cuidados cirúrgicos, momento pós-cirúrgico adequado para realizar o implante, tipo da superfície do implante, cuidados higiênicos, obediência à dose de radiação, além da evolução da aparelhagem de radioterapia, que passou da orthovoltagem para supervoltagem.
CONCLUSÃOImplantes colocados em superfícies ósseas previamente irradiadas tiveram a mesma taxa de sucesso dos que foram colocados em superfícies ósseas não irradiadas.
REFERÊNCIAS1. Quentin PY. Historie de la Prothèse Maxillo Faciale. In: Benoist M. Réhabilitation et prothèse maxillo faciales. Paris: Julien Prélat; 1978. p.425-45.
2. Von Recum AF, Park JB. Permanent percutaneous devices. Crit Rev Bioeng.1981;5(1):37-77.
3. Wolfaardt J, Tjellström A, Parel SM, Wilkes GH. International Perspective on Treatment Outcomes. In: Brånemark PI, Tolman D. Osseointegration in Craniofacial Reconstruction. Illinois: Quintessence; 1998. p.67-77.
4. Brånemark PI, Adell R, Breine U, Hansson BO, Lindström J, Ohlsson A. Intra-osseous anchorage of dental prostheses. I. Experimental studies. Scand J Plast Reconstr Surg. 1969;3:81.
5. Brånemark PI, Hanson BO, Adell R, Breine U, Lindström J, Hallén O, et al. Osseointegrated implants in the treatment of the edentulous jaw. Experience from a 10-year period. Scand J Plast Reconstr Surg. 1977;16:1-132.
6. National Institute of Health Consensus Development Conference Statement: dental implants. J Am Dent Assoc. 1988;117(3):509,511,513.
7. Esposito M, Hirsh JM, Lekholm U, Thomsen P. Biological factors contributing to failure of osseointegrated oral implants. (II). Etiopathogenesis. Eur J Oral Sci.1998;106(3):721-64.
8. Granström G, Bergström K, Tjellström A, Brånemark PI. A detailed analysis of titanium implants lost in irradiated tissues. Int J Oral Maxillofac Implants. 1994;9(6):653-62.
9. Granström G. Osseointegration in irradiated cancer patients: an analysis with respect to implant failure. J Oral Maxillofac Surg. 2005;63(5):579-85.
10. Donoff RB. Treatment of the irradiated patient with dental implants: the case against hyperbaric oxygen treatment. J Oral Maxillofac Surg. 2006;64(5):819-22.
11. Granström G. Pathophysiological basis for HBO in the treatment of healing disorders in radio-injured normal tissues. In: Proceedings of the 5th ECHM Consensus Conference; 2001; Lisbon. p.85-93.
12. Marx RE, Ehler WJ, Tayapongsak P, Pierce LW. Relationship of oxygen dose to angiogenesis induction in irradiated tissue. Am J Surg. 1994;160(5):519-24.
13. Marx RE, Johnson RP. Studies in the radiobiology of osteoradionecrosis and their clinical significance. Oral Surg Oral Med Oral Pathol. 1987;64(4):379-90.
14. Granström G, Bergström K, Tjellström A. Some considerations regarding the rehabilitation of patients with congenital ear malformations using the osseointegration concept. Transplants and Implants in Otology - III. New York: Kugler;1995. p.91-8.
15. Tolman DE, Taylor PF. Bone anchored craniofacial prosthesis study. Int J Oral Maxillofac Implants. 1996;11(2):159-68.
16. Dutra AK, Dib LL, Curi MM, Oliveira JAP. Aplicação de Implantes Osteointegrados nas Deformidades Craniofaciais. Rev Soc Bras Cir Plast. 2000;15(2):15-26.
17. Karakoca S, Aydin C, Yilmaz H, Bal BT. Survival rates and periimplant soft tissue evaluation of extraoral implants over a mean follow-up period of three years. J Prosthet Dent. 2008;100(6):458-64.
1. Mestre em Ciências (Cirurgião Dentista).
2. Professor Titular da Disciplina de Cirurgia de Cabeça e Pescoço, Departamento de Otorrinolaringologia da Universidade Federal de São Paulo - UNIFESP.
3. Professor Titular de Semiologia da Universidade Paulista - UNIP. Universidade Federal de São Paulo - UNIFESP.
Endereço para correspondência:
Joaquim Augusto Piras de Oliveira
Av. José Galante, nº 671, apto. 51. Vila Suzana
São Paulo - SP. Brasil. CEP: 05642-001
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 28 de junho de 2012. cod. 9300.
Artigo aceito em 14 de dezembro de 2012.


