INTRODUÇÃOAs tonsilas palatinas e faríngea, juntamente com as tonsilas linguais, tubárias e as bandas faríngeas laterais, representam as estruturas mais importantes do anel linfático de Waldeyer1,2. São consideradas órgãos linfoides secundários, que fazem parte do tecido linfoide associado à mucosa (MALT) e que apresentam atividade imunológica principal entre os 4 e 10 anos de idade2.
Estrategicamente localizadas na entrada comum dos sistemas respiratório e digestivo, representam o primeiro contato do organismo com uma variedade de microorganismos e outras substâncias antigênicas presentes nos alimentos e no ar inalado3-6.
Do ponto de vista histológico, organizam-se de uma maneira intimamente relacionada com a sua função no sistema imunológico e são divididas em quatro zonas ou compartimentos: epitélio críptico reticular, área extrafolicular e área folicular, subdividida em zona do manto e centro germinativo1-3.
O epitélio críptico apresenta um sistema de 10 a 30 invaginações tubulares (criptas amigdalianas) desde a sua superfície até a profundidade1-3. Complementando sua função de captação de antígenos, abriga um complexo sistema de células especializadas - células M e células apresentadoras de antígenos (APC), que são responsáveis por aprisioná-los e transportá-los através da barreira epitelial1-3,7.
Na área extrafolicular, as células dendríticas e os macrófagos processam os antígenos e os apresentam aos linfócitos T, que uma vez ativados diferenciam-se em células T citotóxicas ou efetoras (CD8+) e principalmente células T helper (CD4+), as quais passam a produzir citocinas1-3,7.
Nos centros germinativos dos folículos linfoides, estimulados pelas células T helper (CD4+) e citocinas, os linfócitos B iniciam sua proliferação e transformação em plasmócitos, resultando na produção de todos os tipos de imunoglobulinas (IgG: ~65%, IgA: ~20%, IgM, IgD, IgE), expansão dos clones de memória ou migração das células B para sítios distantes. Extravasamento de linfócitos do sangue para as tonsilas palatinas e vice-versa é essencial para a competência imunológica destes órgãos. A zona do manto está normalmente próxima ao epitélio críptico e nela predominam os linfócitos B naive (virgens), os quais exercem provavelmente um papel na imunidade local1-3,7.
O avanço no conhecimento da fisiologia do anel linfático de Waldeyer e as claras evidências da sua contribuição na resposta imunológica local e sistêmica geraram uma série de controvérsias, sobretudo pela maneira pouco criteriosa com que a adenotonsilectomia tem sido realizada ao longo dos anos. Além disso, tornaram imprescindível a pesquisa dos possíveis prejuízos decorrentes da sua remoção cirúrgica.
Mais recentemente, uma diversidade de estudos tem evidenciado que a resolução da obstrução das vias aéreas superiores de pacientes pediátricos após adenotonsilectomia tem levado a uma melhora na qualidade do sono e de parâmetros polissonográficos, clareza e qualidade da voz, crescimento e ganho de peso, enurese noturna, problemas comportamentais e neurocognitivos e melhora global da qualidade de vida8.
Por outro lado, mesmo sendo a adenotonsilectomia o procedimento cirúrgico mais realizado por otorrinolaringologistas em crianças7,9,10, a sua verdadeira repercussão no sistema imune das crianças ainda hoje permanece controversa e poucos são os estudos com um seguimento a longo prazo.
Dessa forma, este estudo teve como propósito verificar o impacto da adenotonsilectomia, a curto e longo prazo, em marcadores séricos de imunidade celular e humoral da população pediátrica.
MÉTODOEsta pesquisa foi realizada por meio de um estudo longitudinal, prospectivo, previamente aprovado pelo Comitê de Ética em Pesquisa, sob número de protocolo 0582/07.
Todos os pais e/ou responsáveis pelos participantes foram informados sobre o caráter voluntário da investigação, objetivos da pesquisa, exames realizados e possíveis riscos à saúde durante o estudo. Após leitura e assinatura do Termo de Consentimento Livre e Esclarecido, os pacientes foram incluídos na pesquisa.
CasuísticaEste trabalho caracterizou-se por ser a fase complementar do estudo previamente apresentado na Jornada de Trabalhos Científicos no ano de 2008. Portanto, constitui-se no seguimento a longo prazo de alguns pacientes envolvidos na fase inicial desta pesquisa.
A fase inicial ocorreu no período entre maio e outubro de 2008, quando foram incluídas 29 crianças entre 2 e 8 anos de idade (16 do sexo masculino e 13 do sexo feminino, com média de idade de 4,5 anos). Os pacientes foram acompanhados por médicos da equipe de Otorrinolaringologia e apresentavam diagnóstico de hipertrofia de tonsilas palatinas e faríngea com indicação de adenotonsilectomia.
Estes pacientes foram inicialmente seguidos por 1 a 2 meses após o procedimento cirúrgico. No final deste período de pós-operatório recente, foram submetidos à avaliação da repercussão da adenotonsilectomia a curto prazo em marcadores séricos de imunidade.
Ainda nesta fase inicial, os 29 pacientes foram divididos em dois grupos de acordo com a faixa etária:
grupo I - crianças menores de 4 anos;grupo II - crianças com 4 anos ou mais.
O presente estudo, que constituiu a fase complementar da pesquisa, foi realizado num intervalo entre 12 a 14 meses após o procedimento cirúrgico. Acompanhamento a longo prazo e nova verificação laboratorial dos efeitos da adenotonsilectomia foram obtidos com sucesso para 14 dos 29 pacientes inicialmente selecionados. Não houve divisão de acordo com a faixa etária neste grupo.
Antecedentes clínicos pessoais ou familiares de imunodeficiência ou doença conhecida de etiologia imunológica foram considerados critérios de exclusão.
Todos os pacientes foram submetidos à adenotonsilectomia, sob anestesia geral e intubação orotraqueal. A tonsilectomia foi realizada com o uso da técnica de dissecção a frio e a adenoidectomia através de curetagem, com curetas de Beckman.
Avaliação laboratorial A avaliação laboratorial envolveu a pesquisa de marcadores séricos de imunidade humoral - níveis de imunoglobulinas A (IgA), M (IgM) e G (IgG) - e celular - contagem absoluta de linfócitos T helper (TCD4+) e citotóxicos (TCD8+).
As amostras foram obtidas em três momentos distintos: período pré-operatório, durante a indução anestésica (1ª amostra); 1 a 2 meses de pós-operatório (2ª amostra) e 12 a 14 meses após a cirurgia (3ª amostra).
Todas as 29 crianças participantes da etapa inicial do estudo foram submetidas à coleta das duas primeiras amostras. Os resultados foram submetidos à análise da variação entre período pré-operatório e pós-operatório recente.
Amostras pareadas para os três diferentes períodos (pré-operatório e pós-operatórios recente e tardio) foram disponíveis para 14 dos 29 pacientes previamente selecionados.
Os níveis séricos de imunoglobulinas foram determinados por meio da técnica de turbidimetria (Wiener
® - Argentina). Subpopulações de linfócitos foram determinadas pelo método de citometria de fluxo (Beckman Coulter
® - Estados Unidos). Níveis séricos de imunoglobulinas e contagem absoluta de linfócitos com variação de dois desvios-padrão acima ou abaixo da média específica para a idade foram considerados normais, tendo como referência uma média dos valores encontrados na literatura internacional, fornecida pelo Laboratório de Patologia Clínica do Complexo Hospitalar Edmundo Vasconcelos, onde foi realizada a análise de todas as amostras obtidas para o estudo.
Análise estatística A análise estatística dos dados obtidos foi realizada com o uso do software SPSS
®, versão 16.0 (Chicago, Estados Unidos). As variações das contagens séricas de linfócitos TCD4+ e TCD8+ e dos níveis séricos de imunoglobulinas A, M e G entre o período pré-operatório e pós-operatório recente (1ª e 2ª amostras/n = 29) foram comparadas utilizando-se o teste t de
Student para amostras pareadas. As amostras foram submetidas ao teste de Kolmogorov - Smirnoff para comprovação de distribuição normal.
Para a comparação entre os três diferentes momentos (1ª, 2ª e 3ª amostras/n = 14) realizada na fase complementar, utilizou-se o teste de comparações múltiplas de Friedman.
Foram consideradas diferenças estatisticamente significantes quando os valores de p foram menores que 0,05 (nível de significância de 5%).
RESULTADOSOs valores séricos dos parâmetros de imunidade celular (contagem absoluta de linfócitos TCD4+ e TCD8+) e humoral (níveis séricos de IgA, IgM e IgG) e a variação média entre os valores dos períodos pré-operatório e pós-operatório recente (1 a 2 meses) dos 29 pacientes encontram-se na Tabela 1. Na fase inicial da pesquisa, a qual envolveu os 29 pacientes, observamos que considerando a variação global entre os períodos pré-operatório e pós-operatório recente (1 a 2 meses após o procedimento cirúrgico) houve um aumento médio de 186 células/mm
3 na contagem absoluta de linfócitos TCD4+, o que foi estatisticamente significante (
p < 0,05). Os linfócitos TCD8+ apresentaram discreta diminuição nos seus valores pós-operatórios, mantendo-se dentro dos valores considerados normais. Os níveis séricos pós-operatórios de IgA, IgM e IgG apresentaram-se discretamente aumentados, embora sem significância estatística (Tabela 1).
Analisando os pacientes separadamente, em grupos de acordo com a faixa etária, nos pacientes do grupo I (< 4 anos), houve diminuição nos valores de linfócitos TCD8+ e IgG, porém, sem significância estatística. Linfócitos TCD4+, IgA e IgM apresentaram-se aumentados com uma diferença também não estatisticamente significante.
Os pacientes do grupo II (4 anos ou mais) apresentaram aumento em todos os parâmetros avaliados, com diferença estatisticamente significante apenas para a contagem absoluta de linfócitos TCD4+, com aumento médio de 230 células/mm
3 (
p < 0,05) (Tabela 2).
A análise dos resultados obtidos do grupo de 14 pacientes dos quais foi possível a obtenção das amostras para os três períodos distintos (pré-operatório e pós-operatório recente e tardio) evidenciou uma redução estatisticamente significante dos níveis de IgA e IgG no período do pós-operatório tardio em comparação aos níveis obtidos nos períodos pré-operatório e pós-operatório recente. No entanto, estes valores permaneceram dentro dos limites considerados normais. Populações de linfócitos TCD4+ e TCD8+ apresentaram discreto aumento dos seus níveis pós-operatórios tardios, porém sem significância estatística (Tabela 3).
Nenhum dos pacientes acompanhados a longo prazo apresentou níveis de imunoglobulinas e/ou linfócitos fora dos limites da normalidade no período pós-operatório tardio. Exceção feita a um paciente, o qual apresentou níveis de IgA discretamente abaixo dos valores de referência mesmo anteriormente a cirurgia, e que mantiveram-se inalterados após 14 meses de seguimento.
DISCUSSÃOA relação entre a adenotonsilectomia e a sua repercussão na função imunológica das crianças tem sido objeto de estudo há algum tempo. Foram analisados os principais estudos relacionados ao tema, publicados na literatura internacional até o presente momento (Tabela 4).
Resultados divergentes têm sido apresentados em relação às alterações pós-operatórias nos níveis de imunoglobulinas a curto e médio prazo.
Veltri et al.22 demonstraram em seu estudo uma queda estatisticamente significante, para valores dentro da variação normal, nos níveis de IgG, enquanto que IgA, IgM e IgD permaneceram inalterados. No estudo de Lal et al.11, da mesma forma, houve diminuição de IgG para níveis não inferiores aos do grupo controle, com
p < 0,01. O mesmo resultado foi encontrado por Friday et al.12, a médio prazo, nos pacientes submetidos à adenotonsilectomia, em comparação aos controles acompanhados clinicamente. Também não houve aumento na frequência de infecções de vias aéreas superiores durante o seguimento deste estudo.
Cantani et al.13 e Kaygusuz et al.9, em diferentes estudos, observaram queda significativa em IgA, IgM e IgG a médio prazo, concluindo que a remoção das tonsilas não é um evento apenas anatômico. Zielnik-Jurkiewicz et al.3 documentaram uma diminuição transitória em IgA, IgM e IgG (1 mês), com posterior recuperação para a normalidade (6 meses). Com um seguimento pós-operatório de 2 meses, El-Ashmawy et al.23 relataram uma diminuição significativa em IgA e IgG.
Ao contrário dos demais, Gogoi et al.14, Redondo et al.24 e Ikinciogullari et al.4 não encontraram alterações significativas nas imunoglobulinas séricas após adenotonsilectomia comparadas aos valores pré-operatórios.
Por outro lado, os efeitos sobre a imunidade celular não foram extensivamente estudados e a disponibilidade de publicações é limitada4.
Baradaranfar et al.6 e Bussi et al.15 demonstraram um aumento pós-operatório significativo na contagem de linfócitos T e B ativados. Ikinciogullari et al.4, ao mesmo tempo que observaram diminuição dos valores de CD19+, apresentaram aumento de CD3+, CD8+CD25+, CD19+CD23+.
Em seu estudo publicado em 2003, Kaygusuz et al.9 encontraram aumento significante de linfócitos TCD4+ em um mês de pós-operatório, assim como diminuição de CD25+.
Queda na contagem de linfócitos TCD8+ foi demonstrada por Zielnik-Jurkiewicz et al.3, com 1 e 6 meses de seguimento, embora para valores comparáveis com seus controles normais.
Os efeitos da adenotonsilectomia sobre os níveis de imunoglobulinas e da população linfocitária a longo prazo tem sido menos pesquisados e poucos são os estudos disponíveis.
Friday et al.12 não encontraram alterações a longo prazo (16 a 30 meses) em IgA, IgM e IgG de pacientes de 1 a 16 anos. Em seu estudo com 106 pacientes e uma média de 6,6 anos de seguimento, Böck et al.16 demonstraram um aumento discreto nos valores de linfócitos CD21+ e uma diminuição nos valores de CD4+ e IgA, todos estatisticamente significantes. No entanto, não houve aumento na incidência de infecções das vias respiratórias superiores.
Em 1996, no Brasil, Mira et al.17 acompanharam 30 pacientes de 3 a 15 anos, em um período de 1 e 12 meses. Houve pequena diminuição dos níveis de imunoglobulinas, porém sem significância estatística.
Akker et al.18 estudaram 123 pacientes em um período de 12 meses após adenotonsilectomia. Queda significante dos níveis de IgA foi observada, mas para valores dentro da normalidade.
No seu estudo publicado em 2009, como um seguimento da primeira fase publicada no ano de 20039, Kaygusuz et al.19 demonstraram, após 54 meses de acompanhamento pós-operatório, aumento nos níveis de linfócitos CD4+ e CD19+ e diminuição nos valores de CD16+56+ e CD25+, estatisticamente significantes. Nenhuma alteração foi encontrada nos níveis de imunoglobulinas a longo prazo.
A produção de anticorpos pelas tonsilas humanas foi primeiramente observada em 1958 e, desde então, estas estruturas têm sido consideradas órgãos linfoides imunologicamente ativos, os quais manifestam anticorpos específicos e atividade de células T e B em resposta a uma variedade de antígenos, desempenhando funções de imunidade humoral e celular3,16.
As afecções relacionadas às tonsilas estão entre os motivos mais comuns de consulta em consultórios de otorrinolaringologistas, sendo os distúrbios respiratórios obstrutivos uma das queixas mais frequentes7.
Sabe-se que o atraso no diagnóstico e tratamento destas afeções podem resultar em consequências importantes, como alteração de comportamento e de medidas antropométricas, alterações craniofaciais decorrentes da respiração bucal, dificuldades de mastigação e deglutição, além de cor pulmonale e insuficiência cardíaca esquerda8.
Por outro lado, nos últimos anos, têm sido bem demonstrados na literatura os benefícios da adenotonsilectomia na saúde de crianças com distúrbios respiratórios obstrutivos relacionados ao sono8.
A despeito de diversas publicações nas últimas três décadas sobre a repercussão da adenotonsilectomia na resposta imunológica de pacientes pediátricos, não existem evidências definitivas de que este procedimento resulte em prejuízo ao sistema imunológico.
No entanto, ainda hoje, é bastante frequente entre familiares de pacientes e inclusive entre médicos, a crença de que a remoção das tonsilas palatinas e faríngea resulte em prejuízo à imunidade das crianças.
Grande parte da controvérsia em torno do possível comprometimento da imunidade local e/ou sistêmica surge ao serem comparados os benefícios da remoção de tecidos cronicamente infectados e/ou hipertrofiados com as possíveis consequências da eliminação de uma fonte importante de defesa do hospedeiro4.
Para facilitar a compreensão de nossos resultados, dividiremos o presente estudo em duas fases: a fase inicial, que estudou a repercussão da adenotonsilectomia a curto prazo (após 1 a 2 meses de pós-operatório) em todas as crianças inicialmente incluídas; e a fase complementar, após 12 a 14 meses da primeira amostra, na qual foi possível o acompanhamento e obtenção dos mesmos parâmetros laboratoriais de 14 destes 29 pacientes.
Considerando-se a análise global dos resultados obtidos na 1ª fase, o presente estudo não demonstrou alterações estatisticamente significantes a curto prazo nos níveis de IgA, IgM e IgG.
Ainda no período pós-operatório recente, em relação à pesquisa dos valores absolutos de linfócitos, foi verificado um aumento da contagem de linfócitos TCD4+, com variação média da diferença pré e pós-operatória de 186 células/mm
3 e valor de
p < 0,05.
Um gráfico ilustra os valores da variação média entre os parâmetros adquiridos na fase inicial (pré-operatório e pós-operatório recente) e seus respectivos valores de
p (Gráfico 1).
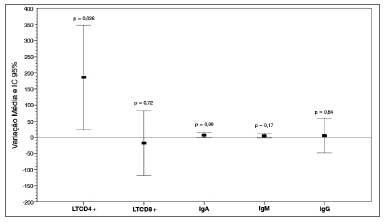
Gráfico 1. Marcadores séricos de imunidade celular e humoral. Variação média pós-operatória e IC 95%. LTCD4+: Linfócitos TCD4+; LTCD8+: Linfócitos T CD8+; IgA: Imunoglobulina A; IgM: Imunoglobulina M; IgG: Imunoglobulina G.
Com a finalidade de investigar o possível impacto da adenotonsilectomia no sistema imune de pacientes de diferentes idades, os 29 pacientes foram ainda divididos em dois grupos: menores de 4 anos (n = 14) e pacientes com 4 anos ou mais (n = 15).
Não foi observado prejuízo importante na função imune em nenhum dos dois grupos isoladamente. Pelo contrário, houve aumento significativo na contagem absoluta de linfócitos TCD4+ no grupo II (Tabela 2), os quais teoricamente estariam sob um maior risco, pois nesta faixa etária a atividade imunológica das tonsilas é mais proeminente.
A análise das amostras obtidas a longo prazo nos 14 pacientes que permaneceram em acompanhamento até a conclusão da fase complementar nos permitiu observar uma diminuição estatisticamente significante nos níveis de IgA e IgG em comparação aos períodos pré e pós-operatório recente (Gráfico 2 e Tabela 3). Diferentemente dos resultados a curto prazo, neste momento não foram verificadas alterações significantes na contagem absoluta de Linfócitos TCD4+ e TCD8+ (Tabela 3).
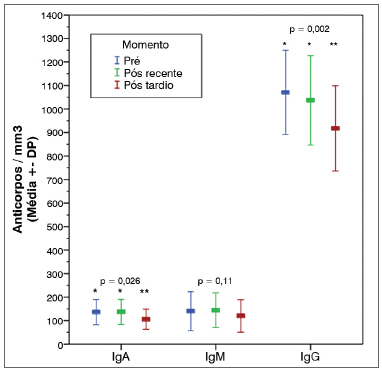
Gráfico 2. Marcadores séricos de imunidade humoral. Variação média nos períodos pré-operatório e pós-operatório recente (1 a 2 meses) e tardio (12 a 14 meses) e IC 95%. IgA: Imunoglobulina A; IgM: Imunoglobulina M; IgG: Imunoglobulina G.
Nossos resultados estão em concordância com a literatura, apesar de grande parte dos estudos disponíveis apresentarem ampla divergência nas suas observações.
De uma forma geral, as publicações mais recentes demonstram diminuição na produção de anticorpos (sobretudo IgA e IgG) apenas transitória e/ou para níveis ainda considerados normais. Apenas duas publicações16,19 estudaram as variações na contagem de linfócitos a longo prazo e nenhuma delas demonstrou repercussão negativa na função imune.
Ainda são incertas as origens destas alterações, mas estas estariam possivelmente relacionadas ao stress cirúrgico, redução do tecido linfoide produtor de imunoglobulina e à redução da carga antigênica3,6,9,12,18,21. Além do mais, estas alterações não têm apresentado repercussão negativa na frequência e gravidade de infecções das vias aéreas superiores, diferentemente do que se pensava há alguns anos12,18,25.
Akker et al.18, em um estudo controlado (adenotonsilectomia x tratamento clínico), sugeriu que o tecido linfoide remanescente pode perfeitamente compensar a perda das tonsilas, uma vez que não houve diferença entre os valores encontrados nos dois grupos.
Pelo contrário, acredita-se que estes órgãos, quando cronicamente inflamados, não desempenham um papel importante na defesa contra infecções das vias aéreas superiores e, sim, são responsáveis por uma inibição da resposta imunológica e pelo aumento e gravidade destas infecções3,7,9.
Linfócitos TCD4+ e TCD8+ estão envolvidos com a regulação da resposta dos linfócitos B, que resulta na produção de imunoglobulinas. Na zona extrafolicular, onde acontece o processamento antigênico, aproximadamente 2/3 dos linfócitos T são TCD4+. Em situações de infecção, no entanto, foi observada uma proliferação importante de células T citotóxicas (TCD8+) com consequente inversão da relação TCD4+/TCD8+, resultando em uma supressão inicialmente local e posteriormente sistêmica da formação de anticorpos. A ativação de linfócitos B é afetada, o que resulta em menor quantidade destas células. Desta forma, também a resposta dos linfócitos TCD4+ dependente de células B poderia encontrar-se prejudicada3,6.
Outros achados importantes na literatura são os relatos de níveis aumentados de imunoglobulinas e linfócitos no período pré-operatório, supostamente devido ao estímulo antigênico crônico nas tonsilas3,9,11,22,25. Alguns autores o consideram um importante marcador de doença, auxiliando na decisão quando é considerada a possibilidade de adenotonsilectomia3,9.
Sob um ponto de vista global, portanto, as evidências atuais apontam para alterações laboratoriais clinicamente insignificantes e falhas em demonstrar que a remoção das tonsilas resulte em comprometimento da função imune. Logo, ainda hoje, a função imunológica das tonsilas palatinas e faríngea e os possíveis efeitos da sua remoção cirúrgica são ainda controversos.
Nossos resultados complementares nos permitem reforçar os achados iniciais de nossa pesquisa de que a adenotonsilectomia não apresenta prejuízo importante à função imunológica, uma vez que os níveis dos marcadores séricos, apesar de diminuídos, mantiveram-se dentro dos limites da normalidade. Desta forma, apresentam um alto grau de relevância no que diz respeito à prática clínica, pois acaba nos servindo como uma ferramenta muito importante na tomada de decisão junto aos familiares e demais médicos assistentes quando é proposto o tratamento cirúrgico.
Finalmente, ao apreciarmos os resultados desta pesquisa, algumas considerações são merecidas. A dificuldade em manter-se o acompanhamento dos pacientes a longo prazo impediu a reavaliação de todas as 29 crianças na fase complementar do estudo. Como motivos principais desta limitação, encontram-se a pandemia de gripe A H1N1 - que apresentou-se de maneira mais intensa no período de coleta da 3ª amostra, afastando a população de ambientes hospitalares - e a melhora importante dos sintomas apresentados anteriormente à cirurgia. Optamos por manter estes pacientes que não completaram todas as fases da investigação na análise das variações a curto prazo, devido ao fato de nos permitirem a obtenção de resultados mais significativos. A redução da amostra inicial também resultou em dificuldades na estratificação dos pacientes por faixa etária nesta fase final.
Ainda, a futura inclusão de um grupo controle contribuiria para a maior legitimidade dos resultados.
CONCLUSÃOEste trabalho nos permitiu concluir que a adenotonsilectomia, a curto e longo prazo, não apresenta repercussão negativa sobre os marcadores séricos de imunidade celular e humoral da população pediátrica. Portanto, caracteriza-se como um procedimento cirúrgico que não resulta em condição de imunodeficiência.
REFERÊNCIAS1. Brandtzaeg P. Immunology of tonsils and adenoids: everything the ENT surgeon needs to know. Int J Pediatr Otorhinolaryngol. 2003;67(Suppl 1):S69-76.
2. Nave H, Gebert A, Pabst R. Morphology and immunology of the human palatine tonsil. Anat Embryol (Berl). 2001;204(5):367-73.
3. Zielnik-Jurkiewicz B, Jurkiewicz D. Implication of immunological abnormalities after adenotonsillectomy. Int J Pediatr Otorhinolaryngol. 2002;64(2):127-32.
4. Ikinciogullari A, Dogu F, Ikinciogullari A. Is immune system influenced by adenotonsillectomy in children? Int J Pediatr Otorhinolaryngol. 2002;66(3):251-7.
5. Richtmeister WJ, Shikhani AH. The physiology and immunology of the pharyngeal lymphoid tissue. Otolaryngol Clin North Am. 1987;20(2):219-28.
6. Baradaranfar MH, Dodange F, Tahipour-Zahir S. Humoral and celular immunity parameters in children before and after adenotonsillectomy. Acta Medica Iranica. 2007;45(5):345-50.
7. Paulussen C, Claes J, Claes G, Jorissen M. Adenoids and tonsils, indications for surgery and immunological consequences of surgery. Acta Otorhinolaryngol Belg. 2000;54(3):403-8.
8. Waitrak BJ, Woolley AL. Pharyngitis and adenotonsilar disease. Em: Cummings CW, Flint PW, editors. Cummings otolaryngology head and neck surgery. 4th ed. Philadelphia: Elsevier Mosby; 2005. p.4135-9.
9. Kaygusuz I, Godekmerdan A, Karlidag T, Keles E, Yalçin S, Aral I, et al. Early stage impacts of tonsillectomy on immune functions of children. Int J Pediatr Otorhinolaryngol. 2003;67(12):1311-5.
10. Faramarzi A, Shamseddin A, Ghaderi A. IgM, IgG serum levels and lymphocytes count before and after adenotonsillectomy. Iran J Immunol. 2006;3(4):187-91.
11. Lal H, Sachdeva OP, Mehta HR. Serum immunoglobulins in patients with chronic tonsillitis. J Laryngol Otol. 1984;98(12):1213-6.
12. Friday GA, Paradise JL, Rabin BS, Colborn DK, Taylor FH. Serum immunoglobulin changes in relation to tonsil and adenoid surgery. Ann Allergy. 1992;69(3):225-30.
13. Cantani A Bellioni P, Salvinelli F, Businco L. Serum immunoglobulins and secretory IgA deficiency in tolsillectomized children. Ann Allergy. 1986;57(6):413-6.
14. Gogoi D, Gupta OP, Agarwal MK, Gupta RM. Immunological evaluation of children undergoing tonsillectomy. J Otolaryngol. 1979;8(6):508-14.
15. Bussi M, Carlevato MT, Galeazzi E, Morra B. Immunological investigations on tonsillar and peripheral blood lymphocytes after adenotonsillectomy. Possible suggestions for phenotypical and functional differences. Acta Otolaryngol. 1991;111(2):379-83.
16. Böck A, Popp W, Herkner KR. Tonsillectomy and the imunne system: a long-term follow up comparison between tonsillectomized and non-tonsillectomized children. Eur Arch Otorhinolaryngol. 1994;251(7):423-7.
17. Mira JGS, Pasinato RC, Mocellin M, Ferreira Neto O, Capasso R, Catam GSA, et al. Efeitos da adenoamigdalectomia no sistema imune humoral. Rev Bras Otorrinolaringol. 1998;64(5):437-40.
18. van den Akker EH, Sanders EA, van Staaij BK, Rijkers GT, Rovers MM, Hoes AW, et al. Long-term effects of pediatric adenotonsillectomy on serum immunoglobulin levels: results of a randomized controlled trial. Ann Allergy Asthma Immunol. 2006;97(2):251-6.
19. Kaygusuz I, Alpay HC, Gödekmerdan A, Karlidag T, Keles E, Yalcin S et al. Evaluation of long-term impacts of tonsillectomy on immune functions of children: a follow-up study. Int J Pediatr Otorhinolaryngol. 2009;73(3):445-9.
20. Del Rio-Navarro BE, Torres S, Barragán-Tame L, De la Torre C, Berber A, Acosta G, et al. Immunological effects of tonsillectomy/ adenoidectomy in children. Adv Exp Med Biol. 1995;371B:737-9.
21. Amorós Sebastiá LI, Ferrer Ramírez MJ, López Mollá C, Carrasco Llatas M, Plá Mochilí A, Díaz Ruiz M, et al. Alteraciones de la inmunidad trás adenoidectomía y amigdalectomía. Acta Otorrinolaryngol Esp. 2004;55(9):404-8.
22. Veltri RW, Sprinkle PM, Keller SA, Chicklo JM. Immunoglobulin changes in a pediatric otolaryngic patient sample subsequent to T & A. J Laryngol Otol. 1972;86(9):905-16.
23. El-Ashmawy, Taha A, Fatt-hi A, Basyouni A, Zaher S. Serum immunoglobulins in patients with chronic tonsillitis. J Laryngol Otol. 1980;94(9):1037-45.
24. Redondo Ventura F, Guerrero Gilaber D, Reina García P, López Aguado D. Serum immunoglubulin levels in tonsillectomized patients. An unsolved mystery. Acta Otorhinolaryngol Esp. 2000;51(5):403-6.
25. Sainz M, Gutierrez F, Moreno PM, Muñoz C, Ciges M. Changes in immunologic response in tonsillectomized children. I. Immunosuppression in recurrent tonsillitis. Clin Otolaryngol Allied Sci. 1992;17(5):376-9.
1. Ex-Fellowship em Otologia e cirurgia otológica na UNIFESP/EPM. Especialista em Otorrinolaringologia pela ABORL-CCF (Médico Otorrinolaringologista do Centro de Otorrinolaringologia do Hospital Professor Edmundo Vasconcelos).
2. Doutor em Otorrinolaringologia pela FMUSP. Ex-Fellowship em Plástica Facial pela FMUSP Especialista em Otorrinolaringologia pela ABORL-CCF (Médico Otorrinolaringologista do Centro de Otorrinolaringologia do Hospital Professor Edmundo Vasconcelos).
3. Médica Residente do Primeiro Ano do Centro de Otorrinolaringologia do Hospital Professor Edmundo Vasconcelos.
4. Doutora em Medicina UNIFESP/EPM. Mestre em Otorrinolaringologia pela UNIFESP/EPM. Especialista em Otorrinolaringologia pela ABORL-CCF. Professora Adjunta do Departamento de ORL-UNIFESP/EPM (Médica Otorrinolaringologista do Centro de Otorrinolaringologia do Hospital Professor Edmundo Vasconcelos).
Centro de Otorrinolaringologia do Hospital Professor Edmundo Vasconcelos.
Endereço para correspondência:
Bibiana Callegaro Fortes
Rua Borges Lagoa, nº 1450, 3º andar do prédio de ambulatórios. Vila Clementino
São Paulo - SP. Brasil. CEP: 04038-905.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 14 de abril de 2012. cod. 9153.
Artigo aceito em 13 de outubro de 2012.


