INTRODUÇÃOLaringomalácia é o colapso cíclico dos tecidos supraglóticos durante a inspiração, levando à obstrução respiratória, que pode ser leve, moderada ou grave; é a causa mais comum de estridor na infância, sendo responsável por 60% a 75% dos casos em crianças de até 2 anos e meio1. Sua real incidência é desconhecida e o diagnóstico dos casos graves é feito predominantemente em hospitais pediátricos terciários2. A fisiopatologia da doença ainda é incerta. Inicialmente, especulava-se que a laringomalácia poderia ser secundária à imaturidade das cartilagens, insuficientes para manter um arcabouço rígido para a laringe, o que foi refutado por dados histopatológicos que não encontraram alterações cartilaginosas nos acometidos3. Atualmente, a teoria mais aceita sugere que o problema seja decorrente de alterações no tônus neuromuscular laríngeo4,5. Tal hipótese é reforçada por estudos com biópsia que demonstram alterações histopatológicas no tecido nervoso laríngeo de crianças com laringomalácia grave6.
Clinicamente, o achado característico é o estridor inspiratório, que é percebido entre a 2ª e a 6ª semana de vida e tende à resolução espontânea até os dois anos de idade1. Até 20% dos pacientes, variando com o nível de complexidade do local de atendimento, apresentam laringomalácia grave, caracterizada por obstrução de vias aéreas superiores, eventos agudos que ameaçam a vida, baixo ganho de peso e retardo de crescimento. Esse é o grupo crianças candidatas à intervenção cirúrgica7.
A supraglotoplastia, descrita inicialmente por Igauer em 1922 8, é, atualmente, o procedimento de escolha e tem diminuído a porcentagem de pacientes submetidos à traqueostomia, a qual por longo período era o único tratamento disponível para evitar eventos fatais. Várias técnicas já foram descritas. Os índices de sucesso podem variar de 38,1% a 100% 9. Parece que o maior fator prognóstico para o insucesso cirúrgico é a presença de comorbidades, que podem estar presentes em até 45% dos casos (doença neurológica, cardiopatia, síndrome ou anomalia genética)10,11. Além disso, por volta de 30% dessas crianças podem apresentar lesões sincrônicas em via aérea12-14 e em torno de 85% a 96% delas podem apresentar edema laríngeo ou refluxo faringolaríngeo15.
As técnicas cirúrgicas atuais baseiam-se na individualização do tratamento de acordo com a alteração anatomofuncional apresentada pelo paciente analisado. Assim, quando o problema é a presença de pregas ariepiglóticas curtas, recomenda-se a ressecção das mesmas, com microtesoura2, laser16 ou microdebridador17. Se há associada redundância de superfície de cobertura mucosa de aritenoides ou de cuneiformes, recomenda-se a supragloplastia, termo mais genérico que engloba a ressecção das pregas ariepiglóticas, da redundância de mucosa e da superfície lateral da epiglote18. Se o fator determinante da obstrução é a epiglote retroprojetada na inspiração, advoga-se o uso da epiglotectomia parcial ou de glossoepiglotopexia19.
Esse trabalho objetiva a descrição de casuística de hospital pediátrico terciário brasileiro, os índices de sucesso da cirurgia e a análise de fatores prognósticos.
MÉTODORealizou-se estudo de coorte histórico, prospectivamente planejado, por meio de revisão de prontuários. Foram incluídos no estudo pacientes com laringomalácia grave submetidos à cirurgia por via endoscópica no período de julho de 2007 a maio de 2011, em um Serviço Terciário de Otorrinolaringologia Pediátrica do sul do país. A amostra foi composta de 20 casos. Estudo aprovado pelo Comitê de Ética e Pesquisa, sob o protocolo número 3682/11.
Para o diagnóstico de laringomalácia, foram avaliadas as seguintes variáveis clínicas: início do estridor, fatores de piora e melhora, antecedentes perinatais, presença de outras anomalias congênitas, dificuldade durante mamadas, ganho de peso, episódios de cianose, além da presença de apneia e de intercorrências que tenham necessitado de internação devido à obstrução respiratória.
Os pacientes com suspeita de laringomalácia foram submetidos à videonasofaringolaringobroncoscopia em centro cirúrgico utilizando endoscópio da marca Machida
®, de 3,2 mm de diâmetro, sob anestesia geral inalatória em ventilação espontânea, sendo inspecionada a via aérea até nível de ramificação secundária de brônquios. Os exames realizados foram gravados em DVD. Classificou-se a laringomalácia em cinco tipos, conforme classificação proposta por Holinger20: tipo I (prolapso de cartilagens cuneiformes aumentadas), II (exagero no formato em ômega da epiglote, que é longa e tubular, curvando-se sobre si na inspiração), tipo III (colapso anterior e medial das aritenoides na inspiração), tipo IV (projeção posterior da epiglote na inspiração) e tipo V (encurtamento das pregas ariepiglóticas), podendo haver mais de um tipo de alteração no mesmo paciente. Nesta casuística não foi utilizada broncoscopia rígida para avaliação dos pacientes.
Os critérios para laringomalácia grave com indicação cirúrgica foram: a) evidência clínica de obstrução respiratória grave, manifestada por crises de cianose com presença ou não de tiragens supracostais e intercostais e/ou
pectus excavatum e/ou b) distúrbios da deglutição com falha no desenvolvimento ponderoestatural.
Na revisão de prontuários, observaram-se, também, a história pregressa dos pacientes, com ênfase nas comorbidades presentes, como presença de clínica de DRGE, doenças neurológicas, alterações cardíacas; conforme protocolo estabelecido antes da coleta de dados (Anexo 1).
Na revisão de prontuários, observaram-se, também, a história pregressa dos pacientes, com ênfase nas comorbidades presentes, como presença de clínica de DRGE, doenças neurológicas, alterações cardíacas; conforme protocolo estabelecido antes da coleta de dados. A presença de refluxo foi considerada naqueles pacientes que apresentavam clínica de refluxo (isto é, vômitos, baixo ganho de peso, desconforto abdominal), já que, em sua maioria, as crianças chegam ao nosso serviço encaminhadas por outros especialistas já com o diagnóstico e/ou tratamento clínico para DRGE. Além disso, na prática clínica de nossa instituição, a pHmetria não é realizada em todos os pacientes em avaliação para de DRGE, uma vez que exige internação do paciente, tornando tal exame indisponível para todas as crianças.
Técnica Cirúrgica e SeguimentoAs cirurgias foram realizadas sob anestesia geral inalatória (sevoflorano) e endovenosa (propofol e fentanil) sem utilização de intubação orotraqueal em 14 casos. Dos seis pacientes restantes, um era traqueostomizado e cinco foram intubados devido a suas comorbidades ou por dificuldade de manutenção de plano anestésico durante o procedimento.
A exposição laríngea era obtida por meio de laringoscopia direta de suspensão (laringoscópio de Parsons) adaptada ao tamanho do paciente. Um cateter de oxigênio era posicionado em região supraglótica, próximo às pregas vocais, sob visualização direta. Sob microscopia era realizada hemostasia primária, colocando-se algodões reparados embebidos em solução de adrenalina 1:9000 junto às pregas ariepiglóticas e cartilagens aritenoides. A seguir, era realizada incisão de pregas ariepiglóticas bilateralmente, associada à ressecção dos tecidos moles supraglóticos, quando redundantes, utilizando-se micropinças e microtesouras (instrumentos frios) próprias para microlaringoscopia pediátricas modelo Karl Storz. Em um caso foi realizada glossoepiglotopexia, utilizando-se cautério monopolar para revitalizar a base da língua e a face lingual da epiglote, com finalidade de produção de sinéquia. Por fim, era realizada cuidadosa revisão da hemostasia, com aspiração de eventual sangramento e colocação novamente, se necessário, de algodões com solução de adrenalina, retirados ao final da microlaringoscopia.
No pós-operatório imediato, todos pacientes eram encaminhados para observação na Unidade de Tratamento Intensivo Pediátrica (UTIP), sempre que possível extubados. Corticoterapia sistêmica e medicação antirrefluxo foram instituídos rotineiramente.
Os pacientes recebiam alta hospitalar quando estabelecida via oral adequada e ventilação espontânea, sem necessidade de oxigenioterapia suplementar. Corticoterapia oral em doses regressivas era mantida por uma semana, bem como terapia antirrefluxo. No seguimento ambulatorial pós-operatório, tais medicações eram retiradas conforme a evolução favorável do paciente. Os pacientes eram acompanhados em ambulatório até tornarem-se assintomáticos com critério de alta; aqueles com evolução desfavorável eram submetidos à avaliação complementar com nova videonasofaringolaringobroncoscopia, sendo a conduta individualizada conforme os achados.
Nesta casuística, o diagnóstico de doença do refluxo gastroesofágico foi feito com base na história clínica. Não se realizou pHmetria antes do iniciado o tratamento antirrefluxo, exceto em um caso, que, ao ser avaliado, já tinha realizado o exame por indicação da equipe de pediatria clínica assistente.
Análise EstatísticaA análise dos dados foi feita com o pacote estatístico R versão 2.12.2 (R Development Core Team [2010]) e com a planilha eletrônica Microsoft Excel 2007. Todos os testes foram realizados assumindo um erro alfa de 5%. Os dados foram analisados com testes descritivos e utilizou-se um modelo de regressão logística (Agresti [2007]) para avaliar a influência das variáveis idade, tipo de laringomalácia, presença lesões sincrônicas em vias aéreas, presença de refluxo e presença de comorbidades no prognóstico da supraglotoplastia. Para fins de adequação estatística ao tamanho amostral, os desfechos "resolução completa sintomática" e "manutenção de estridor leve ocasional" foram agrupados em desfecho favorável e comparados ao desfecho desfavorável equivalente à manutenção de sintomas de gravidade e/ou necessidade de traqueostomia. Optou-se por não avaliar o tipo de cirurgia como fator prognóstico devido à pequena variância de tipo de procedimento entre os pacientes.
RESULTADOSForam incluídos no estudo os 20 pacientes submetidos à supraglotoplastia por laringomalácia grave no período de julho de 2007 a maio de 2011, sendo 13 (65%) do sexo masculino. A idade dos pacientes na data do procedimento cirúrgico variou de 12 dias a 31 meses, apresentando média de 6,32 meses (DP ± 6,473 meses) (Tabela 1).
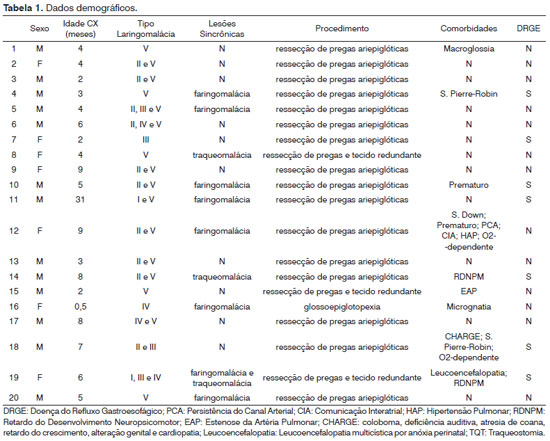
Dos pacientes analisados, sete (35%) apresentavam alguma comorbidade neurológica, cardíaca, craniofacial ou síndrome genética associada. Entre os casos com comorbidades, um (5%) era portador de Sequência de Pierre-Robin, um era prematuro, um apresentava retardo de desenvolvimento neuropsicomotor, um era portador de Síndrome de Down (além de patência de canal arterial, comunicação interatrial e hipertensão pulmonar), um apresentava Sequência de Pierre-Robin e associação CHARGE e um era portador de retardo do desenvolvimento neuropsicomotor e leucoencefalopatia multicística por anóxia perinatal. O refluxo gastroesofágico esteve presente em seis das crianças com as comorbidades acima citadas, sendo que somente um paciente analisado apresentava refluxo gastroesofágico isolado (Tabela 1).
Quanto aos achados endoscópicos, foram observadas associações entre diferentes tipos de laringomalácia (60%); considerando-se os tipos isolados, o mais comumente encontrado foi o V (30%). Oito pacientes (40%) apresentavam faringomalácia associada à laringomalácia e em três (15%) evidenciou-se traqueomalácia durante a endoscopia (Tabela 1).
Considerando-se o tipo de procedimento realizado, 15 pacientes (75%) foram submetidos à ressecção bilateral das pregas ariepiglóticas; em quatro crianças (20%) associou-se ressecção de mucosa redundante e em uma (5%) foi realizada apenas glossoepiglotopexia (Tabela 1).
Após o procedimento, 11 crianças (55%) apresentaram-se assintomáticas, cinco crianças (25%) permaneceram com estridor leve ocasional e dois pacientes (10%) apresentaram manutenção dos sintomas de gravidade, necessitando de traqueostomia; esses dois pacientes foram a óbito no pós-operatório tardio por complicações pulmonares (Tabela 2).
A média de acompanhamento pós-operatório dos pacientes foi de 5,66 meses (DP ± 4,82), variando de 15 dias a 17 meses; dois pacientes (10%) perderam o acompanhamento, pois não compareceram às consultas pós-operatórias.
Na determinação do valor prognóstico das variáveis idade, tipo de laringomalácia, lesões sincrônicas em vias aéreas, presença de DRGE e presença de comorbidades no desfecho da supraglotoplastia, a única variável que atingiu significância estatística foi a presença de comorbidades associadas (
p < 0,05; Tabela 3). A ausência de comorbidades esteve associada a uma redução de 48,7% de haver um desfecho com manutenção dos sintomas de gravidade e/ou necessidade de traqueostomia após supraglotoplastia em relação àqueles pacientes que possuíam comorbidades.
DISCUSSÃOA presente investigação demostrou a eficácia da supraglotoplastia na resolução da laringomalácia em pacientes selecionados. Outros autores já haviam demonstrado os benefícios desse procedimento cirúrgico em séries de casos. Em 1922, Igauer descreveu o primeiro procedimento cirúrgico na laringe supraglótica para correção de laringomalácia, com ressecção parcial da epiglote8. Lane et al.21, em 1984, excisaram as porções laterais da epiglote e cartilagens corniculadas, relatando melhora importante da laringomalácia em um lactente de 3 meses. Já em 1985, Seid et al.16 descreveram a excisão das pregas ariepiglóticas, seguidos por trabalho de Zalzal et al.19, em 1987, que demonstraram eficácia de procedimento similar em 10 pacientes. Na literatura nacional, existem poucos estudos relatando a experiência de hospitais terciários com a supraglotoplastia para laringomalácia grave22-25.
A laringomalácia é a causa mais comum de estridor congênito. Em estudo prévio, Lubianca et al.26 demonstraram ser a laringomalácia responsável por 40,8% dos casos de estridor avaliados com videofibronasolaringoscopia e por até 58% dos casos de estridor abaixo de 30 meses de idade avaliados por esse exame. No presente estudo, a presença de estridor foi o sintoma mais comum que levou ao diagnóstico de laringomalácia, tendo esse sido feito pela videonasofaringolaringoscopia em 100% dos casos. Tal exame também se mostrou importante para o diagnóstico de lesões associadas em vias aéreas, pois a presença delas também teve participação num pior desfecho pós-operatório, determinando a necessidade de traqueostomia ou outros procedimentos cirúrgicos associados para alívio sintomático. No estudo de Manusco et al.14, aproximadamente 19% de 90 pacientes submetidos à avaliação intraoperatória de toda a via aérea apresentavam lesão sincrônica em via aérea superior ou inferior. No presente estudo, oito crianças (40%) apresentavam faringomalácia associada à laringomalácia e três (15%) pacientes apresentavam traqueomalácia associada.
A indicação de supraglotoplastia para crianças com laringomalácia grave no presente estudo baseou-se na avaliação clínica associada aos achados da videofibronasofaringolaringoscopia. Os critérios clínicos de indicação de gravidade utilizados foram evidência clínica de obstrução respiratória grave. Essa avaliação tem sido a rotina na maioria dos serviços para indicação de supraglotoplastia. Mais recentemente, estudos têm sugerido que a polissonografia possa ser instrumento de auxílio para critérios de laringomalácia grave24,27,28. No estudo brasileiro de Avelino et al.22, entretanto, a polissonografia não mostrou ser um parâmetro importante, nem para o acompanhamento clínico nem para a indicação cirúrgica, tendo os parâmetros baixo ganho ponderal e
pectus excavatum sido preditores de gravidade da laringomalácia. Até o momento, não há evidências que suportem o uso rotineiro desse exame na avaliação diagnóstica e na determinação de gravidade ou indicação cirúrgica. Nessa casuística, nenhuma das crianças foi submetida ao estudo polissonográfico para indicação cirúrgica.
A abordagem cirúrgica foi individualizada conforme os achados da videofibronasofaringolaringoscopia, realizando-se o procedimento menos invasivo necessário para alívio das principais alterações anatômicas a fim de evitar as complicações cirúrgicas descritas na literatura9. Já foi demonstrado que a maioria das complicações está relacionada diretamente à extensão da cirurgia, à quantidade de tecido excisado e ao modo de excisão. A divisão simples das pregas ariepiglóticas e a supraglotoplastia unilateral parecem ser os procedimentos de menor morbidade e parecem ter a mesma eficácia que outros procedimentos mais elaborados9,29,30. Na presente investigação, o procedimento predominantemente realizado foi a ressecção bilateral de pregas ariepiglóticas, e não se observaram complicações menores como granulomas, formação de sinéquias e aspiração, nem complicações maiores como estenose. Além disso, a taxa de sucesso cirúrgico, considerando como evolução favorável o grupo dos pacientes que teve resolução completa dos sintomas e o grupo que manteve estridor leve ocasional sem sintomas de gravidade, foi de 80%. Esse resultado assemelha-se ao encontrado por Kelly & Gray31, por Loke et al.29 e por Zafereo et al.27 adotando abordagens também minimamente invasivas. Nenhum dos nossos pacientes foi submetido à nova supraglotoplastia para ampliação de excisão, provavelmente porque a excisão de ambas as pregas ariepiglóticas curtas foi realizada de rotina.
A idade média dos pacientes foi 6,32 meses (+-6,47). Denoyelle et al.9 encontraram idade média de 3 meses, numa série de 136 casos submetidos à supraglotoplastia. Toyton et al.32 descreveram 100 casos consecutivos de crianças com laringomalácia grave submetidas à supraglotoplastia, sendo que dessas aproximadamente 50% apresentavam idades abaixo de 3 meses. Hoff et al.10 avaliaram a eficácia da supraglotoplastia correlacionando a idade e as comorbidades associadas dos pacientes ao desfecho. Encontraram que casos com comorbidades neurológicas, cardíacas e síndromes genéticas associadas apresentavam idade significativamente superior à de casos sem comorbidades associadas, bem como pior desfecho pós-operatório e a necessidade de um maior número de cirurgias revisionais ou traqueostomia pós-operatória. Além disso, ainda observaram que pacientes com diagnóstico de laringomalácia grave em uma idade menor que 2 meses tinham uma maior taxa de cirurgia revisional. Acredita-se que casos de diagnóstico em idade mais tardia estiveram associados à presença de outras comorbidades, bem como à dificuldade de acesso a serviços terciários observada no nosso país. O estudo brasileiro de Fraga et al.25 reforça essa hipótese, pois encontraram uma idade média de 11,5 meses para diagnóstico e indicação cirúrgica.
A presença de comorbidades associadas parece ser o fator determinante para falha terapêutica. Em nosso estudo, sete crianças (35%) apresentavam comorbidades associadas, entre elas malformações craniofaciais, doenças neurológicas, cardíacas e síndromes genéticas. A variável presença de comorbidades associadas foi a única que apresentou correlação estatística significativa (
p < 0,05) com o desfecho desfavorável de manutenção dos sintomas de gravidade ou necessidade de traqueostomia. De acordo com o estudo de Senders et al.33, a presença de comorbidades determinou pior desfecho a curto, médio e longo prazo do pós-operatório. No estudo de Denoyelle et al.9, a comparação entre as taxas de sucesso, de complicações, de recorrência e de estenose supraglótica entre um grupo com laringomalácia isolada e outro com comorbidades associadas demonstrou ser a taxa de sucesso cirúrgico a única variável influenciada pela presença de comorbidades, não havendo diferença entre as complicações e recorrência entre os dois grupos. No estudo de Hoff et al.10, a presença de comorbidades cardíacas, neurológicas ou síndromes genéticas também foi determinante de taxa maior de cirurgia revisional e traqueostomia.
As desordens neurológicas parecem ser as comorbidades com pior prognóstico cirúrgico. Em nosso meio, Fraga et al.25 comparam crianças com e sem desordens neurológicas e observaram que 50% daquelas com desordens neurológicas necessitaram de traqueostomia e outros 50% tiveram persistência sintomática. Em outro estudo, Schroeder et al.12 também obtiveram uma taxa de 55% de cirurgias revisionais em crianças com desordens neurológicas comparado a 5% nas sem tais alterações.
A presença de lesões sincrônicas em vias aéreas não foi fator prognóstico com significância estatística para pior desfecho cirúrgico, bem como a presença de um diagnóstico de DRGE. Considerando que a pHmetria não foi um exame padronizado para todos os pacientes para o diagnóstico de DRGE, essa variável pode ter sido subdiagnosticada. Belmont et al.11 e, posteriormente, Mathews et al.15 sugeriram ser a relação entre o refluxo e laringomalácia tanto causal em alguns pacientes, como de adjuvância na exacerbação da laringomalácia em outros. Além disso, Hadfield et al.34, em estudo que avaliou com pHmetria o refluxo pré e pós-ariepiglotoplastia, mostraram que o alívio da obstrução da via aérea superior levou à diminuição do refluxo. Dados sobre a manutenção de medicação antirrefluxo no pós-operatório tardio não estiveram disponíveis adequadamente para análise, tornando impossível a determinação do papel da supraglotoplastia na resolução do refluxo gastroesofágico. Esforços são necessários para que uma rotina de avaliação de DRGE seja padronizada a fim de determinar sua real participação na laringomalácia.
CONCLUSÃOA supraglotoplastia com ressecção das pregas ariepiglóticas bilateral é um procedimento seguro na criança, proporcionando melhora significativa da laringomalácia grave em pacientes sem comorbidades associadas.
REFERÊNCIAS1. Holinger LD. Etiology of stridor in the neonate, infant and child. Ann Otol Rhinol Laryngol. 1980;79(5 Pt 1):397-400.
2. Jani P, Koltai P, Ochi JW, Bailey CM. Surgical treatment of laryngomalacia. J Laryngol Otol. 1991;105(12):1040-5.
3. Chandra KR, Gerber ME, Holinger LD. Histological insight into the pathogenesis of severe laryngomalacia. Int J Pediatr Otorhinolaryngol. 2001;61(1):31-8.
4. Archer SM. Acquired flaccid larynx. A case report supporting the neurologic theory of laryngomalacia. Arch Otolaryngol Head Neck Surg. 1992;118(6):654-7.
5. Thompson DM. Abnormal sensorimotor integrative function of the larynx in congenital laryngomalacia: a new theory of etiology. Laryngoscope. 2007;117(6 Pt 2 Suppl 114):1-33.
6. Munson PD, Saad AG, El-Jamal SM, Dai Y, Bower CM, Richter GT. Submucosal nerve hypertrophy in laryngomalacia. Laryngoscope. 2011;121(3):627-9.
7. Roger G, Denoyelle F, Triglia JM, Garabedian EN. Severe laryngomalacia: surgical indications and results in 115 patients. Laryngoscope. 1995;105(10):1111-7.
8. Igauer S. Epiglottidectomy for the relief of congenital laryngeal stridor, with report of a case. Laryngoscope. 1922;32(1):56-9.
9. Denoyelle F, Mondain M, Gresillon N, Roger G, Chaudre F, Garabedian EM. Failures and complications of supraglottoplasty in children. Arch Otolaryngol Head Neck Surg. 2003;129(10):1077-80.
10. Hoff SR, Schroeder JW Jr, Rastatter JC, Holinger LD. Supraglottoplasty outcomes in relation to age and comorbid conditions. Int J Pediatr Otorhinolaryngol. 2010;74(3):245-9.
11. Belmont JR, Grundfast K. Congenital stridor (laryngomalacia) etiologic factors and associates disorders. Ann Otol Rhinol Laryngol. 1984;93(5 Pt 1):430-7.
12. Schroeder JW Jr, Bhandarkar ND, Holinger LD. Synchronous airway lesions and outcomes in infants with severe laryngomalacia requiring supraglottoplasty. Arch Otolaryngol Head Neck Surg. 2009;135(7):647-51.
13. Dickson JM, Richter GT, Meinzen-Derr J, Rutter MJ, Thompson DM. Secondary airway lesions in infants with laryngomalacia. Ann Otol Rhinol Laryngol. 2009;118(1):37-43.
14. Mancuso RF, Choi SS, Zalzal GH, Grundkast KM. Laryngomalacia. The search for the second lesion. Arch Otolaryngol Head Neck Surgery. 1996;122(3):302-6.
15. Mathews BL, Little JP, Mcguirt WF Jr, Koufman JA. Reflux in infants with laryngomalacia: results of 24-hour double-probe pH monitoring. Otolaryngol Head Neck Surg. 1999;120(6):860-4.
16. Seid AB, Park SM, Kearns MJ, Gugenheim S. Laser division of the aryepiglottic folds for severe laryngomalacia. Int J Pediatr Otorhinolaryngol. 1985;10(2):153-8.
17. Zalzal GH, Collins WO. Microdebrider-assisted supraglottoplasty. Int J Pediatr Otorhinolaryngol. 2005;69(3):305-9.
18. Solomons NB, Prescott CA. Laryngomalacia. A review and the surgical management for severe cases. Int J Pediatr Otorhinolaryngol. 1987;13(1):31-9.
19. Zalzal GH, Anon JB, Cotton RT. Epiglottoplasty for the treatment of laryngomalacia. Ann Otol Rhinol Laryngol. 1987;96(1 Pt 1):72-6.
20. Holinger LD. Congenital Laryngeal Anomalies. In: Holinger LD, Lusk RP, Green CG. Pediatric laryngology and bronchoesophagology. Philadelphia: Lippincott-Raven Publishers; 1997. p.137-64.
21. Lane RW, Weider DJ, Steinem C, Marin-Padilla M. Laryngomalacia. A review and case report of surgical treatment with resolution of pectus excavatum. Arch Otolaryngol. 1984;110(8):546-50.
22. Avelino MAG, Liriano RYG, Fujita R, Pignatari S, Weckx LLM. Management of laryngomalacia: experience with 22 cases. Braz J Otorhinolaryngol. 2005;71(3):330-4.
23. Oliveira RC, Molina FD, Assis CM, Coraçari AR, Maniglia JV. Laringomalácia: experiência com manejo cirúrgico da Faculdade de Medicina de São José do Rio Preto. Braz J Otorhinolaryngol. 2003;69(1):16-8.
24. Valera FC, Tamashiro E, de Araújo MM, Sander HH, Küpper DS. Evaluation of the efficacy of supraglottoplasty in obstructive sleep apnea syndrome associated with severe laryngomalacia. Arch Otolaryngol Head Neck Surg. 2006;132(5):489-93.
25. Fraga JC, Schopf L, Volker V, Canani S. Endoscopic supraglottoplasty in children with severe laryngomalacia with and without neurological impairment. J Pediatr (Rio J). 2001;77(5):420-4.
26. Lubianca Neto JF, Fischer GB, Peduzzi FD, L Junior H, Krumenauer RCP, Richter VT. Achados clínicos e endoscópicos em crianças com estridor. Braz J Otorhinolaryngol. 2002;68(3):314-8.
27. Zafereo ME, Taylor RJ, Pereira KD. Supraglottoplasty for laryngomalacia with obstructive sleep apnea. Laryngoscope. 2008;118(10):1873-7.
28. Gonçalves MTM, Sato J, Avelino MAG, Pizarro GU, Moreira GA, Pradella-Hallinan M, et al. Polisomnographic findings on children with laryngopathies. Braz J Otorhinolaryngol. 2006;72(2):187-92.
29. Loke D, Ghosh S, Panarese A, Bull PD. Endoscopic division of the ary-epiglottic folds in severe laryngomalacia. Int J Pediatr Otorhinolaryngol. 2001;60(1):59-63.
30. Reddy DK, Matt BH. Unilateral vs bilateral supraglottoplasty for severe laryngomalacia in children. Arch Otolaryngol Head Neck Surg. 2001;127(6):694-9.
31. Kelly SM, Gray SD. Unilateral endoscopic supraglottoplasty for severe laryngomalacia. Arch Otolaryngol Head Neck Surg. 1995;121(12):1351-4.
32. Toynton SC, Saunders MW, Bailey CM. Aryepiglottoplasty for laryngomalacia: 100 consecutive cases. J Laryngol Otol. 2001;115(1):35-8.
33. Senders CW, Navarrete EG. Laser supraglottoplasty for laryngomalacia: are specific anatomical defects more influential than associated anomalies on outcome? Int J Pediatric Otorhinolaryngol. 2001;57(3):235-44.
34. Hadfield PJ, Albert DM, Bailey M, Lindley K, Pierro A. The effect of aryepiglottoplasty for laryngomalacia on gastro-esophageal reflux. Int J Pediatr Otorhinolaryngol. 2003;67(1):11-4.
1. Doutor em Medicina/Ciências Médicas pela Universidade Federal do Rio Grande do Sul (Professor Associado de ORL da Universidade Federal das Ciências da Saúde de Porto Alegre. Chefe do Serviço de ORL Pediátrica do HCSA. Presidente da Assoc. Brasileira de Otorrinolaringologia Pediátrica).
2. Médica Residente do Serviço de Otorrinolaringologia da Santa Casa de Porto Alegre.
3. Médica Otorrinolaringologista.
4. Mestre em Ciências da Saúde/Pediatria (Orientadora do Serviço de Otorrinolaringologia Pediátrica da Santa Casa de Porto Alegre - Hospital da Criança Santo Antônio).
Endereço para correspondência:
José Faibes Lubianca Neto
Rua Dona Laura, nº 320, 9º andar. Rio Branco
Porto Alegre - RS. CEP: 90430-090
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 7 de outubro de 2011. cod. 8822.
Artigo aceito em 6 de outubro de 2012.


