INTRODUÇÃOOs aminoglicosídeos estão entre os antibióticos mais usados no mundo em virtude de sua alta eficácia e de seu baixo custo. Entretanto, apresentam efeitos colaterais importantes como nefrotoxicidade e ototoxicidade.
A ação ototóxica destes antibióticos ocorre diretamente nos receptores polifosfoinositídeos, localizados na membrana das células ciliadas do órgão de Corti, da mácula sacular e utricular e das cristas ampulares do sistema vestibular. Estes receptores são lipídeos componentes da membrana celular que formam complexos com os aminoglicosídeos, produzindo modificações na permeabilidade da membrana, o que pode causar falência celular, com o consequente aparecimento da perda auditiva1.
O mecanismo da ototoxicidade contra as células ciliadas envolve desde a captação celular dos aminoglicosídeos por estas células, através de endocitose receptor-mediada2, predisposição genética individual ao dano celular envolvendo alterações de DNA mitocondrial3,4, atuação lesiva de Espécies Reativas de Oxigênio (ERO) - formados como consequência da capacidade dos aminoglicosídeos de quelar ferro5,6 - e até a indução de morte celular programada por apoptose7.
A ototoxicidade pode surgir durante a exposição aguda ao aminoglicosídeo ou tardiamente, até meses após a exposição. Pode evoluir para um grau mais grave ou recuperação dos limiares auditivos normais (previamente à exposição). Ao ocorrer lesão coclear com destruição das células ciliadas do órgão de Corti, a perda auditiva é irreversível8.
A amicacina, primeiro aminoglicosídeo semissintético descrito, é um derivado da kanamicina, ativo contra a maioria das espécies microbianas resistentes à gentamicina e à própria kanamicina9.
O padrão de lesão do órgão de Corti envolve acometimento inicial de células ciliadas externas nas espiras basais da cóclea, progredindo posteriormente, com menor grau de lesão ciliar, para o ápice da cóclea10. As lesões ocorrem preferencialmente nas células ciliadas externas, atingindo inicialmente a primeira fileira de células, seguindo, então, para segunda e terceira fileiras11.
Uma dose de 400 mg/kg/dia de amicacina intramuscular por 12 dias provoca a completa destruição das células ciliadas externas e lesão parcial das internas, na primeira e na segunda espiras da cóclea de cobaias, com lesões em menor grau nas terceira e quarta espiras10.
Os estímulos sonoros não lesivos (de baixa intensidade), aplicados durante longo período de tempo previamente à exposição de ruído traumático do mesmo tipo, protegem as cócleas dos animais experimentais, diminuindo as alterações fisiológicas e as lesões das células sensoriais cocleares12, fenômeno conhecido como resistência. Provavelmente, os estímulos condicionantes modificariam a célula, tornando-a capaz de suportar estímulos lesivos e a proteção parece ser mediada por alterações cocleares13.
Já está provado que o fenômeno da resistência também se manifesta quando administração prévia prolongada de doses não lesivas de amicacina antes da aplicação da mesma em doses ototóxicas, ou seja, a dose não lesiva da amicacina protege as células ciliadas contra a ototoxicidade da própria amicacina, de modo significante nas duas espiras mais basais14.
O objetivo é verificar se a otoproteção das células ciliadas externas contra a ototoxicidade da amicacina é temporalmente persistente.
MÉTODOCatorze cobaias albinas (
Cavia porcellus), com peso de 250g e reflexo de Preyer presente, foram utilizadas. O estudo foi aprovado pelo comitê de ética em experimentação animal da Instituição, protocolo de aprovação nº 075/2008.
A droga utilizada nesta pesquisa foi o antibiótico aminoglicosídeo amicacina administrado por via intramuscular. O reflexo de Preyer foi testado diariamente, o mesmo ocorrendo com a avaliação do peso até o tempo máximo para a eutanásia dos animais.
Os animais foram distribuídos em três grupos:
Grupo A (controle) - Quatro cobaias tratadas com água destilada por via intramuscular por 30 dias (duas cobaias) e 60 dias (duas cobaias).
Grupo B - Cinco cobaias tratadas com amicacina 20mg/kg/dia, via intramuscular, por 30 dias (dose protetora), e, após, dose de 400 mg/kg/dia de amicacina (dose lesiva) por 12 dias, tempo médio necessário para o desaparecimento do reflexo de Preyer. A partir de então, os animais foram mantidos por 30 dias com dieta regular, quando então foram sacrificados.
Grupo C - Cinco cobaias com o mesmo esquema de administração da amicacina do grupo B, porém, mantidos por 60 dias e sacrificados.
A técnica para estudo de alterações histopatológicas utilizada nesta pesquisa foi a microscopia eletrônica de varredura (MEV) com atenção às lesões estruturais do órgão de Corti nas diferentes espiras cocleares, especialmente às células ciliadas externas de cobaias que receberam doses diferentes do aminoglicosídeo amicacina.
As cobaias foram anestesiadas com éter inalatório e decapitadas, os ossos temporais contendo as bulas foram removidos. Realizada abertura no ápice e na janela redonda e injetado, para fixação, glutaraldeído a 2,5% em tampão fosfato 0,1M (Sorensen) a 4ºC. A microdissecção realizada preservou as lâminas espirais com o órgão de Corti. Esse material foi conservado por 12 horas em solução tampão 0,1M, sendo refixado em solução de tetróxido de ósmio a 1% com tampão fosfato 0,1M, por 1 hora, a 4ºC. As etapas seguintes são a desidratação em etanol e a secagem pelo método do ponto crítico de dióxido de carbono líquido em equipamento BALTEC - CPD 030 - "CRITICAL POINT DRYER". A cóclea foi acomodada em um porta-espécimen cilíndrico, fixada com pasta condutora de carbono e metalizada com ouro (fina camada) por vaporizador (BALTEC - SDC 050) para a perfeita visualização à microscopia eletrônica de varredura.
A função auditiva dos animais foi avaliada por emissões otoacústicas por produto de distorção (EOAPD), no equipamento ILO 92 CAE System Otodynamics LTDA, com intensidade do estímulo desencadeante de 70 dB NPS para F1 e F2 com proporção F1:F2 = 1,217. As OEA-PD foram realizadas nas seguintes situações: pré-exposição à amicacina, no 15º dia de aplicação da dose não lesiva, no final da aplicação da dose lesiva e antes da eutanásia.
As OEA-PD permitem uma comparação funcional das células ciliadas externas antes e após a aplicação da dose de habituação e da dose lesiva, fornecendo informação da ação da droga sobre estas células durante todo o período de estudo, reduzindo a interferência da diferença constitucional na função auditiva de cada animal, possibilitando a avaliação real da ação da amicacina sobre as células ciliadas externas.
RESULTADOSTodas as cobaias do Grupo A apresentaram função auditiva e padrão histológico normais (Figura 1A-D).
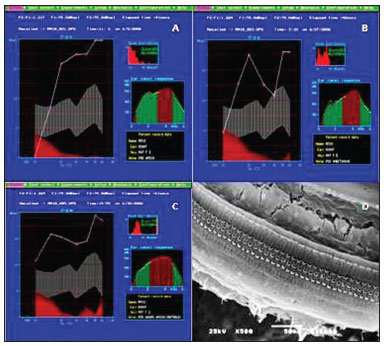
Figura 1. Exemplo de OEA-PD no grupo A. A: pré-exposição, observa-se a manutenção da função auditiva a partir de 1 KHz, com a presença das OEA-PD; B: Após dose não lesiva, mostrando padrão de normalidade com presença das OEA-PD; C: Após dose lesiva, mostrando presença das OEA-PD; D: Exemplo de MEV no grupo controle, mostrando na espira basal Células Ciliadas Externas e Internas normais. Aumento de 500x.
No Grupo B, o estudo das OEA-PD mostrou função auditiva normal no período pré-exposição à droga e manutenção do padrão após dose não lesiva (Figura 2A-B). No entanto, vemos perda importante da função auditiva após término do período de aplicação da dose lesiva demonstrada pela ausência das OEA-PD (Figura 2C).
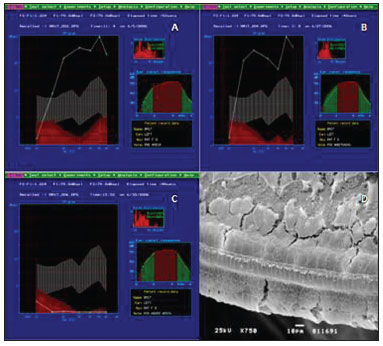
Figura 2. Exemplo de OEA-PD no grupo B. A: pré-exposição, observase a manutenção da função auditiva a partir de 1 KHz, com a presença das OEA-PD; B: OEA-PD presentes após tratamento com baixas doses, não lesivas, de amicacina; C: OEA-PD ausentes em todas as frequências testadas após dose lesiva de 400 mg/kg/dia de amicacina por 12 dias; D: Exemplo de MEV no grupo B, mostrando na espira basal destruição de Células Ciliadas Externas. Aumento de 750x.
Ao exame histológico (Figura 2D), nota-se comprometimento coclear. O órgão de Corti perde claramente a sua sustentação, evidenciando um padrão de lesão que se inicia desde a espira basal, em geral a mais afetada, com ausência total de células ciliadas externas e presença apenas de células ciliadas internas, padrão este que se mantém para a espira E2. Já na espira E3, as células ciliadas internas e as 1ª e 2ª fileiras de células ciliadas externas foram as mais afetadas, de modo a notarmos apenas a presença de extrusões celulares na fileira de células ciliadas internas e poucas células intactas na 3ª fileira de células ciliadas externas. Na espira apical, há a presença de um maior número de células intactas na 1ª fileira de células ciliadas externas, além de ausência de cílios das células ciliadas internas.
No grupo C, os achados funcionais avaliados pelas OEA - PD e o exame histopatológico por meio da MEV mostraram resultados idênticos aos encontrados no grupo B.
DISCUSSÃOA ototoxicidade pelo uso de aminoglicosídeos é uma das maiores causas de perda auditiva neurossensorial que pode ser prevenida15.
Os aminoglicosídeos apresentam a capacidade de interagir com o ferro, gerando um metabólito ativo capaz de catalisar a formação das ERO, que são compostos altamente reativos formados fisiologicamente como consequência do metabolismo celular aeróbio16. Dentre os principais exemplos de ERO, temos o peróxido de hidrogênio e os radicais hidroxila, hidroperoxila e superóxido.
Tais compostos podem gerar alterações de DNA, inativação de proteínas e lipoperoxidação de membranas celulares. Apesar destes efeitos deletérios, são importantes para o organismo, pois também atuam em processos de defesa contra patógenos17,18. Por isso, é indispensável a existência de um sistema de defesa celular contra a ação potencialmente nociva das ERO, composto por agentes antioxidantes como glutationa, catalase e superóxido dismutase.
A coadministração de agentes antioxidantes a cobaias com gentamicina mostrou redução da perda auditiva induzida pela droga19.
CONCLUSÃONão houve manutenção do fenômeno da autodefesa estendida por um período de 30 a 60 dias após a aplicação de doses lesivas de amicacina (400 mg/kg/dia).
A otoproteção coclear contra a ototoxicidade dos aminoglicosídeos está comprovada, no entanto, seu mecanismo não está completamente elucidado. Sabe-se que, provavelmente, envolve a ação de antirradicais livres como a glutationa anteriormente citada, substância capaz de inativar o metabólito ativo formado pela interação da amicacina com o ferro e que foi encontrada na orelha interna. Assim, os níveis intracocleares de glutationa estariam aumentados quando da administração por período prolongado de baixas doses do antibiótico previamente a uma dose lesiva, protegendo as CCE cocleares14.
O objetivo deste estudo foi avaliar se os mecanismos responsáveis pela otoproteção seriam capazes de manter a defesa celular por períodos de tempo mais prolongados - 30 e 60 dias. Não se pode afirmar se há manutenção do fenômeno de autodefesa por períodos maiores que 60 dias.
Concluiu-se que os antirradicais livres em níveis elevados que deveriam proteger a cóclea foram consumidos durante o período de tempo em que as cobaias foram mantidas, gerando, assim, um desequilíbrio entre os níveis de ERO (agentes lesivos) e os de antioxidantes (agentes protetores), permitindo a ação nociva dos primeiros sobre o Órgão de Corti. Esse desequilíbrio se soma à manutenção de níveis séricos elevados de amicacina (efeito nefrotóxico).
Este resultado permite delinear novos caminhos para melhor elucidação do fenômeno da autodefesa, como projetos com alteração do esquema de aplicação da droga, modificação dos períodos de aplicação de dose lesiva ou de períodos de administração de dose protetora e dose lesiva.
A busca de uma melhor compreensão dos mecanismos de autodefesa coclear e de como atuar na manutenção de tais mecanismos por longos períodos até o fim dos efeitos tóxicos do aminoglicosídeo circulante aspira uma aplicabilidade clínica em terapias farmacológicas.
REFERÊNCIAS 1. Harrison RV, Shirane M, Fukushima N, Mount RJ. Morphological changes to the coclea in an animal model of profound deafness. Acta Otolaryngol Suppl.1991;489:5-11.
2. Wu WJ, Sha SH, Schacht J. Recent advances in understanding aminoglycoside ototoxicity and its prevention. Audiol Neurootol. 2002;7(3):171-4.
3. Sha SH, Schacht J. Stimulation of free radical formation by aminoglycoside antibiotics. Hear Res.1999;128(1-2):112-8.
4. Barber DA, Harris SR. Oxygen free radicals and antioxidants: a review. Am Pham. 1994;NS34(9):26-35.
5. Knight JA. Diseases related to oxygen-derived free radicals. Ann Clin Lab Sci. 1995;25(2):111-21.
6. Priuska EM, Schacht J. Formation of free radicals by gentamicin and iron and evidence for an iron/gentamicin complex. Biochem Pharmacol. 1995;50(11):1749-52.
7. Jezowska-Bojczuk M, Szczepanik W, Leśniak W, Ciesiołka J, Wrzesiński J, Bal W. DNA and RNA damage by Cu(II)-amikacin complex. Eur J Biochem. 2002;269(22):5547-56.
8. Rybak LP, Whitworth CA. Ototoxicity: therapeutic opportunities. Drug Discov Today. 2005;10(19):1313-21.
9. Kitasato I, Yokoda M, Inouye S, Igarashi M. Comparative ototoxicity of ribostamycin, dactimicin, dibekacin, kanamycin, amikacin, tobramycin, gentamicin, sisomicin and netilmicin in the inner ear of guinea pigs. Chemotherapy. 1990;36(2):155-68.
10. Selimoglu E. Aminoglycoside-Induced ototoxicity. Curr Pharm Des. 2007;13(1):119-26.
11. Nakayama M, Riggs LC, Matz GJ. Quantitative study of vestibular toxicity induced by gentamicin or cisplatin in the guinea pig. Laryngoscope. 1996;106(2 Pt 1):162-7.
12. Dagli S, Canlon B. The effect of repeated daily noise exposure on sound-conditioned and unconditioned guinea pigs. Hear Res. 1997;104(1-2):39-46.
13. Oliveira JA, Canedo DM, Rossato M, Andrade MH. Self-protection against aminoglycoside ototoxicity in guinea pigs. Otolaryngol Head Neck Surg. 2004;131(3):271-9.
14. Rybak LP, Whitworth CA, Mukherjea D, Rankumar V. Mechanisms of cisplatin-induced ototoxicity and prevention. Hear Res. 2007;226(1-2):157-67.
15. Forge A, Schacht J. Aminoglycoside antibiotics. Audiol Neurootol. 2000;5(1):3-22.
16. Dehne N, Lautermann J, Petrat F, Rauen U, de Groot H. Cisplatin ototoxicity: involvement of iron and enhanced formation of superoxide anion radicals. Toxicol Appl Pharmacol. 2001;174(1):27-34.
17. Floyd RA. Role of oxygen free radicals in carcinogenesis and brain ischemia. FASEB J. 1990;4(9):2587-97.
18. Hatherill JR, Till GO, Ward PA. Mechanisms of oxidant-induced changes in erythrocytes. Agents Actions. 1991;32(3-4):351-8.
19. Song BB, Schacht J. Variable efficacy of radical scavengers and iron chelators to attenuate gentamicin ototoxicity in guinea pig in vivo. Hear Res. 1996;94(1-2):87-93.
1. Doutouranda em Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto - USP - Departamento de Oftalmologia, Otorrinolaringologia e CIrurgia de Cabeça e Pescoço (Medica Assistente do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto - USP).
2. Residência em Otorrinolaringologia - Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto - USP - Departamento de Oftalmologia, Otorrinolaringologia e CIrurgia de Cabeça e Pescoço (Médico Otorrinolaringologista).
3. Mestranda em Ciências Médicas da Faculdade de Medicina de Ribeirão Preto - USP - Departamento de Oftalmologia, Otorrinolaringologia e CIrurgia de Cabeça e Pescoço (técnica de laboratório).
4. Ensino Médio (técnica de laboratório).
5. Doutorado em Ciências Médicas (Professor Doutor da Faculdade de Medicina - USP - Ribeirão Preto - Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço).
6. Professor Titular (Professor Titular - aposentado - Faculdade de Medicina de Ribeirão Preto - USP - Departamento de Oftalmologia, Otorrinolaringologia e CIrurgia de Cabeça e Pescoço).
Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto - USP Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço.
Endereço para correspondência:
Andréia Ardevino de Oliveira
Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço. Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto - USP - SP. Avenida Bandeirantes, nº 3.900, 12º andar. Monte Alegre
Ribeirão Preto - SP. CEP: 14049-900
E-mail: andreiaoliveira@hcrp.fmrp.usp.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 30 de maio de 2012. cod. 9233.
Artigo aceito em 2 de outubro de 2012.


