INTRODUÇÃOA Rinossinusite Crônica (RSC) é um dos problemas de saúde mais comuns na população, com custos médicos significativos. Cerca de 135 em cada 1000 americanos, ou um total de 31 milhões de pessoas, são afetadas nos Estados Unidos a cada ano, com custo total de 6 bilhões de dólares1-3.
A fisiopatologia da RSC até hoje continua incerta e a hipótese mais aceita é a de uma doença crônica inflamatória e multifatorial com provável predisposição genética. Alguns fatores relacionados incluem: os biofilmes, a osteíte, alergia, os distúrbios imunológicos, fatores intrínsecos das vias aéreas superiores, superantígenos do
Staphylococcus aureus, a inflamação eosinofílica induzida por colonização fúngica e as perturbações metabólicas, como a hipersensibilidade à aspirina3. Acredita-se que envolva vários padrões inflamatórios que possam diferir, por exemplo, conforme o prognóstico pós-operatório3,4.
Várias opções terapêuticas foram sugeridas para a melhora da RSC, sendo os corticoides nasais tópicos e sistêmicos e os macrolídeos em baixa dosagem, por longo período, medicações que se mostraram eficazes, com alto grau de evidência científica. O tratamento cirúrgico via cirurgia endoscópica funcional pode ser uma alternativa aos casos não responsivos ao tratamento clínico5.
O fato de não se conhecer a verdadeira fisiopatologia da RSC traduz-se na dificuldade em se alcançar um tratamento curativo, tornando a aderência e preferência do paciente à terapêutica instituída aspectos de grande importância. A forma de administração, o veículo da medicação, custo total do tratamento e os efeitos colaterais são sempre considerados.
Pensando em melhorar a qualidade de vida dos pacientes com doenças do humor vítreo, submetidos a injeções frequentes de corticoide intraocular, os oftalmologistas começaram a utilizar, recentemente, implantes biodegradáveis contendo corticoide na tentativa de evitar o emprego das injeções repetidas e, assim, evitar os numerosos transtornos causados por esse procedimento6,7.
A colocação do implante biodegradável diretamente no órgão alvo permite maior controle de liberação da droga desejada, atingindo o nível terapêutico com o uso de concentração menor de droga e praticamente eliminando os efeitos sistêmicos adversos8-10. Implantes não biodegradáveis também foram utilizados para o mesmo fim, com resultados promissores. No entanto, estes últimos requerem um segundo procedimento para a remoção do implante após a completa liberação da droga8.
Implantes biodegradáveis são sistemas de transporte de drogas preparados a partir de diferentes polímeros que,
in vivo, idealmente, devem ser degradados em tempo suficiente para a liberação controlada da droga e produzirem metabólitos biocompatíveis e facilmente eliminados do organismo11.
Os polímeros biodegradáveis mais utilizados atualmente são os poliésteres, tais como a poli (caprolactona), o ácido polilático (PLA) e os diferentes tipos de copolímeros dos ácidos lático e glicólico (PLGA), sendo que os dois últimos tipos têm sido amplamente empregados12.
O PLA e os diferentes tipos de PLGA têm sido muito utilizados e estudados em sistemas de liberação prolongada de drogas (SLP) para diferentes tecidos do organismo. A biodegradação desses polímeros ocorre por erosão, por meio de clivagem da cadeia polimérica por hidrólise, liberando os ácidos lático e glicólico. Esses ácidos, por serem metabólitos naturais do organismo, são eliminados pelo ciclo de Krebs na forma de gás carbônico e água (Figura 1)13.
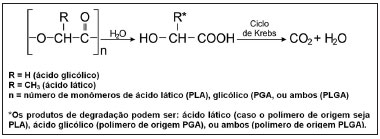
Figura 1. Mecanismo de hidrólise de PLA, PGA ou PLGA (adaptada de Merkli et al.13).
A presença do grupo metila (CH3) na cadeia de ácido lático de polímeros do tipo PLGA confere maior hidrofobicidade ao biomaterial quando comparado aos derivados contendo maior proporção de ácido glicólico (PGA). O PGA, portanto, por ser bastante sensível à hidrólise, não é adequado para a utilização em SLP. Com relação ao PLGA, quanto maior a proporção de acido lático, maior a hidrofobicidade do copolímero, já que absorve menos água, e consequentemente, menor será a velocidade de degradação. Além disso, a massa molecular e o grau de cristalinidade podem influenciar as propriedades mecânicas, a capacidade de hidrólise e velocidade de degradação desses polímeros9.
A confecção de SLP com a utilização de polímeros do tipo PLGA com elevado teor de ácido lático, que apresentam velocidade de degradação lenta, podem resultar em sistemas cuja liberação da droga ocorra por longo período (até três anos), dependendo da forma que o SLP for confeccionado e das variáveis externas dependentes do tecido onde o mesmo é locado14. Assim, o desenvolvimento destes sistemas pode se tornar um grande avanço, já que são capazes de manter concentrações da droga no local, dentro da faixa terapêutica desejada e por longo período15-19. Muitas drogas podem ser veiculadas nesses sistemas (implantes), como, por exemplo, os antibióticos, antivirais, quimioterápicos e corticoides, que já apresentaram resultados satisfatórios na oftalmologia, de acordo com trabalhos recentemente publicados, nos quais é possível observar a degradação do implante no vítreo sem provocar danos aos tecidos oculares6,8,13.
Estes implantes podem ser uma alternativa no tratamento da RSC, pois uma vez aplicados, e em contato com a mucosa dos seios paranasais, poderão facilitar o tratamento e a aderência dos pacientes ao mesmo, substituindo a aplicação diária de corticoide nasal tópico. Portanto, este estudo teve como objetivo avaliar histologicamente a mucosa de seio maxilar de coelhos após a colocação de implante biodegradável contendo prednisolona.
MÉTODOForam estudados 18 coelhos do gênero feminino, da raça Nova Zelândia, pesando entre 2,5 e 3,5 quilogramas mantidos em gaiolas no biotério da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP). Os 18 coelhos foram divididos aleatoriamente em dois grupos.
Para o preparo dos implantes biodegradáveis, inicialmente, foram pesados prednisolona e polímero do tipo PLGA (75:25), na razão de massa entre 21-26/79-74%, os quais foram solubilizados em mistura de solvente adequado e água destilada. A solução obtida foi filtrada em filtro estéril de 0,22 mm, sob fluxo laminar, liofilizada e utilizada para o preparo do implante na forma de bastões pelo método de moldagem a quente. Estes sistemas apresentavam peso médio de 0,9 a 1,2 mg e 4,5 a 6,0 mm de comprimento e 0,4 a 0,5 mm de diâmetro (Figura 2A). O baixo coeficiente de variação entre os implantes foi indicativo da reprodutibilidade das técnicas empregadas. Macroscopicamente, os implantes se apresentam lisos, com aparência similar, e como sistemas monolíticos, nos quais a droga se encontra dispersa na matriz polimérica. A superfície e a forma externa dos implantes foram examinadas por microscopia eletrônica de varredura (MEV). Foram obtidas imagens da superfície dos implantes em aumentos que variaram de 250 a 5000 vezes (Figura 2B-C).

Figura 2. A: Visão macroscópica do implante biodegradável. B: Imagens de MEV do implante biodegradável com aumento de 250X. C: Imagens de MEV do implante biodegradável com aumento de 5000X.
Os animais foram submetidos à anestesia com a administração de cloridrato de xilazina (20 mg/Kg) e cloridrato de ketamina (10 mg/Kg) por via intramuscular. No dorso nasal do coelho foi realizada assepsia com álcool iodado. Uma incisão sagital de cerca 5 cm na linha média do dorso nasal até o periósteo foi realizada (Figura 3A-B). O periósteo de ambos os lados do dorso nasal foi descolado com descolador de microcirurgia otológica Paparella expondo-se a sutura óssea na linha média e as paredes anteriores de ambos os seios maxilares (Figura 3C). Com emprego de escopro e martelo foi confeccionado um retalho ósseo-mucoso retangular de 25 x 8 mm na parede anterior de ambos os seios maxilares, cujo maior eixo era paralelo à sutura óssea na linha média. O limite medial do retalho estava a 3 mm da sutura óssea na linha média e o limite superior estava de 3 a 5 mm abaixo da sutura fronto-maxilar (Figura 3D). O aspecto macroscópico da mucosa dos seios maxilares foi observado com o auxílio de iluminação externa por um fotóforo.

Figura 3. A: Incisão sagital no dorso do coelho; B: Incisão sagital de 5 cm até o periósteo; C: Descolamento do periósteo expondo-se a sutura óssea na linha média e as paredes anteriores de ambos os seios maxilares; D: Confecção com escopro e martelo de um retalho ósseo-mucoso retangular; E: Inserção do implante biodegradável contendo prednisolona no seio maxilar esquerdo; F: Retalho ósseo foi recolocado.
Os coelhos foram divididos em dois grupos. Grupo 1: No seio maxilar esquerdo foi inserido um implante biodegradável contendo prednisolona e no seio maxilar direito foi realizado o mesmo procedimento cirúrgico acima mencionado, porém sem a introdução de nenhum implante (Figura 3E); Grupo 2: No seio maxilar esquerdo foi inserido um implante biodegradável sem medicação e no seio maxilar direito também foi realizado o mesmo procedimento cirúrgico, porém sem a introdução de nenhum implante biodegradável.
Os seios maxilares do lado direito de ambos os grupos serviram como controle. Após esta etapa, o retalho ósseo foi recolocado para diminuir a invasão de tecidos no seio e a pele foi fechada com fio de nylon 4-0 tomando-se o cuidado com a aproximação hermética de periósteo e subcutâneo (Figura 3F). Nova antissepsia do campo operatório foi realizada com álcool iodado e foi administrado, por via intramuscular, cetoprofeno (10 mg/kg) durante dois dias e enrofloxacina (0,1 ml/kg) durante três dias.
O protocolo experimental empregado foi aprovado pelo Comitê de Ética em Pesquisa Animal da FMRP-USP (Protocolo 132/2010).
Após 7, 14 e 28 dias foram escolhidos aleatoriamente três coelhos de cada grupo para serem submetidos à eutanásia sob anestesia geral nos mesmos moldes dos procedimentos descritos. A mesoestrutura facial foi retirada por ressecção em bloco e colocada em formaldeído a 10%, para estudo histológico posterior (Figura 4A-B). Para a realização do estudo histológico, as peças foram fixadas em solução de formol (10% p/v) e permaneceram por seis dias imersas em solução de ácido nítrico (5% p/v) para descalcificação. Foram feitos cortes seriados transversais do nariz ao crânio a cada dois centímetros (Figura 4C-E); e os mesmos foram desidratados, clarificados e incluídos em parafina. Em seguida, espécimes foram cortados em micrótomo com espessura média de 5 µm, corados pela coloração hematoxilina-eosina e os padrões de resposta tecidual inflamatória foram avaliados.
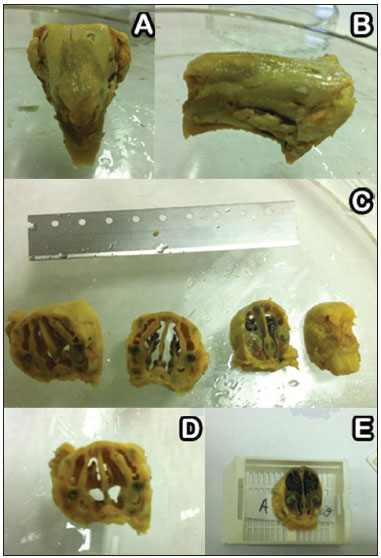
Figura 4. A-B: Meso-estrutura facial desidratada em formaldeído a 10%. C-E: Cortes seriados transversais do nariz ao crânio a cada dois centímetros.
As lâminas foram analisadas por um único patologista, por meio de método semiquantitativo, de maneira cega quanto ao grupo a que o espécime pertencia, e, posteriormente, classificadas de acordo com os critérios de inflamação adotados: 0 = ausência de inflamação; 1 = inflamação leve (esparsas células inflamatórias, sem lesão epitelial evidente); 2 = inflamação moderada (infiltrado inflamatório difuso em lâmina própria, sem formação de agregados inflamatórios com lesão focal de células epiteliais caracterizadas por desorganização e ruptura de células epiteliais); 3 = inflamação intensa (denso infiltrado inflamatório difuso com formação de agregados de células inflamatórias com lesão difusa de células epiteliais caracterizada por desorganização e ruptura de células epiteliais)20.
Foi utilizado o Programa SPSS (
Statistical Package for Social Sciences), em sua versão 19.0, para o processamento dos dados e a obtenção dos resultados. O nível de significância de 5% (0,05) foi adotado para a aplicação dos testes estatísticos.
RESULTADOSNo Grupo 1, em que os coelhos receberam implantes biodegradáveis contendo prednisolona no seio maxilar esquerdo, sete animais não apresentaram sinais de inflamação na mucosa, sendo que dois deles sofreram eutanásia com 7 dias, três com 14 dias e dois com 28 dias. Em apenas dois casos, um animal que sofreu eutanásia com 7 dias e outro sacrificado com 28 dias, foi observada inflamação de grau leve e moderada, respectivamente (Figura 5). Nos seios maxilares direitos (controle) do mesmo grupo foi observado processo inflamatório da mucosa de grau grave em dois animais que foram sacrificados com sete dias e ausência de processo inflamatório no restante do grupo (Tabela 1). No Grupo 2, no qual os animais receberam implantes biodegradáveis sem medicação no seio maxilar esquerdo, foi observada inflamação leve da mucosa de um animal sacrificado com 7 dias e em dois animais sacrificados com 14 dias. Em dois animais, um sacrificado com 7 dias e outro com 28 dias, foi observada inflamação de grau moderado nas suas mucosas (Figura 5A-B). Apenas um animal apresentou processo inflamatório grave que foi verificado após seu sacrifício aos 28 dias. No restante dos animais do grupo não foi observado processo inflamatório após o término do estudo. Em quatro animais do Grupo 2 (controle), não foi observada inflamação na mucosas dos seios maxilares direitos. Processo inflamatório leve foi observado em três animais; moderado em um e grave em outro que foi sacrificado com 28 dias (Tabela 2).
Resultados Estatísticos
Descrição e comparação intraelemento amostralFoi aplicado o
Teste de McNemar para se verificar possíveis diferenças entre ambos os lados investigados, para a variável "inflamação" em duas categorias (Tabela 3). Não foi observada diferença estatística no padrão inflamatório quando comparadas as mucosas dos seios maxilares que receberam implante com e sem prednisolona com os seus próprios controles.
Descrição e comparação entre implante com e sem drogaFoi utilizado
Teste Exato de Fisher para se verificar possíveis diferenças entre implante com e sem droga, para a variável "inflamação" em duas categorias (Tabela 4). Quando comparadas as mucosas dos seios maxilares dos animais que receberam implante com prednisolona com as que receberam implante sem prednisolona, foi encontrada tendência à diferença entre elas com menor padrão inflamatório onde foi colocado o implante contendo prednisolona, pois a significância calculada ('
p') ficou entre 5% (0,050) e 10% (0,100).
Estudo do efeito da variável 'tempo de eutanásia'O
Teste da Razão de Verossimilhança foi aplicado com o intuito de se verificarem possíveis diferenças entre os três tempos de eutanásia, quando comparadas, concomitantemente, para as variáveis de interesse (Tabelas 5 e 6). Levando em consideração a variável "tempo de eutanásia", não foi encontrada diferença estatística significativa de inflamação na mucosa, quando comparado o grupo de coelhos que receberam implantes contendo ou não droga com o grupo controle; ou quando comparado o grupo que recebeu implante com prednisolona com o grupo que recebeu implante sem droga.
DISCUSSÃOPor não se conhecer a fisiopatogenia exata da RSC, vários tratamentos já foram testados, sejam eles clínicos e/ou cirúrgicos, sem se conseguir, em muitos casos, a cura completa da doença. Cientes de que se trata de uma doença crônica, em que o comprometimento do paciente com o tratamento é essencial para o controle da mesma, os autores do presente estudo hipotetizaram uma nova forma de veicular o agente farmacológico à mucosa doente do nariz e dos seios paranasais destes pacientes, de modo que os mesmos não necessitassem da utilização diária de medicamentos de ação tópica e/ou sistêmica, o que aumentaria a eficácia do tratamento. Consequentemente, os implantes biodegradáveis poderiam surgir como excelente opção: o paciente teria o implante inserido na mucosa do nariz e/ou seios paranasais com a droga adequada e na concentração terapêutica ideal, sem a necessidade de removê-lo em determinado período, uma vez que o mesmo seria absorvido pelo próprio organismo.
Em seu primeiro estudo, realizado em 20067, e em outros dois estudos publicados em 2007 e 2008, Fialho et al.8,10 mostraram que implantes biodegradáveis contendo corticoide implantados no vítreo de olhos de coelhos não causaram toxicidade ou reação inflamatória significativa aos mesmos, se assemelhando aos resultados encontrados nas mucosas dos seios paranasais dos animais empregados no presente estudo. No entanto, cabe enfatizar que na otorrinolaringologia este é o primeiro estudo descrevendo o uso de implante biodegradável como sistema de liberação controlada de droga (prednisolona) em seios paranasais.
Como pode ser observado, este primeiro estudo se restringiu a avaliar a inflamação que o implante poderia trazer à mucosa do seio maxilar do coelho. Outros parâmetros ainda devem ser estudados, como, por exemplo, a concentração adequada de droga no implante e a massa ideal de matriz polimérica que influenciaria no tempo de degradação do mesmo e, consequentemente, na quantidade de droga que seria liberada no órgão alvo, a melhor dimensão do implante para atingir cada objetivo específico e o quanto da droga poderia ser absorvida sistemicamente. Essas informações são fundamentais para que, futuramente, os implantes em desenvolvimento possam ser utilizados em humanos com segurança, como já está ocorrendo na oftalmologia.
Cabe ressaltar, de forma inequívoca, que o estudo aqui descrito representa o primeiro passo, fundamental para uma possível opção de tratamento da RSC.
CONCLUSÃOÉ possível concluir, mesmo em se tratando de estudo preliminar, que os implantes utilizados, com e sem droga, não causaram toxicidade ou inflamação à mucosa do seio maxilar dos animais.
REFERÊNCIAS 1. Benninger MS, Ferguson BJ, Hadley JA, Hamilos DL, Jacobs M, Kennedy DW, et al. Adult chronic rhinosinusitis: definitions, diagnosis, epidemiology, and pathophysiology. Otolaryngol Head Neck Surg. 2003;129(3 Suppl):S1-32.
2. Osguthorpe JD. Adult rhinosinusitis: diagnosis and management. Am Fam Physician. 2001;63(1):69-76.
3. Fokkens W, Lund V, Mullol J; European Position Paper on Rhinosinusitis and Nasal Polyps Group. EP3OS 2007: European position paper on rhinosinusitis and nasal polyps 2007. A summary for otorhinolaryngologists. Rhinology. 2007;45(2):97-101.
4. Voegels RL, de Melo Pádua FG. Expression of interleukins in patients with nasal polyposis. Otolaryngol Head Neck Surg. 2005;132(4):613-9.
5. Ragab SM, Lund VJ, Scadding G. Evaluation of the medical and surgical treatment of chronic rhinosinusitis: a prospective, randomised, controlled trial. Laryngoscope. 2004;114(5):923-30.
6. Fialho SL, Silva Cunha A. Manufacturing techniques of biodegradable implants intended to intraocular application. Drug Deliv. 2005;12(2):109-16.
7. Fialho SL, Rêgo MB, Siqueira RC, Jorge R, Haddad A, Rodrigues AL, et al. Safety and pharmacokinetics of an intraviteral biodegradable implant of dexamethasone acetate in rabbit eyes. Curr Eye Res. 2006;31(6):525-34.
8. Fialho SL, Siqueira RC, Jorge R, Silva-Cunha A. Biodegradable implants for ocular delivery of anti-inflammatory drug. J Drug Del Sci Tech. 2007;17(1):93-7.
9. Fialho SL, Cunha Júnior Ada S. Drug delivery systems for the posterior segment of the eye: fundamental basis and applications. Arq Bras Oftalmol. 2007;70(1):173-9.
10. Fialho SL, Behar-Cohen F, Silva-Cunha A. Dexamethasone-loaded poly (ε-caprolactone) intravitreal implants: A pilot study. Eur J Pharm Biopharm. 2008;68(3):637-46.
11. Dash AK, Cudworth GC 2nd. Therapeutic applications of implantable drug delivery systems. J Pharmacol Toxicol Methods. 1998;40(1):1-12.
12. Jain R, Shah NH, Malick AW, Rhodes CT. Controlled drug delivery by biodegradable poly(ester) devices: different preparative approaches. Drug Dev Ind Pharm. 1998;24(8):703-27.
13. Merkli A, Tabatabay C, Gurny R, Heller J. Biodegradable polymers for the controlled release of ocular drugs. Prog Polym Sci. 1998;23(3):563-80.
14. Saettone MF, Salminen L. Ocular inserts for topical delivery. Adv Drug Deliv Rev. 1995;16(1):95-106.
15. Hashizoe M, Ogura Y, Kimura H, Moritera T, Honda Y, Kyo M, et al. Scleral plug of biodegradable polymers for controlled drug release in the vitreous. Arch Ophthalmol. 1994;112(10):1380-4.
16. Zhou T, Lewis H, Foster RE, Schwendeman SP. Development of a multiple-drug delivery implant for intraocular management of proliferative vitreoretinopathy. J Control Release. 1998;55(2-3):281-95.
17. Tan DT, Chee SP, Lim L, Theng J, Van Ede M. Randomized clinical trial of Surodex steroid drug delivery system for cataract surgery: anterior versus posterior placement of two Surodex in the eye. Ophthalmology. 2001;108(12):2172-81.
18. Kimura H, Ogura Y, Hashizoe M, Nishiwaki H, Honda Y, Ikada Y. A new vitreal drug delivery system using an implantable biodegradable polymeric device. Invest Ophthalmol Vis Sci. 1994;35(6):2815-9.
19. Sakurai E, Nozaki M, Okabe K, Kunou N, Kimura H, Ogura Y. Scleral plug of biodegradable polymers containing tacrolimus (FK506) for experimental uveitis. Invest Ophthalmol Vis Sci. 2003;44(11):4845-52.
20. Ozcan KM, Ozcan I, Selcuk A, Akdogan O, Gurgen SG, Deren T, et al. Comparison of Histopathological and CT Findings in Experimental Rabbit Sinusitis. Indian J Otolaryngol Head Neck Surg. 2011;63(1):56-9.
1. MD (pós-graduando - Doutorado).
2. PhD (Professor Associado).
3. PhD (Gerente de Desenvolvimento Farmacotécnico).
4. MD (aluna de graduação).
5. MD (pós-graduando - Doutorado).
6. MD (pós-graduando - Mestrado).
7. Professor doutor (Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo).
8. Técnica de Laboratório (Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo).
9. Professora Associada (Docente).
Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo.
Endereço para correspondência:
Wilma T. Anselmo-Lima
Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo
Av. Bandeirantes, nº 3900
Ribeirão Preto - SP. Brasil. CEP: 14049-900
Tel: 55 (16) 3602-2862. Fax: 55 (16) 3602-2860
E-mail: mcecilia@hcrp.fmrp.usp.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 7 de fevereiro de 2012. cod. 9031.
Artigo aceito em 23 de agosto de 2012.


