INTRODUÇÃOA Neurofibromatose tipo 2 (NF2) é uma doença autossômica dominante que acomete 1 a cada 40.000 indivíduos1,2. A mutação dos dois alelos do gene supressor tumoral do braço longo do cromossomo 22 ocorre nesses casos1,2. Tipicamente, os pacientes desenvolvem múltiplos schwannomas ao longo da coluna e intracranialmente. O schwannoma vestibular bilateral ocorre em 90% dos portadores do gene1. Invariavelmente, estes pacientes desenvolverão perda auditiva sensorioneural progressiva caracterizada por uma discriminação ruim. Zumbido e desequilíbrio podem estar presentes1.
A reabilitação auditiva dos pacientes que evoluíam para surdez grave-profunda, até pouco tempo atrás se restringia ao treinamento de leitura orofacial. Em 1979, House e Hitselberger começaram a mudar essa história, com a realização do primeiro implante auditivo de tronco encefálico (ABI) monocanal em um paciente com NF2 surdo3. O feixe de eletrodos do implante foi sendo aprimorado ao longo dos anos, passando de oito para 21 eletrodos4. Esse avanço tecnológico já beneficiou mais de 700 pacientes implantados com ABI, com respostas auditivas variáveis1,2,4-8.
Nos anos 90, o implante coclear (IC) também se tornou uma opção na reabilitação auditiva de pacientes surdos com NF2 submetidos à ressecção tumoral com preservação do nervo coclear9-15.
A reabilitação auditiva dos portadores de NF2 pode ser realizada de duas maneiras (IC ou ABI). Iremos relatar os resultados auditivos de quatro pacientes portadores de NF2 submetidos à cirurgia de implante auditivo de tronco encefálico ou implante coclear em nosso serviço e realizar uma revisão da literatura sobre o assunto.
MÉTODOForam avaliados prospectivamente quatro pacientes portadores de NF2, submetidos à cirurgia de exérese de schwannoma vestibular, entre fevereiro de 2006 e março de 2009. No mesmo tempo cirúrgico, foi realizado implante auditivo de tronco encefálico (ABI) ou implante coclear (IC) ipsilateral, dependendo da preservação ou não do nervo coclear.
Dados clínicos e radiológicos foram coletados no pré-operatório, com ênfase ao desempenho auditivo, tempo de privação auditiva e tamanho tumoral.
Três pacientes foram implantados pela via translabiríntica com Nucleus 24
® ABI (Cochlear Corporation) após remoção tumoral. Para o acesso da parede lateral do IV ventrículo (forame de Luschka), foram utilizados como pontos de reparo anatômico o IX par craniano, o tronco acústicofacial, o flóculo cerebelar e o plexo coroide. Durante todas as cirurgias, o VII, IX, X e XI pares cranianos ipsilaterais foram continuamente monitorizados (NIM Response-2; Medtronic Xomed).
Potenciais auditivos eletricamente evocados de tronco cerebral (ABR elétrico) foram usados para verificar o posicionamento adequado do feixe de eletrodos por meio do equipamento Biologic Navigator Pro (Bio-logic Systems Corp.
®), acoplado à interface de estimulação do implante por meio de um cabo de sincronização.
Em um paciente, a preservação anatômica do nervo coclear foi possível durante a exérese tumoral via retrolabiríntica. O teste de estimulação elétrica do promontório no intraoperatório mostrou resposta presente, embora com morfologia pobre e reprodutibilidade duvidosa. Optou-se pela realização do implante coclear Nucleus Freedom Contour Advanced
® (Cochlear Corporation) simultâneo via janela redonda. Nesse caso, a telemetria neural intraoperatória mostrou ausência de resposta nos cinco eletrodos testados. O posicionamento do feixe de eletrodos foi checado no pós-operatório através de raio-x nas incidências transorbitária e Stenvers.
A aferição das impedâncias dos eletrodos, tanto nos ABI como no CI, mostrou valores adequados.
A ativação do ABI foi realizada aproximadamente 1 mês após a cirurgia, com o paciente consciente em unidade de terapia intensiva com monitorização cardiorrespiratória. Os eletrodos foram ativados sequencialmente com corrente monopolar, com aumento gradual para o registro de sensação auditiva confortável e de efeitos colaterais. A estratégia de codificação de fala utilizada nos três pacientes foi o Spectral peak (Speak). A ativação do IC foi realizada 1 mês após a cirurgia e a estratégia de codificação de fala utilizada foi
advanced combination encoders (ACE).
Os resultados auditivos após 48 meses de uso de ABI e 12 meses de uso de IC foram expressos em: limiares tonais em campo sonoro, teste four choice, índice de reconhecimento de vogais e de frases apresentadas em formato fechado e aberto, uso de telefone.
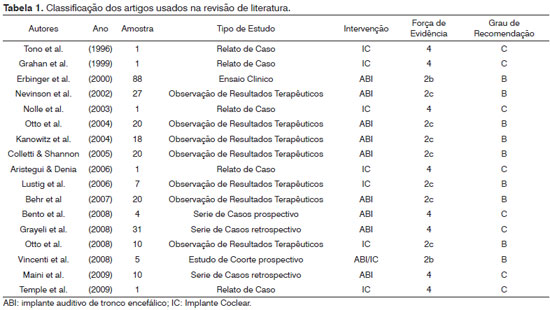
Para revisão de literatura, utilizamos como estratégia de busca os descritores: (cochlea or cochlear or auditory or ear) and (brain implant or brain implants), nas bases de dados Medline, Lilacs e Scielo, com o limite para período de publicação até março de 2010. Foram recuperadas 1118 publicações. Destes, 17 estudos clínicos em portadores de NF2 submetidos à cirurgia de implante coclear ou implante auditivo de tronco cerebral, em língua inglesa ou portuguesa, foram selecionados. Cada estudo foi classificado segundo sua força de evidência, conforme a classificação do Oxford Centre for Evidence-based Medicine para estudos sobre tratamento (Tabela 1). Posteriormente, estes estudos também foram classificados segundo o grau de recomendação, sendo nove publicações com grau de recomendação B e oito com grau de recomendação C (Tabela 1).
Este estudo foi aprovado pela Comissão de Ética para Análise de Projetos de Pesquisa da instituição sob o protocolo de número 1135/07. Extensa explanação sobre os riscos e benefícios da cirurgia de implante auditivo de tronco encefálico e a opção de continuar apenas com terapia de treinamento de leitura orofacial foram dadas aos pacientes. A assinatura do Termo de Consentimento Livre e Esclarecido significou concordância em participar do estudo.
RESULTADOSOs três pacientes implantados com ABI eram do sexo masculino, com idade média de 26,3 ± 1,5 anos, tempo de surdez médio de 6,0 ± 4,0 anos e tamanho tumoral médio de 3,2 ± 1,4 cm (Tabela 2). Todos fazem uso regular de seu aparelho por mais de oito horas por dia. Nenhum deles utiliza aparelho de amplificação sonora individual (AASI) na orelha contralateral.
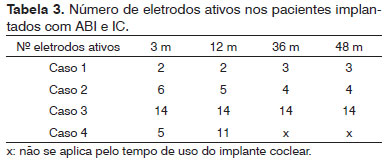
Nenhuma complicação pós-operatória adicional pela colocação do ABI foi observada nesses pacientes. Dois pacientes tiveram paralisia facial no pós-operatório, permanecendo com escore de House-Brackmann VI. Um evoluiu com fistula liquórica, resolvida com derivação lombar externa e curativo cefálico compressivo. Os efeitos adversos observados durante a ativação ABI foram: estimulação na garganta (1), tronco (2), membros superiores (2) e inferiores (1), náusea (1) e nistagmo (1). O número de eletrodos que geraram sensação auditiva sem efeitos colaterais variou entre 2 e 14 (Tabela 3).
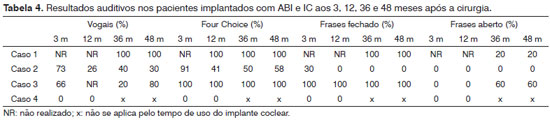
O valor médio do limiar audiométrico em campo livre com uso do dispositivo nos pacientes com ABI nas frequências 500, 1000, 2000 e 4000 Hz foi de 36,7 ± 5,7 decibéis (Gráfico 1). Os limiares tonais alcançados foram semelhantes entre os pacientes e mantiveram-se estáveis ao longo dos anos. O desempenho auditivo foi variável, um paciente não reconhece sentenças em formato aberto e apenas 20% em formato fechado. Os outros dois reconhecem 100% de sentenças no formato fechado e 10% e 20% no formato aberto (Tabela 4). Apenas um deles é capaz de se comunicar ao telefone.
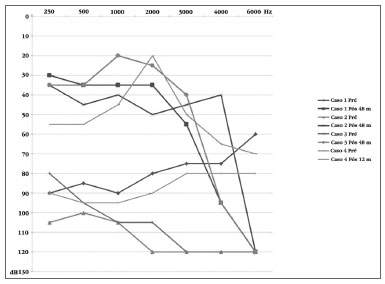
Gráfico 1. Limiares audiométricos em campo livre pré e pós-implante.
A paciente implantada com IC tinha 36 anos, com história de surdez progressiva há 10 anos, evoluindo para surdez grave há 1 ano (Tabela 2). O tumor do lado implantado media 1,5 cm (Tabela 2). Ela também faz uso regular de seu implante por mais de 8 horas por dia e usa AASI contralateral há 7 meses, com percepção de sons graves.
Na ativação, apresentou cinco eletrodos com sensação auditiva e sem efeitos colaterais. Após 12 meses de estimulação, 11 eletrodos puderam ser ativados sem efeitos colaterais. O limiar audiométrico em campo livre melhorou após o IC, a média das frequências 500, 1000, 2000 e 4000 Hz é de 46,2 decibéis (Gráfico 1). Apesar da melhora dos limiares tonais, a paciente consegue apenas detectar presença de som, não discriminando sentenças, palavras, vogais nem ritmo (Tabela 4).
REVISÃO SISTEMÁTICA DE LITERATURA E DISCUSSÃOA reabilitação auditiva dos portadores de NF2, que evoluem com surdez, pode ser realizada de duas maneiras: implante coclear ou implante auditivo de tronco encefálico2,3. A escolha do tipo de implante a ser utilizado dependerá da preservação anatômica e funcional do nervo coclear durante a cirurgia de ressecção tumoral2,3. Nesse intuito, os testes eletrofisiológicos desempenham um papel crucial na identificação de respostas do nervo coclear.
Isto pode ser feito no intraoperatório, com a pesquisa do potencial de ação do nervo coclear2. Se esse potencial estiver presente, o implante coclear simultâneo à ressecção tumoral pode ser realizado. Caso esse potencial esteja ausente ou não seja reprodutível, deve-se realizar o teste de estimulação elétrica do promontório 6 a 8 semanas após a cirurgia2. No pós-operatório imediato, o teste de estimulação elétrica do promontório pode ser negativo pela neuropraxia do nervo coclear, devido à manipulação cirúrgica2. Esse teste consiste na introdução de uma agulha transtimpânica, com anestesia tópica, que fará contato com o promontório. O estímulo elétrico é fornecido ao promontório em cinco frequências diferentes (50, 100, 200, 400 e 800 Hz) e o nível de corrente, inicialmente de 0 microampère, é aumentado progressivamente até o paciente ouvir ou perceber o estímulo2. O teste é considerado positivo quando há percepção discreta de um tom e diferenciação entre os diferentes pitches. Quando apenas sensação de desconforto pelo estímulo elétrico é obtida, o teste é considerado negativo2.
Dados descritos na literatura de oito pacientes com preservação anatômica do nervo coclear submetidos à cirurgia de IC, mas sem comprovação funcional por algum teste eletrofisiológico, mostraram resultados inferiores ao grupo de pacientes com confirmação funcional do nervo coclear15,16 (Tabela 5). Apenas três dos oito casos apresentaram discriminação de sentenças15,16 (Tabela 5). Já os dados do outro grupo de seis pacientes com preservação anatômica e funcional do nervo coclear, comprovada por testes eletrofisiológicos, mostraram discriminação de sentenças em todos os casos, numa média de 74,5 ± 18,8% (50-100)2,16,17 (Tabela 5).
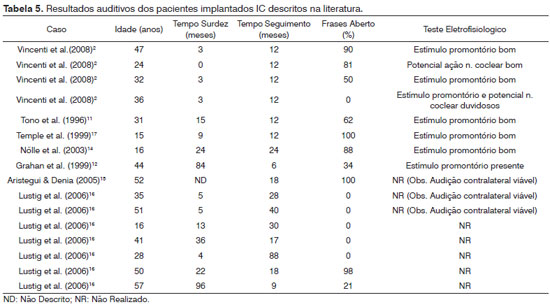
Em um caso com estimulação do promontório presente, porém, com tempo muito longo entre a cirurgia de ressecção tumoral e do implante coclear, a discriminação de sentenças em formato aberto foi pior12 (Tabela 5). Nesse caso, o giro basal da cóclea encontrava-se ossificado no intraoperatório, sugerindo que a inserção do feixe de eletrodos na cóclea, quando não for simultâneo à exérese tumoral, deve ser realizado no menor tempo possível para evitar a ossificação coclear consequente à manipulação cirúrgica12. Em um caso com preservação anatômica do nervo coclear, mas com resposta duvidosa tanto no teste de estimulação elétrica do promontório quanto no potencial de ação do nervo, não foi obtida discriminação de fala2 (Tabela 5). O mesmo foi observado por nós no paciente com IC; apesar da preservação anatômica do nervo coclear, o teste de estimulação elétrica do promontório obteve resposta pobre e a paciente não discrimina os sons. Por isso, a importância da comprovação funcional do nervo para obtenção de um bom resultado audiológico.
Quando não for possível preservar o nervo coclear durante a cirurgia de ressecção do schwannoma vestibular ou que a sua preservação anatômica não gerou respostas eletrofisiológicas, a única opção viável para reabilitação auditiva é o implante auditivo de tronco encefálico1,2,4-6,16,18-21.
Estudos mostram que o ABI apresenta respostas audiológicas variáveis. Mas é consenso que o ABI permitirá a percepção dos sons ambientais de alerta em 85%7 a 96,2%5 dos pacientes após um ano da cirurgia, além de facilitar a leitura orofacial5,18,20.
Pacientes com percepção auditiva reconhecem a diferença entre o som da fala humana e o som ambiente e 64% reconhecem a diferença entre as vozes feminina/masculina e adulto/infantil5. O reconhecimento médio de sentenças em formato aberto após 1 ano de uso do ABI varia entre os estudos de menos de 5% a 48%, conjuntamente com leitura orofacial os valores variam entre 25% a 79%20. No geral, o uso do ABI fornece um ganho adicional entre 30% a 40% comparado com a leitura orofacial isolada1,2,5,18-20. O uso do telefone não é um resultado esperado, sendo a exceção à regra2,5.
O benefício fornecido pelo ABI não dispensa o treinamento de leitura orofacial e a reabilitação multidisciplinar é muito importante para a evolução do paciente1. Mesmo após um ano de uso do ABI, melhoras continuam sendo observadas4. Em nossa série, um dos pacientes apresentou piora na percepção auditiva com o passar dos anos, apesar de seus limiares tonais terem melhorado. Dos seis eletrodos funcionantes que ele possuía, apenas quatro permaneceram. Não sabemos ao certo a explicação para essa deterioração, mas, por ser o paciente com tumor de maiores dimensões, especula-se que possa ter ocorrido dano progressivo no núcleo coclear, evidenciado pela progressiva desativação de eletrodos ao longo do tempo. Os eletrodos são desativados quando a estimulação não gera sensação auditiva significativa ou quando causa sensações extra-auditivas (efeitos colaterais por estimulação de núcleos adjacentes). Neste paciente, com o passar do tempo foi preciso aumentar a carga elétrica para a geração de estimulação auditiva, o que levou à maior dissipação da estimulação e efeitos colaterais maiores.
Comparando os resultados da literatura obtidos em pacientes com NF2 com preservação anatômica e funcional do nervo coclear e submetidos ao IC com aqueles submetidos ao ABI, não se observaram grandes diferenças em relação ao reconhecimento de vogais e consoantes2. Já o reconhecimento de dissílabos e de sentenças foi superior com o implante coclear2. Além disso, a maior parte dos implantados com IC utilizam o telefone.
CONCLUSÃOPacientes portadores de Neurofibromatose tipo 2 dispõem de recursos tecnológicos que auxiliam na reabilitação auditiva, fornecendo um ganho adicional ao treinamento de leitura orofacial. Embora nossa experiência tenha demonstrado o contrário, a literatura mostra que quando a preservação anatômica e funcional do nervo coclear é possível, o implante coclear proporcionará melhores resultados auditivos e de linguagem. Quando a preservação do nervo coclear não for possível, pode-se utilizar o implante auditivo de tronco encefálico para o mesmo fim.
REFERÊNCIAS1. Kanowitz SJ, Shapiro WH, Golfinos JG, Cohen NL, Roland JT Jr. Auditory brainstem implantation in patients with neurofibromatosis type 2. Laryngoscope. 2004;114(12):2135-46.
2. Vincenti V, Pasanisi E, Guida M, Di Trapani G, Sanna M. Hearing rehabilitation in neurofibromatosis type 2 patients: cochlear versus auditory brainstem implantation. Audiol Neurootol. 2008;13(4):273-80.
3. Hitselberger WE, House WF, Edgerton BJ, Whitaker S. Cochlear nucleus implants. Otolaryngol Head Neck Surg. 1984;92(1):52-4.
4. Maini S, Cohen MA, Hollow R, Briggs R. Update on long-term results with auditory brainstem implants in NF2 patients. Cochlear Implants Int. 2009;10 Suppl 1:33-7.
5. Nevison B, Laszig R, Sollmann WP, Lenarz T, Sterkers O, Ramsden R, et al. Results from a European clinical investigation of the Nucleus multichannel auditory brainstem implant. Ear Hear. 2002;23(3):170-83.
6. Colletti V, Shannon RV. Open set speech perception with auditory brainstem implant? Laryngoscope. 2005;115(11):1974-8.
7. Ebinger K, Otto S, Arcaroli J, Staller S, Arndt P. Multichannel auditory brainstem implant: US clinical trial results. J. Laryngol Otol Suppl. 2000;(27):50-3.
8. Bento RF, Brito Neto RV, Tsuji RK, Gomes MQ, Goffi-Gomez MV. Auditory Brainstem Implant: surgical technique and early audiological results in patients with neurofibromatosis type 2. Braz. J Otorhinolaryngol. 2008;74(5):647-51.
9. Cueva RA, Thedinger BA, Harris JP, Glasscock ME 3rd. Electrical promontory stimulation in patients with intact cochlear nerve and anacusis following acoustic neuroma surgery. Laryngoscope. 1992;102(11):1220-4.
10. Hulka GF, Bernard EJ, Pillsbury HC. Cochlear implantation in a patient after removal of an acoustic neuroma: the implications of magnetic resonance imaging with gadolinium on patient management. Arch Otolaryngol Head Neck Surg. 1995;121(4):465-8.
11. Tono T, Ushisako Y, Morimitsu T. Cochlear implantation in an intralabyrinthine acoustic neuroma patient after resection of an intracanalicular tumour. J Laryngol Otol. 1996;110(6):570-3.
12. Graham J, Lynch C, Weber B, Stollwerck L, Wei J, Brookes G. The magnetless Clarion cochlear implant in a patient with neurofibromatosis 2. J Laryngol Otol. 1999;113(5):458-63.
13. Ahsan S, Telischi F, Hodges A, Balkany T. Cochlear implantation concurrent with translabyrinthine acoustic neuroma resection. Laryngoscope. 2003;113(3):472-4.
14. Nölle C, Todt I, Basta D, Unterberg A, Mautner VF, Ernst A. Cochlear implantation after tumour resection in neurofibromatosis type 2: impact of infra- and postoperative neural response telemetry monitoring. ORL J Otorhinolaryngol Relat Spec. 2003;65(4):230-4.
15. Aristegui M, Denia A. Simultaneous cochlear implantation and translabyrinthine removal of vestibular schwannoma in an only hearing ear: report of two cases (neurofibromatosis type 2 and unilateral vestibular schwannoma). Otol Neurotol. 2005;26(2):205-10.
16. Lustig LR, Yeagle J, Driscoll CL, Blevins N, Francis H, Niparko JK. Cochlear implantation in patients with neurofibromatosis type 2 and bilateral vestibular schwannoma. Otol Neurotol. 2006;27(4):512-8.
17. Temple RH, Axon PR, Ramsden RT, Keles N, Deger K, Yücel E. Auditory rehabilitation in neurofibromatosis type 2: a case for cochlear implantation. J Laryngol Otol. 1999;113(2):161-3.
18. Otto SR, Shannon RV, Wilkinson EP, Hitselberger WE, McCreery DB, Moore JK, et al. Audiologic outcomes with the penetrating electrode auditory brainstem implant. Otol Neurotol. 2008;29(8):1147-54.
19. Behr R, Müller J, Shehata-Dieler W, Schlake HP, Helms J, Roosen K, et al. The High Rate CIS Auditory Brainstem Implant for Restoration of Hearing in NF-2 Patients. Skull Base. 2007;17(2):91-107.
20. Otto SR, Brackmann DE, Hitselberger W. Auditory brainstem implantation in 12- to 18-year-olds. Arch Otolaryngol Head Neck Surg. 2004;130(5):656-9.
21. Grayeli AB, Kalamarides M, Bouccara D, Ambert-Dahan E, Sterkers O. Auditory brainstem implant in neurofibromatosis type 2 and non-neurofibromatosis type 2 patients. Otol Neurotol. 2008;29(8):1140-6.
1. Médico Otorrinolaringologista (Fellow Cirurgia Otologica e Base Lateral do Crânio do Departamento de Otorrinolaringologia do HCFMUSP).
2. Doutorado (Fonoaudióloga do Departamento de Otorrinolaringologia do HCFMUSP).
3. Doutorado (Médico assistente do Departamento de Otorrinolaringologia do HCFMUSP).
4. Médico Neurocirurgião (Médico assistente da Disciplina de Neurocirurgia da Faculdade de Medicina USP).
5. Livre Docência (Professor Associado da Disciplina de Otorrinolaringologia da Faculdade de Medicina USP).
6. Livre Docência (Professor Titular da Disciplina de Otorrinolaringologia da Faculdade de Medicina USP).
Departamento de Otorrinolaringologia e Neurocirurgia do Hospital das Clinicas da Faculdade de Medicina da Universidade de São Paulo.
Endereço para correspondência:
Tatiana Alves Monteiro
Av. Doutor Eneas de Carvalho Aguiar, nº 155, 6º andar, sala 6167
São Paulo - SP. Brasil
Tel: +55 (11) 81537487. Fax: +55 (11) 30697833
E-mail: vitatimonteiro@ig.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 27 de junho de 2011. cod. 8656.
Artigo aceito em 13 de abril de 2012.


