INTRODUÇÃOA orientação espacial em relação ao eixo gravitacional da Terra é de suma importância para a manutenção da postura, marcha e para a maioria das atividades motoras executadas pelos seres humanos. Tal orientação espacial é realizada por meio da integração de quatro diferentes sistemas sensoriais: o interoceptivo, o visual, o somatossensorial e o vestibular1-8.
De forma geral, tal integração multissensorial apresenta vários benefícios reconhecidos, tais como a melhora da acurácia, precisão e tempo de reação promovida pela apresentação simultânea de dois ou mais estímulos sensoriais durante tarefas de discriminação sensorial. Além disso, as informações fornecidas por um único sensor frequentemente são ambíguas e podem tão somente ser resolvidas pela combinação de estímulos de várias fontes sensoriais5,9. Mais especificamente, o envolvimento dessa integração multissensorial na representação da verticalidade foi sugerida, bem como foi amplamente investigado o papel das informações visuais e vestibulares na percepção da verticalidade5,7,8,10-13.
As percepções que representam as percepções espaciais subjetivas de verticalidade são avaliadas pela vertical háptica subjetiva, vertical postural subjetiva, subjetiva da posição adiante e vertical visual subjetiva (VVS)14-18. A vertical háptica subjetiva é determinada pela manipulação de uma barra de madeira ou metal pela posição vertical da Terra com o indivíduo de olhos fechados. A vertical háptica subjetiva é guiada pela percepção háptica originária da estimulação de mecanorreceptores da pele, músculos, tendões e articulações no processo de exploração manual da barra no espaço7,14,15. A vertical postural subjetiva é avaliada com o indivíduo assentado em uma cadeira reclinável capaz de girar num plano específico imobilizada por estabilização lateral para evitar reações posturais. O indivíduo informa, na ausência de visão, quando sente que seu corpo está orientado na posição vertical. A vertical postural subjetiva se baseia em informações originadas nos graviceptores do tronco e nos receptores de cabeça e pescoço16-18. A subjetiva na posição adiante é avaliada pedindo ao indivíduo que aponte para a direção que ele percebe como adiante; representa um referencial egocêntrico19,20. Por fim, a VVS é avaliada pedindo ao indivíduo que alinhe uma barra luminosa na posição vertical, sem qualquer referência da vertical real, na escuridão total1,21,22.
A VVS é um exame clínico válido e os desvios da barra luminosa em relação ao eixo vertical da gravidade são medidos em graus2-6. Essa capacidade de julgar se a barra está alinhada ou não com a vertical real depende da integridade das informações visuais e vestibulares otolíticas3-6,11,12,15,22,23. Nas informações visuais, há uma dissociação dos fluxos de processamento ventral e dorsal baseados nos mecanismos neurais envolvidos na avaliação de identidade ou localização de um alvo, respectivamente18,24. No córtex visual, a preferência de orientação das células é sistematicamente organizada. Células que respondem a orientações específicas são arranjadas em colunas perpendiculares à superfície cortical e colunas adjacentes que respondem a orientações similares24-28. As informações vestibulares envolvem a orientação gravitacional estática e os movimentos de aceleração cefálica linear, com consequente manutenção de postura e equilíbrio10,12,21. Os órgãos otolíticos produzem os reflexos posturais inconscientes e contribuem com a percepção da orientação espacial29. As informações originadas nos órgãos otolíticos viajam através do nervo auditivo pelos núcleos vestibulares até várias regiões do sistema nervoso central para auxiliar no controle postural, equilíbrio, coordenação dos movimentos oculares e posição da cabeça30,31. Há relatos de que inclinações de VVS são um sinal sensível de disfunção vestibular, especialmente dos otólitos, e que estão presentes em distúrbios periféricos e centrais em qualquer ponto das vias vestibulares, do labirinto ao córtex vestibular2-4,21,32.
O teste dinâmico de VVS consiste do mesmo exame estático para VVS (ajuste da linha virtual na posição vertical sem qualquer referência da vertical real), com o acréscimo de um estímulo em rotação contínua no fundo. Foi descrito que, após a rotação do campo visual periférico, os indivíduos sentem uma sensação de aparente automovimento em geral33. Medidas de VVS demonstram que os valores de VVS são inclinados durante a estimulação dinâmica na mesma direção da rotação em um observador estacionário. Portanto, a VVS dinâmica reflete um processo de substituição dos sinais vestibulares por sinais visuais34. Foi relatado que durante voos espaciais a contribuição relativa das informações visuais foi profundamente aprimorada em microgravidade35, demonstrando uma plasticidade na contribuição das diferentes modalidades sensoriais para a determinação da VVS5.
Vários estudos clínicos investigaram a influência de diferentes afecções como doença de Parkinson, AVC e esclerose múltipla sobre a percepção visual de verticalidade34,36-40. Foi demonstrado que inclinações na VVS após AVC são consequência de lesões que acometem as vias vestibulares centrais (tronco cerebral, tálamo, córtex), as vias sensoriais (tálamo, córtex sensorial) e lesões em regiões relacionadas à análise visuo-espacial, tais como lesões parietais36,37. Pacientes com doença de Parkinson apresentam orientação muito mais variável que controles pareados a dependência aumentada da visão para a realização de tarefas de VVS poderia estar relacionada a atrofia do putâmen presente em pacientes com doença de Parkinson34,38. Pacientes com esclerose múltipla também apresentam VVS anormal, o que pode se dever a acometimento do tronco cerebral e das estruturas cerebelares, achado comumente observado em pacientes com esclerose múltipla39,40. Pacientes com disfunção vestibular periférica unilateral súbita tipicamente apresentam desvios de VVS no mesmo lado da lesão vestibular4,41-43, o que sugere a manutenção da reação de inclinação ocular ipsilateral ao distúrbio vestibular4,41-43. Em pacientes com distúrbios centrais, lesões pontino-medulares tegmentares do tronco encefálico causam desvios ipsilaterais na VVS. Na presença de lesões pontino-mesencefálicas tegmentares, desvios contralaterais na VVS podem ser observados44,45. Além disso, lesões posterolaterais no tálamo ou parieto-insulares unilaterais no córtex vestibular podem causar desvios ipsilaterais ou contralaterais de VVS46.
A VVS é uma modalidade amplamente utilizada na avaliação da percepção de verticalidade tanto em pesquisa como na prática clínica. Contudo, vários aparatos foram propostos para avaliar VVS. Alguns autores avaliaram VVS com um dispositivo mecânico de vertical háptica subjetiva composto por um fundo circular preenchido com círculos e uma barra, que o paciente deve posicionar na posição vertical. Chamado VVS háptica, esse método permite a avaliação da VVS estática (disco estático) e da VVS dinâmica (disco rotativo)1,5,47. Entretanto, esse método fornece informações somatossensoriais além das informações sensoriais utilizadas na execução da tarefa, gerando, assim, resultados que não conseguem avaliar precisamente ou isolar o sistema sensorial comprometido. Um outro dispositivo usado com frequência é uma linha de laser projetada em uma tela, em que o ângulo do desvio da linha pode ser lido36. Porém, essa técnica não permite a realização de exames dinâmicos.
Em função das lacunas deixadas pelos aparatos de VVS mencionados acima, o objetivo do presente estudo é desenvolver um sistema virtual para simplificar a avaliação e produzir uma ferramenta simples e flexível para a prática clínica. O software desenvolvido no presente estudo irá aumentar a acessibilidade aos profissionais especializados em função otolítica e distúrbios do equilíbrio humano, melhorando o tratamento dessas afecções. Além disso, o fato de ser esta uma ferramenta computacional permite que o exame seja explorado em diferentes configurações de estimulação visual, possibilitando assim o desenvolvimento de novos estudos.
MÉTODO
Desenvolvimento do softwareO desenvolvimento do software foi feito em Qt3, uma biblioteca de classes do C++ e um conjunto de ferramentas para construir programas de interface multiplataforma, e a interface do usuário foi elaborada com o Qt Designer da
Trolltech. O sistema operacional escolhido foi Linux.
A estrutura gráfica do software foi baseada na classe QCanvas da biblioteca Qt, que oferece alto desempenho para aplicativos que fazem uso intenso de recursos gráficos.
A principal interface de estimulação (Figura 1) consistiu de um fundo branco e uma linha com sete círculos vermelhos. A linha de sete círculos vermelhos está sempre alinhada para estimular uma linha de 11 cm que o indivíduo deve alinhar na posição vertical. Quando a linha é movida, ela gira em ambas as direções (sentido horário e anti-horário) com o centro de rotação localizado no meio da linha.
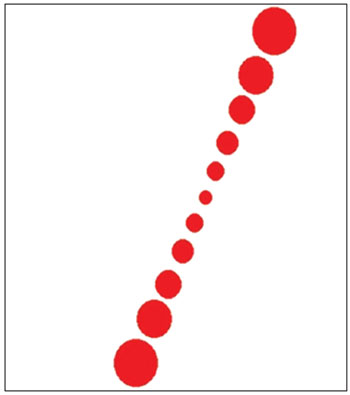
Figura 1. Tela de interface do software exibindo ambiente de estimulação.
O uso de uma linha de círculos ao invés de um retângulo ou uma agulha se deveu ao fato de a linha inclinada no monitor não ser suave o suficiente para a aplicação em questão, apresentando mudanças em sua geometria, dependendo do ângulo de inclinação. Tais fatos poderiam dar indicações sobre o ângulo de inclinação e, portanto, introduzir viés indesejável na avaliação.
Dois outros campos foram incluídos no software. Um para informar dados do paciente a ser examinado e outro para mostrar resultados em graus de cada medição da avaliação. A precisão da medição do ângulo foi ajustada em 0,1 grau.
O exameO exame de VVS consistiu no ajuste de uma linha virtual composta por uma linha de sete círculos vermelhos na posição vertical usando o mouse do computador. O botão da direita girava a linha no sentido horário (SH) e o da esquerda a girava no sentido anti-horário (SAH) e podiam ser controlados pelo examinador ou pelo paciente. A tela foi configurada em modo tela cheia (Figura 2 A-B) e um tubo foi utilizado para privar o voluntário de referências visuais externas (Figura 3 A-B). O tubo conectava a tela ao rosto do paciente e tinha 30 cm de comprimento, 30 cm de diâmetro com interior preto opaco para evitar reflexos. Assim, o ângulo visual apresentado era de 20,14º e o exame também era executado em sala totalmente escura para evitar referências visuais.
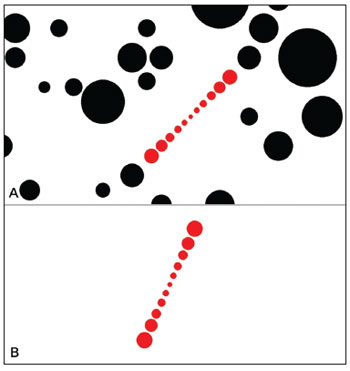
Figura 2. A: Representação de excitação visual em tela cheia. Para condição dinâmica. B: Representação de excitação visual em tela cheia. Para condição estática.
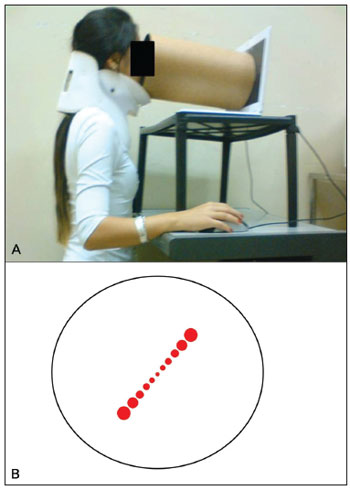
Figura 3. A: Exame de VVS é executado na posição demonstrada. B: Tubo escuro conectado ao monitor para permitir que o exame seja conduzido sem referências externas.
A VVS foi avaliada em condições estáticas e dinâmicas. Para a condição estática, a tela projetava apenas a linha de círculos vermelhos sobre o fundo branco sem qualquer outro estímulo visual. Para a condição dinâmica, além da linha de sete círculos contra o fundo branco, de maneira a proporcionar estímulos visuais dinâmicos, a tela também projetava círculos pretos em posições e tamanhos aleatórios girando nos sentidos horário ou anti-horário, conforme determinação do examinador. A velocidade angular do círculo preto podia ser facilmente modificada pelo teclado, e seu valor correspondente era exibido no canto superior esquerdo da tela. A tecla 'para cima' aumentava e a tecla 'para baixo' reduzia a velocidade angular. No presente estudo, foi utilizada velocidade angular de 30º/s.
Os voluntários permaneceram sentados com as costas eretas. Eles foram orientados a girar a barra usando o mouse do computador e a informar o examinador quando a linha estivesse na posição vertical. Assim, quando o indivíduo estava satisfeito com a orientação da linha, o examinador executava um comando no teclado para salvar o desvio angular e o software automaticamente atribuía uma nova posição inicial aleatória à linha. Por convenção, os desvios angulares da linha virtual foram definidos como positivos quando inclinados no SH e negativos quando inclinados no SAH em relação à vertical real. Para minimizar o efeito de aprendizado, cada voluntário executou cinco medidas de VVS para a avaliação real, que não foram incluídas nos resultados do presente estudo. Para cada condição (VVS estática, VVS dinâmica sentido horário e VVS dinâmica sentido anti-horário), seis medidas foram feitas, sendo o resultado final determinado pelo valor médio das medições3,5,48,49. Quando eram completadas 18 medições, uma mensagem de que o teste havia sido concluído aparecia na tela e os resultados eram automaticamente salvos em arquivo de texto com o mesmo nome do sujeito avaliado.
Os participantesTrinta voluntários sãos, 23 do sexo feminino (76,7%) com idades entre 20 e 35 anos (média 24,17 ± 3,9), fizeram o exame de VVS com colar cervical para evitar inclinação cefálica (Figura 3)50. Os critérios de exclusão foram: histórico de vestibulopatia ou sensação anterior de tontura ou vertigem, enxaqueca, doença neurológica ou metabólica. Os sujeitos que usavam lentes visuais corretivas fizeram o exame as utilizando. Todos os voluntários concordaram em participar da pesquisa, que recebeu a aprovação do Comitê de Ética sob o processo número 364/2008.
Análise dos dadosO valor médio das seis medições3,5,48,49 foi usado nas análises dos dados, feitas com o software SPSS (Statistical Package for Social Sciences) 17.0 para Windows. Após o teste de Shapiro-Wilk, as variáveis VVS estática e VVS dinâmica SH apresentaram distribuição normal e foram analisadas pelo teste
t de
Student. As variáveis da VVS dinâmica SAH não apresentaram distribuição normal e foram analisadas pelo teste U de Mann-Whitney. Em todos os testes, o critério para significância estatística foi bicaudal e definido em α < 0,05.
RESULTADOSA Tabela 1 apresenta os valores médios e o desvio padrão (DP) da VVS estática e dinâmica. O desvio médio dos testes de VVS estática foi -0,372º ± 1,21. Na VVS dinâmica sentido horário o desvio médio foi de 1,53º ± 1,80 e na condição dinâmica sentido anti-horário foi -1,11º ± 2,46.
DISCUSSÃORecentemente, novos métodos de avaliação do sistema vestibular foram introduzidos na rotina clínica, trazendo luz à investigação dos reflexos vestibulo-oculares originados na membrana otolítica16. Assim, a aquisição de dados sobre a funcionalidade dos órgãos otolíticos gera diagnósticos mais precisos e, consequentemente, tratamentos mais adequados. Dentre tais avaliações, a determinação da VVS é um método simples e de baixo custo para avaliar a função otolítica16.
Considera-se que valores normais de VVS estática em sujeitos saudáveis variam de -2,0º a +2,0º, em que o sinal positivo corresponde a inclinações no sentido horário e o negativo a inclinações no sentido anti-horário4,10,11,51. Portanto, no presente estudo, os voluntários apresentaram médias consideradas normais.
Para VVS dinâmica já foi descrito que quando o sujeito está na posição ereta o fluxo visual rotativo com velocidade angular constante causa desvio angular na VVS na mesma direção do fluxo visual5,52. Acredita-se que após rotação do campo visual periférico, o indivíduo vivencia uma sensação de aparente automovimento33. Já que os desvios de VVS do presente estudo estavam inclinados na mesma direção de rotação dos círculos pretos (estímulo dinâmico), nota-se que o software desenvolvido provocou o mesmo efeito de fluxo visual observado em estudos anteriores5,23,52 sendo, portanto, capaz de avaliar a VVS dinâmica.
Contudo, a análise dos resultados obtidos na VVS dinâmica é mais complexa, já que envolve processos corticais multivariados e o aparato e os protocolos usados para investigar tal percepção ainda não foram padronizados. Na literatura, o diâmetro do disco usado para promover estímulo visual giratório não está estabelecido, como tampouco a velocidade angular do estímulo de fundo5,23,43,47. Isso mostra que o aprimoramento de protocolos padronizados para percepção visual é essencial. Desta maneira, resultados diferentes que aparentemente indicam diferentes processos no corpo humano acabarão por se dever de fato a diferenças de protocolo e equipamentos utilizados.
A medição da VVS é um parâmetro clínico para a detecção de doenças vestibulares periféricas e centrais e lesões do sistema nervoso central51,53. Assim, é importante para o pessoal clínico dispor de equipamentos adequados para executar esse exame. Recentemente, um estudo desenvolveu um aparato simples para testar VVS usando um balde, que provou ser um método confiável e simples para avaliar pacientes ao lado do leito54. Não obstante, tal avaliação de VVS só poderia ser controlada pelo examinador de modo a evitar a transmissão de informações hápticas para os membros superiores caso o paciente segurasse o balde. Com o software desenvolvido pelo presente estudo, é possível que os pacientes movam a linha virtual sem informações hápticas significativas. Além disso, o presente software também pode ser facilmente usado na rotina clínica.
Uma outra vantagem é que o software de VVS em questão pode ser conectado a equipamentos de realidade virtual, associando a análise de paradigmas estáticos e dinâmicos aos sistemas motor e sensorial. Uma vez que a percepção de verticalidade interage com vários outros sistemas de controle postural, a possibilidade de associar o exame de VVS a avaliações motoras e sensoriais revela-se de grande interesse. O software pode, ainda, ser usado em estudos de imagens funcionais de ressonância magnética em VVS. Essa aplicação envolve o emprego da ressonância para medir a resposta hemodinâmica ao estímulo que, nesse caso, é fornecido pelo software. Portanto, este prático software também possibilitará a identificação de que estruturas cerebrais estão relacionadas à percepção visual de verticalidade55.
CONCLUSÃOO software desenvolvido e descrito no presente estudo provou ser prático e acurado, podendo ser inserido no rol de exames clínicos de rotina. Além disso, ele oferece a vantagem de ser potencialmente utilizado com outros equipamentos diagnósticos (ex.: ressonância magnética). O software não fornece informações hápticas para o paciente, tornando a medição de VVS mais precisa que várias das ferramentas atualmente disponíveis.
AGRADECIMENTOSO presente projeto teve o apoio de FAPESP (Fundação de Apoio à Pesquisa do Estado de São Paulo), CAPES (Coordenação de Aperfeiçoamento de Pessoal de nível Superior) e CNPq (Centro Nacional de Pesquisa).
REFERÊNCIAS1. Anastasopoulos D, Bronstein AM. A case of thalamic syndrome: somatosensory influences on visual orientation. J Neurol Neurosurg Psychiatry. 1999;67(3):390-4.
2. Mazibrada G, Tariq S, Pérennou D, Gresty M, Greenwood R, Bronstein AM. The peripheral nervous system and the perception of verticality. Gait Posture. 2008;27(2):202-8.
3. Barbieri G, Gissot AS, Fouque F, Casillas JM, Pozzo T, Pérennou D. Does proprioception contribute to the sense of verticality? Exp Brain Res. 2008;185(4):545-52.
4. Kanashiro AM, Pereira, CB, Maia FM, Scaff M, Barbosa ER. Subjective visual vertical evaluation in normal Brazilian subjects. Arq Neuropsiquiatr. 2007;65(2B):472-5.
5. Kobayashi H, Hayashi Y, Higashino K, Saito A, Kunihiro T, Kanzaki J, et al. Dynamic and static subjective visual vertical with aging. Auris Nasus Larynx. 2002;29(4):325-8.
6. Pavan TZ, Colafemina JF, Tedeschi W, Carneiro AAO. Virtual apparatus to study the subjective visual vertical. International Summer School and Symposium on Medical Devices and Biosensors. Sept 4-6; 2006.
7. Sharpe JA, Kumar S, Sundaram AN. Ocular torsion and vertical misalignment. Cur Opin Neurol. 2011;24(1):18-24.
8. Aspell JE, Wattam-Bell J, Atkinson J, Braddick OJ. Differential human brain activation by vertical and horizontal global visual textures. Exp Brain Res. 2010;202(3):669-79.
9. Green AM, Angelaki DE. Multisensory integration: resolving sensory ambiguities to build novel representations. Cur Opin Neurobiol. 2010;20(3):353-60.
10. Pérennou DA, Mazibrada G, Chauvineau V, Greenwood R, Rothwell J, Gresty MA, et al. Lateropulsion, pushing and verticality perception in hemisphere stroke: a causal relationship? Brain. 2008;131(Pt 9):2401-13.
11. Barra J, Marquer A, Joassin R, Reymond C, Metge L, Chauvineau V, et al. Humans use internal models to construct and update a sense of verticality. Brain. 2010;133(Pt 12):3552-63.
12. Vingerhoets RA, De Vrijer M, Van Gisbergen JA, Medendorp WP. Fusion of visual and vestibular tilt cues in the perception of visual vertical. J Neurophysiol. 2009;101(3):1321-33.
13. Lorincz EN, Hess BJ. Dynamic effects on the subjective visual vertical after roll rotation. J Neurophysiol. 2008;100(2):657-69.
14. Schuler JR, Bockisch CJ, Straumann D, Tarnutzer AA. Precision and accuracy of the subjective haptic vertical in the roll plane. BMC Neurosci. 2010;11:83.
15. Sharpe JA. What's up doc? Altered perception of the haptic, postural and visual vertical. Neurology. 2003;61(9):1172-3.
16. Saeys W, Vereeck L, Bedeer A, Lafosse C, Truijen S, Wuyts FL. Suppression of the E-effect during the subjective visual and postural vertical test in healthy subjects. Eur J Appl Physiol. 2010;109(2):297-305.
17. Karnath HO, Ferber S, Dichgans J. The origin of contraversive pushing: evidence for a second graviceptive system in humans. Neurology. 2000;55(9):1298-304.
18. Walter E, Dassonville P. Visuospatial contextual processing in the parietal cortex: an fMRI investigation on the induced Roelofs effect. Neuroimage. 2008;42(4):1686-97.
19. Richard C, Rosseaux M, Saj A, Honoré J. Straight ahead in spatial neglect: evidence that space in shifted, not rotated. Neurology. 2004;63(11):2136-8.
20. Saj A, Honoré J, Richard C, Coello Y, Bernati T, Rosseaux M. Where is the "straight ahead" in spatial neglect? Neurology. 2006;67(8):1500-3.
21. Mittelstaedt H. Origin and processing of postural information. Neurosci Biobehav Rev. 1998;22(4):473-8.
22. Trousselard M, Cian C. Contribution of somesthethic cues to the perception of body orientation and subjective visual vertical. Percept Psychophys. 2003;65(8):1179-87.
23. Goto F, Kobayashi H, Saito A, Hayashi Y, Higashino K, Kunihiro T, et al. Compensatory changes in static and dynamic subjective visual vertical in patients following vestibular schwanoma surgery. Auris Nasus Larynx. 2003;30(1):29-33.
24. Koelewijn L, Dumont JR, Muthukumaraswamy SD, Rich AN, Singh KD. Induced and evoked neural correlates of orientation selectivity in human visual cortex. Neuroimage. 2011;54(4):2983-93.
25. Hubel DH, Wiesel TN. Shape and arrangement of columns in cat's striate cortex. J Physiol. 1963;165:559-68.
26. Hubel DH, Wiesel TN, Stryker MP. Anatomical demonstration of orientation columns in macaque monkey. J Comp Neurol. 1978;177(3):361-79.
27. Reid RC, Alonso JM. Specificity of monosynaptic connections from thalamus to visual cortex. Nature. 1995;378(6554):281-4.
28. Ferster D, Chung S, Wheat H. Orientation selectivity of thalamic input to simple cells of cat visual cortex. Nature. 1996;380(6571):249-52.
29. Böhmer A, Mast F. Assessing otolith function by the subjective visual vertical. Ann N Y Acad Sci. 1999;871:221-31.
30. Dieterich M. Central vestibular disorders. J Neurol. 2007;254(5):559-68.
31. Grande G, Bui TV, Rose PK. Distribution of vestibulospinal contacts on the dendrites of ipsilateral splenius motoneurons: an anatomical substrate for push-pull interactions during vestibulocollic reflexes. Brain Res. 2010;1333:9-27.
32. Pavlou M, Wijnberg N, Faldon ME, Bronstein AM. Effect of semicircular canal stimulation on the perception of the visual vertical. J Neurophysiol. 2003;90(2):622-30.
33. Dichgans J, Held R, Young LR, Brandt T. Moving visual scenes influence the apparent direction of gravity. Science. 1972;178(4066):1217-9.
34. Bronstein AM, Yardley L, Moore AP, Cleeves L. Visually and posturally mediated tilt illusion in Parkinson's disease and in labyrinthine defective subjects. Neurology. 1996;47(3):651-6.
35. Rosenhall U. Degenerative patterns in the aging human vestibular neuro-epithelia. Acta Otolaryngol. 1973;76(2):208-20.
36. Bonan IV, Guettard E, Leman MC, Colle FM, Yelnik AP. Subjective visual vertical perception relates to balance in acute stroke. Arch Phys Med Rehabil. 2006;87(5):642-6.
37. Bonan IV, Hubeaux K, Gellez-Leman MC, Guichard JP, Vicaut E, Yelnik AP. Influence of subjective visual vertical misperception on balance recovery after stroke. J Neurol Neurosurg Psychiatry. 2007;78(1):49-55.
38. Barnett-Cowan M, Dyde RT, Fox SH, Moro E, Hutchison WD, Harris LR. Multisensory determinants of orientation perception in Parkinson's disease. Neuroscience. 2010;167(4):1138-50.
39. Crevits L, Venhovens J, Vanoutrive J, Debruyne J. False perception of visual verticality in multiple sclerosis. Eur J Neurol. 2007;14(2):228-32.
40. Serra A, Derwenskus J, Downey DL, Leigh RJ. Role of eye movement examination and subjective visual vertical in clinical evaluation of multiple sclerosis. J Neurol. 2003;250(5):569-75.
41. Vibert D, Häusler R, Safran AB. Subjective visual vertical in peripheral unilateral vestibular diseases. J Vestib Res. 1999;9(2):145-52.
42. Kim HA, Hong JH, Lee H, Yi HA, Lee SR, Lee SY, et al. Otolith dysfunction in vestibular neuritis: recovery pattern and a predictor of symptom recovery. Neurology. 2008;70(6):449-53.
43. Faralli M, Ricci G, Molini E, Longari F, Altissimi G, Frenguelli A. Determining subjective visual vertical: dynamic versus static testing. Otol Neurotol. 2007;28(8):1069-71.
44. Dieterich M, Brandt T. Ocular torsion and tilt of subjective visual vertical are sensitive brainstem signs. Ann Neurol. 1993;33(3):292-9.
45. Zwergal A, Cnyrim C, Glaser M, Fesl G, Brandt T, Strupp M. Unilateral INO is associated with ocular tilt reaction in pontomesencephalic lesions: INO plus. Neurology. 2008;71(8):590-3.
46. Dieterich M, Brandt T. Thalamic infarctions: differential effects on vestibular function in the roll plane. Neurology. 1993;43(9):1732-40.
47. Gómez García A, Jáuregui-Renaud K. Subjective assessment of visual verticality in follow-up of patients with acute vestibular disease. Ear Nose Throat J. 2003;82(6):442-4.
48. Kumagami H, Saino Y, Baba A, Fujiyama D, Takasaki K, Takahashi H. Subjective visual vertical test in patients with chronic dizziness without abnormal findings in routine vestibular function tests. Acta Otolaryngol Suppl. 2009;562:46-9.
49. Faralli M, Longari F, Ricci G, Ibba MC, Frenguelli A. Influence of extero- and proprioceptive afferents of the plantar surface in determining subjective visual vertical in patients with unilateral vestibular dysfunction. Acta Otorhinolaryngol Ital. 2009;29(5):245-50.
50. Funabashi M, Silva NN, Watanabe LM, Santos-Pontelli TE, Colafêmina JF, Carneiro AA, et al. The use of a neck brace does not influence the visual vertical perception. Arq Neuropsiquiatr. 2011;69(3):509-12.
51. Böhmer A, Rickenmann J. The subjective visual vertical as a clinical parameter of vestibular function in peripheral vestibular diseases. J Vestib Res. 1995;5(1):35-45.
52. Dichgans J, Diener HC, Brandt T. Optokinetic-graviceptive interaction in different head positions. Acta Otolaryngol. 1974;78(5-6): 391-8.
53. Brandt T, Dieterich M, Danek A. Vestibular cortex lesions affect the perception of verticality. Ann Neurol. 1994;35(4):403-12.
54. Zwergal A, Rettinger N, Frenzel C, Dieterich M, Brandt T, Strupp M. A bucket of static vestibular function. Neurology. 2009;72(19):1689-92.
55. Dieterich M. Functional brain imaging: a window into the visuo-vestibular systems. Curr Opin Neurol. 2007;20(1):12-8.
1. MSc (Doutorando do Departamento de Física, Faculdade de Filosofia Ciências e Letras de Ribeirão Preto, Universidade de São Paulo).
2. MSc (Doutoranda do Rehabilitation Sciences Department, Faculty of Rehabilitation Medicine, University of Alberta).
3. MSc (Doutorando do Departamento de Clínica Médica, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo).
4. PhD (Pós-Doutorando no Departamento de Neurociências e Ciências do Comportamento, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo).
5. PhD (Hospital das Clínicas, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo).
6. PhD, livre-docente (Docente do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo).
7. PhD (Docente do Departamento de Física, Faculdade de Filosofia, Ciências e Letras de RIbeirão Preto, Universidade de São Paulo).
Endereço para correspondência:
Taiza Elaine Grespan Santos Pontelli
Departamento de Neurociência e Ciências do Comportamento
Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo
Av. Bandeirantes, nº 3900, Monte Alegre
Ribeirão Preto - SP. Brasil. CEP: 14049-900
E-mail: taiza@fmrp.usp.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 17 de abril de 2012. cod. 9158.
Artigo aceito em 10 de junho de 2012.
FAPESP, CAPES e CNPq.


