INTRODUÇÃOA acromegalia é uma doença endócrina rara, com incidência de cerca de cinco casos novos por 1 milhão de habitantes a cada ano1. A grande maioria dos casos trata-se de um adenoma hipofisário secretor de GH, que, por sua vez, induz a síntese do fator de crescimento insulina símile-1 (IGF-1), que é o principal mediador das ações de proliferação celular e metabólicas do GH1,2. As principais comorbidades associadas à acromegalia são doença cardiovascular, diabetes, hipertensão arterial sistêmica, apneia do sono, artrite e desordens do metabolismo ósseo (osteoporose)2-5. Entre as desordens metabólicas, podemos enumerar distúrbios do metabolismo dos carboidratos, como diabetes melito, intolerância à glicose de jejum, resistência à insulina, além de redução do colesterol total e aumento dos triglicerídeos3,5.
Até agora, poucos estudos evidenciaram envolvimento de nervos periféricos e acroparestesias, porém, sem relatos de alterações do sistema nervoso central, exceto pelas alterações compressivas do tumor hipofisário2,5,6. O envolvimento do aparelho auditivo na acromegalia tem sido estudado por diversos autores, com resultados inconsistentes até o momento.
Maj et al.7 mencionaram brevemente alta incidência de perda auditiva condutiva e mista em um grupo de 34 acromegálicos.
Menzel8 relatou um caso de uma paciente de 72 anos com perda auditiva sensorioneural bilateral portadora de acromegalia, tendo atribuído esse achado a uma hipertrofia do osso temporal, com resultante estreitamento dos condutos auditivos internos e pressão sobre os nervos acústicos.
Num estudo com 15 pacientes, Richards9 encontrou perda auditiva condutiva em cinco das 30 orelhas estudadas, atribuindo essa perda à otosclerose, pois em dois casos foi realizada timpanotomia exploradora unilateral, em que o estribo estava fixado e foi substituído por prótese. Nesses casos, a análise histopatológica das platinas removidas evidenciou otosclerose ativa em um paciente e inativa em outro. Ao analisar os limiares auditivos do grupo como um todo e compará-la a uma população controle, afirmou existir deficiência auditiva sensorioneural em graus variados em 100% dos pacientes. Não houve relação estatisticamente significativa com o tempo de doença ou os níveis circulantes de GH, embora os resultados parecessem indicar que os limiares auditivos foram piores naqueles pacientes com níveis menores de GH circulante.
Doig & Gatehouse10, em estudo controlado com 56 indivíduos com acromegalia encaminhados para cirurgia hipofisária, não encontraram diferença significativa entre os grupos com relação aos limiares auditivos por via óssea e aérea.
Crosara et al.11 realizaram estudo controlado com um grupo de 15 pacientes (cinco homens; 10 mulheres, idades entre 39-67 anos) no qual utilizaram audiometria tonal, imitanciometria e potenciais evocados auditivos de tronco encefálico (PEATE), além de estudo radiológico do osso temporal. Os resultados mostraram alta taxa de resultados anormais em todas as frequências testadas, principalmente em 4 e 8 KHz. Somente um paciente apresentou DA mista. Quanto aos PEATE, somente 11 pacientes foram avaliados e apenas dois apresentaram resultados alterados. Em ambos os casos, a latência da onda I foi normal bilateralmente, enquanto em um paciente encontrou-se prolongamento do intervalo I-III e, no outro, os intervalos I-III e III-V estavam alterados. A avaliação radiológica não mostrou anormalidades na orelha média, cápsula ótica ou meato auditivo interno. Não houve correlação entre o grau de DA e a duração da doença ou entre a presença de DA com os níveis de GH.
Ozata et al.6 realizaram uma avaliação do sistema nervoso central e periférico utilizando os PEATE em pacientes acromegálicos. Além disso, avaliaram potenciais evocados somatossensoriais do nervo tibial e mediano num grupo de 10 acromegálicos (nove homens, uma mulher, idades entre 21-65 anos) com doença ativa não tratada (GH maior que 1 ng/mL), comparando com 20 controles saudáveis. Pacientes com alteração no teste de tolerância à glicose ou hipotireoidismo foram excluídos do estudo. Finalmente, evidenciaram prolongamento significativo nas latências dos potenciais no nervo mediano e tibial, porém, todos os componentes dos PEATE foram normais. Assim, os resultados sugeriram existir acometimento neural periférico sem envolvimento neural central nos pacientes avaliados.
Babic et al.12 realizaram avaliação em um grupo de 30 acromegálicos não tratados, comparados com grupo controle de 20 pacientes, na busca por evidências de perda auditiva condutiva. Foi evidenciada maior prevalência de problema de ventilação da orelha média nos pacientes acromegálicos, sete pacientes (23%), contra nenhum do grupo controle,
p = 0,033. Tais pacientes foram significativamente mais velhos, com maior tempo de doença e níveis médios mais baixos de hormônio do crescimento em correlação aos acromegálicos sem esse problema.
Pilecki et al.13 realizaram estudo com 37 acromegálicos (22 mulheres, 15 homens; média idade 51,7 anos, variando entre 21,1-77,8 anos) comparando a 47 controles saudáveis. Foram avaliadas a transmissão neural periférica, representada pela latência da onda I do PEATE, e a transmissão em nível de tronco encefálico, representada pelo intervalo interpico I-V. Em nenhum caso foi encontrada alteração na transmissão periférica. Quando analisados os 74 traçados, resultados normais da latência interpico I-V foram encontrados em 34 casos (45,9%), prolongamento da latência em 33 casos (44,6%) e encurtamento em sete casos (9,5%). Tais resultados sugeriram influência não homogênea da acromegalia sobre o funcionamento cerebral. Os autores sugeriram, ainda, que o prolongamento dos intervalos I-V encontrados poderiam sugerir uma diminuição da mielinização das vias auditivas no tronco encefálico, provavelmente decorrente de alterações no metabolismo da glicose presentes na acromegalia. Nesse estudo, 12 pacientes estavam no estágio ativo da doença, enquanto o restante encontrava-se em fase inativa, porém, não foram descritos os critérios de sucesso terapêutico utilizados para qualificar esses grupos.
Aydin et al.14 publicaram, recentemente, os resultados de avaliação funcional e estrutural da audição em um grupo de 44 pacientes. Foram realizadas, além da avaliação por audiometria e impedanciometria, tomografia computadorizada dos ossos temporais e ressonância nuclear magnética das estruturas do ouvido. Os pacientes foram ainda divididos em três subgrupos, de acordo com a atividade da doença, segundo critérios de Giustina15. A média dos limiares (pure tone average-PTA) tonais foi determinada baseada nos níveis de condução aérea em cada orelha nas frequências de 500, 1000 e 2000 KHz. PTA > 15 dBNA foi considerado perda auditiva. Segundo esse critério, 21 pacientes (48%) demonstraram perda auditiva em pelo menos uma orelha. Além disso, quatro pacientes (9%) tiveram perda condutiva, 13 (30%) sensorioneural e oito (18%) perda mista em pelo menos um lado acometido. Não houve diferenças entre os subgrupos quanto à prevalência de perda auditiva.
Podemos notar claramente que as conclusões acerca de DA em acromegálicos são contraditórias. A escassez de estudos e o número limitado de pacientes são fatores determinantes nas avaliações. Dessa forma, esse trabalho visa avaliar a prevalência e possíveis fatores associados à DA em um grupo de pacientes com acromegalia em tratamento, bem como verificar o funcionamento das vias de transmissão auditiva periférica e central nesse grupo.
MÉTODOSFoi realizado um estudo de coorte contemporânea com corte transversal em ambulatório especializado de um centro de referência terciário. Depois da aprovação pelo Comitê de Ética da instituição (protocolo nº 065.08.07), os pacientes foram avaliados após consentimento livre e esclarecido.
A presença de deficiência auditiva sensorioneural (DASN) foi avaliada por meio da audiometria de tons puros por via aérea e óssea realizada com
Beltone 2000 - Clinical Audiometer (Eletronics corp.; Chicago, Ill.). Definiu-se DA quando a média das frequências graves/médias (250, 500, 1 e 2 KHz) ou a média em agudos (3, 4, 6 e 8 KHz) foi > 25 dbNA em pelo menos uma orelha.
Pacientes com história de uso de ototóxicos, exposição a ruído, trauma encefálico ou história familiar de deficiência auditiva foram excluídos do estudo. Somente foram incluídos pacientes com otoscopia rigorosamente normal. Apenas um paciente avaliado previamente apresentou perfuração timpânica unilateral e não foi incluído no grupo em estudo. Outros dois pacientes foram excluídos, pois não foi possível a aquisição dos PEATE devido à interferência elétrica da atividade muscular. Outros dois pacientes com DA neurossensorial foram excluídos por apresentar idade maior ou igual a 70 anos devido à provável associação com presbiacusia.
Nossa população final constituiu-se de 34 pacientes com acromegalia, 11 homens (43,9 ± 6,2) e 23 mulheres (48,7 ± 14,6).
Doze pacientes (35,3%) apresentaram DASN, enquanto 22 (64,7%) apresentaram limiares auditivos normais. Os pacientes foram divididos em dois subgrupos: grupo A com DASN e grupo B sem DASN. Nenhum paciente apresentou DA condutiva ou mista.
Os grupos foram comparados com relação a parâmetros clínicos e laboratoriais, incluindo níveis séricos de hormônio do crescimento (Growth hormone- GH) e fator de crescimento insulina símile (Insuline-like growth factor - 1 IGF-1). Consideramos o índice de massa corporal (IMC) elevado quando maior que 25 Kg/m
2.
Também agrupamos os pacientes quanto à presença de acromegalia em atividade. Os pacientes foram divididos em dois grupos: com doença ativa e doença controlada. Definimos doença controlada quando o nível de IGF-1 foi normal para sexo e idade e o nível de GH < 1.0 µg/litro, segundo proposto por Giustina et al.4.
Além disso, todos os pacientes foram avaliados por meio dos potenciais evocados auditivos de tronco encefálico (PEATE) com equipamento Medical PC da Interacustics A/S (Denmark, 2005) com software
IaBaseII, version 4.08, em ambiente silencioso. Os potenciais foram evocados utilizando-se 2000 cliques rarefeitos, com taxa de estimulação de 20 cliques/segundo, com intensidade de 100 dBNA. Os estímulos foram monoaurais (fone ABR-3A), com mascaramento contralateral (40 dBNA inferior ao estímulo). O filtro passa-banda manteve-se entre 0 a 3000 Hz e a impedância abaixo de 3 Kohms. Foram avaliadas as latências absolutas das ondas I e os intervalos interpicos I-III, III-V e I-V.
Para avaliar a normalidade da distribuição, foi utilizado o teste de Kolmogorov-Smirnov quando necessário. Utilizou-se o teste
t-Student para comparação de médias e o χ
2 para comparação de proporções entre grupos, bem como o teste exato de Fisher. Os resultados são apresentados na forma de média ± desvio padrão. Foi estabelecido nível de significância de 5% (α = 0,05). Para as análises estatísticas, utilizou-se o software SPSS 12.0 Inc.
RESULTADOSDoze (35,3%) pacientes apresentaram DA neurossensorial (48,2 ± 9,0 anos) - Grupo A, enquanto 22 (64,7%) apresentaram limiares auditivos normais (46,6 ± 14,3 anos) - Grupo B. Não houve diferença em relação à idade entre os dois grupos (
p = 0,7). Além disso, em ambos houve prevalências semelhantes de diabetes/intolerância a glicose (
p = 1,5) sendo 41,7% no grupo A vs. 63,6% no grupo B. O grupo A apresentou igual proporção entre os sexos (seis homens: seis mulheres), enquanto no grupo B encontramos 17 mulheres e cinco homens.
Dentre os pacientes do grupo A, oito apresentaram DA bilateral e quatro unilateral. Além disso, quatro apresentaram DA para graves e agudos, enquanto oito somente em frequências agudas (Tabela 1).
Quando analisamos cada frequência sonora isoladamente observou-se, tanto nas orelhas esquerdas quanto nas direitas, a presença de limiares auditivos elevados (> 25 DBNA) em quase todas as frequências analisadas em pelo menos um paciente. Tal alteração predominou nas frequências de 3, 4, 6 e 8 KHz bilateralmente (Gráficos 1 e 2).
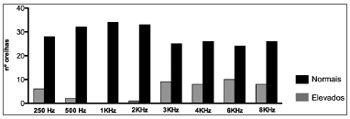
Gráfico 1. Número de orelhas direitas com limiares tonais auditivos normais e alterados (> 25 DBNA) nas diferentes frequências.
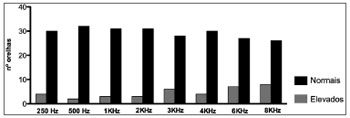
Gráfico 2. Número de orelhas esquerdas com limiares tonais auditivos normais e alterados (> 25 DBNA) nas diferentes frequências.
Diversos dados laboratoriais relacionados a distúrbios do metabolismo foram avaliados em ambos os grupos. Avaliaram-se os níveis de colesterol total, HDL, LDL, triglicerídeos, glicemia de jejum, não havendo diferença significativa entre esses parâmetros nos grupos A e B (Tabela 2).
Os pacientes do grupo A apresentarem nível médio de GH menor (média = 1,76 µg/litro) em relação aos pacientes do grupo B (média = 4,4 µg/litro), embora sem associação significante (
p = 0,2). O mesmo ocorreu com os níveis de IGF-1, quando analisados como variável contínua (Tabela 2). O tempo médio estimado de duração da doença foi de 10,2 ± 5,5 anos no grupo A e de 7,7 ± 5,9 anos no grupo B, sem diferença significativa entre os grupos (
p = 0,2).
Não houve diferença estatisticamente significativa entre os grupos com relação às variáveis categóricas: presença de hipertensão arterial sistêmica, cirurgia tranesfenoidal, radioterapia, uso de cabergolina, nível normal de IGF-1 (titulados para o sexo e faixa etária), IMC normal ou elevado. Quando analisados os grupos em relação à presença de acromegalia em atividade e deficiência auditiva, não se encontrou associação estatística (
p = 0,4).
Quando avaliadas as latências absolutas da onda I e os intervalos interpicos I-III, III-V e I-V, para a orelha direita e esquerda separadamente, não houve diferença significativa entres os grupos A e B (Tabelas 3 e 4).
DISCUSSÃOPoucos artigos existem na literatura abordando a possível relação entre deficiência auditiva e acromegalia. No presente estudo, encontrou-se prevalência de 14 pacientes (38,9%) com deficiência auditiva sensorioneural, predominantemente bilateral e em frequências agudas (Tabela 1). Aydin et al.14 encontraram prevalência DA de 48% sendo 30% sensorioneural, porém, utilizaram como critério PTA > 15 DBNA, mais sensível que o utilizado no presente estudo.
Não houve pacientes com DA condutiva ou mista no grupo avaliado. Dessa forma, tais resultados não reforçam o proposto por Richards9 acerca da maior incidência de otosclerose na acromegalia, quando é esperado existir DA condutiva com membrana timpânica normal.
Quando avaliada cada frequência isoladamente em ambas as orelhas (Gráficos 1 e 2) também se percebeu a presença de limiares auditivos aumentados. Os resultados alterados estiveram presentes em quase todas as frequências avaliadas, pelo menos em um paciente. Além disso, predominaram nos sons agudos e de forma bilateral. Tais resultados são compatíveis com os resultados de Crosara et al.11, que evidenciaram altas taxas de resultados alterados principalmente em 4 e 8 KHz.
Ao compararmos os grupos A e B não foi possível identificar associações significativas entre medicações em uso, comorbidades e distúrbios do metabolismo com DASN. Destaca-se que os pacientes do grupo A apresentaram idade média maior, tempo mais longo de doença e níveis menores de GH que o grupo B, porém, sem significância estatística. De forma semelhante, Richards9 concluiu que seus resultados pareciam indicar que os limiares auditivos foram piores naqueles pacientes com níveis menores de GH circulante. Ao contrário, Babic et al.12 encontraram alterações semelhantes (maior idade, maior tempo de doença e menores níveis de GH) ao comparar pacientes com acromegalia com e sem distúrbio de ventilação da orelha média; nesse caso, as alterações foram estatisticamente significativas.
A proporção de pessoas com acromegalia em atividade, segundo os critérios de Giustina et al.4, foi semelhante nos dois grupos. Dessa forma, não parece haver, pelo menos diretamente, interferência negativa dos níveis excessivos de GH e IGF-1 sobre o funcionamento do sistema auditivo periférico, seja a nível coclear ou retrococlear.
O presente artigo talvez seja o primeiro a realizar o modelo de comparação de PEATE entre acromegálicos com e sem DASN. Quando avaliada a transmissão dos impulsos elétricos auditivos por meio dos PEATE, constatou-se não haver diferença significativa entre os grupos A e B. Todos os pacientes foram submetidos à verificação dos limiares auditivos tonais e apresentaram limiares que possibilitavam a aquisição dos potenciais.
Dessa forma, mesmo com limiares auditivos alterados em diversas frequências no grupo A, não houve diferença entre os grupos na transmissão neural ao nível do nervo auditivo (onda I) e do tronco encefálico (intervalos interpico I-III e III-V).
Não se conseguiu determinar, no presente estudo, fatores que pudessem estar envolvidos no desenvolvimento de DA em pacientes com acromegalia. Fatores associados e prevalentes nessa doença como diabetes/intolerância a glicose de jejum, hipertensão arterial sistêmica e índice de massa corporal elevado não se associaram estatisticamente ao desfecho. Os níveis menores de GH, o maior tempo de doença e maior idade média talvez estejam implicados na DA sensorioneural, mas requerem um maior número de estudos e grupos maiores de indivíduos para uma melhor análise estatística. Devido à raridade da doença, não se podem esperar estudos com grupos muito grandes de indivíduos.
Questões quanto à real relação de causa e efeito entre acromegalia e DA requerem estudos longitudinais, nos quais os fatores causais possam ser avaliados com precisão. Estudos transversais podem revelar associações estatísticas, porém, sem determinar causalidade.
CONCLUSÃONesse estudo encontrou-se uma prevalência de DASN (35,3%) em um grupo de pacientes com acromegalia em tratamento. Predominaram as perdas bilaterais e nas frequências agudas. As frequências mais acometidas foram de 3000, 4000, 6000 e 8000 Hz, em ambas as orelhas.
Não houve associação estatística entre DASN e parâmetros clínico-laboratoriais analisados, incluindo tempo de doença, idade média, atividade da doença, distúrbios metabólicos, nível de GH e IGF-1. Além disso, não houve distúrbio de transmissão periférica ou ao nível de tronco encefálico nas vias auditivas quando comparados os grupos A e B.
REFERÊNCIAS1. Melmed S. Acromegaly pathogenesis and treatment. J Clin Invest. 2009;119(11):3189-202.
2. Møller N, Jørgensen JO. Effects of growth hormone on glucose, lipid and protein metabolism in human subjects. Endocr Rev. 2009;30(2):152-77.
3. Scacchi M, Cavagnini F. Acromegaly. Pituitary. 2006;9(4):297-303.
4. Giustina A, Chanson P, Brostein MD, Klibanski A, Lamberts S, Casanueva FF, et al. A consensus on criteria for cure of acromegaly. J Clin Endocrinol Metab. 2010;95(7):3141-8.
5. Colao A, Ferone D, Marzullo P, Lombardi G. Systemic complications of acromegaly: epidemiology, pathogenesis and management. Endocr Rev. 2004;25(1):102-52.
6. Ozata M, Ozkardes A, Beyhan Z, Coracki A, Gundogan MA. Central and peripheral neural responses in acromegaly. Endocr Pract. 1997;3(3):118-22.
7. Maj J, Materlich H, Szymczyk K. Zagadnienie akromegalii w otolaryngologii. Otolaryngol Pol. 1965;19(4):497-500.
8. Menzel O. Hearing loss secondary to acromegaly: case report. Eye Ear Nose Throat Mon. 1966;45:84-5.
9. Richards S. Deafness in acromegaly. J Laryngol Otol. 1968;82(12):1053-65.
10. Doig JA, Gatehouse S. Hearing in acromegaly. J Laryngol Otol. 1984;98(11):1097-101.
11. Crosara C, Colletti V, Sittoni V, Bonanni G, Motta RG. Analysis of auditory and brainstem function in acromegalic patients. Adv Audiol. 1985;3:152-60.
12. Babic BB, Petakov MS, Djukic VB, Ognjanovic SI, Arsovic NA, Isailovic TV, et al. Conductive hearing loss in patients with active acromegaly. Otol Neurotol. 2006;27(6):865-70.
13. Pilecki W, Bolanowski M, Janocha A, Daroszewski J, Kaluzny M, Sebzda T, et al. Assessment of brainstem auditory evoked potentials (BAEPs) in patients with acromegaly. Neuroendocrinol Lett. 2008;29(3):373-8.
14. Aydin K, Ozturk B, Turkyilmaz MD, Dagdelen S, Ozgen B, Unal F, et al. Functional and structural evaluation of hearing in acromegaly. Clin Endocrinol (Oxf). 2012;76(3):415-9.
15. Giustina A, Barkan A, Casanueva FF, Cavagnini F, Frohman L, Ho K, et al. Criteria for cure of acromegaly: a consensus statement. J Clin Endocrinol Metab. 2000;85:526-9.
1. Médico Otorrinolaringologista (Mestrando em Saúde Pública da Faculdade de Medicina da Universidade Federal do Ceará).
2. Médico Endocrinologista Doutor (Professor Adjunto da Faculdade de Medicina da Universidade Federal do Ceará).
3. Médico Otorrinolaringologista Doutor (Professor Adjunto da Faculdade de Medicina da Universidade Federal do Ceará).
4. Médico Endocrinologista Doutor (Professor Adjunto da Universidade Federal de Pernambuco).
5. Bacharel em Fonoaudiologia (Fonoaudióloga do Serviço de Otorrinolaringologia do Hospital Universitário Walter Cantídio da Universidade Federal do Ceará).
Faculdade de Medicina Universidade Federal do Ceará.
Endereço para correspondência:
Marcelo Alexandre Carvalho
Rua Jaime Benévolo, 414. José Bonifácio
Fortaleza - CE. Brasil. CEP: 60050-080
E-mail: marceloalexc@yahoo.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 6 de março de 2012. cod. 9075.
Artigo aceito em 20 de maio de 2012.


