INTRODUÇÃOOs papilomavírus humanos (HPV) pertencem à família
Papillomaviridae. São pequenos, epiteliotrópicos e têm cerca de 55 mm de diâmetro. Apresentam um genoma composto de 7200 a 8000 pares de base com peso molecular de 5,2 x 106 daltons. O HPV é formado por um capsídeo que possui 72 capsômeros de estruturas icosaédricas, sem envelope lipoproteico e uma única molécula circular dupla de DNA1. Seu genoma é dividido em E (early - codifica as proteínas que serão produzidas inicialmente) e L (late - codifica as proteínas que serão produzidas após as proteínas da região E). Essas duas regiões representam, respectivamente, 45% e 40% do genoma viral e contêm as open reading frames (ORFS) E1, E2, E4, E5, E6, E7, L1 e L2. Sabe-se que o gene E1 está envolvido com a manutenção e replicação do DNA viral; E2 regula a transcrição viral e E4 codifica uma proteína que destrói a queratina citoplasmática, produzindo a imagem do halo de coilocitose. Acredita-se que E5, E6 e E7 estão envolvidas com a transformação e degradação celular; enquanto a L1 e L2 codificam as proteínas do capsídeo viral. Entre as regiões E e L, está a região não codificadora denominada LCR (long control region) ou URR (upstream regulatory region), representando 15% do genoma viral envolvido no controle da expressão dos genes virais2.
A infecção pelo HPV é basicamente de forma sexual. Como tal, tanto os homens como as mulheres estão envolvidos na cadeia epidemiológica da infecção e são capazes, ao mesmo tempo, de serem portadores assintomáticos, transmissores e vítimas da infecção pelo HPV. Neste sentido, os fatores de risco estão claramente associados com o comportamento sexual do indivíduo. Os mais importantes são: idade precoce no início das primeiras relações sexuais, número elevado de parceiros sexuais ao longo da vida e contatos sexuais com indivíduos de alto risco (no caso dos homens, contato frequente com as mulheres que praticam prostituição; já no caso das mulheres, relação com homens com múltiplas parceiras sexuais)3.
O HPV infecta células epiteliais e mucosas, podendo causar uma variedade de lesões hiperplásicas. Estes vírus, portanto, podem ser mucosotrópicos, que infectam as mucosas oral, respiratória e genital; e cutaneotrópicos, encontrados em indivíduos imunocompetentes e em portadores de epidermodisplasias verruciformes4. Como o HPV se limita apenas a infectar a camada epitelial, não ultrapassando a membrana basal, a exposição imunológica primária deve ocorrer por meio de mecanismos existentes nesta camada. A membrana celular infectada expressa somente a proteína E5, e esta pequena quantidade de antígenos virais de superfície pode permitir a atenuação da resposta imune. A E5 se liga e inativa a proteína necessária para processar antígenos. Como a célula epitelial não é boa apresentadora de antígenos, o HPV permanece dentro dela sem ser reconhecido pelo sistema imunológico. Devido ao fato do HPV não causar lise ou morte da célula do hospedeiro, o vírus permanece isolado do contato de células do sistema imune, que iniciaria o processo de reconhecimento5.
A infecção viral pode gerar lesões clínicas de forma localizada, subclínica ou latente. De uma maneira geral, o HPV segue o ciclo produtivo viral clássico: adsorção, penetração, transcrição, tradução, replicação do DNA e maturação. Mas, em alguns casos, esse processo não chega a acontecer completamente, uma vez que o vírus pode integrar-se ao genoma das células hospedeiras e induzir à carcinogênese das mesmas. Nas lesões benignas, o vírus está na forma circular, chamada epissomal, não integrado ao genoma da célula hospedeira, e em grande número de cópias. Nas lesões malignas, apresenta-se na forma integrada ao genoma da célula hospedeira. Entretanto, é possível encontrar formas epissomais nas células malignas e, uma vez estando integrado, o vírus não pode ser revertido à sua forma epissomal6.
Os tipos virais de alto e baixo risco de malignidade se diferenciam de acordo com a capacidade de transformação das oncoproteínas codificadas pelos genes E6 e E7. As oncoproteínas E6 e E7 se ligam, respectivamente, às proteínas p53 e pRB, reguladoras do ciclo celular, consideradas supressoras do câncer. Este fenômeno causa o desbloqueio do ciclo celular e instabilidade genética, o que provoca alterações genéticas adicionais que levam ao câncer por impedirem a apoptose, causando o fenômeno de imortalização celular. Este processo é encontrado somente nos vírus de alto risco, não sendo observados nos de baixo risco7.
Estima-se que, no Brasil, haja cerca de 500 mil a 1 milhão de casos novos por ano da infecção pelo HPV, enquanto são registrados 80 mil casos de AIDS, 200 mil a 500 mil casos de herpes, 100 mil casos de sífilis e 800 mil ocorrências de gonorreia8. A presença na mucosa oral dos tipos anogenitais, HPV 6/11 e 16/18, poderia significar transmissão orogenital, o que tornaria este vírus um importante cofator no desenvolvimento do câncer oral, assim como é considerado no colo uterino9. A prevalência de HPV em mucosa oral, macroscopicamente normal, é muito variável na literatura: varia de 0 a 81,1%, com média de 10%. Nem sempre as infecções são visíveis macroscopicamente. Assim, a infecção pelo HPV pode ser classificada em: (a) latente, a qual só pode ser diagnosticada por métodos de biologia molecular; (b) subclínica, na qual não há sintomas clínicos, mas há alterações sutis que podem ser detectadas por métodos diagnósticos, como peniscopia, colpocitologia, colposcopia e/ou biópsia; (c) clínica, na qual há lesões evidentes ao exame clínico. Não se sabe, do ponto de vista molecular, como uma infecção por HPV permanece latente e outra, por outro lado, desenvolve lesão macroscópica decorrente de intensa replicação viral10. Os avanços no campo da genética e biologia molecular têm contribuído decisivamente para o estudo desses vírus. De todas as técnicas de detecção de DNA do HPV, a reação em cadeia da polimerase (PCR) é a mais sensível11.
O papilomavírus humano (HPV) se destaca como uma das doenças sexualmente transmissíveis (DST) mais comuns no mundo. O Ministério da Saúde registra a, cada ano, 137 mil novos casos no país. Uma vez que o diagnóstico viral pode ser feito ainda na fase latente da infecção, torna-se possível o acompanhamento do paciente, a fim de alertar para o tratamento adequado de lesões ou alterações que possam surgir como consequência da progressão da infecção viral. Deste modo, o estudo propõe-se a determinar a prevalência do HPV em mucosa oral de pacientes que não apresentam qualquer tipo de lesão e, concomitantemente, avaliar se hábitos sexuais e sociais, como a atividade sexual, presença de parceiro fixo, relação com prostitutas, prática de sexo oral, uso de preservativos e tabagismo, estão associados com a presença viral.
MATERIAL E MÉTODOSO trabalho foi previamente submetido à apreciação e aprovação do Comitê de Ética em Pesquisa e Mérito Científico da instituição, sob a seguinte numeração: 840/2007.
Seleção das amostrasForam coletadas 125 amostras de raspado de mucosa oral, de homens e mulheres escolhidos aleatoriamente, os quais foram esclarecidos sobre a pesquisa, preencheram o questionário com questões comportamentais e assinaram o termo de consentimento, aceitando participar da pesquisa. Para a coleta das amostras, foi utilizada a escovinha "Campos da paz" e o material foi armazenado em tubos do tipo
Eppendorff®, contendo solução salina 0,9%. Os mesmos foram congelados para conservação até a extração.
Questionário ComportamentalO questionário comportamental foi aplicado após prévia explicação sobre a importância do mesmo na pesquisa e esclarecimento de que seus dados seriam mantidos em sigilo (Quadro 1).
Análise EstatísticaO teste exato de Fischer foi utilizado, como ferramenta estatística, a fim de verificar se a prevalência do HPV esta relacionada, de maneira estatisticamente significante, ao sexo e aos hábitos de vida dos pacientes. Um valor de
p menor que 0,05 demonstra a existência de correlação. Também foram obtidos valores de intervalo de confiança (C.I.), estabelecido em 95% e
Odds Ratio. Dados estatísticos foram produzidos pelo programa SISA
® (Simple Interactive Statistical Analysis).
Extração do DNAProcedeu-se, inicialmente, com agitação das amostras em vórtex (AP56 - Phoenix - Brasil) e seguido da retirada de alíquotas de 300 µl, que foram transferidas para outro recipiente. O mesmo foi centrifugado e o sobrenadante desprezado. Ao precipitado, foram adicionados 600 µl de hidróxido de sódio (NaOH) a 50 mM. Levou-se ao "Banho Maria" (MA159 - Marconi - Brasil) a 95ºC por 5 minutos e logo após adicionou-se 60 µl de tris-HCL 1 M. O material extraído foi congelado.
Reação em Cadeia de Polimerase (PCR)Todas as amostras foram submetidas a PCR, utilizando a betaglobina para testar o método de extração e evitar falsos negativos, uma vez que esse gene é comum a todos os seres humanos, devendo, assim, aparecer em todas as amostras.
Para preparar o
mix de reação da PCR para a betaglobina, utilizou-se um
Eppendorf® de 1,5 ml. A mistura de reação é composta, respectivamente, por: 12,5 µl de água deionizada e autoclavada, 2,5 µl de tampão de reação (10x -
Invitrogen®), 1,0 µl de MgCl
2 (50 mM -
Invitrogen®), 2,5 µl de solução de dNTP (deoxinucleotídeo trifosfato) (2 mM -
Invitrogen®), 1,0 µl do par de
primers12 GH
20 (GAAGAGCCAAGGACAGGTAC)/PC04 (CAACTTCATCCACGTTCACC) a 10 pmol/µl (
Invitrogen®), 4 µl de DNA e 0,5 µl de
Taq polimerase (5U/µl -
Invitrogen®), totalizando um volume de 25 µl. Em todos os lotes amplificados, foram utilizados controles negativos (4 µl água no lugar de DNA) e controles positivos para detecção de possíveis contaminantes durante a reação.
Para preparar o
mix de reação da PCR para o HPV, utilizou-se um
Eppendorf® de 1,5 ml. A mistura de reação é composta, respectivamente, por: 12,0 µl de água deionizada e autoclavada, 2,5 µl de tampão de reação (10x -
Invitrogen®), 1,5 µl de MgCl
2 (50 mM -
Invitrogen®), 2,5 µl de solução de dNTP (deoxinucleotídeo trifosfato) (2 mM -
Invitrogen®), 1,0 µl par de
primer2 geral para HPV MY09 (GT CCM AAR GGA WAC TGA TC*) / MY11 (GCM CAG GGW CAT AAY AAT GG*) a 10 pmol/µl (
Invitrogen®), 4 µl de DNA e 0,5 µl de
Taq polimerase (5U/µl -
Invitrogen®), totalizando um volume de 25 µl. Em todas as análises, foram utilizados controles negativos (4 µl água no lugar de DNA) e controles positivos para detecção contaminações e atuar como padrões da presença viral.
Os ciclos térmicos para as reações de PCR foram realizados no Peltier Thermal Cycler
® (
Biocycler Termocicaldores), sendo o programa de amplificação da betaglobina composto de: Um ciclo inicial a 95ºC por 5 minutos, 35 ciclos sucessivos compostos de três etapas (desnaturação a 94ºC por 1 minuto, hibridização a 60ºC por 1 minuto e síntese a 72ºC por 1 minuto) e um ciclo final a 72ºC por 10 minutos. O programa de execução de PCR para o
primer geral do HPV foi composto de: um ciclo inicial a 95ºC por 5 minutos, 35 ciclos sucessivos compostos de três etapas (desnaturação a 94ºC por 1 minuto, hibridização a 40ºC por 1 minuto e síntese a 72ºC por 1 minuto) e um ciclo final a 72ºC por 10 minutos.
Os produtos de PCR foram submetidos à eletroforese em gel de agarose a 1,5% (0,75 g de agarose em 50 ml de tampão TBE 1x e 5,0 µl de brometo de etídeo) em cuba horizontal (Horizon 11-14
® -
Lifetechnologies - USA) sob uma diferença de potencial de 100 volts por uma hora. O gel foi analisado em transluminador (foto-Prep
®) no qual amostras com bandas de 268 pb foram consideradas positivas para betaglobina. Para o produto proveniente da amplificação com o
primer geral para o HPV, foi utilizada a metodologia de eletroforese em gel de Bis-Acrilamida a 10% (23,33 ml de Bis-Acrilamida; 4,9 ml de Glicerol; 7 ml de TBE 10x; 52,5 µl de Temed; 1050 µl de persulfato de potássio e 34,1 ml de água destilada), o qual foi levado à diferença de potencial de 120 volts por 3 horas em cuba vertical (Model V15-17
® - Lifetechnologies - USA) e o gel corado pelo protocolo de nitrato de prata13, para visualização das bandas.
RESULTADOSFoi encontrada a presença do DNA viral em 23,2% (29/125) das amostras, sendo que todas foram positivas para a amplificação do gene da betaglobina, garantindo a fidedignidade do experimento.
No que se refere ao questionário comportamental, dentre as variantes abordadas (Sexo, Atividade Sexual, Parceiro Fixo, Relação Sexual com Prostitutas, Prática de Sexo Oral, Uso de Preservativo e Tabagismo), somente o sexo dos pacientes (OR = 2,2404, CI [0,9339 - 5,3749],
p = 0,03631) e a prática de sexo oral (OR = 0,0473, CI [0,0095 - 0,2358],
p = 0,0473) estiveram correlacionados de forma estatisticamente significante com a presença do HPV (Figura 1).
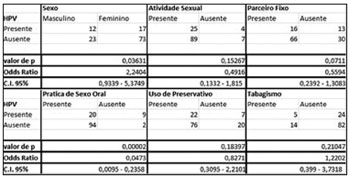
Figura 1. Teste Exato de Fischer (Relação estatisticamente significante se p < 0,05).
Dentre os indivíduos abordados pela pesquisa, 37 (29,6%) voluntários eram homens na faixa etária de 17-54 anos e 88 (70,4%) eram mulheres na faixa etária de 17-44 anos. Predominando a faixa etária dos 18-21 em ambos os sexos. Das 29 amostras HPV positivas, 41,4% (12/29) eram homens e 58,6% (17/29) eram mulheres; 17,24% (5/29) eram tabagistas; 24,13% (7/29) disseram não utilizar preservativos em todas as relações sexuais; 68,96% (20/29) declararam ser praticantes de sexo oral; 13,79% (4/29) não tinham iniciado a vida sexual; 44,82% (13/29) não tinham parceiros fixos e 13,79% (4/29) já tiveram relações com prostitutas.
DISCUSSÃODiversos efeitos citopáticos relacionados à infecção pelo HPV já estão bem estabelecidos na literatura (koilocitose, alargamento nuclear, megalocitose, binucleação, dentre outros), bem como lesões intraepiteliais, que variam de baixo grau (LSIL) a alto grau (HSIL), podendo evoluir a carcinoma de célula escamosa (SCC)14. Entretanto, o HPV pode apresentar-se assintomático, uma vez que a maioria das infecções são subclínicas ou latentes. Segundo Xavier et al.10, a prevalência de HPV em mucosa oral macroscopicamente normal é muito variável na literatura: varia de 0 a 81,1%, com média de 10%. Castro & Bussoloti15 afirmam que as taxas de detecção podem variar de 0 a 100%, mesmo com o uso de métodos mais sensíveis como a PCR, e citam que a grande discrepância dos resultados pode ser atribuída aos erros na hora da coleta do material, os quais podem comprometer os resultados finais. Em maior proporção, quando comparado aos nossos resultados, Peixoto5 diagnosticou em sua coorte, composta por 100 pacientes sem lesões em mucosa oral, prevalência viral de 81%, embora, diferentemente do nosso estudo, não tenha encontrado relação estatisticamente significante entre a prática de sexo oral e a presença do HPV. Porém, em concordância com nossos resultados, Cardesa & Nadal16 relatam que a prática de sexo oral é um dos principais fatores de risco para a progressão da biopatologia desenvolvida pelo HPV. Em relação ao tabagismo e ao sexo, Gilison et al.17 relataram que o HPV foi mais prevalente em homens e tabagistas de forma estatisticamente significante, além de relatar uma prevalência de 6,9% de HPV na população geral dos Estados Unidos da América, quando avaliaram uma coorte composta por 5579 indivíduos, sem prévia seleção. Kreimer et al.18, analisando 1688 amostras de mucosas orais de homens sadios, em concordância com nossos resultados, não encontraram associação estatisticamente significante entre o número de parceiros sexuais, uso de preservativo, bem como a atividade sexual e a presença do HPV em mucosa oral. Segundo Castellsagué3, o uso de preservativos é um fator que pode diminuir os riscos de transmissão de HPV, porém, não garante total proteção.
CONCLUSÕESO papilomavírus humano está presente em 23,2% dos 125 casos estudados. Uma vez que estes pacientes não apresentaram quaisquer manifestações clínico-patológicas correlacionadas com a presença do vírus, o HPV pode estar presente em mucosas orais sadias em proporções significativas. Embora estudos de coortes americanas tenham encontrado maior prevalência de HPV em mucosas orais de homens, dentre os pacientes abordados pelo estudo, as mulheres e/ou os praticantes de sexo oral compuseram o grupo de risco no qual o HPV foi prevalente de forma estatisticamente significante.
Embora outros hábitos de vida não tenham atingido a significância estatística, estudos com um maior número de pacientes devem ser conduzidos, uma vez que fatores como o tabagismo, a abdicação do uso de preservativos, bem como múltiplos parceiros sexuais e a atividade sexual, são fatores que aumentam as chances de transmissão e/ou infecção pelo HPV.
REFERÊNCIAS1. Castro TMPG, Neto CER, Scala KA, Scala WA. Manifestações orais associadas ao papilomavírus humano (HPV) conceitos atuais. Rev Bras Otorrinolaringol. 2004;70(4):546-50.
2. Bettini Jde S, Soares EG, Duarte G, Simões RT, Simões AL. PCR diagnosis of HPV in cervical biopsies of CIN and invasive neoplasia formerly diagnosed as HPV negative. Acta Cytol. 2003;47(4):545-9.
3. Castellsagué X. Natural history and epidemiology of HPV infection and cervical cancer. Gynecol Oncol. 2008;110(3 Suppl 2):S4-7.
4. Saraiva ACM. Implicações do gene TP53 e do vírus do papiloma humano no câncer de próstata [Tese de doutorado]. Uberlândia: Universidade Federal de Uberlândia;2002.
5. Peixoto AP. Detecção do Papilomavírus Humano na cavidade bucal de pacientes com infecção por este vírus na mucosa cervico-vaginal [Dissertação de mestrado]. Bahia: Universidade Federal da Bahia;2006.
6. Cavalcanti SMB, Carestiato FN. Infecções causadas pelos papilomavírus humanos: atualizações sobre aspectos virológicos, epidemiológicos e diagnosticados. DST. J Bras Doenças Sex Transm. 2006;18(1):73-9.
7. Salvia PND. Indicadores de doença residual no seguimento de pacientes conizadas por lesão intraeptelial escamosa de alto grau [dissertação de mestrado]. Campinas: Universidade Estadual de Campinas, Departamento de Anatomia Patológica;2004.
8. Carvalho JJM, Oyakawa N. I Consenso Brasileiro do HPV, 1a edição, São Paulo: BG Cultural; 2000.
9. Soares CP, Malavazi I, dos Reis RI, Neves KA, Zuanon JA, Benatti Neto C, et al. Presença do papilomavírus em lesões malignas de mucosa oral. Rev Soc Bras Med Trop. 2002;35(5):439-44.
10. Xavier SD, Filho IB, Carvalho JM, Framil VMS, Castro TMPPG. Frequência de Aparecimento de papilomavírus humano (HPV) na mucosa oral de homens com hpv anogenital confirmado por biologia molecular. Arq Int Otorrinolaringol. 2007;11(1):36-44.
11. Oliveira MC, Soares RC, Pinto LP, Costa ALL. HPV e carcinogênese oral: revisão bibliográfica. Rev Bras Otorrinolaringol. 2003;69(4):553-9.
12. Gravitt PE, Peyton CL, Alessi TQ, Wheeler CM, Coutlée F, Hildesheim A, et al. Improved amplification of genital human papillomaviruses. J Clin Microbiol. 2000;38(1):357-61.
13. Sanguinetti CJ, Dias Neto E, Simpson AJ. Rapid silver staining and recovery of PCR products separated on polyacrilamide gels. Biotechniques. 1994;17(5):914-21.
14. Méndez Toro L, Rodríguez Meza A, López de Sánchez M, Toro de Méndez M. HPV infection associated with nonclassic cytological signs in patients from Mérida, Venezuela. Invest Clin. 2011;52(2):162-9.
15. Castro TPPG, Bussoloti Filho I. Prevalence of human papillomavirus (HPV) in oral cavity and oropharynx. Braz J Otorhinolaryngol. 2006;72(2):272-82.
16. Cardesa A, Nadal A. Carcinoma of the head and neck in the HPV era. Acta Dermatovenerol Alp Panonica Adriat. 2011;20(3):161-73.
17. Gillison ML, Broutian T, Pickard RK, Tong ZY, Xiao W, Kahle L, et al. Prevalence of oral HPV infection in the United States, 2009-2010. JAMA. 2012;307(7):693-703.
18. Kreimer AR, Villa A, Nyitray AG, Abrahamsen M, Papenfuss M, Smith D, et al. The epidemiology of oral HPV infection among a multinational sample of healthy men. Cancer Epidemiol Biomarkers Prev. 2011;20(1):172-82.
1. Departamento de Obstetrícia e Ginecologia, Faculdade de Medicina da Universidade de São Paulo (Mestrando).
2. Programa de Pós-Graduação em Ciências Biomédicas da Fundação Hermínio Ometto - UNIARARAS (Co-orientadora).
3. Graduação em Farmácia (aluno de iniciação científica vinculado ao Programa de Pós-Graduação em Ciências Biomédicas).
4. Programa de Pós-Graduação em Ciências Biomédicas da Fundação Hermínio Ometto - UNIARARAS (Orientadora).
UNIARARAS-FHO.
Endereço para correspondência:
Julio Cesar Betiol
Av. Leme, nº 770, Parque das Árvores
Araras - SP. CEP: 13604-186
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 5 de outubro de 2011. cod. 8820.
Artigo aceito em 12 de maio de 2012.


