INTRODUÇÃOO esvaziamento cervical é um procedimento padronizado, sendo indicado para o estadiamento e tratamento das metástases regionais nos tumores malignos das vias aerodigestivas superiores. A presença de linfonodos metastáticos é um dos aspectos mais relevantes no prognóstico, configurando doença de estádio avançado (estádio III ou IV). Embora o estadiamento TNM seja o principal indicador prognóstico em uso, estudos recentes sugerem que a densidade linfonodal permite discriminar melhor o prognóstico entre os pacientes pN+1,2.
O presente estudo avalia a densidade linfonodal nos pacientes com carcinoma epidermoide de língua e assoalho de boca, considerando o controle locorregional e sobrevida.
CASUÍSTICA E MÉTODOSO presente estudo foi aprovado pelo Comitê de ética em Pesquisa da instituição na qual os pacientes foram arrolados, pelo número 071/2000.
Foram revisados os prontuários dos pacientes submetidos a esvaziamento cervical por carcinoma epidermoide de língua ou assoalho de boca entre janeiro de 1985 e dezembro de 2007. Do total de 440 pacientes, foram selecionados 182, cujo exame histopatológico confirmou a presença de metástases linfonodais nos estádios pN1 e pN2. Destes, 169 eram masculinos e 13 femininos, com idade média de 52 anos (27 a 78). Todos os pacientes apresentavam carcinoma epidermoide, sendo 77 casos com tumor primário na língua, 98 casos no assoalho da boca e seis acometendo igualmente ambos os sítios. Quanto ao estadiamento inicial, cinco eram estádio I, 35 estádio II, 56 estádio III, 85 estádio IV e um paciente não pode ser reestadiado. O esvaziamento foi eletivo em 64 casos e terapêutico em 118. Foram realizados 112 esvaziamentos unilaterais e 70 bilaterais, totalizando 252 esvaziamentos, sendo 181 radicais e 71 seletivos. Os linfonodos foram individualizados imediatamente após a realização do procedimento por um dos cirurgiões da equipe e enviados para exame histológico.
A densidade linfonodal foi calculada dividindo o número de linfonodos metastáticos pelo número total de linfonodos removidos, independentemente do tipo de esvaziamento realizado. Utilizou-se a mediana da densidade linfonodal para definir dois grupos, sendo avaliado o controle locorregional e a sobrevida livre de doença pelo MÉTODO de Kaplan-Meier e a diferença entre os grupos pelo teste de
log-rank. Foram consideradas significantes as diferenças com erro alfa inferior a 5%.
RESULTADOSO número de linfonodos comprometidos apresentou média de 3,2 (1 a 12), enquanto foram removidos em média 42 linfonodos por paciente (7 a 140). A densidade variou de 0,009 a 0,4, com média de 0,09 e mediana de 0,06 (Figura 1).
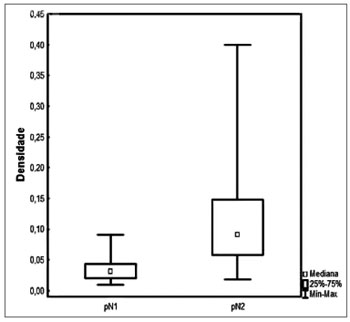
Figura 1. Densidade linfonodal de acordo com o estadiamento pN.
As recidivas locais, isoladas ou associadas, ocorreram em 57 pacientes. As recidivas regionais foram observadas em 32 casos, sendo associadas à recidiva no sítio primário em 16 casos e isoladas em apenas 10. Em 16 pacientes, foi diagnosticado segundo tumor primário. As recidivas à distância ocorreram em 14 casos; Porém, de forma isolada, em apenas oito.
A sobrevida livre de doença em cinco anos foi de 44% e 28% para os grupos com densidade linfonodal abaixo ou acima da mediana, respectivamente (
p = 0,006 - Figura 2). O controle locorregional em dois anos foi de 71% e 49% para os casos com densidade abaixo ou acima da mediana, respectivamente (
p = 0,01 - Figura 3). Quanto ao estádio pN, o controle locorregional foi de 70% e 54% para os casos pN1 e pN2, respectivamente; Porém, sem significância estatística (
p = 0,20 - Figura 4).
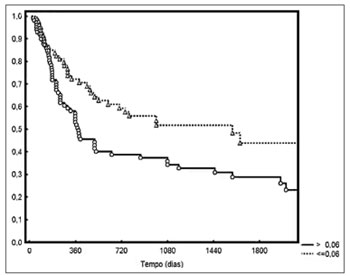
Figura 2. Sobrevida livre de doença para os grupos com densidade linfonodal abaixo ou acima da mediana.
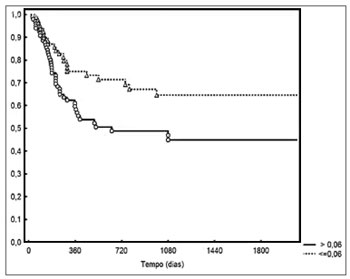
Figura 3. Controle locorregional conforme a densidade linfonodal.
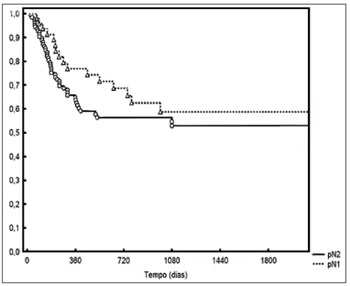
Figura 4. Controle locorregional conforme o estadiamento pN.
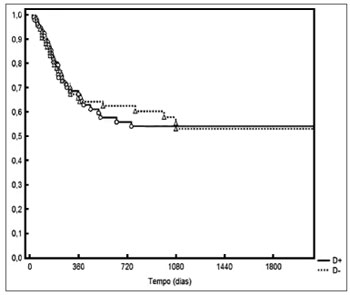
Figura 5. Controle locorregional conforme a densidade mediana nos diferentes estádios pN.
A densidade linfonodal apresentou mediana de 0,03 nos casos pN1 e 0,09 nos casos pN2. Quando avaliados os casos com densidade acima ou abaixo da mediana conforme o respectivo estadiamento pN, não foi observada diferença no controle locorregional (Figura 5).
DISCUSSÃOO esvaziamento cervical é um procedimento rigidamente padronizado; contudo, o número de linfonodos recuperados apresenta grande variação individual. O número de linfonodos removidos, assim como o número de metástases e a respectiva densidade linfonodal apresentaram os mesmos valores tanto no presente estudo como em outras grandes séries anteriormente publicadas, sugerindo a semelhança de procedimentos entre os diferentes serviços, assim como na apresentação da doença em diferentes populações.
A conduta padrão para pacientes portadores de carcinoma epidermoide oral é a ressecção do tumor primário com margens de segurança adequadas para assegurar bom controle local e o esvaziamento cervical para apropriado controle regional. Radioterapia ou quimiorradioterapia é utilizada em pacientes com tumores em estádio avançado. Como a terapia adjuvante pode induzir graves efeitos tóxicos, um significativo desafio é encontrar um MÉTODO confiável para estratificar pacientes sob risco de recidiva tumoral, imediatamente após a cirurgia3. A análise dos padrões de falha em pacientes com câncer oral revela que aproximadamente 33% delas ocorrerão devido às metástases regionais. Um dos mais significativos fatores prognósticos nessa população é a presença de metástases cervicais4. No sistema convencional de estadiamento TNM, a doença linfonodal é quantificada pelo número, lado e lateralidade dos linfonodos positivos.
Segundo alguns autores, o número de linfonodos removidos tem significado prognóstico entre os pacientes pN0, sugerindo um estadiamento mais fidedigno ou um sistema imunológico mais reativo5-9. A presença de linfonodos metastáticos é um dos indicadores prognósticos mais relevantes nos tumores malignos da cabeça e pescoço. A presença de metástases linfonodais acarreta redução de aproximadamente 50% da sobrevida e o prognóstico é significativamente pior na presença de três ou mais linfonodos metastáticos10,11.
A extensão do esvaziamento cervical, técnica cirúrgica e o nível de investigação histopatológica determinam o grau por meio do qual os linfonodos regionais são examinados para a detecção dessas metástases e, assim, a probabilidade de identificar as metástases no contexto dos linfonodos sob risco6. Deste modo, espera-se que tais fatores determinem o estádio linfonodal patológico pN (negativa ou positiva).
Recentemente, a densidade linfonodal (número de linfonodos positivos dividido pelo número total de linfonodos excisados) emergiu como um sistema de estadiamento alternativo para predizer a sobrevida após a cirurgia por carcinoma de bexiga e de esôfago. Nesse sistema, o índice de linfonodos positivos em relação ao total excisado foi considerado como superior ao estadiamento convencional pelo TNM em termos de predição de sobrevida. Como o esvaziamento cervical pode levar à compreensão da condição patológica linfonodal, a densidade linfonodal tenta compensar esse fator ao recapitular duas informações: a extensão do câncer pelo pescoço (número de linfonodos positivos) e a extensão da eliminação cirúrgica desses linfonodos (número total de linfonodos removidos durante a cirurgia)1.
A densidade linfonodal, no ponto de corte estabelecido, permitiu identificar um grupo de pacientes que engloba a maioria dos pacientes pN1 e uma minoria dos pN2 que apresenta melhor controle da doença. Embora seja uma variável quantitativa, a densidade linfonodal não parece apresentar relação direta com a agressividade da doença, mas permite discriminar melhor um grupo pN+ com prognóstico mais favorável e que eventualmente poderia ser dispensado de um tratamento adjuvante. A densidade de 0,06 representa pacientes com o mínimo de 17 linfonodos dissecados para cada linfonodo metastático, identificando pacientes com poucos linfonodos metastáticos, cujo estadiamento pode ser considerado mais fidedigno em virtude da maior amostra de linfonodos ressecados.
Postula-se que a densidade linfonodal pode ter um grande valor prognóstico porque leva em consideração três tipos de fatores: tumorais (número de linfonodos positivos), terapêuticos (número de linfonodos removidos durante o esvaziamento cervical) e de estadiamento (radicalidade do procedimento relacionada ao cirurgião e ao patologista)1. A detecção de pequenos depósitos metastáticos em linfonodos pode ser incrementada por secções seriadas, avaliação imunohistoquímica e/ou técnicas moleculares complementares12.
Os resultados da sobrevida nesta amostra representam um grupo de pacientes exclusivamente pN+, dos quais 80% apresentam estádio IV, explicando as taxas encontradas. O principal motivo de falha do tratamento foi a recidiva no sítio primário, sendo que as recidivas regionais isoladas foram incomuns.
Assim, a presença de linfonodos metastáticos e a densidade linfonodal também revelam um fenótipo de agressividade no sítio primário e sistêmica. A densidade linfonodal pode ser utilizada como indicador prognóstico nos carcinomas de língua e assoalho oral, sendo superior ao estadiamento pN entre os pacientes pN1 e pN2.
REFERÊNCIAS1. Gil Z, Carlson DL, Boyle JO, Kraus DH, Shah JP, Shaha AR, et al. Lymph node density is a significant predictor of outcome in patients with oral cancer. Cancer. 2009;115(24):5700-10.
2. Kim SY, Nam SY, Choi SH, Cho KJ, Roh JL. Prognostic value of lymph node density in node-positive patients with oral squamous cell carcinoma. Ann Surg Oncol. 2011;18(8):2310-7.
3. Bernier J, Domenge C, Ozsahin M, Matuszewska K, Lefèbvre JL, Greiner RH, et al.; European Organization for Research and Treatment of Cancer Trial 22931. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med. 2004;350(19):1945-52.
4. Shah JP, Candela FC, Poddar AK. The patterns of cervical lymph node metastases from squamous carcinoma of the oral cavity. Cancer. 1990;66(1):109-13.
5. Ebrahimi A, Zhang WJ, Gao K, Clark JR. Nodal yield and survival in oral squamous cancer: Defining the standard of care. Cancer. 2011;117(13):2917-25.
6. Agrama MT, Reiter D, Cunnane MF, Topham A, Keane WM. Nodal yield in neck dissection and the likelihood of metastases. Otolaryngol Head Neck Surg. 2003;128(2):185-90.
7. Ampil FL, Caldito G, Ghali GE, Baluna RG. Does the negative node count affect disease-free survival in early-stage oral cavity cancer? J Oral Maxillofac Surg. 2009;67(11):2473-5.
8. Berlinger NT, Tsakraklides V, Pollack K, Adams GL, Yang M, Good RA. Immunologic assessment of regional lymph node histology in relation to survival in head and neck carcinoma. Cancer. 1976;37(2):697-705.
9. Herr HW. The concept of lymph node density--is it ready for clinical practice? J Urol. 2007;177(4):1273-5.
10. Kowalski LP, Medina JE. Nodal metastases: predictive factors. Otolaryngol Clin North Am. 1998;31(4):621-37.
11. Mamelle G, Pampurik J, Luboinski B, Lancar R, Lusinchi A, Bosq J. Lymph node prognostic factors in head and neck squamous cell carcinomas. Am J Surg. 1994;168(5):494-8.
12. Kell MR, Winter DC, O'Sullivan GC, Shanahan F, Redmond HP. Biological behaviour and clinical implications of micrometastases. Br J Surg. 2000;87(12):1629-39.
1. Doutor pelo Curso de Pós-graduação em Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo, São Paulo (Cirurgião do Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital Heliópolis HOSPHEL, São Paulo/SP).
2. Professor Livre Docente pelo Departamento de Cirurgia da Faculdade de Medicina da Universidade de São Paulo (Cirurgião do Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital Heliópolis HOSPHEL, São Paulo/SP).
3. Doutor pelo Curso de Pós-graduação em Patologia da Faculdade de Medicina da Universidade de São Paulo (Chefe do Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital Heliópolis HOSPHEL, São Paulo/SP).
4. Professor Livre Docente pela Fundação Lusíada UNILUS (Médico).
5. Professor Associado do Departamento de Cirurgia de Cabeça e Pescoço da Faculdade de Medicina da Universidade de São Paulo, São Paulo/SP. (Professor Associado do Departamento de Cirurgia de Cabeça e Pescoço da Faculdade de Medicina da Universidade de São Paulo, São Paulo/SP).
6. Professor Titular do Departamento de Cirurgia de Cabeça e Pescoço da Faculdade de Medicina da Universidade de São Paulo, São Paulo/SP. (Professor Titular do Departamento de Cirurgia de Cabeça e Pescoço da Faculdade de Medicina da Universidade de São Paulo, São Paulo/SP).
Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital Heliópolis HOSPHEL, São Paulo/SP; e Departamento de Cirurgia de Cabeça e Pescoço da Faculdade de Medicina da Universidade de São Paulo, São Paulo/SP.
Endereço para correspondência:
Rua Cônego Xavier, 276
São Paulo - SP. CEP: 04231-030
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 20 de setembro de 2011. cod. 8787
Artigo aceito em 15 de janeiro de 2012.


