INTRODUÇÃOA polipose nasossinusal eosinofílica é uma afecção inflamatória crônica da mucosa nasal e dos seios paranasais. A polipose nasossinusal eosinofílica deflagra diferentes graus de obstrução do trato respiratório superior e tanto pacientes atópicos como a população em geral são afetados pela mesma1,2. A polipose nasal é considerada parte de uma subdivisão das rinossinusites crônicas, já que parece ser impossível diferenciar ambas com clareza3.
Normalmente, o acometimento é bilateral, com maior incidência na quarta década de vida, afetando 2,7% da população, em sua maioria homens (na proporção de 2,2/1). Está associada a asma, rinite não alérgica eosinofílica, intolerância a aspirina, sinusite fúngica eosinofílica e síndrome de Churg-Strauss. A incidência da polipose nasossinusal eosinofílica é semelhante em pacientes atópicos e na população em geral e sua ocorrência é mais elevada com asma brônquica concomitante4,5.
Apesar dos mecanismos de evolução da polipose nasossinusal eosinofílica ainda não serem completamente compreendidos, sabe-se que a resposta inflamatória está ligada ao seu processo de formação. Presume-se que os pólipos nasais possam ser o estágio final de um processo inflamatório complexo resultante de etiologia múltipla. Os eosinófilos e as células estruturais dos pólipos produzem citocinas que mantêm ativos o processo inflamatório e o recrutamento de novos eosinófilos. Citocinas, como interleucina 5 (IL-5) e o fator estimulador de colônia de granulócitos macrófagos (GM-CSF), prolongam a vida útil dos eosinófilos e aumentam sua presença no tecido polipóide, reduzindo, assim, o índice apoptótico dessas células6. A detecção de fator de crescimento do endotélio vascular (VEGF) em casos de sinusite crônica com polipose foi associada à indução de proliferação celular e inibição da apoptose das células epiteliais avaliadas em tais casos7.
Corticosteróides são a principal opção clínica terapêutica para polipose nasossinusal devido a seu papel na diminuição do processo inflamatório. Foi possível demonstrar a ação dos corticosteroides sobre o índice apoptótico das células do infiltrado inflamatório no estroma da polipose nasossinusal eosinofílica8-10. O crescimento da expressão do gene BAX (pró-apoptótico) em pólipos nasais eosinofílicos elevou o índice apoptótico induzido por tratamento com glicocorticoides11.
A busca por outras opções terapêuticas levou ao estudo do efeito de medicamentos que possam agir sobre as células do processo inflamatório. O objetivo seria interromper o processo fisiopatológico que promove e perpetua a recidiva da polipose nasossinusal. A mitomicina C é um medicamento antissépticos e antibiótico extraído do
Streptomyces caespitosus usado como agente antiproliferativo12. Na otorrinolaringologia, sua aplicação em humanos tem se concentrado, principalmente, por conta da ação do medicamento na redução de sinéquias na nasoendoscopia13 e em cirurgias de laringe14. Aplicações tanto em humanos como em modelos animais confirmam segurança do uso tópico de mitomicina C15. Poucos trabalhos investigaram a ação da mitomicina C em pacientes com polipose nasossinusal eosinofílica. Já foi demonstrada
in vivo e
in vitro a ação da mitomicina C na redução dos níveis de interleucina 5 e fator estimulador de colônia de granulócitos macrófagos (GM-CSF) em pólipos nasais eosinofílicos. Estas oligoproteínas diminuem a taxa de apoptose nos pólipos nasais eosinofílicos e prolongam a sobrevida dos eosinófilos16-18.
O objetivo do presente estudo é avaliar as ações da mitomicina C
in vitro sobre os eosinófilos dos pólipos nasais eosinofílicos por meio de um estudo experimental auto-pareado com avaliação do índice apoptótico.
MATERIAIS E MÉTODOSO presente estudo foi submetido e aprovado pelo Comitê de ética em Pesquisa sob nº. ETIC 484/08. Quinze amostras de pacientes com polipose nasossinusal eosinofílica com infiltração eosinofílica igual ou superior a 40%19-21 foram estudadas. A pesquisa não considerou pacientes com polipose não-eosinofílica, pacientes com polipose nasossinusal eosinofílica e processo infeccioso em andamento, ou pacientes tomando corticosteroides ou anti-histamínicos por mais de 30 dias antes da execução do estudo. Pacientes com deformidades septais ou variações anatômicas também foram excluídos. Os principais sintomas observados foram: anosmia, hipósmia, obstrução nasal e gotejamento retronasal. Todos os pacientes foram aconselhados a se submeter à cirurgia. Primeiramente, os pólipos foram extraídos através de biópsia do meato médio e colocados em solução de formol a 10%. As amostras foram, então, processadas em exames histopatológicos e corados com hematoxilina-eosina para caracterizar eosinofilia. Em seguida, os pacientes incluídos foram submetidos a outra biópsia. As amostras dessa biópsia foram colocadas em uma lâmina com três orifícios, cada uma contendo 250µl de meio de cultura RPMI 1.64022.
Os fragmentos contidos no primeiro orifício foram imediatamente preparados para histopatologia e assim denominados controles zero hora (0h). Os demais orifícios constituíram o grupo de controle (12 horas) e o grupo experimental (12 horas). Uma dose de 400 µg/ml de mitomicina C foi administrada ao grupo experimental por cinco minutos23. Depois, as culturas foram lavadas com meio de cultura RPMI. O grupo controle foi submetido aos mesmos procedimentos, com apenas com o uso de meio de cultura RPMI 1640. Fragmentos de ambos os grupos (controle e experimental) foram incubados a 37º C (98º F) e em CO
2 a 0,5% por 12 horas. Depois desse período, foram submetidos a exames histopatológicos24. As amostras dos 15 foram sujeitas à preparação de rotina para histopatologia (coloração em hematoxilina-eosina) para avaliação do índice apoptótico por meio de morfometria. Uma sub-amostra aleatória (n = 6 pacientes) foi submetida à reação de TUNEL para avaliação da fragmentação de DNA.
Análise do índice apoptótico através de histopatologiaPara a análise do índice apoptótico por meio da coloração em hematoxilina-eosina, cada lâmina teve seus eosinófilos contados em óleo de imersão com ampliação de 100X e seu índice apoptótico calculado. O número foi calculado dividindo-se a soma de eosinófilos em apoptose pela soma total dos eosinófilos contados25.
Para caracterizar os eosinófilos em apoptose, vários aspectos foram considerados, a saber: anoikis (retração celular com perda de adesão entre as células adjacentes); condensação citoplasmática; condensação nuclear (condensação da cromatina com possível compactação da cromatina contra a carioteca, formando figuras de meia-lua); fragmentação nuclear e citoplasmática e formação de corpos apoptóticos (Figuras 1 e 2)25-27. Revisão ao microscópio foi realizada por dois analistas diferentes.
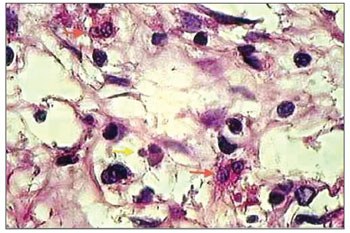
Figura 1. Histopatologia de pólipo nasossinusal eosinofílico (grupo controle) incubado por 12 horas (H&E 1000×).
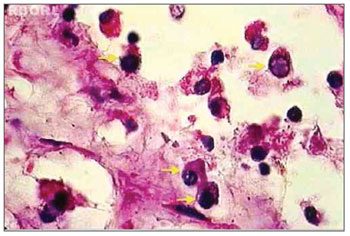
Figura 2. Histopatologia de pólipo nasossinusal eosinofílico tratado com mitomicina C e incubado por 12 horas (H&E. 1000×). É possível identificar alterações compatíveis com apoptose eosinofílica na maioria das células (setas amarelas).
A ocorrência de apoptose foi avaliada através da observação da fragmentação do DNA genômico por meio da reação de TUNEL. O procedimento foi executado com o uso de um kit comercial de detecção de fragmentação genômica
in situ (
Klenow FragEl DNA fragmentation. DetectionKit - In QIA21 Catalog;
Calbiochem /Oncogene-internet address: http://calbiochem.com/). O tempo de proteinase K foi definido em 20 minutos. A peroxidase endógena foi desativada com 3% de peróxido de hidrogênio por 5 minutos. As lâminas foram lavadas com PBS (tampão fosfato-salino) e submersas em solução tampão de equilíbrio. As amostras foram cobertas com enzima TdT (deoxinucleotidil transferase terminal) e desoxinucleotídeos (marcados e não marcados) e incubadas em atmosfera úmida a 37ºC (98ºF) por duas horas. Então, elas foram lavadas em TBS 1X e cobertas com solução tampão de corrida (EDTA 0.5 M, pH = 8) por 5 minutos. Mais uma vez, as lâminas foram lavadas em TBS 1X e cobertas com solução tampão de bloqueio por 10 minutos. Elas foram mantidas em conjugado estreptavidina-peroxidase diluído em solução tampão de bloqueio e incubadas em câmara úmida a 37ºC (98ºF) por 30 minutos. As lâminas foram novamente lavadas em TBS 1X e mantidas em DAB (diaminobenzidina) por 6 minutos, lavadas em água destilada, contra-coradas em hematoxilina e montadas. Controles negativos e positivos foram usados em todas as reações (Figuras 3 e 4). A contagem de eosinófilos foi registrada por um analista.
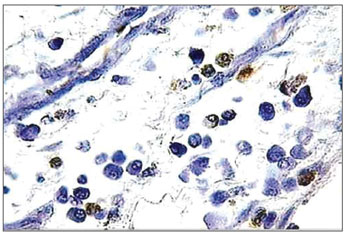
Figura 3. Histopatologia de pólipo nasossinusal eosinofílico (grupo de controle) incubado por 12 horas (TUNEL 400×).
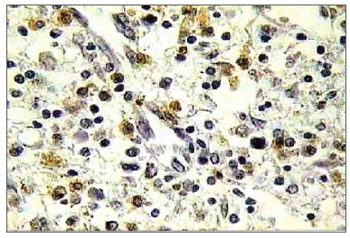
Figura 4. Histopatologia de pólipo nasossinusal eosinofílico tratado com mitomicina C e incubado por 12 horas (TUNEL 400×).
A contagem de eosinófilos foi feita a 40X de ampliação juntamente com o cálculo do índice apoptótico. O índice apoptótico foi calculado dividindo-se a soma de eosinófilos em apoptose pela soma total de eosinófilos contados.
Análise estatísticaOs programas computacionais utilizados para análise estatística foram
Statistical Package for Social Science (SPSS), versão 17.0 (SPSS. Inc, Chicago, IL, USA) e
The R Project for Statistical Computing (GNU General Public License); versão 2.9.1.
Os resultados foram submetidos aos testes de Kolmogorov-Smirnoff e Shapiro-Wilk para verificação de normalidade. Os dados analisados foram submetidos ao teste de Kruskall-Wallis para comparar índices apoptóticos, seguido do pós-teste de Wilcoxon com correção de Bonferroni. Foi considerado nível de significância de 5%.
RESULTADOSForam capturados 1.214 quadros para a análise do índice apoptótico por meio de morfometria. A comparação entre os grupos controle a 0h, controle a 12h e experimental a 12h demonstrou diferença significativa entre os três experimentos (
p < 0,001), como ilustrado na Figura 5.
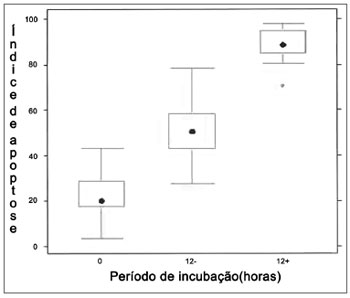
Figura 5. Análise do índice apoptótico por meio de morfometria (coloração hematoxilina-eosina. Ampliação 1000×). Teste de Kruskall Wallis:
p < 0,001 para todos os pacientes. Pós-teste de Wilcoxon com correção de Bonferroni:
p < 0,001 para todos os pacientes/comparações, exceto para ambos marcos zero em que o valor de
p = 0,1724. "0" reflete o período de incubação em zero hora; "12-" é a incubação com 12 horas sem qualquer tratamento; e "12+" representa 12 horas de incubação com tratamento de Mitomicina C.
Na análise do índice apoptótico por meio da reação de TUNEL, 645 quadros foram capturados e analisados à ampliação de 400x. Todos os pacientes apresentaram diferença significativa nos três experimentos: grupo controle em 0h e 12h e grupo experimental em 12h (
p < 0,001). A reação de TUNEL positiva foi destacada para todos os grupos. Os núcleos das células apoptóticas foram claramente diferenciados por sua coloração amarronzada. também foi possível perceber reação de TUNEL positiva em outras células do infiltrado inflamatório dos pólipos nasais eosinofílicos. Os resultados individuais dos índices apoptóticos das sub-amostras de seis pacientes
in vitro podem ser avaliados na Figura 6.
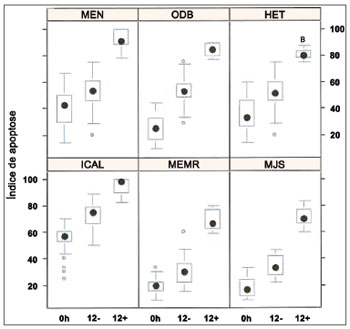
Figura 6. Índice apoptótico (n = 6 pacientes) avaliados através da reação de TUNEL. Teste de Kruskall Wallis:
p < 0,001 para todos os pacientes. Pós-teste de Mann-Whitney com correção de Bonferroni:
p < 0,001 para todos os pacientes/comparações.
Eosinófilos são o principal tipo celular associado à fisiopatologia da polipose nasossinusal eosinofílica. Sabe-se que eles prolongam a sobrevida do infiltrado inflamatório em pacientes com polipose nasossinusal eosinofílica28. A remoção dos eosinófilos do tecido polipóide ocorre por meio da apoptose29. O número de células em apoptose no infiltrado inflamatório de pacientes com polipose nasossinusal eosinofílica é mais baixo do que o número encontrado em tecidos sãos16. Os eosinófilos produzem uma grande quantidade de substâncias através das quais podem lesionar os tecidos e perpetuar o processo inflamatório30. Apesar da fisiopatologia da polipose nasossinusal eosinofílica ainda não ter sido completamente desvendada, está claro que a resposta inflamatória está envolvida em seu processo de formação. Citocinas como IL5 e GM-CSF, prolongam a sobrevida dos eosinófilos e, portanto, a sua presença no tecido polipoide, reduzindo, assim, o nível de apoptose dessas células. Tais citocinas podem ser produzidas a partir de um processo autócrino. Assim, a inibição da apoptose retardaria a remoção dos eosinófilos do tecido, promovendo indefinidamente o processo inflamatório da polipose nasossinusal eosinofílica6,26,31,32. Portanto, no presente estudo, foi feita uma escolha consciente pela avaliação do nível apoptótico dos eosinófilos do infiltrado inflamatório de pacientes com polipose nasossinusal eosinofílica.
A mitomicina C é utilizada na prevenção de sinéquias e estenose em procedimentos de nasoendoscopia. O uso tópico da mitomicina C é seguro13. São poucos os estudos realizados sobre a substância e os pólipos nasais eosinofílicos. A redução
in vitro dos níveis de IL-5 e GM-CSF em pólipos nasais eosinofílicos sugere a presença de um mecanismo indireto entre mitomicina C e apoptose dos eosinófilos dos pólipos nasais eosinofílicos17,18. Ao reduzir a expressão de proteínas anti-apoptóticas, a mitomicina C promoveria um desequilíbrio entre as proteínas que regulam a apoptose, resultando, assim, na liberação da cascata apoptótica.
No presente estudo, a mitomicina C foi a única variável na manipulação dos grupos controle e experimental. Comparando-se os grupos controle e experimental em 12 horas, percebeu-se que a elevação do índice apoptótico em tais grupos pode ser parcialmente explicada pelo período de incubação das culturas. A comparação entre grupos controle e experimental em diferentes períodos de incubação possibilita atribuir a diferença de índice apoptótico ao efeito da mitomicina C. Tais resultados confirmam os achados da literatura especializada no tocante à ação da mitomicina C na indução
in vitro da apoptose em pólipos nasais eosinofílicos.
Um dos objetivos do presente estudo era estimar o evento biológico conhecido como apoptose. Dois MÉTODOs diferentes foram utilizados: histopatologia de rotina (coloração hematoxilina-eosina) e imuno-histoquímica (reação de TUNEL). Foi possível identificar alterações compatíveis com evolução da apoptose por meio de morfometria: condensação citoplasmática, condensação nuclear, perda de adesão celular e formação de corpos apoptóticos. A reação de TUNEL é o MÉTODO padrão para avaliar apoptose. Esse MÉTODO permite destacar a fragmentação do DNA genômico que ocorre prematuramente no processo de apoptose. Trata-se de um estágio decisivo no processo, já que deste ponto em diante ele é irreversível. A formação de corpos apoptóticos inibe tanto a liberação de constituintes celulares internos como a ativação dos mediadores inflamatórios. A apoptose resulta na resolução do processo inflamatório, diferentemente do processo necrótico, que permite a permeabilizacão prematura da membrana celular33. Já que a estimativa de um evento biológico era um dos objetivos do presente estudo, o uso de diferentes MÉTODOs torna tal exercício mais confiável. O presente estudo não traça comparações entre os tratamentos com mitomicina C e glicocorticoides. Os glicocorticoides são potentes anti-inflamatórios muito comumente utilizados no tratamento da polipose nasal. Seu efeito sobre o índice apoptótico das células do infiltrado inflamatório do estroma na polipose nasossinusal eosinofílica já foi demonstrado.
A expressão de diferentes proteínas com ação anti-apoptótica no início da polipose nasossinusal eosinofílica foi demonstrada em vários estudos, reafirmando, assim, a importância das alterações dos mecanismos apoptóticos na fisiopatologia da polipose nasal34-37. Um dos prováveis mecanismos de ação da mitomicina C é a redução nos níveis de interleucinas (IL-5 e GM-CSF) com a redução da expressão de proteínas pró-apoptóticas17,32. Então, a mitomicina C aprimora a suspensão do mecanismo anti-apoptótico, tornando possível a elevação do índice apoptótico dos pólipos nasais eosinofílicos. A apoptose de eosinófilos pode abrir caminho para a resolução do processo inflamatório da polipose nasossinusal eosinofílica. A análise de amostras por meio da reação de TUNEL também identificou fibroblastos, macrófagos e, especialmente, linfócitos no processo apoptótico. A coloração amarronzada dessas células ficou mais evidente no grupo experimental em 12 horas. Acredita-se que a mitomicina C também aja sobre outras células do infiltrado inflamatório, bem como no estroma dos pólipos nasais. Estudos futuros poderão analisar a ação da mitomicina C em outras células dos pólipos nasais eosinofílicos.
A mitomicina C representa uma opção prospectiva no tratamento futuro da polipose nasossinusal eosinofílica e o estudo de sua administração clínica permitirá um conhecimento mais aprofundado dos traços apoptóticos envolvidos na fisiopatologia da polipose nasossinusal eosinofílica.
CONCLUSÃOConclui-se, portanto, que a mitomicina C age
in vitro sobre os pólipos nasais eosinofílicos, induzindo à elevação do índice apoptótico de eosinófilos
in vitro. O presente estudo foi executado em ambiente
in vitro e seus resultados podem não se reproduzir
in vivo. Mais estudos são necessários para avaliar a ação
in vivo da mitomicina C em pólipos nasais eosinofílicos.
REFERÊNCIAS1. Settipane GA. Nasal polyps and systemic diseases. In: Schatz M, Zeiger RS, Settipane GA. Nasal manifestations of systemic diseases. Providence: Oceanside Publ.; 1991. p.43-51.
2. Settipane GA. Nasal polyps: epidemiology, pathogenesis and treatment. Providence: Ocean Side Publ.; 1997. p.137.
3. Fokkens W, Lund V, Mullol J; European Position Paper on Rhinosinusitis and Nasal Polyps group. European Position Paper on Rhinosinusitis and nasal polyps 2007. Rhinol Suppl. 2007;(20):1-136.
4. Tos M, Larsen PL, Larsen K, Thomasen PC. Nasal polyps. In: Stamm AC, Draf W. Micro-endoscopic surgery of the paranasal sinuses and the skull base. Heidelberg: Springer; 2000. p.103-25.
5. Ryan MW. Diseases associated with chronic rhinosinusitis: what is the significance? Curr Opin Otolaryngol Head Neck Surg. 2008;16(13):231-6.
6. Shin SH, Lee SH, Jeong HS, Kita H. The effect of nasal polyp epithelial cell in eosinophil activation. Laryngoscopy. 2003;113(8):1374-7.
7. Lee HS, Myers A, Kim J. Vascular endothelial growth factor drives autocrine epithelial cell proliferation and survival in chronic rhinosinusitis with nasal polyposis. Am J Respir Crit Care Med. 2009;180(11):1056-67.
8. Saunders MW, Wheatley AH, George SJ, Lai T, Birchall MA. Do corticosteroids induce apoptosis in nasal polyp inflammatory cells? In vivo and in vitro studies. Laryngoscope. 1999;109(5):785-90.
9. Watanabe K, Shirasaki H, Kanaizumi E, Himi T. Effects of glucocorticoids on infiltrating cells and epithelial cells of nasal polyps. Ann Otol Rhinol Laryngol. 2004;113(6):465-73.
10. Hirano S, Asano K, Namba M, Kanai K, Hisamitsu T, Suzaki H. Induction of apoptosis in nasal polyp fibroblasts by glucocorticoids in vitro. Acta Otolaringol. 2003;123(9):1075-9.
11. Kimura Y, Sugimoto C, Takabayashi T, Tanaka T, Kojima A, Narita N, et al. Bax-gene transfer enhances apoptosis by steroid treatment in human nasal fibroblasts. Eur Arch Otorhinolaryngol. 2010;267(1):61-6.
12. Kim JW, Kim SK, Song IH, Kim IT. Mitomycin C-induced apoptosis in cultured human Tenon's capsule fibroblasts. Korean J Ophthalmol. 1999;13(1):7-15.
13. Konstantinidis I, Tsakiropoulou E, Vital I, Triaridis S, Vital V, Constantinidis J. Intra-and postoperative application of Mitomycin C in the middle meatus reduces adhesions and antrostomy stenosis after FESS. Rhinology. 2008;46(2):107-11.
14. Hueman EM, Simpson CB. Airway complications from topical mitomycin C. Otolaryngol Head Neck Surg. 2005;133(6):831-5.
15. Warner D, Brietzke SE. Mitomycin C and airway surgery: how well does it work? Otolaryngol Head Neck Surg. 2008;138(6):700-9.
16. Crosara PFTB, Vasconcelos AC, Guimarães RES, Becker HMG, Becker CG, Crosara SLR, et al. Effect of mitomycin C on the secretion of granulocyte macrophages colonies stimulating factor and interleukin-5 in eosinophilic nasal polyps stromal culture. Braz J Otorhinolaryngol. 2005;71(4):459-63.
17. Castro MCM, Assunção E, Castro MM, Araujo RN, Guimarães RE, Nunes FB. Effect of mitomocin C in eosinophilic nasal polyposis, in vivo: concentration of IL5 and GM-CSF, RT-PCR. Braz J Otorhinolaryngol. 2006;72(1):38-42.
18. Crosara PFTB, Nascimento E, Sobrinho SC, Vasconcelos AC, Guimarães RES, Becker HMG, et al. Effect of mitomicin C in eosinofilic nasal polyps estromal culture: induction of apoptosis in eosinophil. Braz J Otorhinolaryngol. 2004;70(5):658-63.
19. Mullarkey MF, Hill JS, Webb DR. Allergic and nonallergic rhinitis: their characterization with attention to the meaning of nasal eosinophilia. J Allergy Clin Immunol. 1980;65(2):122-6.
20. Ingels K, Durdurez JP, Cuvelier C, van Cauwenberge P. Nasal biopsy is superior to nasal smear for finding eosinophils in nonallergic rhinits. Allergy. 1997;52(3):338-41.
21. Moneret-Vautrin DA, Jankowski R, Wayoff M. Clinical and pathogenic aspects of NARES (non-allergic rhinitis with eosinophilic syndrome). Rev Laryngol Otol Rhinol (Bord). 1991;112(1):41-4.
22. Park HS, Jung KS, Shute J, Roberts K, Holgate ST, Dujukanovic R. Allergen-induced release of GM-CSF and IL-8 in vitro by nasal polyp tissue from atopic subjects prolongs eosinophil survival. Eur Respir J. 1997;10(7):1476-82.
23. Khaw PT, Doyle JW, Sherwood MB, Grierson H, Shultz G, McGorray S. Prolonged localized tissue effects from 5-minute exposures to fluorouracil and mitomycin C. Arch Ophtalmol. 1993;111(2):263-7.
24. Teram LM, Park HS, Djukanovic R, Roberts K, Holgate S. Cultured nasal polyps from nonatopic and atopic patients release RANTES spontaneously and after stimulation with phytohemagglutinin. J Allergy Clin Immunol. 1997;100(4):499-504.
25. Woolley KL, Gibson PG, Carty K, Wilson AJ, Twaddell SH, Wooley MJ. Eosinophil apoptosis and the resolution of airway inflammation in asthma. Am J Respir Crit Care Med. 1996;154(1):237-43.
26. Stern M, Meagher L, Savill J, Haslett C. Apoptosis in human eosinophils. Programmed cell death in the eosinophil leads to phagocytosis by macrophages and is modulated by IL-5. J Immunol. 1992;148(11):3543-9.
27. Walsh GM, Dewson G, Wardlaw AJ, Levi-Schaffer F, Moqbel R. A comparative study of different methods for the assessment of apoptosis and necrosis in human eosinophils. J Immunol Methods. 1998;217(1-2):153-63.
28. Xaubet A, Mullol J, López E, Roca-Ferrer J, Rozman M, Carrión T, et al. Comparison of the role of nasal polyp and normal nasal mucosal epithelial cells on in vitro eosinophil survival. Mediation by GM-CSF and inhibition by dexamethasone. Clin Exp Allergy. 1994;24(4):307-17.
29. Davidsson A, Anderson T, Hellquist HB. Apoptosis and phagocytosis of tissue-dwelling eosinophils in sinonasal polyps. Laryngoscope. 2000;110(1):111-6.
30. Kowalski ML, Grzegorczyk J, Pawliczak R, Kornatowski T, Wagrowska-Danilewicz M, Danilewicz M. Decreased apoptosis and distinct profile of infiltrating cells in the nasal polyps of patients with aspirin hypersensitivity. Allergy. 2002;57(6):493-500.
31. Simon HU. Regulation of eosinophil and neutrophil apoptosis - similarities and differences. Immunol. 2001;179:156-62.
32. Simon HU, Yousefi S, Schranz C, Schapowal A, Bachert C, Blaser K. Direct demonstration of delayed eosinophil apoptosis as a mechanism causing tissue eosinophilia. J Immunol. 1997;158(8):3902-8.
33. Degterev A, Yuan J. Expansion and evolution of cell death programmes. Nat Rev Mol Cell Biol. 2008;9(5):378-90.
34. Qiu ZF, Han DM, Zhang L, Zhang W, Fan EZ, Cui SJ, et al. Expression of survivin and enhanced polypogenesis in nasal polyps. Am J Rhinol. 2008;22(2):106-10.
35. Cho SH, Lee SH, Kim KR, Lee HM, Lee SH, Kim TH. Expression and distributional patterns of the inhibitor of apoptosis protein family and caspase 3 in nasal polyps. Arch Otolaryngol Head Neck Surg. 2008;134(3):316-21.
36. Dutsch-Wicherek M, Tomaszewska R, Lazar A, Strek P, Wicherek L, Piekutowski K, et al. The evaluation of Metallothionein expression in nasal polyps with respect to immune cell presence and activity. BMC Immunol. 2010;11:10.
37. Garavello W, Viganò P, Romagnoli M, Sordo L, Berti E, Tredici G, et al. Expression of cell cycle regulatory proteins and analysis of apoptosis in normal nasal mucosa and in nasal polyps. Am J Rhinol. 2005;19(6):549-53.
1. Mestre (médica Otorrinolaringologista).
2. Doutor (Professor Titular do Departamento de Patologia do Instituto de Ciências biológicas da Universidade Federal de Minas Gerais).
3. Doutor (Professor adjunto do Departamento de Oftalmologia e Otorrinolaringologia e fonoaudiologia da Faculdade de medicina da Universidade Federal de Minas Gerais).
4. Mestre (Médico Otorrinolaringologista).
5. Doutor (Professor Adjunto do Departamento de Oftalmologia , Otorrinolaringologia e Fonoaudiologia da faculdade de medicina da Universidade Federal de Minas Gerais).
6. Livre Docente (Professor Associado do Departamento e Oftalmologia , Otorrinolaringologia e Fonoaudiologia da Faculdade de Medicina da Universidade Federal de Minas Gerais).
Faculdade de Medicina da Universidade Federal de Minas Gerais.
Endereço para correspondência:
Rua Manaus, 638, Santa Efigênia
CEP: 30150-350
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 5 de outubro de 2011. cod. 8817.
Artigo aceito em 3 de março de 2012.


