INTRODUÇÃOO vírus linfotrópico para células T humanas tipo 1 (HTLV-1) é um retrovírus humano com tropismo para linfócitos T. Doenças, como a leucemia das células T do adulto e a mielopatia, estão fortemente associadas à infecção pelo HTLV-11. Outras condições inflamatórias, incluindo pneumonia intersticial, anormalidades alveolares e brônquicas relacionadas ao HTLV-1 foram descritas em relatos de casos1-3. Porém, a maioria dos indivíduos infectados pelo HTLV-1 são clinicamente assintomáticos e denominados "portadores".
Enquanto a infecção pelo HTLV-1 está associada à infiltração de linfócitos nos tecidos afetados, a rinite alérgica, o tipo mais comum de rinite crônica, e a asma se caracterizam por infiltração eosinofílica da mucosa nasal e brônquica, respectivamente4,5. Embora se ignorem as características histológicas da mucosa nasal de indivíduos com rinite alérgica e concomitante infecção pelo HTLV-1, sabe-se que tanto a infecção pelo HTLV-1 quanto a doença alérgica respiratória podem estar associadas à fibrose3,5.
Alguns portadores do HTLV-1 apresentam sintomas respiratórios sugestivos de rinite crônica, mas as características da mucosa nasal destes pacientes são desconhecidas. Conhecê-las, portanto, é desejável, sobretudo na cidade de Salvador, Nordeste do Brasil, cuja soroprevalência para o HTLV-1 é a maior do país: 1,76%6. A análise histológica destes casos auxiliará na investigação da etiologia da rinite crônica e da possível influência do HTLV-1 sobre a rinite alérgica. Deste modo, o objetivo do presente trabalho é descrever os achados histológicos da mucosa nasal de portadores do HTLV-1 com diagnóstico de rinite crônica, sendo que a histologia daqueles com rinite alérgica será comparada com a de pacientes sem infecção pelo HTLV-1.
CASUÍSTICA E MÉTODOS
VoluntáriosO estudo foi aprovado pelo Comitê de Ética da instituição, sob número 09/2002, e todos os participantes, sendo adultos, deram o seu consentimento por escrito.
Oito pacientes portadores assintomáticos do HTLV-1 com diagnóstico de rinite alérgica perene não tratada foram recrutados no Ambulatório Multidisciplinar de HTLV-I da instituição e submetidos à biópsia nasal. O diagnóstico de rinite alérgica perene foi obtido pela história e exame físico e corroborado pela positividade ao teste cutâneo para aeroalérgenos relevantes em nosso meio. Adicionalmente, foram estudados dois portadores do HTLV-1 com rinite crônica de etiologia desconhecida, tendo testes cutâneos negativos para os aeroalérgenos mais comuns na região, e cujos sintomas predominantes foram obstrução nasal e coriza.
Pacientes com parasitose intestinal, desvio de septo nasal, pólipo nasal, tabagismo, hepatite viral, infecção por micobactérias ou uso de corticoesteroide e/ou imunossupressores foram excluídos da seleção.
Como controles, foram utilizadas amostras de peças cirúrgicas obtidas por turbinectomia eletiva em pacientes com rinite alérgica e sorologia negativa para o HTLV-1. Tratou-se, portanto, de uma amostra de conveniência. De acordo com a rotina da instituição, os pacientes deste grupo utilizaram corticoterapia tópica nasal durante três meses previamente à cirurgia associada a antihistamínico oral por três semanas. O uso de corticoide nasal foi mantido nesses pacientes por razões éticas, mesmo motivo pelo qual não submetemos à biópsia nasal pacientes sem queixas nasais.
Biópsia nasalNos pacientes portadores do HTLV-1 com rinite crônica, as amostras de biópsia nasal foram obtidas em ambulatório de acordo com a técnica de Fokkens modificada7. Inicialmente, uma anestesia local foi obtida com algodão embebido em xilocaína a 10% e epinefrina (três gotas de solução 1:1.000) sobre o corneto inferior. Três amostras de cada paciente foram coletadas a partir da extremidade inferior da concha inferior, 2 cm posterior à borda anterior, usando o fórceps Gerritsma com um diâmetro de 2,5 mm.
Estudo morfológicoAs amostras da biópsia foram fixadas em formalina tamponada a 10% e embebidas em parafina. Secções de espessura de 5μm foram coradas com hematoxilina e eosina (HE), ácido periódico Schiff (PAS) e vermelho Sirius, e observadas à microscopia de luz, de modo cego, por patologista experiente (EAR). As biópsias foram classificadas de acordo com a metodologia definida por Shioda & Mishima8. A contagem de células foi determinada de modo semiquantitativo pela avaliação dos linfócitos e eosinófilos, e classificada como se segue: ±, células ocasionais; +, poucas células; + +, moderado número de células; + + +, um grande número de células. Para a classificação da fibrose subepitelial, edema e espessamento da membrana basal, o critério adotado foi: 0, ausente; +, discreto; + +, moderado; + + +, intenso. Para fins de teste estatístico analítico, a gradação foi convertida numericamente, de modo que 0,5 representou ±, 1 representou +, e assim sucessivamente. O revestimento epitelial foi classificado como normal, esfoliado ou portador de metaplasia escamosa.
Estudo imunohistoquímicoUm estudo imunohistoquímico das células inflamatórias foi realizado em dois portadores do HTLV-1, cujos testes alérgicos foram negativos. As secções de parafina embebidas foram avaliadas por meio de um painel de anticorpos e uma técnica padrão de estreptavidina-biotina-peroxidase9. Os seguintes marcadores imunohistoquímicos foram utilizados: marcadores de célula T CD45RO (UCHL-1), CD4 (OPD4); marcador de célula B CD20; marcador de linfoma CD30; e marcador de proliferação Ki-67 (MIB-1).
Análise estatísticaO teste de Mann-Whitney foi usado para comparar a média de idade, a presença de linfócitos, eosinófilos, fibrose subepitelial, espessura da membrana basal e edema na mucosa nasal entre os portadores do HTLV-1 com rinite alérgica (grupo infectado) e os pacientes com rinite alérgica e sorologia negativa para HTLV-1 (grupo controle). O teste de Fisher foi utilizado para análise do gênero. Para todos os testes, o valor de
p<0,05 foi considerado estatisticamente significante.
RESULTADOSTrês homens e cinco mulheres com rinite alérgica infectados pelo HTLV-1 apresentaram idades que variaram de 25 a 55 anos, com média 44,5. Um paciente do sexo feminino com 55 anos tinha asma concomitante. No grupo de pacientes com rinite alérgica não infectados pelo HTLV-1 (controles), cinco pacientes do sexo masculino e cinco do sexo feminino tiveram idades entre 22 e 56 anos, com média 38,9. Não houve diferença estatisticamente significante no que diz respeito ao gênero e à idade dos pacientes com rinite alérgica, entre infectados e não infectados pelo HTLV-1.
Os dois pacientes infectados pelo HTLV-1 com rinite não alérgica foram do sexo masculino, com idades de 36 e 42 anos, respectivamente.
Os achados histológicos da mucosa nasal dos pacientes estudados estão descritos nas Tabelas 1 e 2. As seguintes variáveis histológicas apresentaram diferenças estatisticamente significantes: grau de fibrose, maior nos portadores do HTLV-1 com rinite alérgica (
p=0,01), exemplificada na comparação entre as Figuras 1 e 2; e espessamento da membrana basal, maior nos controles não infectados (
p=0,03). Houve tendência a menor eosinofilia e edema entre os portadores do HTLV-1, mas a diferença não foi estatisticamente significante (
p=0,2). Com relação ao infiltrado linfocítico, não houve diferença entre os pacientes com rinite alérgica infectados e não infectados (
p=1,0). As alterações observadas no revestimento epitelial da mucosa nasal foram semelhantes entre os pacientes infectados e não infectados.
Na Figura 3, observa-se infiltrado mononuclear com predomínio de linfócitos em portador do HTLV-1 com rinite crônica não alérgica. O estudo imunohistoquímico da mucosa nasal dos dois portadores do HTLV-1 com rinite não alérgica mostrou positividade para os marcadores de células T CD45RO e CD4, com distribuição difusa e focal, respectivamente. As amostras foram negativas para CD20 (marcador de células B), CD30 (marcador de linfoma) e Ki-67 (marcador de proliferação).
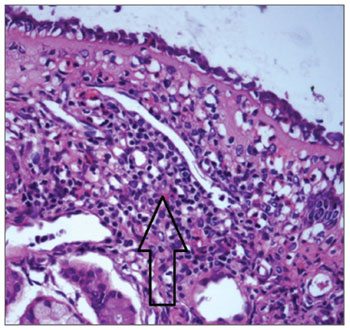
Figura 3. Infiltrado mononuclear na mucosa nasal de portador do HTLV-1 com rinite não alérgica. HE, 400X.
A rinite alérgica e a concomitante infecção pelo HTLV-1 associaram-se à fibrose subepitelial da mucosa nasal em nosso estudo. Em contraste com o espessamento da membrana basal, que foi observado em grau maior entre os portadores de rinite alérgica não infectados pelo HTLV-1, a fibrose subepitelial da mucosa nasal foi maior em portadores do HTLV-1 com rinite alérgica quando comparada a pacientes com rinite alérgica não infectados. A diferença na intensidade da fibrose subepitelial observada entre os dois grupos não pode ser explicada unicamente pelo efeito anti-inflamatório do corticoide nasal usado pelo grupo controle, pois tal relação não está estabelecida na literatura, e a corticoterapia não foi de longa duração. Nos pacientes com rinite alérgica infectados pelo HTLV- 1, deve-se considerar que tanto a rinite alérgica quanto a infecção pelo HTLV-1 podem potencialmente associar-se a fibrose dos tecidos afetados. Por outro lado, não está claro por que o espessamento da membrana basal subepitelial foi menor nos pacientes com rinite alérgica infectados pelo HTLV-1.
Montero Mora et al.5 descreveram espessamento de membrana basal e fibrose subepitelial na mucosa nasal em, respectivamente, 92,3% e 92,4% dos indivíduos com rinite alérgica. A inflamação crônica associada a citocinas e mediadores, tais como fator de crescimento de células T (TGF-β1) e fator estimulador de colônia de granulócitos macrófagos (GM-CSF), podem induzir a ativação e a proliferação fibroblástica, resultando na deposição de colágeno e de outros produtos da matriz extracelular10. Considera-se que o fenômeno de remodelamento morfológico em pacientes alérgicos ocorra com menor frequência em vias aéreas superiores do que nas vias aéreas inferiores, como observado na asma10.
A inflamação crônica associada à infecção pelo HTLV-1 causa fibrose nos tecidos afetados. Há fibrose leptomeníngea precoce em pacientes com mielopatia relacionada ao HTLV-111. Nas vias aéreas, a fibrose alveolar em portadores do HTLV-1 foi documentada, mas não há qualquer estudo sobre a mucosa nasal de portadores do HTLV-112.
A infecção pelo HTLV-1 estimula a produção de GM-CSF, interferon gama (IFN-γ), interleucina-2 (IL-2), e fator de necrose tumoral (TNF-α), citocinas de resposta imune tipo 1, além de IL-4, IL-5 e IL-1013. Na resposta imune do tipo 2, observada na inflamação alérgica, há produção elevada de IL-4, IL-5, e IL-1314. As respostas imunes tipo 1 e tipo 2 podem se influenciar mutuamente tanto por contrarregulação quanto por sinergia15. A propósito, a mútua potencialização entre as respostas imunes pode explicar a significativa fibrose subepitelial observada nos pacientes com rinite alérgica e concomitante infecção pelo HTLV-1, enquanto que um efeito inibitório contrarregulador pode estar implicado no perfil do infiltrado celular da mucosa nasal destes indivíduos.
A concomitante infecção pelo HTLV-1 associa-se à escassa eosinofilia na mucosa nasal de pacientes com rinite alérgica. No presente estudo, houve tendência a menor eosinofilia nasal nos pacientes com rinite alérgica portadores do HTLV-1 quando comparada aos pacientes não infectados com rinite alérgica tratados com corticoterapia. Portanto, este trabalho sugere que a infecção pelo HTLV-1 pode afetar a eosinofilia nasal na medida em que o achado neste grupo de pacientes é, ao menos, semelhante ao encontrado em alguns indivíduos que supostamente sofreram efeito terapêutico do corticosteroide. Isso porque, ao contrário da fibrose subepitelial, o infiltrado eosinofílico nasal em pacientes com rinite alérgica pode ser reduzido em apenas quatro semanas de tratamento corticoterápico16. No grupo infectado e sem tratamento por corticoide, a regulação inibitória entre os perfis imunes da infecção pelo HTLV-1 e da alergia pode ser responsável pela discreta eosinofilia observada na mucosa nasal destes indivíduos.
Souza-Machado et al.17 encontraram uma prevalência de atopia em portadores do HTLV-1 de 14,9% contra 29,7% em controles não infectados. O diâmetro das pápulas obtidas pelo teste alérgico cutâneo também foi menor em portadores atópicos do HTLV-1 quando comparados aos controles atópicos não infectados17. Os níveis da molécula de adesão intercelular tipo 1 (ICAM-1) do fluido nasal de portadores do HTLV-1 com rinite alérgica foram menores que os obtidos nos controles com rinite alérgica não infectados18. Estes dados sugerem que a resposta imune à infecção pelo HTLV-1 pode modificar as manifestações da alergia. O presente estudo histológico corrobora aquelas observações, indicando um incipiente infiltrado nasal eosinofílico em pacientes portadores do HTLV-1 com concomitante rinite alérgica.
Os dois portadores do HTLV-1 com rinite não alérgica apresentaram infiltrado mononuclear, cujo predomínio de células T foi confirmado por análise imunohistoquímica. Considerando-se a hipótese da via aérea única19, é plausível supor a existência de uma rinite associada ao HTLV-1 análoga à bronquite e pneumonite linfocítica já descritas na infecção pelo HTLV-12,20-23. Um infiltrado linfocítico foi descrito na mielite11, uveíte24, artrite25, sialoadenite26, dermatite27 e nefrite28 associadas à infecção pelo HTLV-1, mas a possível existência de uma rinite crônica não alérgica relacionada ao HTLV-1 requer estudos adicionais e novos relatos de casos.
CONCLUSÃOO presente estudo sugere que a infecção pelo HTLV-1 pode modificar a histopatologia nasal da rinite alérgica. O presente trabalho indica que a coexistência da rinite alérgica e da infecção pelo HTLV-1 num mesmo indivíduo pode associar-se a maior fibrose subepitelial e menor espessamento da membrana basal subepitelial, além de tendência à escassa eosinofilia. Entretanto, o papel da alergia e da infecção pelo HTLV-1 concomitantes na fibrose e na celularidade da mucosa nasal necessitam melhor caracterização em estudos futuros. Não sabemos, tampouco, se a fibrose e o infiltrado linfocítico nasal descritos nos portadores do HTLV-1 representam uma nova entidade distinta entre as rinites.
REFERÊNCIAS1. Blattner W. Retroviruses other than human immunodeficiency virus. In: Goldman L, Ausiello D. Cecil Textbook of Medicine. 23 ed. Philadelfia: Saunders; 2008.
2. Burioka N, Suyama H, Sugimoto Y, Chikumi H, Yajima H, Tomita K, et al. Interstitial pneumonia developed in HTLV-I carrier: report of two cases. Yanago Acta Med. 1997;40:125-31.
3. Sugimoto M, Nakashima H, Watanabe S, Uyama E, Tanaka F, Ando M, et al. T-lymphocyte alveolitis in HTLV-I-associated myelopathy. Lancet. 1987;2(8569):1220.
4. Carvalho EM, Bastos LS, Araujo MI. Worms and allergy. Parasite Immunol. 2006;28(10):525-34.
5. Montero Mora P, Blanco E, Matta Campos JJ, González Espinosa A, Guidos Fogelbach G, Tinajeros Castañeda OA. Nasal remodeling in patient with perennial allergic rhinitis. Rev Alerg Mex. 2003;50(3):79-82.
6. Dourado I, Alcantara LC, Barreto ML, da Glória Teixeira M, Galvão-Castro B. HTLV-I in general population of Salvador, Brazil: a city with African ethnic and sociodemographic characteristics. J Acquir Immune Defic Syndr. 2003;34(5):527-31.
7. Fokkens WJ, Vroom TM, Gerritsma V, Rijntjes E. A biopsy method to obtain high quality specimens of nasal mucosa. Rhinology. 1998;26(4):293-5.
8. Shioda H, Mishima T. Significance of mast cells in nasal smears from patients with food allergy. J Allergy. 1966;37(6):321-8.
9. Key M. Immunohistochemistry staining methods. In: Education Guide Immunohistochemichal (IHC) staining methods, 4 Ed., Carpinteria: DakoCytomation; 2006.
10. Constantino Gde T, Mello Jr. JF. Remodeling of lower and upper airways. Braz J Otorhinolaryngol. 2009;75(1):151-6.
11. Wu E, Dickson DW, Jacobson S, Raine CS. Neuroaxonal dystrophy in HTLV-1-associated myelopathy/tropical spastic paraparesis: neuropathologic and neuroimmunologic correlations. Acta Neuropathol. 1993;86(3):224-35.
12. Matsuyama W, Kawabata M, Mizoguchi A, Iwami F, Wakimoto J, Osame M. Influence of human T lymphotrophic virus type I on cryptogenic fibrosing alveolitis - HTLV-I associated fibrosing alveolitis: proposal of a new clinical entity. Clin Exp Immunol. 2003;133(3):397-403.
13. Carvalho EM, Bacellar O, Porto AF, Braga S, Galvão-Castro B, Neva F. Cytokine profile and immunomodulation in asymptomatic human T-lymphotropic virus type 1-infected blood donors. J Acquir Immune Defic Syndr. 2001;27(1):1-6.
14. Santos SB, Porto AF, Muniz AL, Jesus AR, Carvalho EM. Clinical and immunological consequences of human T cell leukemia virus type-I and Schistosoma mansoni co-infection. Mem Inst Oswaldo Cruz. 2004;99(5 Suppl 1):121-6.
15. Rabin RL, Levinson AI. The nexus between atopic disease and autoimmunity: a review of the epidemiological and mechanistic literature. Clin Exp Immunol. 2008;153(1):19-30.
16. Holm A, Djikstra M, Kleinjan A, Severijnen LA, Boks S, Mulder P, et al. Fluticasone propionate aqueous nasal spray reduces inflammatory cells in unchallenged allergic nasal mucosa: effects of single allergen challenge. J Allergy Clin Immunol. 2001;107(4):627-33.
17. Souza-Machado A, Galvão TS, Porto A, Figueiredo J, Cruz AA. Skin reactivity to aeroallergens is reduced in human T-lymphotropic virus type I-infected healthy blood-donors (asymptomatic carriers). Allergy. 2005;60(3):379-84.
18. Galvão T. Caracterização clínica e imunopatológica da rinite alérgica em pacientes infectados pelo HTLV-1. Gaz Méd Bahia. 2006;76:192-3.
19. Rimmer J, Ruhno JW. Rhinitis and asthma: united airway disease. Med J Aust. 2006;185(10):565-71.
20. Higashiyama Y, Katamine S, Kohno S, Mukae H, Hino S, Miyamoto T, et al. Expression of human T lymphotropic virus type 1 (HTLV-1) tax/rex gene in fresh bronchoalveolar lavage cells of HTLV-1-infected individuals. Clin Exp Immunol. 1994;96(2):193-201.
21. Mukae H, Kohno S, Morikawa N, Kadota J, Matsukura S, Hara K. Increase in T-cells bearing CD25 in bronchoalveolar lavage fluid from HAM/TSP patients and HTLV-I carriers. Microbiol Immunol. 1994;38(1):55-62.
22. Seki M, Higashiyama Y, Mizokami A, Kadota J, Moriuchi R, Kohno S, et al. Up-regulation of human T lymphotropic virus type 1 (HTLV-1) tax/rex mRNA in infected lung tissues. Clin Exp Immunol. 2000;120(3):488-98.
23. Seki M, Kadota JI, Higashiyama Y, Iida K, Iwashita T, Sasaki E, et al. Elevated levels of beta-chemokines in bronchoalveolar lavage fluid (BALF) of individuals infected with human T lymphotropic virus type-1 (HTLV-1). Clin Exp Immunol. 1999;118(3):417-22.
24. Mochizuki M, Ono A, Ikeda E, Hikita N, Watanabe T, Yamaguchi K, et al. HTLV-I uveitis. J Acquir Immune Defic Syndr Hum Retrovirol. 1996;13(Suppl 1):S50-6.
25. Ijichi S, Matsuda T, Maruyama I, Izumihara T, Kojima K, Niimura T, et al. Arthritis in a human T lymphotropic virus type I (HTLV-I) carrier. Ann Rheum Dis. 1990;49(9):718-21.
26. Martins FM, Casseb J, Penalva-de-Oliveira AC, de Paiva MF, Watanuki F, Ortega KL. Oral manifestations of human T-cell lymphotropic virus infection in adult patients from Brazil. Oral Dis. 2010;16(2):167-71.
27. Bittencourt AL, de Oliveira Mde F. Cutaneous manifestations associated with HTLV-1 infection. Int J Dermatol. 2010;49(10):1099-110.
28. Deguchi HE, Amemiya T. Two cases of uveitis with tubulointerstitial nefritis in HTLV-1 carriers. Jpn J Ophtalmol. 2003;47(4):372-8.
1. Doutor em Medicina (Médico Colaborador do Serviço de Otorrinolaringologia do Hospital Universitário Professor Edgar Santos da Universidade Federal da Bahia).
2. Doutor em Medicina (Professor do Departamento de Biomorfologia do Instituto de Ciências da Saúde da Universidade Federal da Bahia).
3. Doutor em Medicina (Professor Adjunto da Faculdade de Medicina da Universidade Federal da Bahia).
4. Doutor em Cirurgia (Professor Titular de Otorrinolaringologia da Faculdade de Medicina da Universidade Federal da Bahia).
5. Doutor em Patologia Humana (Coordenador do Laboratório de Histotecnologia da Fundação Instituto Oswaldo Cruz, Bahia).
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 2 de outubro de 2011. Cod. 8811.
Artigo aceito em 15 de janeiro de 2012.


