INTRODUÇÃOO carcinoma de cabeça e pescoço ocupa a quinta posição na lista das neoplasias mais frequentes, com incidência mundial estimada de 50.000 novos casos por ano1,2. No Brasil, a estimativa para câncer de cavidade oral em 2010 era de 14.120 casos novos (10.330 homens e 3.790 mulheres)3. A grande maioria desses tumores epiteliais é classificada como carcinoma de células escamosas de cabeça e pescoço (HNSCC -
head and neck squamous cell carcinoma) e os sítios anatômicos que estão incluídos neste grupo compreendem a cavidade oral, faringe e laringe, com ocorrência aproximada de 40%, 15% e 25%, respectivamente2,4-6.
Cerca de dois terços dos pacientes com essa doença apresentam estágio avançado, geralmente envolvendo linfonodos regionais. Metástase à distância ocorre somente em 10% do pacientes7. O tratamento varia de acordo com o estágio da doença e, segundo dados da literatura, cerca de 60% a 65% dos pacientes com câncer de cabeça e pescoço podem ser curados com cirurgia e/ou radioterapia. Pacientes com fase inicial (estádios I e II) da doença são tratados com uma única modalidade de tratamento (cirurgia ou radioterapia), enquanto pacientes com doença mais avançada (estágios III e IV) necessitam de uma abordagem combinada, como a cirurgia e radioterapia ou quimioradioterapia8.
Este tipo de tumor acomete em maior proporção indivíduos do gênero masculino e com idade avançada, sendo que a média de idade de diagnóstico é de 60 anos7,9. No entanto, a incidência de câncer na base da língua e amígdalas tem aumentado em pessoas com idade inferior a 45 anos e isto é atribuído ao aumento da prevalência da infecção pelo vírus HPV, que contribui para o desenvolvimento desta neoplasia nos países em desenvolvimento10-11.
Os principais fatores de risco já estabelecidos para esta doença são tabagismo e etilismo, que quando atuam em conjunto multiplicam o risco para câncer, especialmente câncer de cavidade oral e faringe12. Isto porque o cigarro possui aproximadamente 4.700 substâncias e, dessas, pelo menos 50 são carcinogênicas. Já o consumo frequente de bebida alcoólica impede que as células epiteliais formem a barreira de proteção contra agentes externos, permitindo, assim, a entrada facilitada dos agentes carcinógenos do cigarro, que formam adutos de DNA, que não são reconhecidos durante o processo de replicação do DNA13,14.
O estudo de Hashibe et al.12 mostrou que o consumo de álcool, independente do fumo, apresentou risco elevado para o câncer de orofaringe, hipofaringe e laringe em indivíduos que nunca fumaram. O consumo excessivo de álcool pode também resultar em deficiências nutricionais devido às falhas na absorção intestinal e alterar vias metabólicas importantes, como, por exemplo, a do metabolismo do folato envolvida nas reações de metilação celular. Como consequência, a metilação de genes com um potencial papel na carcinogênese pode ser comprometida15.
Estudos também sugerem que a pobre higienização oral está associada com o risco de câncer de cabeça e pescoço. As doenças periodontais, resultantes da pobre higienização oral, podem levar a infecções, com consequente liberação de mediadores inflamatórios, como as citocinas e as reações contra as inflamações podem favorecer o desenvolvimento do câncer16. A perda de dentes também pode contribuir para o desenvolvimento do câncer oral; uma vez que leva a alteração da flora oral, favorece a redução de nitritos e nitratos e a produção de acetaldeído, que leva à formação de adutos de DNA14,17.
Em relação à dieta, os resultados da literatura evidenciam que a dieta rica em cereais integrais, frutas e verduras, e pobre em alimentos processados, associada a um estilo de vida saudável pode proteger contra danos oxidantes do DNA, uma vez que esses alimentos possuem micronutrientes, tais como vitaminas B, C e E, carotenóides, flavonódeis entre outros, com propriedades antioxidantes e anticarcinogênicas, diminuindo, assim, o risco de câncer oral18-21.
A deficiência de folato no organismo, vitamina presente em frutas e vegetais, está associada ao aumento do risco de vários tipos de câncer, entre eles, de cabeça e pescoço 20,22-26, pois este micronutriente participa da síntese, reparo e metilação do DNA22,27.
OBJETIVO E MÉTODOMostrar os resultados de estudos que avaliaram a modulação de polimorfismos envolvidos no metabolismo do folato e o risco de câncer de cabeça e pescoço por meio de revisão em literatura.
METABOLISMO DO FOLATOO folato está envolvido na formação de grupos metil (CH3) durante a interconversão de um carbono no metabolismo intermediário de S-adenosilmetionina (SAM), que serve como um doador de grupos metil nas reações de metilação celulares26,28,29. A metilação do DNA é a transferência de grupos metil para a posição 5 de resíduos de citosinas localizadas em dinucleotídeos citosina-guanina (CpG), por meio de reações catalisadas por proteínas denominadas DNA metiltransferases30. Esta modificação epigenética do DNA possui vários papéis funcionais, incluindo controle da expressão gênica, estabilidade da estrutura da cromatina e manutenção da estabilidade genômica23,26,29,30-34.
Existem três mecanismos pelos quais as alterações no metabolismo do folato podem contribuir com a carcinogênese: (1) hipometilação de DNA e subsequente ativação dos proto-oncogenes26,35; (2) erro de incorporação da uracila durante a síntese de DNA que leva à instabilidade genômica26,35,36; e (3) aumento na desaminação de citosina nos sítios de metilação de DNA26,36.
Alterações nos níveis de folato devido a polimorfismos genéticos envolvidos em sua via metabólica estão associadas com mudanças na metilação, síntese e reparo do DNA, pois níveis adequados de folato são essenciais para a biossíntese de purinas e pirimidinas, necessárias para esses processos biológicos37-45.
Na Figura 1, estão apresentadas as enzimas que participam do metabolismo do folato. O folato é primeiramente convertido em folato fisiológico reduzido pela enzima Dihidrofolato redutase (DHFR). A enzima Serina hidroximetiltransferase (SHMT) catalisa a reação reversível de THF em 5,10-MTHF, constituindo uma enzima chave na manutenção e regulação da homeostase da concentração de folato e de grupos metil intracelulares. É uma enzima dependente de vitamina B6 e possui papel significante na síntese de DNA e proteínas e nas reações de metilação dos ácidos nucléicos46,47.
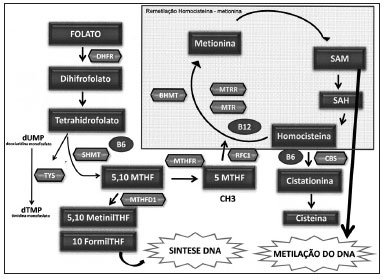
Figura 1. Principais enzimas envolvidas no metabolismo do folato. Metabolismo do Folato - DHF: Dihidrofolato; THF- Tetrahidrofolato; DHFR: Dihidrofolato redutase; SHMT: Serina hidroximetiltransferase; TYS: Timidilato sintase; MTHFD1: Metilenotetrahidrofolato desidrogenesase 1; MTHFR: Metileno tetrahidrofolato redutase; MTR: metionina sintase; MTRR: Metionina sintase redutase; BHMT: Betaínahomocisteína metiltransferase; CBS: Cistationina beta sintase; RFC1: Carreador de folato reduzido 1; SAM: S S-adenosilmetionina; SAH: S- adenosilhomocisteina; dUMP: Deoxiuridina monofosfato; dTMP: Timidina monofosfato.
A enzima Metilenotetrahidrofolato redutase (MTHFR) catalisa a conversão do 5,10 metilenotetrahidrofolato para 5-metiltetrahidrofolato (5-MTHFR), a principal forma circulante de folato, que atua como doador de grupos metil para a remetilação da homocisteína (Hcy) para metionina. Esta reação de remetilação é catalisada pela enzima Metionina sintase (MTR), que requer a vitamina B12 (metilcobalamina) como cofator, e resulta na formação de SAM. A enzima metionina sintase redutase (MTRR) é responsável pela manutenção do estado ativo da enzima MTR. Após a metilação da Hcy, a metionina formada é condensada com o trifosfato de adenosina (ATP), resultando na S-adenosilmetionina (SAM). Em seguida, por uma reação de desmetilação, forma-se a S-adenosil-homocisteína (SAH), com posterior hidrólise para liberar adenosina e Hcy, completando o ciclo48.
A metilação da Hcy serve para repor os estoques de SAM quando a metionina estiver em baixos níveis. A enzima Betaína-homocisteína metiltransferase (BHMT) catalisa a conversão da Hcy para metionina em uma via alternativa de remetilação, na qual o aminoácido betaína atua como doador de grupos metil para esta reação49-51. Quando a via de remetilação da Hcy catalisada pela enzima MTR, dependente de folato, encontra-se alterada por fatores genéticos ou ambientais, a enzima BHMT desenvolve papel crucial na homeostase da Hcy52.
Participando também desse metabolismo, a enzima Cistationina β-sintase (CβS), dependente de vitamina B
6, desenvolve papel crucial no metabolismo do folato, convertendo a Hcy em cistationina na chamada via de transsulfuração53,54.
Durante o ciclo da regeneração de metionina, após a doação do grupo metil (5-metil -THF) à homocisteína, o THF é recuperado. O THF poderá ser utilizado, por outra via, diretamente, para a síntese de timidilato sintase (TS) que converte deoxiuridina monofosfato (dUMP) à timidina monofosfato (dTMP), utilizando o 10-formil-THF para a síntese de DNA. Nesta reação, o 5,10 metileneTHF é o substrato da timidilato55.
A enzima Metilenotetrahidrofolato desidrogenesase 1 (MTHFD1) catalisa a oxidação do 5,10-metileno-THF a 5,10-metinil-THF, que é, então, convertido para 10-formil-THF (Stevens et al., 2007). Esta três reações estão envolvidas na interconversão de derivados do carbono-1 do THF, que são substratos para a síntese de metionina, timidilato e purinas56.
Além dessas enzimas, a enzima carreadora de folato reduzido 1 (RFC1), localizada na membrana das células da mucosa intestinal, participa do processo de absorção do folato, realizando o transporte do 5-MTHF para o interior de uma variedade de células, constituindo um importante determinante das concentrações de folato disponíveis dentro das células48.
POLIMORFISMOS GENÉTICOS ENVOLVIDOS NO METABOLISMO DO FOLATO E O CÂNCER DE CABEÇA E PESCOÇO
Polimorfismo MTHFR C677T Este polimorfismo está associado à redução da atividade enzimática, limitando a conversão de 5,10 metilenotetrahidrofolato para 5-MTHFR, a forma de folato requerida para as reações de metilação do DNA57. Um estudo
in vitro mostrou que o genótipo heterozigoto 677CT foi associado com redução de 40% da atividade enzimática, enquanto o genótipo homozigoto polimórfico 677TT foi associado com uma redução de 70% da atividade enzimática58.
Além disso, o genótipo homozigoto polimórfico foi associado com níveis baixos de folato e níveis mais altos de homocisteina no plasma59-61 e, consequentemente, a diminuição de folato plasmático pode ocasionar hipometilação do DNA e câncer62.
De acordo com nosso conhecimento, há oito estudos que avaliaram a associação desse polimorfismo em câncer de cabeça e pescoço37-44. Desses, somente o estudo de Reljic et al.41, Vairaktaris et al.40 e Solomon et al.43 confirmaram associação do polimorfismo
MTHFR C677T com o risco de câncer de cabeça e pescoço (Quadro 1).
Reljic et al.41, em seu estudo caso-controle, avaliaram 81 pacientes com câncer de cabeça e pescoço e 102 indivíduos sem história de câncer em uma população croata e encontraram que o genótipo 677TT diminui o risco dessa doença. Por outro lado, o estudo de Vairaktaris et al.40 em 110 indivíduos com câncer de cavidade oral e 102 indivíduos sem história de neoplasia, realizado em indivíduos alemães e gregos, mostrou que o genótipo 677CT foi associado com um aumento de risco para esse tipo de câncer. O estudo de Solomon et al.43 avaliou 126 indivíduos etilistas (33 etilistas crônicos importantes, 56 etilistas moderados e 37 etilistas sociais) com câncer oral e mostrou que o genótipo 677TT foi associado com o grupo de indivíduos etilistas crônicos importantes e também com o grupo de indivíduos com hábito etilista moderado, em menor proporção.
Polimorfismo MTHFR A1298CEsta variante também foi associada
in vitro com diminuição da atividade enzimática, porém em menor proporção em relação ao polimorfismo
MTHFR C677T63. A exata relevância biológica desse polimorfismo ainda não está clara e os resultados são inconsistentes62,64,65.
Dados sobre o risco de câncer de cabeça e pescoço relacionados ao polimorfismo
MTHFR A1298C são contraditórios. O estudo caso-controle de Suzuki et al.42, realizado no Japão, em 237 pacientes com câncer de cabeça e pescoço e 711 indivíduos sem história de neoplasia e o estudo de Kruzsina et al.44 em 131 poloneses com câncer de laringe e 250 poloneses sem história de câncer não encontraram associação desta variante com o risco de carcinoma de cabeça e pescoço.
No entanto, o estudo de Neumann et al.39, realizado no Texas em 537 pacientes com câncer de cabeça e pescoço e 545 indivíduos controle, mostrou que indivíduos com genótipos 1298AC ou 1298CC apresentam uma redução de 35% no risco de câncer de cabeça e pescoço. Entretanto, o estudo mostrou aumento de risco de HNSCC para indivíduos com os três alelos polimórficos (
MTHFR 677T,
MTHFR 1298C e
MTHFR 1793A) em relação àqueles que apresentam apenas um ou dois alelos polimórficos.
Polimorfismo MTR A2756GDe acordo com nosso conhecimento, não há estudos
in vitro que avaliaram a atividade da enzima MTR na presença do polimorfismo
MTR A2756G. Dados sobre alterações nos níveis de Hcy e folato são contraditórios66-71. Alguns autores mostraram que indivíduos com genótipo homozigoto polimórfico (
MTR 2756GG) apresentam níveis baixos de Hcy e níveis altos de folato68-71. Entretanto, o estudo de Li et al.66 mostrou que, na presença dessa variante, há níveis altos de Hcy, enquanto Ma et al.67 demonstraram que esse polimorfismo não altera os níveis de Hcy.
Em relação à metilação do DNA, estudos confirmaram que os genótipos
MTR 2756AG ou GG levam à diminuição da formação de SAM e, consequentemente, hipometilação do DNA72. Além disso, estudos relatam a relação entre o genótipo
MTR 2756GG e hipometilação do DNA em câncer de colorretal, mama, pulmão e câncer cervical72-75.
Em câncer de cabeça e pescoço, este polimorfismo mostrou associação com a doença em três estudos. Zhang et al.75, em estudo caso-controle realizado no Texas, avaliaram 721 pacientes com câncer de cabeça e pescoço e 1.234 indivíduos sem história de neoplasia e observaram que os genótipos
MTR 2756AG ou GG aumentam o risco dessa doença. O estudo de Kruzsina et al.44, em 131 pacientes poloneses com câncer de laringe e 250 indivíduos controle, também encontrou associação desses genótipos (
MTR 2756GG ou AG) com este tipo de tumor. No estudo do nosso grupo, realizado com 236 pacientes brasileiros com câncer de cabeça e pescoço e 469 indivíduos controles, o genótipo
MTR 2756GG e alelo
MTR 2756G foram associados com um risco aumentado de HNSCC45. Por outro lado, o estudo de Suzuki et al.42, realizado no Japão, em 237 pacientes com câncer de cabeça e pescoço e 711 indivíduos controles, não mostrou associação desse polimorfismo com o câncer de cabeça e pescoço.
Polimorfismo MTRR A66GEstudos mostram que essa variante gera uma enzima com baixa afinidade pela enzima MTR76. Quanto ao nível de Hcy plasmática, o estudo de Gaughan et al.77 confirmou que indivíduos com o genótipo
MTRR 66GG apresentam níveis baixos de Hcy quando comparados com o genótipo
MTRR 66AA. No entanto, este efeito não foi observado por outros estudos78,79.
Poucos estudos têm investigado a associação entre
MTRR A66G e o risco de câncer de cabeça e pescoço. Suzuki et al.42 confirmaram que essa variante não está associada com o risco de câncer de cabeça e pescoço, porém, eles encontraram interação entre o consumo de álcool e o polimorfismo
MTRR A66G em uma população japonesa. Zhang et al.75 mostraram que indivíduos com o genótipo homozigoto selvagem (
MTRR 66AA) possuem risco diminuído de câncer de cabeça e pescoço, confirmando que o alelo A é um alelo protetor.
Polimorfismo RFC1 A80GO gene
RFC1 está envolvido no transporte intracelular de folato. Ele é responsável pela absorção e transporte de 5-MTHFR para o interior de uma variedade de células. O polimorfismo
RFC1 A80G pode estar envolvido na carcinogênese por alterar as concentrações de Hcy e folato plasmático, que estão associadas com metilação e reparo do DNA. Entretanto, o exato mecanismo biológico desse polimorfismo ainda não está esclarecido48,80-83.
Somente o estudo do nosso grupo de pesquisa avaliou a variante
RFC1 A80G no risco de câncer de cabeça e pescoço e foi confirmado que os genótipos
RFC1 80AG ou 80AA foram associados com aumento de risco desse tipo de tumor, principalmente em indivíduos do gênero masculino, com idade superior a 50 anos e fumantes84.
Outros polimorfismos do metabolismo do folatoO efeito do polimorfismo
MTHFD1 G1958A foi avaliado em câncer de cabeça e pescoço em apenas um estudo e não mostrou associação com risco da doença44. Os polimorfismos
CBS 844ins68,
BHMT G742A,
SHMT C1420T,
TC2 A67G e
TC2 C776G, também envolvidos no metabolismo do folato, ainda não foram estudados em câncer de cabeça e pescoço, porém, dois deles estão associados a outros tipos de câncer85-89.
CONCLUSÕESOs polimorfismos
MTHFR C677T,
MTHFR A1298C,
MTR A2756G,
MTRR A66G e
RFC1 A80G parecem modular o risco de câncer de cabeça e pescoço. Entretanto, devido aos achados contraditórios, estudos em diferentes populações são necessários para o esclarecimento do papel desses polimorfismos na etiologia do câncer de cabeça e pescoço.
REFERÊNCIAS BIBLIOGRÁFICAS1. Chen YJ, Chang JT, Liao CT, Wang HM, Yen TC, Chiu CC, et al. Head and neck cancer in the betel quid chewing area: recent advances in molecular carcinogenesis. Cancer Sci. 2008;99(8):1507-14.
2. Marcu LG and Yeoh. A review of risk factors and genetic alterations in head and neck carcinogenesis and implications for current and future approaches to treatment. J Cancer Res Clin Oncol. 2009;135(10):1303-14.
3. http: www.inca.gov.br/estimativa/2010/index.asp
4. Lothaire P, de Azambuja E, Dequanter D, Lalami Y, Sotiriou C, Andry G, et al. Molecular markers of head and neck squamous cell carcinoma: promising signs in need of prospective evaluation. Head Neck. 2006;28(3):256-69.
5. Ragin CCR, Modugno F, Gollin SM. The epidemiology and risk factors of head and neck cancer: a focus on a human papillomavirus. J Den Res. 2007;86(2):104-14.
6. Salzwimmer M. Best supportive care in HNSCC. Wien Med Wochenschr. 2008;158(9-10):278-82.
7. Ries LAG, Melbert D, Krapcho M, Stinchcomb DG, Howlader N, Horner MJ, et al. SEER Cancer Statistics Review, 1975-2004. Bethesda, MD: National Cancer Institute 2006.
8. Licitra L, Locati LD, Bossi P. Optimizing approaches to head and neck cancer. Metastatic head and neck cancer: new options. Ann Oncol. 2008;19(7):200-3.
9. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55(2):74-108.
10. D'Souza G, Kreimer AR, Viscidi R, Pawlita M, Fakhry C, Koch WM, et al. Case-control study of human papillomavirus and oropharyngeal cancer. N Engl J Med. 2007;356(19):1944-56.
11. Chaturvedi AK, Engels EA, Anderson WF, Gillison ML. Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol. 2008;26(4):612-9.
12. Hashibe M, Brennan P, Benhamou S, Castellsague X, Chen C, Curado MP, et al. Alcohol drinking in never users of tobacco, cigarette smoking in never drinkers, and the risk of head and neck cancer: pooled analysis in the International Head and Neck Cancer. Epidemiology Consortium. J Natl Cancer Inst. 2007;99(10):777-89.
13. Rubin, H. Synergistic mechanisms in carcinogenesis by polyciclic aromatic hydrocarbons and by tobacco smoke: a bio-historical perspective with updates. Carcinogenesis. 2001;22(12):1903-30.
14. Choi S, Myers JN. Molecular Pathogenesis of Oral Squamous Cell Carcinoma: Implications for Therapy. J Dent Res. 2008;87(1):14-32.
15. Boffetta P, Hashibe M. Alcohol and cancer. Lancet Oncol. 2006;7(2):149-56.
16. Karin M, Lawrence T, Nizet V. Innate immunity gone awry: linking microbial infections to chronic inflammation and cancer. Cell. 2006;124(4):823-35.
17. Abnet CC, Qiao Y-L, Dawsey SM, Dong Z-W, Taylor PR, Mark SD. Tooth loss is associated with increased risk of total death and death from upper gastrointestinal cancer, heart disease, and stroke in a Chinese population-based cohort. Int J Epidemiol. 2005;34(2):467-74.
18. Pavia M, Pileggi C, Nobile CG, Angelillo IF. Association between fruit and vegetable consumption and oral cancer: a meta-analysis of observational studies. Am J Clin Nutr. 2006;83(5):1126-34.
19. Marchioni DML, Fisberg RM, Góis Filho JF, Kowalski LP, Carvalho MB, Abrahão M, et al. Dietary patterns and risk of oral cancer: a case-control study in São Paulo, Brazil. Rev Saúde Pública. 2007;41(1):19-26.
20. Garavello W, Lucenteforte E, Bosetti C, Talamini R, Levi F, Tavani A, Franceschi S, Negri E, La Vecchia C. Diet diversity and the risk of laryngeal cancer: A case-control study from Italy and Switzerland. Oral Oncol. 2009;45(1):85-9.
21. Prado RP, dos Santos BF, Pinto CLS, Assis KRC, Salvadori DMF, Ladeira MSP. Influence of diet on oxidative DNA damage, uracil misincorporation and DNA repair capability. Mutagenesis. 2010;25(5):483-7.
22. Suzuki T, Wakai K, Matsuo K, Hirose K, Ito H, Kuriki K, et al. Effect of dietary antioxidants and risk of oral, pharyngeal and laryngeal squamous cell carcinoma according to smoking and drinking habits. Cancer Sci. 2006;97(8):760-7.
23. Xu WH, Shrubsole MJ, Xiang YB, Cai Q, Zhao GM, Ruan ZX, et al. Dietary folate intake, MTHFR genetic polymorphisms, and the risk of endometrial cancer among Chinese women. Cancer Epidemiol Biomarkers Prev. 2007;16(2):281-7.
24. Sapkota A, Hsu CC, Zaridze D, Shangina O, Szeszenia-Dabrowska N, Mates D, et al. Dietary risk factors for squamous cell carcinoma of the upper aerodigestive tract in central and eastern Europe. Cancer Causes Control. 2008;19(10):1161-70.
25. Garcia-Crespo D, Knock E, Jabado N, Rozen R. Intestinal neoplasia induced by low dietary folate is associated with altered tumor expression profiles and decreased apoptosis in mouse normal intestine. J Nutr. 2009;139(3):488-94.
26. Linhart HG, Troen A, Bell GW, Cantu E, Chao W, Moran E, et al. Folate Deficiency induces genomic uracil misincorporation and hypomethylation but does not increase DNA point mutations. Gastroenterology. 2009;136(1):227-35.e3.
27. Duthie SJ. Folate and cancer: how DNA damage, repair and methylation impact on colon carcinogenesis. J Inherit Metab Dis. 2011;34(1)101-9.
28. Bailey LB. Folate, methyl-related nutrients, alcohol, and the MTHFR 677C-T polymorphism affect cancer risk: intake recommendation. Am Soc Nutrl Sci. 2003;133(11 Suppl 1):3748S-53S.
29. Charasson V, Hillaire-Buys D, Solassol I, Laurand-Quancard A, Pinguet F, Morvan VL, et al. Involvement of gene polymorphisms of the folate pathway enzymes in gene expression and anticancer drug sensitivity using the NCI-60 panel as a model. Eur J Cancer. 2009;45(13):2391-401.
30. DAlessio AC, Szyf M. Epigenetic tête-à-tête: the bilateral relationship between chromatin modifications and DNA methylation. Biochem Cell Biol. 2006;84(4):463-76.
31. Tuck-Muller CM, Narayan A, Tsien F, Smeets DF, Sawyer J, Fiala ES, et al. DNA hypomethylation and unusual chromosome instability in cell lines from ICF syndrome patients. Cytogenet Cell Genet. 2000;89(1-2):121-8
32. Jones PA, Baylin SB. The fundamental role of epigenetic events in cancer. Nat Rev Genet. 2002;3(6):415-28.
33. Ehrlich M. Expression of various genes is controlled by DNA methylation during mammalian development. J Cell Biochem. 2003;88(5):899-910.
34. Sciandrello G, Caradonna F, Mauro M, Barbata G. Arsenic-induced DNA hypomethylation affects chromosomal instability in mammalian cells. Carcinogenesis. 2004;25(3):413-7.
35. Johanning GL, Heimburger DC, Piyathilake CJ. DNA methylation and diet in cancer. J Nutr. 2002;132(12):3814S-18S.
36. Kane, MA. The role of folates in squamous cell carcinoma of the head and neck. Cancer Detect Prev. 2005;29(1):46-53.
37. Weinstein SJ, Gridley G, Harty LC, Diehl SR, Brown LM, Winn DM, et al. Folate intake, serum homocysteine and methylenetetrahydrofolate reductase (MTHFR) C677T genotype are not associated with oral cancer risk in Puerto Rico. J Nutr. 2002;132(4):762-7.
38. Kureshi N, Ghaffar S, Siddiqui S, Salahuddin I, Frossard PM. Head and neck cancer susceptibility: a genetic marker in the methylenetetrahydrofolate reductase gene. ORL J Otorhinolaryngol Relat Spec. 2004;66(5):241-5.
39. Neumann AS, Lyons HJ, Shen H, Liu Z, Shi Q, Sturgis EM, et al. Methylenetetrahydrofolate reductase polymorphisms and risk of squamous cell carcinoma of the head and neck: a case-control analysis. Int J Cancer. 2005;115(1):131-6.
40. Vairaktaris E, Yapijakis C, Kessler P, Vylliotis A, Ries J, Wiltfang J, et al. Methylenetetrahydrofolate reductase polymorphism and minor increase of risk for oral cancer. J Cancer Res Clin Oncol. 2006;132(4):219-22.
41. Reljic A, Simundic AM, Topic E, Nikolac N, Justinic D, Stefanovic M. The methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism and cancer risk: the Croatian case-control study. Clin Biochem. 2007;40(13-14):981-5.
42. Suzuki T, Matsuo K, Hasegawa Y, Hiraki A, Wakai K, Hirose K, et al. One-carbon metabolism-related gene polymorphisms and risk of head and neck squamous cell carcinoma: case-control study. Cancer Sci. 2007;98(9):1439-46.
43. Solomon PR, Selvam GS, Shanmugam G. Polymorphism in ADH and MTHFR genes in oral squamous cell carcinoma of Indians. Oral Dis. 2008;14(7):633-9.
44. Kruszyna Ł, Lianeri M, Rydzanicz M, Gajecka M, Szyfter K, Jagodziński PP. Polymorphic variants of folate metabolism genes and the risk of laryngeal cancer. Mol Biol Rep. 2010;37(1):241-7.
45. Galbiatti ALS, Ruiz MT, Biselli-Chicote PM, Raposo LS, Maniglia JV, Pavarino-Bertelli EC, Goloni-Bertollo EM. 5-Methyltetrahydrofolate-homocysteine methyltransferase gene polymorphism (MTR) and risk of head and neck cancer. Braz J Med Biol Res. 2010;43(5):445-50.
46. Scheer JB, Mackey AD and Gregory JF. Activities of hepatic cytosolic and mitochondrial forms of serine hydroxymethyltransferase and hepatic glycine concentration are affected by vitamin B-6 intake in rats. J Nutr. 2005;135(2):233-8.
47. Niclot S, Pruvot Q, Besson C, Savoy D, Macintyre E, Salles G, et al. Implication of the folate-methionine metabolism pathways in susceptibility to follicular lymphomas. Blood. 2006;108(1):278-85.
48. Finkelstein JD, Martin JJ. Homocysteine. Int J Biochem Cell Biol. 2000;32(4):385-9.
49. Morin I, Platt R, Weisberg I, Sabbaghian N, Wu Q, Garrow TA, Rozen R. Common variant in betaine-homocysteine methyltransferase (BHMT) and risk for spina bifida. Am J Med Genet. 2003;119A(2):172-6.
50. Mason JB, Choi SW. Effects of alcohol on folate metabolism: implications for Carcinogenesis. Alcohol. 2005;35(3):235-41.
51. Ueland PM Holm PI, Hustad S. A key modulator of one-carbon metabolism and homocysteine status. Clin Chem Lab Med. 2005;43(10):1069-75.
52. Weisberg IS, Park E, Ballman KV, Berger P, Nunn M, Suh DS, et al. Investigations of a common genetic variant in betaine-homocysteine methyltransferase (BHMT) in coronary artery disease. Atherosclerosis. 2003;167(2):205-14.
53. Haddad R, Mendes MA, Hoehr NF, Eberlin MN. Amino acid quantitation in aqueous matrices via trap and release membrane introduction mass spectrometry: homocysteine in human plasma. Analyst. 2001;126(8):1212-5.
54. Födinger M, Dierkes J, Skoupy S, Röhrer C, Hagen W, Puttinger H, et al. Effect of glutamate carboxypeptidase ii and reduced folate carrier polymorphisms on folate and total homocysteine concentrations in dialysis patients. J Am Soc Nephrol. 2003;14(5):1314-9.
55. Baluz K, Carmo MGT, Rosas G. The role of folic acid on oncologic prevention and intervention: review. Rev Bras Cancerol. 2002;48(4):597-60.
56. Brody LC, Conley M, Cox C, Kirke PN, McKeever MP, Mills JL, et al. A polymorphism, R653Q, in the trifunctional enzyme methylenetetrahydrofolate dehydrogenase/methenyltetrahydrofolate cyclohydrolase/formyltetrahydrofolate synthetase is a maternal genetic risk factor for neural tube defects: report of the Birth Defects Research Group. Am J Hum Genet. 2002;71(5):1207-15.
57. Leclerc D, Campeau E, Goyette P, Adjalla CE, Christensen B, Ross M, et al. Human methionine synthase: cDNA cloning and identification of mutations in patients of the cblG complementation group of folate/cobalamin disorders. Hum Mol Genet. 1996;5(12):1867-74.
58. Weisberg I, Tran P, Christensen B, Sibani S, Rozen R. A second genetic polymorphism in methylenetetrahydrofolate reductase (MTHFR) associated with decreased enzyme activity. Mol Genet Metab. 1998;64(3):169-72.
59. Molloy AM, Daly S, Mills JL, Kirke PN, Whitehead AS, Ramsbottom D, et al. Thermolabile variant of 5,10-methylenetetrahydrofolate reductase associated with low red-cell folates: implications for folate intake recommendations. Lancet 1997;349(9065):1591-3.
60. Girelli D, Friso S, Trabetti E, Olivieri O, Russo C, Pessotto R, et al. Methylenetetrahydrofolate reductase C677T mutation, plasma homocysteine, and folate in subjects from northern Italy with or without angiographically documented severe coronary atherosclerotic disease: evidence for an important genetic-environmental interaction. Blood. 1998;91(11):4158-63.
61. McNulty H, McKinley MC, Wilson B, McPartlin J, Strain JJ, Weir DG, et al. Impaired functioning of thermolabile methylenetetrahydrofolate reductase is dependent on riboflavin status: implications for riboflavin requirements. Am J Clin Nutr. 2002;76(2):436-41.
62. Friso S, Girelli D, Trabetti E, Olivieri O, Guarini P, Pignatti PF, et al. The MTHFR 1298A.C polymorphism and genomic DNA methylation in human lymphocytes. Cancer Epidemiol. Biomarkers Prev. 2005;14(4):938-43.
63. Lievers KJ, Boers GH, Verhoef P, den Heijer M, Kluijtmans LA, van der Put NM, et al. A second common variant in the methylenetetrahydrofolate reductase (MTHFR) gene and its relationship to MTHFR enzyme activity, homocysteine, and cardiovascular disease risk. J Mol Med. 2001;79(9):522-8.
64. Chango A, Boisson F, Barbé F, Quilliot D, Droesch S, Pfister M, et al. The effect of 677C-.T and 1298A-.C mutations on plasma homocysteine and 5,10-methylenetetrahydrofolate reductase activity in healthy subjects. Br J Nutr. 2000;83(6):593-6.
65. Narayanan S, McConnell J, Little J, Sharp L, Piyathilake CJ, Powers H, et al. Associations between two common variants C677T and A1298C in the methylenetetrahydrofolate reductase gene and measures of folate metabolism and DNA stability (strand breaks, misincorporated uracil, and DNA methylation status) in human lymphocytes in vivo. Cancer Epidemiol Biomarkers Prev. 2004;13(9):1436-43.
66. Li YN, Gulati S, Baker PJ, Brody LC, Banerjee R, Kruger WD. Cloning, mapping and RNA analysis of the human methionine synthase gene. Hum Mol Genet. 1996;5(12):1851-8.
67. Ma J, Stampfer MJ, Christensen B, Giovannucci E, Hunter DJ, Chen J, et al. A polymorphism of the methionine synthase gene: association with plasma folate, vitamin B12, homocyst(e)ine, and colorectal cancer risk. Cancer Epidemiol Biomarkers Prev. 1999;8(9):825-9.
68. Harmon DL, Shields DC, Woodside JV, McMaster D, Yarnell JW, Young IS, et al. Methionine synthase D919G polymorphism significant but modest determinant of circulating homocysteine concentrations. Genet Epidemiol. 1999;17(4):298-309.
69. Silaste ML, Rantala M, Sampi M, Alfthan G, Aro A, Kesäniemi YA. Polymorphisms of key enzymes in homocysteine metabolism affect diet responsiveness of plasma homocysteine in healthy women. J Nutr. 2001;131(10):2643-7.
70. Chen J, Stampfer MJ, Ma J, Selhub J, Malinow MR, Hennekens CH, et al. Influence of a methionine synthase (D919G) polymorphism on plasma homocysteine and folate levels and relation to risk of myocardial infarction. Atherosclerosis. 2001;154(3):667-72.
71. Dekou V, Gudnason V, Hawe E, Miller GJ, Stansbie D, Humphries SE. Gene environment and gene-gene interaction in the determination of plasma homocysteine levels in healthy middle-aged men. Thromb Haemost. 2001;85(1):67-74.
72. Paz MF, Avila S, Fraga MF, Pollan M, Capella G, Peinado MA, et al. Germ-line variants in methyl-group metabolism genes and susceptibility to DNA methylation in normal tissues and human primary tumors. Cancer Res. 2002;62(15):4519-24.
73. Fang JY, Xiao SD. Folic acid, polymorphism of methyl-group metabolism genes, and DNA methylation in relation to GI carcinogenesis. J Gastroenterol. 2003;38(9):821-9.
74. Das PM, Singal R. DNA methylation and cancer. J Clin Oncol. 2004;22(22):4632-42.
75. Zhang Z, Shi Q, Liu Z, Sturgis EM, Spitz MR, Wei Q. Polymorphisms of methionine synthase and methionine synthase reductase and risk of squamous cell carcinoma of the head and neck: a case-control analysis. Cancer Epidemiol Biomarkers Prev. 2005;14(5):1188-93.
76. Olteanu H, Munson T, Banerjee R. Differences in the efficiency of reductive activation of methionine synthase and exogenous electron acceptors between the common polymorphic variants of human me-thionine synthase reductase. Biochemistry. 2002;41(45):13378-85.
77. Gaughan DJ, Kluijtmans LA, Barbaux S, McMaster D, Young IS, Yarnell JW, et al. The methionine synthase reductase (MTRR) A66G polymorphism is a novel genetic determinant of plasma homocysteine concentrations. Atherosclerosis. 2001;157(2):451-6.
78. Geisel J, Zimbelmann I, Schorr H, Knapp JP, Bodis M, Hübner U, et al. Genetic defects as important factors for moderate hyperhomocysteinemia. Clin Chem Lab Med. 2001;39(8):698-704.
79. O'Leary VB, Parle-McDermott A, Molloy AM, Kirke PN, Johnson Z, Conley M, et al. MTRR and MTHFR polymorphism: link to Down syndrome? Am J Med Genet. 2002;107(2):151-5.
80. Eklof V, Van GB, Hultdin J, Johansson I, Hallmans G, Palmqvist R. The reduced folate carrier (RFC1) 80G > A and folate hydrolase 1 (FOLH1) 1561C > T polymorphisms and the risk of colorectal cancer: a nested case-referent study. Scand J Clin Lab Invest. 2008;68(5):393-401.
81. DeVos L, Chanson A, Liu Z, Ciappio ED, Parnell LD, Mason JB, et al. Associations between single nucleotide polymorphisms in folate uptake and metabolizing 497 genes with blood folate, homocysteine, and DNA uracil concentrations. Am J Clin Nutr. 2008;88(4):1149-58.
82. Matherly LH, Hou Z, Deng Y. Human reduced folate carrier: translation of basic biology to cancer etiology and therapy. Cancer Metastasis Rev. 2008;26(1):111-28.
83. Stanisławska-Sachadyn A, Mitchell LE, Woodside JV, Buckley PT, Kealey C, Young IS, et al. The reduced folate carrier (SLC19A1) c.80G[A polymorphism is associated with red cell folate concentrations among women. Ann Hum Genet. 2009;73(Pt 5):484-91.
84. Galbiatti AL, Ruiz MT, Rezende Pinto D, Raposo LS, Maniglia JV, Pavarino- Bertelli EC, et al. A80G polymorphism of reduced folate carrier 1 (RFC1) gene and head and neck squamous cell carcinoma etiology in Brazilian population. Mol Biol Rep. 2011;38(2):1071-8.
85. Wang Y, Guo W, He Y, Chen Z, Wen D, Zhang X, et al. Association of MTHFR C677T and SHMT1 C1420T with susceptibility to ESCC and GCA in a high incident region of Northern China. Cancer Causes Control. 2007;18(2):143-52.
86. Jonge R, Tissing WJE, Hooijberg JH, Jansen G, Kaspers GJL, Lindemans J, et al. Polymorphisms in folate-related genes and risk of pediatric acute lymphoblastic leukemia. Blood. 2009;113(10):2284-9.
87. Guerreiro CS, Carmona B, Gonçalves S, Carolino E, Fidalgo P, Brito M, et al. Risk of colorectal cancer associated with the C677T polymorphism in 5,10-methylenetetrahydrofolate reductase in Portuguese patients depends on the intake of methyl-donor nutrients. Am J Clin Nutr. 2008;88(5):1413-8.
88. Ott N, Geddert H, Sarbia M. Polymorphisms in methionine synthase (A2756G) and cystathionine -synthase (844ins68) and susceptibility to carcinomas of the upper gastrointestinal tract. J Cancer Res Clin Oncol. 2008;134(3):405-10.
89. Le Marchand L, Donlon T, Hankin JH, Kolonel LN, Wilkens LR, Seifried A. B-vitamin intake, metabolic genes, and colorectal cancer risk (United States). Cancer Causes Control. 2002;13(3):239-48.
1. Bióloga (Mestranda em Ciências da saúde - Unidade de Pesquisa em Genética e Biologia Molecular (UPGEM)).
2. Doutora em Ciências da saúde (Professora Adjunta - Universidade Federal do Triângulo Mineiro (UFTM)).
3. Medico, Livre Docente (Professor Adjunto - Faculdade de Medicina de São José do Rio Preto (FAMERP)).
4. Médico (Mestrando em Ciências da saúde).
5. Livre Docente em Genética Humana e Médica (Professora Adjunta - Faculdade de Medicina de São José do Rio Preto (FAMERP)).
6. Livre Docente em Genética Humana e Médica (Professora Adjunto).
FAMERP - Faculdade de Medicina de São José do Rio Preto.
Endereço para correspondência:
Faculdade de Medicina de São José do Rio Preto - FAMERP
Av. Brigadeiro Faria Lima, 5416 - Vila São Pedro
CEP: 15090-000. São José do Rio Preto - SP
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 10 de Agosto de 2010. cod. 7260
Artigo aceito em 18 de setembro de 2010.


