INTRODUÇÃOO zumbido, a percepção de som na ausência de um estímulo acústico aparente, é uma preocupação de saúde crescente em todas as camadas da população. As estimativas indicam que 10%-15% da população podem apresentar zumbido. Adultos e crianças podem ser afetados, a prevalência de zumbido aumenta com a idade e existe uma alta incidência associada tanto com a exposição ao ruído como com a perda de audição relacionada com a idade. Apesar de sua fisiopatologia ainda precisar ser elucidada, o zumbido poderia ser resultado de uma atividade neural espontânea e aberrante em qualquer nível do sistema auditivo1.
Aproximadamente 8% dos indivíduos com zumbido são gravemente debilitados pelo sintoma angustiante; em 2.800 pacientes com zumbido, ocorreu uma associação significante (
p<0,05) entre o sintoma e a redução da qualidade de vida2. Não há influência de gênero, idade e perda auditiva no incômodo gerado pelo zumbido3.
O zumbido subjetivo é um sintoma comum com muitas causas4. Um estudo epidemiológico mostrou que a causa mais comum do zumbido foi a perda da audição induzida pelo ruído (37,8% dos casos); entretanto, muitos casos podem estar correlacionados com diversos outros distúrbios, tais como dor, ansiedade, depressão e dores de cabeça causadas por migrânea5. Distúrbios otológicos, especialmente os que cursam com perda auditiva neurossensorial ou condutiva, como exposição excessiva a ruídos intensos, presbiacusia, doenças metabólicas, ototóxicos, doença de Ménière, schwannoma vestibular, desordens psicológicas, são fatores causais frequentes6. O zumbido também pode ocorrer em pacientes com audiometria normal; os pacientes com zumbido e audição normal apresentaram características clínicas semelhantes às dos pacientes com perda auditiva; no entanto, a faixa etária acometida e a interferência sobre a concentração e o equilíbrio emocional foram significantemente menores7. Em pacientes idosos em que o achado principal à audiometria foi a presbiacusia, não foi encontrada correlação entre o grau da perda auditiva e o grau de insatisfação do paciente com o zumbido8. O zumbido é um dos quatro sintomas clássicos da doença de Ménière, uma condição associada ao prejuízo substancial da qualidade de vida do paciente9.
A terapia do zumbido é tão diversificada quanto a origem da condição. Quando há uma causa aparente, ela deve ser tratada. O controle da causa pode não ser suficiente para reduzir ou eliminar o zumbido. Com graus variáveis de sucesso, foram propostos diferentes tratamentos para zumbido, tais como terapia de retreinamento, mascaramento sonoro, utilização de prótese auditiva, acupuntura e terapia farmacológica.
Diversas opções farmacêuticas têm sido investigadas10-12, com diferentes graus de benefício sintomático e melhora da qualidade de vida1-2,13. Foram experimentados estabilizadores de membrana (cloridrato de lidocaína), anticonvulsivantes (carbamazepina, gabapentina), antidepressivos (cloridrato de fluoxetina, cloridrato de sertralina), ansiolíticos (clonazepam, alprazolam), extrato 761 de Ginkgo biloba, vasomoduladores (flunarizina, cinarizina e betaistina); o tempo de uso de cada medicação e o critério de escolha depende da característica clínica de cada paciente14.
Há estudos mostrando que a betaistina pode oferecer alívio sintomático do zumbido15-18. A betaistina é um heterorreceptor antagonista H3 e um receptor agonista H1 que melhora a microcirculação no ouvido interno19, promovendo e facilitando a compensação vestibular central20-22. É atualmente indicada para o tratamento dos sintomas de diversos distúrbios vestibulares23-24, incluindo o zumbido. Os possíveis eventos adversos da betaistina incluem dor de cabeça e desconforto epigástrico. A betaistina é contraindicada em pacientes com úlcera gastrointestinal, asma, feocromocitoma e hipersensibilidade ao medicamento23.
O objetivo deste estudo foi avaliar o efeito da betaistina sobre o zumbido de pacientes com distúrbios da função vestibular.
MÉTODOEste foi um estudo de controle de caso, retrospectivo e experimental, realizado em uma instituição universitária. Foram coletados os dados retrospectivos de 865 pacientes com idade acima de 18 anos que apresentavam disfunção vestibular periférica e zumbido. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da universidade onde o estudo foi realizado, sob o protocolo de número 0117/08.
Os pacientes foram submetidos a uma avaliação otoneurológica que incluiu história clínica, exame de ouvido, nariz e garganta, avaliação audiológica e vestibular. A avaliação da audição foi realizada por meio de audiometria tonal, testes de reconhecimento da fala e medida de imitância acústica. Avaliação do processamento auditivo, audiometria de tronco encefálico e/ou eletrococleografia foram eventualmente realizadas. A avaliação de equilíbrio corporal incluiu testes de Romberg e Unterberger-Fukuda, pesquisa de nistagmo posicional e de posicionamento e eletronistagmografia.
Foram incluídos pacientes com diagnóstico de distúrbios vestibulares periféricos. Foram excluídos os pacientes com distúrbios do sistema nervoso central e os que não completaram o período de tratamento ou que utilizaram outras medicações antivertiginosas ou zumbidogênicas. Os pacientes que podiam utilizar betaistina formaram o grupo de estudo, enquanto que o grupo controle compreendeu pacientes impossibilitados de receber a medicação por diversos motivos, incluindo gastrite grave, úlcera, gravidez, asma e hipersensibilidade ao medicamento.
Os pacientes do grupo de estudo receberam 48 mg/dia de dicloridrato de betaistina em 2 ou 3 administrações ao dia, durante 120 dias. Todos os pacientes realizaram controle dos fatores agravantes e exercícios de reabilitação vestibular como tratamento de base. Com o objetivo de poder comparar de modo homogêneo os resultados clínicos entre os grupos de tratamento e de controle, uma amostra randômica de pacientes do grupo de estudo foi selecionada para fornecer um número semelhante de indivíduos em cada grupo para análise estatística.
Os pacientes foram observados no início e após quatro meses de terapia. A impressão global do paciente foi utilizada como variável para avaliar a eficácia do tratamento. A efetividade foi avaliada de acordo com a resposta subjetiva ao final do período de tratamento. A avaliação da eficácia foi realizada utilizando-se a classificação a seguir: 1 = melhora completa (paciente livre de sintomas), 2 = melhora muito boa, 3 = melhora boa, 4 = leve melhora e 5 = sem melhora. Os pacientes com melhora muito boa, melhora boa, e melhora leve foram incluídos na categoria de melhora (melhora parcial). A tolerabilidade foi julgada pelos investigadores e pelo paciente no fim do tratamento. O teste de chi-quadrado foi utilizado para comparar estatisticamente a melhora clínica do zumbido entre os grupos de tratamento e controle. O nível de significância foi de 5% (α= 0,05). As análises estatísticas foram realizadas utilizando SPSS 10.0 para Windows (Pacote Estatístico para Ciências Sociais, versão 10.0, 1999).
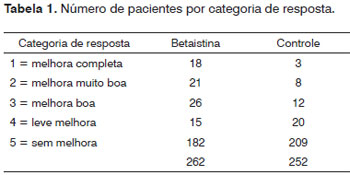
RESULTADOSUm total de 613 pacientes do grupo de estudo (70,9%) e 252 do grupo de controle (29,1%) foram incluídos. A melhora clínica foi observada em 202 (32,8%) pacientes do grupo de estudo e em 43 (17%) casos do grupo de controle, como mostra a Figura 1. Com o objetivo de comparar os resultados clínicos do zumbido entre os grupos, uma amostra randômica de 42,7% pacientes do grupo de estudo (n=262) foi selecionada para fornecer um número semelhante de indivíduos do estudo e do controle para análise (Figura 2). Um total de 514 pacientes constituiu a casuística desta pesquisa. O grupo experimental foi constituído por 262 pacientes (51,0%), com idade variando de 19 a 76 anos (média de 54,5 anos), sendo 160 do gênero feminino (61,1%) e 102 (39,9%) do gênero masculino e o grupo controle foi formado por 252 pacientes (49,0%), com idade variando de 22 a 79 anos (média de 56,0 anos), sendo 156 do gênero feminino (62,4%) e 90 (37,6%) do masculino. Não foi observada diferença entre os grupos de estudo e de controle quanto ao número de casos tratados, a idade e o gênero. Observou-se melhora clínica em 80/262 (30,5%) pacientes tratados com a betaistina e em 43/252 (17,1%) casos do grupo controle (Tabela 1). Houve diferença estatisticamente significativamente (
p<0,0001) entre os resultados do grupo de estudo e o grupo controle, quanto à porcentagem de casos melhorados, demonstrando a eficácia da betaistina na remissão ou eliminação do zumbido nos pacientes com disfunção vestibular.
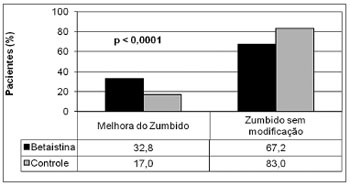
Figura 1. Comparação da melhora clínica do zumbido entre os pacientes do grupo de estudo e do grupo de controle.
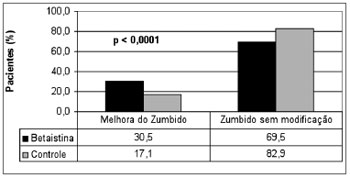
Figura 2. Comparação da melhora clínica do zumbido entre uma amostra randômica do estudo e os pacientes do grupo de controle.
O tratamento com betaistina foi bem tolerado, com uma baixa incidência de eventos adversos leves e transitórios, como dor de cabeça, desconforto epigástrico e dispepsia. Não foi necessário interromper o uso do medicamento em nenhum dos casos que apresentaram estes eventos adversos.
DISCUSSÃOA betaistina é atualmente utilizada no tratamento de diversos distúrbios vestibulares24. Em uma revisão sobre os efeitos da betaistina em pacientes com doença de Ménière, alguns estudos mostraram resultados considerados favoráveis quanto à redução da vertigem e do zumbido e um estudo mostrou que a betaistina não causava efeito sobre o zumbido em comparação com o placebo15. As pesquisas clínicas mais recentes têm demonstrado que a betaistina é eficiente no tratamento dos sintomas da doença de Ménière9,25-26. Os achados do presente estudo também evidenciaram a atividade da betaistina na redução do zumbido em pacientes com distúrbios vestibulares. Observou-se melhora clínica significante (
p<0,0001) em 30,5% pacientes tratados com a betaistina, em comparação com 17,1% casos melhorados no grupo controle.
A melhora do zumbido com o uso da betaistina também tem sido relatada em outros estudos. Em pacientes com doença de Ménière, foi observada redução do zumbido tanto com dimesilato de betaistina (36 mg/dia), como com uma combinação de 20 mg de cinarizina e 40 mg de dimenidrinato, não havendo diferença significante entre os dois grupos de tratamento27. Em outro estudo, o uso durante 5 semanas de uma combinação de mesilato de betaistina, complexo B vitamínico e diazepam reduziu de modo significante o zumbido28. Não é possível estabelecer comparação entre estes achados, pois a presente investigação foi efetuada com dicloridrato de betaistina e com diferente formulação e dosagem.
A betaistina não foi diretamente comparada com outras abordagens farmacológicas no tratamento do zumbido, sendo difícil, portanto, estimar a sua eficácia em relação a outras alternativas. Os antidepressivos são comumente prescritos para zumbido. Existem relatos de casos com o uso de fluoxetina e paroxetina, revisões retrospectivas para imipramina e inibidores seletivos de recaptação da serotonina; estudos com amitriptilina e pesquisas duplo-cegas com trimipramina, nortriptilina, paroxetina e sertralina, em comparação com placebo. Por outro lado, a literatura também menciona que o zumbido pode ser um efeito adverso de medicamentos antidepressivos, tais como fenelzina, amitriptilina, protriptilina, doxepina, imipramina, fluoxetina, trazadone, bupropiona, venlafaxina. O zumbido também pode ser associado com a suspensão dos antidepressivos venlafaxina e sertralina29-31.
A evidência para as abordagens farmacológicas do tratamento do zumbido está sendo construída. Os dados deste estudo sugerem que a betaistina pode ser uma opção terapêutica útil e bem tolerada a ser considerada. Não encontramos outros estudos para comparação pertinente com os nossos achados em pacientes com zumbido e síndromes vestibulares periféricas. São necessários estudos prospectivos controlados para confirmar os presentes resultados.
CONCLUSÃOA dose de 48 mg/dia de betaistina durante 120 dias consecutivos é útil na redução ou eliminação do zumbido de pacientes com distúrbios vestibulares.
REFERÊNCIAS BIBLIOGRÁFICAS1. Henry JA, Dennis KC, Schechter MA. General review of tinnitus: prevalence, mechanisms, effects, and management. J Speech Lang Hear Res. 2005;48:1204-3.
2. Nondahl DM, Cruickshanks KJ, Dalton DS, Klein BE, Klein R, Schubert CR, et al. The impact of tinnitus on quality of life in older adults. J Am Acad Audiol. 2007;18:257-66.
3. Pinto PCL, Sanchez TG, Tomita S. Avaliação da relação entre severidade do zumbido e perda auditiva, sexo e idade do paciente. Braz J Otorhinolaryngol. 2010;76(1):18-24.
4. Fornaro M, Martino M. Tinnitus psychopharmacology: A comprehensive review of its pathomechanisms and management. Neuropsychiatr Dis Treat. 2010;6:209-18.
5. Axelsson A. Tinnitus epidemiology. In: Reich GF, Vernon JA, eds. Fifth international tinnitus seminar; 1995; Portland, Oregon. Proceedings. Portland, Oregon: American Tinnitus Association. 1995;12-15.p.249-53.
6. Crummer RW, Hassan GA. Diagnostic Approach to Tinnitus. Am Fam Physician. 2004;69:120-6,127-8.
7. Sanchez TG, Medeiros ÍRT, Levy CP, Ramalho JRO, Bento F. Zumbido em pacientes com audiometria normal: caracterização clínica e repercussões. Braz J Otorhinolaryngol. 2005;71(4):427-31.
8. Ferreira LMBM, Ramos Júnior AN, Mendes EP. Caracterização do zumbido em idosos e de possíveis transtornos relacionados. Braz J Otorhinolaryngol. 2009;75(2):249-55.
9. Lacour M, van de Heyning PH, Novotny M, Tighilet B. Betahistine in the treatment of Ménières disease. Neuropsych Dis Treat. 2007;3:1-12.
10. Patterson MB, Balough BJ. Review of pharmacological therapy for tinnitus. Int Tinnitus J. 2006;12(2):149-59.
11. Elgoyhen AB, Langguth B. Pharmacological approaches to the treatment of tinnitus. Drug Discov Today. 2010;15(7-8):300-5.
12. Seidman MD, Standring RT, Dornhoffer JL. Tinnitus: current understanding and contemporary management. Curr Opin Otolaryngol Head Neck Surg. 2010;18(5):363-8.
13. Møller AR. Tinnitus: presence and future. Prog Brain Res. 2007;166:3-16.
14. Onishi E, Kasse C, Rodrigues C, Oliveira MHP, Aprile MR, Bataglia PUR, Karsch UM. Como diagnosticar e tratar zumbido. Rev Bras Med. 2008;65:32-7.
15. James AL, Burton MJ. Betahistine for Ménières disease or syndrome. Cochrane Database Syst Rev. 2001;(1):CD001873.
16. Ma FR, Xin Y, Zhao YM, Lü JQ. Efficacy of Betahistine Mesilate combined with Flunarizine Hydrochloride for treating tinnitus. Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2006;41:269-73.
17. Gryczyńska D, Drobik-Wasiewicz K, Malicka M, Kotecki M. Therapy of tinnitus in children. Otolaryngol Pol. 2007;61:784-8.
18. Frew IJC, Menon GN. Betahistine hydrochloride in Ménières disease. Postgrad Med J. 1976;52:501-3.
19. Dziadziola JK, Laurikainen EL, Rachel JD, Quirk WS. Betahistine increases vestibular blood flow. Otolaryngol Head Neck Surg. 1999;120:400-5.
20. Dutia MB. Betahistine, vestibular function and compensation: in vitro studies of vestibular function and plasticity. Acta Otolaryngol Suppl. 2000;544:11-4.
21. Lacour M, Tighilet B. Vestibular compensation in the cat: the role of the histaminergic system. Acta Otolaryngol Suppl. 2000;544:15-8.
22. Lacour M, Sterkers O. Histamine and betahistine in the treatment of vertigo: elucidadtion of mechanisms of action. CNS Drugs. 2001;15:853-70.
23. Ganança MM, Munhoz MSL, Caovilla HH, Silva MLG. Managing vertigo. Hannover: Solvay; 2006. p.112.
24. Ganança MM, Caovilla HH, Munhoz MSL, Ganança CF, Silva MLG, Serafini F, et al. Optimizing the pharmacological component of integrated balance therapy. Braz J Otorhinolaringol. 2007;73:12-8.
25. Strupp M, Hupert D, Frenzel C, Wagner J, Hahn A, Jahn K, et al. Long-term prophylactic treatment of attacks of vertigo in Ménière's disease: comparison of a high with a low dosage of betahistine in an open trial. Acta Otolaryngol. 2008;128(5):520-4.
26. Ganança MM, Caovilla HH, Ganança FF. Comparable efficacy and tolerability between twice daily and three times daily betahistine for Ménières disease. Acta Otolaryngol. 2009;129(5):487-92.
27. Novotný M, Kostrica R. Fixed combination of cinnarizine and dimenhydrinate versus betahistine dimesylate in the treatment of Ménières disease: a randomized, double-blind, parallel group clinical study. Int Tinnitus J. 2002;8:115-23.
28. Ohsaki K, Ueno M, Zheng HX, Wang QC, Nishizaki K, Nobuto Y, et al. Evaluation of tinnitus patients by peroral multi-drug treatment. Auris Nasus Larynx. 1998;25:149-54.
29. Robinson SK, Viirre ES, Bailey KA, Gerke MA, Harris JP, Stein MB. Randomized placebo-controlled trial of a selective serotonin reuptake inhibitor in the treatment of nondepressed tinnitus subjects. Psychosom Med. 2005;67:981-8.
30. Robinson S. Antidepressants for treatment of tinnitus. Prog Brain Res. 2007;166:263-71.
31. Robinson SK, Viirre ES, Stein MB. Antidepressant therapy in tinnitus. Hear Res. 2007;226:221-31.
1. Professor Titular de Otorrinolaringologia da Universidade Federal de São Paulo - Escola Paulista de Medicina. Docente do Programa de Mestrado Profissional em Reabilitação do Equilíbrio Corporal e Inclusão Social da Universidade Bandeirante de São Paulo.
2. Livre-Docente em Otoneurologia. Professor Associado, da Disciplina de Otologia e Otoneurologia da Universidade Federal de São Paulo - Escola Paulista de Medicina. Professor Associado, da Disciplina de Otologia e Otoneurologia da Universidade Federal de São Paulo - Escola Paulista de Medicina.
3. Doutora em Ciências pelo Curso de Pós-Graduação em Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo - Escola Paulista de Medicina. Docente do Programa de Mestrado Profissional em Reabilitação do Equilíbrio Corporal e Inclusão Social da Universidade Bandeirante de São Paulo.
4. Doutora em Ciências pelo Programa Distúrbios da Comunicação Humana pelo Departamento Fonoaudiologia da Universidade Federal de São Paulo - Escola Paulista de Medicina., Doutora em Ciências pelo Programa Distúrbios da Comunicação Humana pelo Departamento Fonoaudiologia da Universidade Federal de São Paulo - Escola Paulista de Medicina.
5. Médico Otorrinolaringologista, Pós-Doutorado pela UNIFESP - EPM. Professor Adjunto, Chefe da Disciplina de Otologia e Otoneurologia da UNIFESP - EPM, Professor Adjunto, Chefe da Disciplina de Otologia e Otoneurologia da UNIFESP - EPM.
Universidade Federal de São Paulo.
Endereço para correspondência:
Maurício Malavasi Ganança
Rua Dr. Eduardo de Souza Aranha, 99 cj. 62
São Paulo - SP. CEP: 04543-120
E-mail: mauricio.gananca@globo.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 9 de agosto de 2010. cod. 7255
Artigo aceito em 1 de dezembro de 2010.


