INTRODUÇÃOA AIDS (Acquired Immunodeficiency Syndrome), identificada em 1981, surgiu como uma epidemia causada pelo vírus da imunodeficiência humana1, capaz de provocar alterações, tais como a disfunção e diminuição dos linfócitos T CD4. Além disso, as demais células do sistema imune serviriam como reservatório para o vírus e, assim, os tecidos linfoides, incluindo o encontrado na região da laringe, serviriam como estruturas de replicação viral2-5.
Os folículos linfoides (FL) são resultantes da união dos diferentes tipos de linfócitos T e B e, quando encontrados próximos às mucosas, produzem substâncias que irão ativar a resposta imune local contra agentes infecciosos. Os FL encontrados nas Pregas Vestibulares (PV), que são duas lâminas espessas, sagitalmente orientadas, com mucosa de tamanho duplicado que surge dentro da parede supraglótica6, são protetores das vias aéreas superiores, do mesmo modo que os tecidos linfoides associados às mucosas7-9.
Os tecidos linfoides associados às mucosas têm como principal função prevenir a penetração de um enorme número de microorganismos no organismo10-12. As citocinas produzidas nos FL promovem diferenciação plasmocitária e produção de anticorpos, que no caso do trato respiratório é principalmente do tipo IgA, liberada na secreção das células da mucosa, inclusive nas PV5,13. Nos indivíduos infectados pelo HIV, a imunidade celular e a humoral são incapazes de controlar a infecção, o que acaba resultando em exaustão de várias funções de linfócitos e aumento da susceptibilidade a infecções secundárias e oportunistas. Alguns dos problemas imunes ocorrem nos linfócitos B policlonais, que se encontram constantemente ativados, levando à hipergamaglobulinemia espontânea14,15. Outros sinais de anormalidade de linfócitos B são a alta incidência de tumores destas células em indivíduos infectados pelo HIV e o desregulamento na expressão de várias moléculas de superfície16. Já foi demonstrado que os níveis séricos de IgA tendem a aumentar como resultado de Infecção pelo HIV, e este fenômeno pode ser preditivo de progressão na AIDS. Porém, embora alterações na secreção de IgA possam ser previstas como resultado de uma infecção pelo HIV, pouco se sabe sobre respostas humorais em mucosas na deficiência imunológica15.
Em pacientes com AIDS, as infecções respiratórias são uma das principais causas de mortalidade e morbidade17-20. O tecido linfoide associado à mucosa secretor de IgA é o principal mecanismo local de proteção do trato respiratório e a sua ativação é o objetivo das vacinas que visam desenvolver a imunidade nas vias aéreas superiores como forma de prevenir infecções respiratórias10,11,13.
Além das alterações na secreção de IgA, alguns autores sugerem que nos pacientes com AIDS a deposição aumentada de colágeno contribui para a depleção de células T CD4. Este aumento da neoformação de colágeno está associado com o aumento da ativação do sistema imune de forma crônica, havendo uma relação entre a neoformação de colágeno e a ruptura da arquitetura do tecido linfoide21-24.
Estudos realizados em nosso departamento demonstraram a natureza das células que formam os FL encontrados nas PV de indivíduos adultos9, e sua redução nos casos com AIDS5. Devido à importância do sistema imune associado à mucosa na proteção local, além de entender a constituição dos FL das PV, o conhecimento de seu arranjo e funcionamento é o primeiro passo para o entendimento mecanismos que influenciam no desenvolvimento de infecções respiratórias em pacientes com AIDS. Portanto, o objetivo deste estudo foi avaliar a influência da fibrose na constituição dos FL encontrados nas PV de adultos autopsiados com AIDS, e avaliar sua função por meio da quantificação das imunoglobulinas produzidas eles.
MATERIAIS E MÉTODOSFoi realizado um estudo retrospectivo transversal de 290 autópsias realizadas entre 1993 e 2007. Foram colhidas dos laudos de autópsia informações como a idade, o sexo, o peso e a causa de morte. Foram excluídos todos os casos em que a laringe não foi coletada, os casos com idade inferior a 18 anos e os casos sem AIDS que não se adequavam ao pareamento pela idade com o grupo com AIDS. Após aplicar os critérios de exclusão da amostra, foram estudadas 71 PV de adultos autopsiados, sendo 52 com AIDS e 19 sem AIDS. Os indivíduos com idade maior ou igual a 60 anos, com índice de massa corporal (IMC) com valores inferiores a 22,0 foram considerados subnutridos, e sobrepeso para os valores superiores a 27 kg/m
2. Para os indivíduos com idade menor que 60 anos, o IMC abaixo de 18,5 e acima de 25,0 kg/m
2 foram considerados subnutrição e sobrepeso, respectivamente25,26. Este projeto foi aprovado pelo Comitê de Ética em Pesquisa no dia 30/05/2004, sob o protocolo de número 481.
Os fragmentos contendo as PV foram incluídos em parafina e os cortes, realizados com espessura de 4 µm. Foi realizada a imuno-histoquímica para posterior análise morfométrica das células dos FL das PV e da expressão de imunoglobulinas. No processo de recuperação antigênica, foi utilizada tripsina. A lavagem das lâminas foi feita com o tampão PBS 0,05M + Triton X-100 0,05%. Todos os anticorpos foram incubados por um tempo médio de 2 horas. O complexo LSAB (DAKO
®) foi adicionado e permaneceu sobre os cortes por trinta minutos. Após esta fase, o material foi incubado com 3,3-Diaminobenzidina (DAB), à temperatura ambiente. As lâminas foram, então, lavadas em água destilada, contracoradas pela hematoxilina e montadas em entelan. Para análise morfométrica das células que compõem os FL das CVF, foi realizada a imunohistoquímica para linfócitos B e T, macrófagos e células dendríticas foliculares, utilizando os anticorpos primários Anti-B-Cells (Biogenex, 1: 100), Anti-CD3 (Dako, 1: 40), Anti-CD68 (Dako, 1: 80) e Anti-Follicular Dendritic Cells (Dako, 1: 80)5. Para a avaliação das imunoglobulinas, foram utilizados os anticorpos: anti-IgA (Novocastra
®, 1:1000), Anti-IgG (Novocastra
®, 1:1000), e anti-IgM (Novocastra
®, 1: 800). A expressão de cada imunomarcação foi quantificada em toda a extensão do corte histológico, com o uso do programa KS 300 (Kontron-Zeiss
®).
Para análise da fibrose, a lâmina foi corada pelo picro-sirius (solução aquosa saturada de ácido pícrico adicionada de 0,1g% de vermelho da Síria F3b, Sirius red F3B-Bayer
®) com contracoloração pela hematoxilina. A quantificação do colágeno foi realizada em toda a extensão do corte da PV, sob luz polarizada, com aumento final de 200X. Os resultados foram expressos em relação ao percentual de colágeno por área do campo analisado, utilizando-se o programa KS 300 (Kontron-Zeiss
®).
Para a análise estatística foi elaborado uma planilha eletrônica no programa Microsoft Excel e utilizado o programa SigmaStat
®, versão 2.0. Foram consideradas estatisticamente significantes as diferenças em que a probabilidade de rejeição da hipótese de nulidade foi menor que 5% (
p<0,05).
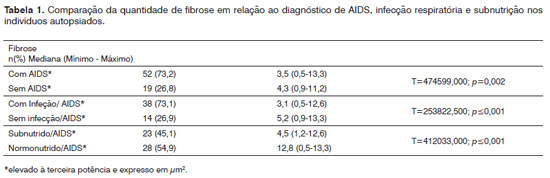
RESULTADOSDentre os 71 indivíduos estudados, 52 (73,24%) possuíam o diagnóstico de AIDS, com mediana de idade de 37,5 anos, variando entre 21 e 61 anos, e 19 (26,8%) não possuíam AIDS, apresentaram mediana de idade de 41,0 anos, variando de 23 a 62 anos. Na análise morfométrica dos FL das PV, observou-se que a quantidade fibrose foi menor nos indivíduos com AIDS, quando comparado com os indivíduos sem AIDS (
p=0,002) (Figuras 1 e 2). Os casos de indivíduos com AIDS e com infecção do trato respiratório apresentaram menor quantidade de fibrose. A fibrose foi significativamente menor nos indivíduos com AIDS e subnutridos quando comparados aos normonutridos com AIDS (
p < 0, 001) (Tabela 1).
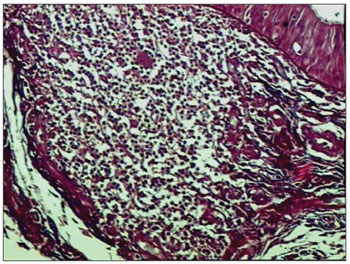
Figura 1. Picro-sirius em CVF de paciente com AIDS (PS 200X).
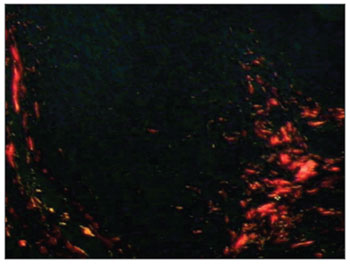
Figura 2. Picro-sirius em CVF de paciente com AIDS em luz polarizada (PS 200X).
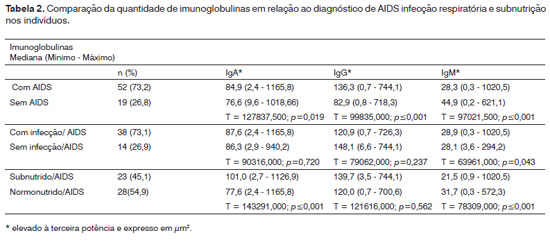
Na análise morfométrica das imunoglobulinas, os indivíduos com AIDS apresentaram quantidades significativamente menores de IgM (Figuras 7 e 8), e maiores de IgG (Figuras 5 e 6) e IgA (Figuras 3 e 4). Os casos de indivíduos com AIDS e infecção do trato respiratório apresentaram IgM significativamente maior, e aqueles com subnutrição apresentaram valores significativamente maiores de IgA, e significativamente menores de IgM (Tabela 2).
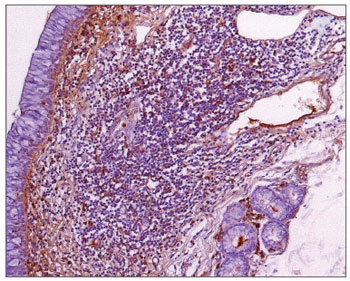
Figura 3. Imuno-histoquímica para IgA em CVF de paciente sem AIDS (PAP 200X).
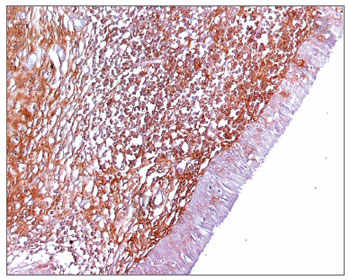
Figura 4. Imuno-histoquímica para IgA em CVF de paciente com AIDS (PAP 200X).
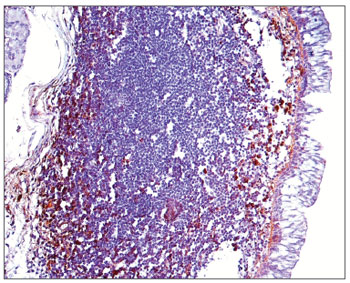
Figura 5. Imuno-histoquímica para IgG em CVF de paciente sem AIDS (PAP 200X).
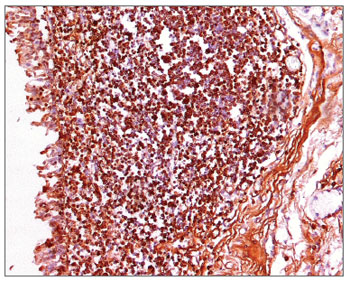
Figura 6. Imuno-histoquímica para IgG em CVF de paciente com AIDS (PAP 200X).
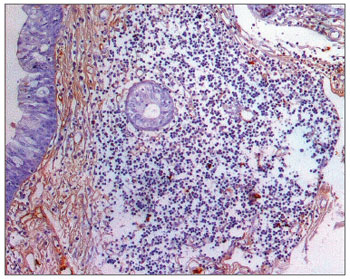
Figura 7. Imuno-histoquímica para IgM em CVF de paciente sem AIDS (PAP 200X).
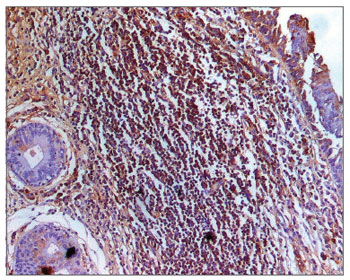
Figura 8. Imuno-histoquímica para IgM em CVF de paciente com AIDS (PAP 200X).
Foram observadas as seguintes correlações: negativa entre a fibrose e a quantidade de linfócitos T (rS= -0,213;
p=0,0657), linfócitos B (sR= -0,0500;
p=0,685) e células dendríticas foliculares (sR= -0,0275;
p=0,819); positiva entre a fibrose e o número de macrófagos (sR= 0,0980;
p=0,415); negativa e significativa entre a fibrose e porcentagem de IGA (sR= -0,0818;
p=0,00762), e positiva e significativa entre a fibrose e a porcentagem de IgG (sR= 0,0874;
p=0,00644) e IgM (sR= 0,108;
p=0,00194).
DISCUSSÃOEm nosso estudo, a quantidade de fibrose foi menor nos pacientes com AIDS, e se relacionou negativamente com a porcentagem de linfócitos T. Nos pacientes com HIV, a neoformação de colágeno e a fibrose contribuem para a depleção de células T CD4
+ e limitam a reconstituição imune. A maior predisposição para a neoformação de colágeno pode, ainda, ser relacionada com a redução da população de células T CD4
+ virgens, que possuem fenótipo não ativado, antes da terapia antirretroviral. Esta fibrose pode ser uma das causas da falha na recuperação imune durante o tratamento, apesar da supressão da replicação viral21-24. Estes dados estão de acordo com os achados de nosso estudo, no qual houve uma correlação negativa entre a quantidade de fibrose e de linfócitos T, demonstrando que, embora em menor quantidade nos indivíduos com AIDS, a fibrose se concentrava na zona parafolicular, ocupando a área onde anteriormente estavam os linfócitos T. Essa alteração da zona parafolicular poderia modificar a estrutura geral do FL, contribuindo com a redução dos outros tipos celulares. Embora tenha sido observada aumento da porcentagem de macrófagos em relação à fibrose, acreditamos que estas células, de modo geral, estejam envolvidas com a reparação tecidual e, consequentemente, com a produção de colágeno27, justificando a correlação positiva encontrada neste trabalho.
A fibrose foi menor nos indivíduos com AIDS associada a infecções respiratórias e subnutrição. Nos indivíduos com AIDS as infecções respiratórias são consideradas as principais causas de morte19,20,24, ocorrendo numa fase mais avançada da doença, onde frequentemente são encontradas alterações do estado nutricional28-30. Um estudo realizado em macacos infectados com o SIV (Simian Immunodeficiency Virus), responsável por induzir nestes animais uma infecção semelhante à que ocorre em humanos, demonstrou uma maior neoformação de fibrose nos tecidos linfoides. No entanto, estes animais foram avaliados por um curto período após a infecção, não tendo relatos sobre o que ocorre em casos de infecção crônica pelo SIV24, que poderia ser semelhante aos casos grave de AIDS observados neste estudo, que culminaram com complicações como infecções e subnutrição, culminando com o óbito.
Embora os indivíduos não tenham sido avaliados em relação ao uso de terapia antirretroviral, estudos demonstram que se instituída num estágio precoce da fase sintomática da doença, esta terapia pode promover um balanço de células T auxiliares e reguladoras, e consequentemente uma menor neoformação de colágeno24,31, como observado em nossos dados, e podendo ser essa a causa da menor quantidade de fibrose nos indivíduos autopsiados com AIDS.
A quantidade de IgM foi menor nos FL das PV de indivíduos com AIDS, enquanto que as quantidades de IgA e IgG se mostraram aumentadas. Estudos já encontraram uma queda na secreção de IgA pela parótida e tonsila palatina, indicando que as respostas imunes sistêmica e de mucosas apresentam variação na infecção pelo HIV14,15,32. Neste estudo os níveis de IgA secretória estão muito diminuídos, e este disparate entre as respostas sistêmica e de mucosa poderia contribuir e/ou justificar a queda nas defesas de mucosa, levando a infecções oportunistas. As concentrações de IgG secretadas estavam elevadas nos pacientes com HIV. Esta alteração poderia refletir sérias alterações na barreira das mucosas ao longo da infecção pelo HIV. A ativação de LB policlonais e secretores de IgG poderia explicar o aumento destas concentrações. O aumento grande de IgA sérica pode ser resultado da ativação de LB policlonais, que produziriam mais IgA monomérica (IgA1) e uma quebra da IgA secretória proveniente das mucosas14,15,32.
As quantidades das imunoglobulinas, principalmente de IgM, foram maiores nos pacientes com AIDS e infecções respiratórias. Vários trabalhos demonstram que os níveis séricos de imunoglobulinas tendem a aumentar como resultado de infecção pelo HIV devido à ativação de LB policlonais, e este fenômeno pode ser preditivo de progressão para instituição e agravamento da AIDS. Embora o papel da IgA sérica na imunidade ainda não ser claramente definido, há cada vez mais evidências que sugerem um papel fundamental para IgA secretora na mediação de imunidade à infecção na superfície de mucosas. No entanto, pouco se sabe sobre respostas humorais em mucosas durante as deficiências imunológicas14,15. Este estudo foi o primeiro a avaliar a expressão de diferentes imunoglobulinas de secreção em indivíduos com AIDS, demonstrando que o seu aumento pode representar uma tentativa do sistema imune associado à mucosa em responder a estas infecções.
Nos nossos casos, os indivíduos com infecção faleceram devido a infecções oportunistas, e houve um aumento da IgM em relação às demais imunoglobulinas. A IgM é um importante elo entre as respostas imunes inata e específica, pois apresenta a capacidade de reter e aumentar a imunogenicidade de patógenos precocemente durante a infecção, permitindo uma neutralização rápida, além de possuir uma importante capacidade de aglutinação frente a vários microorganismos, impedindo a disseminação e reduzindo os títulos virais/microbianos no organismo. Além destas funções, a IgM promove a maturação das respostas por IgG e ativa o sistema complemento nas respostas imunes33. Portanto, espera-se que a fase do óbito dos pacientes tenha coincidido com uma fase mais precoce do processo infeccioso, justificando os valores de IgM encontrados.
Nos indivíduos com AIDS e subnutrição, as quantidades de IgA e IgG foram maiores, e houve redução de IgM. Nos subnutridos, existe um déficit de síntese proteica, o que contribui para a redução inclusive do colágeno, como demonstrado anteriormente. Alterações no metabolismo, desequilíbrio hormonal e concentrações elevadas de citocinas estão documentados na fase tardia da infecção30. Dessa forma, o tempo para desenvolvimento da subnutrição pode se relacionar com casos mais arrastados da AIDS, justificando o desequilíbrio na produção de imunoglobulinas, e a maior expressão de IgA e IgG, geralmente aumentados em processos crônicos.
A fibrose se relacionou de forma negativa com IgA e positiva com IgG e IgM. A estrutura do tecido linfoide é importante para a manutenção de sua homeostase e, mais especificamente, a estrutura do tecido linfoide secundário é fundamental na homeostasia do sistema imune como um todo, fornecendo suporte para as suas funções. A deposição de colágeno nesse tecido limita a população celular residente e altera a estrutura folicular21,22. Desta forma, a fibrose altera tanto os constituintes como a arquitetura do FL, com repercussões funcionais, representadas pela redução da secreção de sua principal imunoglobulina, a IgA, independente do quadro de AIDS.
CONCLUSÃOPortanto, este estudo contribui para o melhor conhecimento da variação dos constituintes dos FL das PV nos indivíduos autopsiados com AIDS, bem como da influência de modificações arquiteturais, e da associação de outras entidades, como infecções respiratórias e a subnutrição, sobre a função destes FL, principalmente nos casos graves de AIDS que culminaram com o óbito. Este trabalho fornece informações para o melhor conhecimento dos mecanismos de atuação do vírus no organismo em áreas específicas como o trato respiratório superior, demonstrando como suas estruturas podem reagir frente ao vírus, às complicações secundárias e doenças oportunistas associadas à AIDS.
REFERÊNCIAS BIBLIOGRÁFICAS1. Brito AM, Castilho EA, Szwarcwald CL. AIDS e infecção pelo HIV no Brasil: uma epidemia multifacetada. Rev Soc Bras Med Trop. 2000;34(2):207-71.
2. Lacerda MJF. Estudo do antígeno p24 em biópsias ganglionares de doentes infectados pelos vírus da imunodeficiência humana HIV-1 e HIV-2. Revista da FML. 1999;4:81-6.
3. Navarrete ML, Ruiz JG, Pollan C, Céspedes R, Calderon R, Garcia M. Câmbios morfológicos em el tejido adenoamigdalar como manifestación inicial de HIV em pacientes asintomáticos. Acta Otorrinolaringol Esp. 2001;52:336-40.
4. Vassena L, Proschan M, Fauci AS, Lusso P. Interleukin 7 reduces the levels of spontaneous apoptosis in CD4+ and CD8+ T cells from HIV-1 infected individuals. Proc Natl Acad Sci. 2007;104(7):2355-60.
5. Olegário JGP, Rossi RC, Salge AKM, Correa RRM, Teixeira VPA, Castro ECC. Avaliação imunológica nas pregas vestibulares de pacientes com a Síndrome da Imunodeficiência Adquirida. Braz J Otorhinolaryngol. 2008;74(3):363-8.
6. Kutta H, Steven P, Tillman BN, Kohla G, Paulsen FP. The human false vocal folds - an analysis of antimicrobial defense mechanisms. Anat Embryol. 2002;205:315-23.
7. Kutta H, Steven P, Tillman BN, Tsokos M, Paulsen FP. Region-specific Imunological response of the different laryngeal compartments: Significance of larynx associated lymphoid Tissue. Cell Tissue Res. 2003;311:365-71.
8. Shacklett BL, Cox CA, Sandberg JK, Stollman NH, Jacobson MA, Nixon DF. Trafficking of human Immunodeficiency Virus 1-Specific CD8+ T cells to gut-associated lymphoid tissue during chronic infection. J Virol. 2003;77(10):5621-31.
9. Rossi e Silva RC, Olegário JGP, Corrêa RRM, Salge AKM, Peres LC, Reis MA, et al. Morphological characterization of the false vocal cords as larynx-associated lymphoid tissue. Pathol Res Pract. 2009;205(1):21-5.
10. Mestecky J. The Common mucosal immune system and current strategies for induction of immune responses in external secretions. J Clin Immunol. 1987;7(4):265-76.
11. Mcghe JR, Mestecky J. In defense of mucosal surfaces. Development of novel vaccines for IgA responses protective at the portals of entry of microbial pathogens. Infect Dis Clin North Am. 1990;4(2):315- 41.
12. McGhee JR, Mestecky J, Dertzbaugh MT, Eldridge JH. The mucosal immune system: from fundamental concepts to vaccine development. Vaccine.1992;10(2):75-88.
13. Mestecky J, McGhee JR. Prospects for human mucosal vaccines. Adv Exp Med Biol. 1992;327:13-23.
14. Muller F, Froland SS, Hvatum M, Radl J, Brandtzaeg P. Both IgA subclasses are reduced in parotid saliva from patients with AIDS. Clin Exp Immunol. 1991;83:203-9.
15. Sweet SP, Rahman D, Challacombe SJ. IgA subclasses in HIV disease: dichotomy between raised levels in serum and decreased secretion rates in saliva. Immunology. 1995;86:556-9.
16. De Milito A, Nilsson A, Titanji K, Thorstensson R, Reizenstein E, Narita M, et al. Mechanisms of hypergammaglobulinemia and impaired antigen-specific humoral immunity in HIV-1 infection. Blood. 2004;103:2180-6.
17. Wolff AJ, O'Donnell AE. Pulmonary manifestations of HIV infection in the era of Highly Active Antiretroviral Therapy. Chest. 2001;120(6):1888-93.
18. Wolff AJ, O'Donnell AE. HIV related pulmonary infections: a review of the recent literature. Curr Opin Pulm Med. 2003;9(3):210-4.
19. Franquet T. Respiratory infection in the AIDS and immunocompromised patient. Eur Radiol. 2004;14(E):21-33.
20. Boytron RJ. Infections lung complications in patients with HIV/ AIDS. Curr Opin Pulm Med. 2005;11(3):203-7.
21. Schacker TW, Nguyen PL, Beilman GJ, Wolinsky S, Larson M, Reilly C, et al. Collagen deposition in HIV-1 infected lymphatic tissues and T cell homeostasis. J Clin Invest. 2002;110:1133-9.
22. Schacker TW, Reilly C, Beilman GJ, Taylor J, Skarda D, Krason D, et al. Amount of lymphatic tissue fibrosis in HIV infection predicts magnitude of HAART-associated change in peripheral CD4 cell count. AIDS. 2005;19(18):2169-71.
23. Schacker TW, Brenchley JM, Beilman GJ, Reilly C, Pambuccian SE, Taylor J, et al. Lymphatic tissue fibrosis is associated with reduced numbers of naïve CD4+ T cells in human immunodeficiency virus type 1 infection. Clin Vaccine Immunol. 2006;13(5):556-60.
24. Estes JD, Wietgrefe S, Shacker T, Southern P, Beilman G, Reilly C, et al. Simian immunodeficiency virus-induced lymphatic tissue fibrosis is mediated by transforming growth factor β1-positive regulatory T cells and begins in early infection. JID. 2007;195:551-61.
25. Heymsfield SB, Tghe A, Wandg Z. Nutritional assessment by anthropometric and biomedical methods. In: Shils ME, Olson JA, Shike M, eds- Modern nutrition in Health and Disease. 8 ed Phila-delphia: Lea & Febiger; 1994.p. 812-41.
26. Vannucchi H. Avaliação dos níveis séricos de vitaminas A, E, C e B2, de carotenoides e zinco em idosos hospitalizados. Rev Saúde Pública. 1994;28:121-6.
27. Savi MA, Souza TRA. Dinâmica da interação entre o sistema imunológico e o vírus HIV. Rev Mil Cien Tecn. 1999,66:15-26.
28. Gasparis AP, Tassiopoulos AK. Nutritional support in the patient with HIV infection. Nutrition. 2001;17(11-12):981-2.
29. Centeville M, Morcillo AM, Barros Filho AA, Silva MT, Toro AA, Vilela MM. Lack of association between nutritional status and change in clinical category among HIV-infected children in Brazil. Sao Paulo Med J. 2005;123(2):62-6.
30. Faintuch J, Soeters PB, Osmo HG. Nutritional and metabolic abnormalities in pre-AIDS HIV infection. Nutrition.2006;22(6):683-90.
31. Baker CAR, Clark R, Ventura F, Jones NG, Guzman D, Bangsberg DR, et al. Peripheral CD4 loss of regulatory T cells is associated with persistent viraemia in chronic HIV infection. Clin Exp Immunol. 2007;147:533-9.
32. Cartry O, Moja P, Quesnel A, Pozzetto B, Lucht FR, Genin C. Quantification of IgA and IgG and specificities of antiboies to viral proteins in parotid saliva at different stages of HIV-1 infection. Clin Exp Immunol. 1997;109:47-53.
33. Couper KN, Roberts CW, Brombacher F, Alexander J, Johnson LL. Toxoplasma gondii-specific immunoglobulin M limits parasite dissemination by preventing host cell invasion. Infect Immun. 2005;73(12):8060-8.
1. Mestre, Aluna pós-graduação em nível de doutorado da Universidade Federal do Triângulo Mineiro - UFTM.
2. Doutora, Professora da Universidade do Oeste Paulista - UNOESTE.
3. Doutor, Professor Titular da Disciplina de Patologia Geral da Universidade Federal do Triângulo Mineiro - UFTM.
4. Doutora, Professora da Universidade Federal do Triângulo Mineiro - UFTM.
5. Doutora, Professora Adjunto da Disciplina de Patologia Geral da Universidade Federal do Triângulo Mineiro - UFTM.
Disciplina de Patologia Geral, Universidade Federal do Triangulo Mineiro, Uberaba, Minas Gerais, Brasil.
Endereço para correspondência:
Rosana Rosa Miranda Corrêa
Universidade Federal do Triângulo Mineiro/Disciplina de Patologia Geral
Rua Frei Paulino 30 Bairro Abadia
38025-180 Uberaba MG
Fax: (0xx34) 3318-5462
E-mail: rosana@patge.uftm.edu.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 29 de julho de 2010. cod. 7231
Artigo aceito em 5 de outubro de 2010.
Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG), Fundação de Ensino e Pesquisa de Uberaba (FUNEPU).


