INTRODUÇÃOO câncer oral representa um problema de saúde pública no Brasil. O INCA1 (Instituto Nacional do Câncer) estimava, para 2010, 10.330 novos casos em homens e 3.790 novos casos em mulheres, por 100.000 habitantes. Sua incidência é maior em indivíduos do sexo masculino, da raça branca, na faixa etária acima dos 40 anos e que têm o hábito de fumar e/ou ingerir bebidas alcoólicas. Clinicamente, o Carcinoma Epidermóide Oral (CEO) é precedido por lesões pré-malignas denominadas de Leucoplasia Oral 2,3. Estas lesões pré-malignas podem apresentar diversidade de características histológicas como: hiperceratose, acantose, atrofia do epitélio, diferentes graus de displasia e infiltrado inflamatório crônico no tecido conjuntivo subjacente3. A displasia epitelial é caracterizada por modificações dos processos de renovação e maturação epitelial, resultando em alterações arquiteturais e citológicas3,4.
O tratamento para esse tipo de enfermidade é muito variável e está intimamente relacionado ao estágio da doença e à origem do tumor, podendo compreender a excisão cirúrgica e a radioterapia, combinado ou não à quimioterapia, como tratamento complementar. Em caso de metástase nodal, realiza-se o esvaziamento cervical 5.
Atualmente, inúmeras pesquisas vêm sendo desenvolvidas no sentido de propor novas modalidades terapêuticas, como, por exemplo, a utilização de fitoterápicos no tratamento de neoplasias. Khalil5 revelou resultados animadores no tratamento de células cancerígenas humanas
in vitro e com animais, utilizando compostos químicos semelhantes aos encontrados na própolis, Orsolic
et al.6 demonstraram também que diversos componentes hidrossolúveis da própolis como o ácido caféico, o éster feniletil do ácido caféico e a quercentina, poderiam ser extremamente úteis no controle do crescimento tumoral em modelos experimentais. Luo et al.7 demonstraram, em estudo com um dos compostos isolados da própolis brasileira, o ácido PM-3 (3-[2-dimetil-8-(3-metil-2-butenil) benzopirano]-6-propenóico), que marcadamente inibiu o crescimento de células MCF-7 de câncer de mama humano. Esta avaliação foi associada com a inibição de células no ciclo celular e indução de apoptose.
Neste estudo utilizou-se o carcinógeno químico denominado 9,10-dimetil-1,2-benzatraceno (DMBA), o qual se comporta experimentalmente como um agente iniciador e promotor da carcinogênese, com o objetivo de avaliar a ação antitumoral de diferentes doses do extrato hidroalcoólico de própolis verde, nos estágios iniciais de desenvolvimento do câncer bucal, por meio da análise histomorfológica das lesões orais DMBA-induzidas. Pretendeu-se, ainda, comparar a aplicabilidade de dois sistemas de gradação histológica de displasias epiteliais orais (OMS e Sistema Binário) para estudos experimentais de quimioprevenção de carcinogênese.
MATERIAL E MÉTODO
Aspectos ÉticosPara o desenvolvimento deste projeto, foram aplicados os princípios éticos da experimentação animal, de acordo com o COBEA (Colégio Brasileiro de Experimentação Animal), sendo assim necessária a aprovação do Comitê de Ética da instituição, cujo número do protocolo de aprovação foi 191208. O estudo foi realizado no Biotério e no Laboratório de Morfologia da instituição.
Coleta da própolisForam realizadas coletas de própolis nos apiários, em caixas do tipo Langstrot previamente marcadas. O material coletado foi etiquetado e acondicionado em vasilhames estéreis, sob refrigeração e encaminhados ao Laboratório. Durante as coletas nos apiários, foram feitos os registros referentes à localização, condições do enxame, floradas, condições climáticas durante a coleta e demais observações pertinentes que possam interferir na característica da própolis coletada.
Obtenção do extrato de própolisA extração foi realizada conforme a metodologia aplicada por Park et al.8. Foi usado 1g da amostra de própolis, passando por um processo de trituração e homogeneização e em seguida foram adicionados 100 mL de solução hidroalcoólica 70%. A extração foi feita em temperatura ambiente durante 24h sob agitação. Após a extração, a amostra foi filtrada e o solvente rotaevaporado. O pó obtido foi armazenado em tubo de ensaio estéril com rosca e mantido sob refrigeração. O rendimento da extração foi calculado em relação à massa inicial de própolis utilizada e expressa em porcentagem.
Determinação do índice de flavonóidesA concentração de flavonóides totais foi determinada por meio do método descrito por Adelmann9. Para determinar o teor de flavonóides totais nas amostras, foram adicionados volumes de 15 a 1000 µL dos extratos (concentrações de 5 a 100 mg/mL) a uma solução de 0,1 mL de nitrato de alumínio 10 % e 0,1 mL de acetato de potássio 1 mol/litro. O volume final foi completado para 5 mL com etanol a 80%. As amostras foram homogeneizadas e após 40 minutos, em temperatura ambiente, a absorvância foi determinada espectrofotometricamente no comprimento de onda 415 nm. Para elaboração da curva de concentração padrão foi utilizada a quercetina nas concentrações de 5 a 50 µg/mL dissolvida em etanol e os valores de flavonóides totais foram expressos como equivalentes de quercetina (mg de quercetina em 100 mg de sólidos totais).
Ensaio BiológicoForam utilizados 42 ratos (
Rattus novergicus albinus, linhagem
Wistar), machos adultos, com massa corporal aproximadamente 350±50g, provenientes do Biotério da instituição, distribuídos em sete grupos experimentais sendo determinados aleatoriamente. A escolha do animal baseou-se na peculiaridade de oferecerem boas condições de manipulação, acompanhamento e avaliação (Quadro 1).
Os animais foram mantidos em gaiolas com cama de maravalha, trocadas diariamente, mantidos à temperatura controlada de 22ºC, em regime de luz com ciclo claro-escuro de 12h e recebendo água
ad libitum e dieta padrão Labina
® (Purina, São Paulo, Brasil). Após atingir o peso supracitado, os animais foram submetidos aos procedimentos de indução de carcinogênese química experimental no Biotério da instituição.
Procedimento de indução de carcinogênese químicaA carcinogênese foi induzida no terço médio do dorso da língua de ratos nos grupos TUM1, TUM2, PROP1, PROP2 e PROP3, pela aplicação tópica de 9,10 dimetil 1,2-benzantraceno (DMBA, Sigma-Aldrich, St. Louis, USA). Para tanto, 1 g do carcinógeno foi diluído em 200 mL de acetona (P.A.), para obtenção de uma solução a 0,5%. Para procedimento de indução, um pincel de pêlo, Marta (nº 0), foi mergulhado na solução, e depois de removido o excesso, realizou-se o pincelamento do material no dorso lingual dos animais. O pincelamento era realizado duas vezes para cada procedimento de indução, com o animal imobilizado, sem sedação. A aplicação do carcinógeno foi efetuada em dias alternados, por um período de 20 semanas10. Nos animais dos grupos CTR1 e CTR2 procedeu-se o pincelamento de água destilada, sob as mesmas condições técnicas utilizadas nos demais grupos.
Procedimentos de gavagemPara administração do extrato de própolis verde, o extrato seco foi ressuspendido em Tween 80 a 2%, na concentração de 10 mg/mL. Os animais dos grupos PROP1, PROP2 e PROP3 foram tratados com administração oral (gavagem) de extrato hidroalcoólico de própolis verde, nas doses de 100; 200 e 300 mg/Kg, respectivamente. Os animais dos grupos CTR1 e CTR2 receberam água destilada, e dos grupos TUM1 e TUM2 3mL de tween 80 a 2% (grupos controle negativo - CTR1 e CTR2 não receberam DMBA; e positivo - TUM1 e TUM2 receberam DMBA). A administração oral destas substâncias foi realizada em dias alternados (diferindo dos dias de aplicação do DMBA). Antes da indução da carcinogênese, foi feita uma semana de gavagem com as mesmas dosagens, estendendo-se por 20 semanas, a fim de verificar possíveis reações adversas ao produto natural utilizado, conforme preconizado por Kavitha & Manoharan (2006)
10.
Procedimento de análise histomorfológica dos espécimesDecorridas as 20 semanas, os animais foram eutanasiados em câmara de CO
2, para que a área pincelada fosse submetida à remoção
post-mortem. Os espécimes teciduais foram fixados em formol tamponado (10%, pH 7,4) por 24 h, desidratados em soluções crescentes de álcool etílico e diafanizados em xilol, para posterior inclusão em parafina. Foram obtidas secções histológicas de 5µm de espessura, e estas submetidas à coloração de rotina pela Hematoxilina/Eosina, sendo os espécimes examinados ao microscópio de luz (Microscópio Óptico Olympus CX31) por três observadores previamente calibrados.
As lesões foram classificadas conforme os sistemas de gradação histológica propostos pela Organização Mundial da Saúde (OMS)4, e pelo método proposto por Kujan et al.11, denominado de Sistema Binário. Foram avaliadas as seguintes alterações arquiteturais e citológicas:
1) Arquiteturais: estratificação epitelial irregular; perda da polaridade das células da camada basal; projeções epiteliais em forma de gota; aumento do número de figuras de mitose; presença de figuras de mitose anormais na metade superior do epitélio (mitoses altas); queratinização prematura em células isoladas e pérolas de queratina em projeções epiteliais;
2) Citológicas: variação anormal de tamanho do núcleo; pleomorfismo nuclear; variação anormal de tamanho da célula; pleomorfismo celular; proporção núcleo/citoplasma aumentada; aumento no tamanho do núcleo; figuras de mitoses anormais; número e tamanho de nucléolos aumentados; hipercromatismo nuclear. De acordo com a OMS 4, as alterações foram classificadas em: displasia leve, quando as alterações supracitadas restringem-se ao terço inferior do epitélio (camadas basais e parabasais); displasia moderada, quando tais alterações atingem o terço médio do epitélio (porção média da camada espinhosa), e displasia grave, quando as alterações arquiteturais e citológicas ultrapassam o terço médio do epitélio. Conforme o Sistema Binário11, as alterações epiteliais categorizadas em: 1) lesões de alto risco: presença de 4 ou mais alterações arquiteturais e/ou 5 ou mais alterações citológicas, e 2) lesões de baixo risco: presença de menos de 4 alterações arquiteturais e menos de 5 alterações citológicas.
Os valores médios dos escores finais foram comparados entre os grupos por meio de análise de variância (ANOVA), seguido pelo teste
post-hoc de Tukey. As diferenças entre as médias foram consideradas significativas quando o valor de
p fosse menor que 0,05.
RESULTADOSO rendimento do extrato seco da própolis verde foi de 41,43%. Além disso, a amostra utilizada da própolis verde apresentou um teor de flavonóides equivalente a 0,95 ± 0,44 %. Os dados referentes à análise histopatológica do revestimento epitelial lingual dos animais está sintetizada na Tabela 1.
Os grupos CTR1 (Figura 1a) e CTR2 (Figura 1b) exibiram os mais baixos números de alterações morfoarquiteturais (1.5±0.22 e 1.75±1.50, respectivamente) que, quando presentes, estavam representadas por áreas focais de duplicação da camada basal e discreto estrangulamento e hiperplasia de papilas epiteliais. Não foi evidenciada atipia citológica. As alterações epiteliais foram classificadas como de baixo risco pelo Sistema Binário11 e como modificações morfológicas não displásicas de acordo com os critérios preconizados pela OMS4.
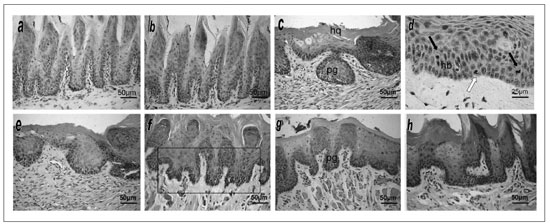
Figura 1. Secções histológicas coradas em HE do epitélio de revestimento da mucosa da borda de língua dos animais experimentais.(a) e (b) Grupos controles negativos (CTR1 e CTR2) exibindo epitélio com características de normalidade. (c) Grupo TUM1 exibindo epitélio hiperqueratinizado (HQ) com características displásicas, destacando-se as papilas estranguladas em forma de gota (pg). (d) Grupo TUM1 apresentando moderado pleomorfismo celular e núcleos celulares hipercromáticos, hiperplasia basilar patente (hp) e figuras mitóticas basais (seta clara) e suprabasais (setas escuras). (e) Grupo TUM2 mostrando epitélio com alterações displásicas se estendendo até o terço médio, semelhantes àquelas vistas em TUM1. (f) Grupo PROP1 exibindo hipercromatismo nuclear de células epiteliais, com destaque para as papilas irregulares em gota (quadro). (g) Grupo PROP2 apresentando escassas e focais características de atipia, expressas por discretas papilas em gota (pg) e leve hipercromatismo nuclear. (h) Grupo PROP3 mostrando apenas leve desarranjo na arquitetura das papilas epiteliais e núcleos celulares discretamente hipercromáticos.
Os grupos TUM1 (Figura 1c/d) e TUM2 (Figura 1e) exibiram os mais altos escores de alterações morfoarquiteturais (4,83±0,40 e 4,50±1,51, respectivamente) e citológicas (2.33±1.36 e 3.16±2.13, respectivamente). As alterações morfo-arquiteturais estavam representadas por hiperplasia basilar, projeções papilares estranguladas (em forma de gota), aumento do número de figuras mitóticas (duas ou mais em cada campo histológico em magnificação de 200x), algumas delas em estratos epiteliais altos, e disceratose. Já as citológicas consistiram de núcleos celulares exibindo hipercromatismo e discreto a moderado pleomorfismo, além de ocasional aumento da relação núcleo/citoplasma. Tais alterações citomorfológicas, apesar de se distribuírem ao longo do revestimento epitelial, se limitavam aos estratos basal, parabasal e espinhoso médio. As alterações epiteliais foram classificadas como de alto risco de acordo com o Sistema Binário e como displasias moderadas conforme preconizado pela OMS4.
O grupo PROP1 (Figura 1f) exibiu elevado número médio de alterações morfo-arquiteturais (4.0±1.22), mas baixo número de citológicas (0.80±0.30). As alterações morfo-arquiteturais observadas foram similares àquelas evidenciadas em TUM1 e TUM2, embora limitadas ao terço inferior do tecido epitelial (basal/parabasal), enquanto que as citológicas foram representadas apenas por discreto hipercromatismo de células basais e parabasais. As alterações epiteliais foram classificadas como de alto risco de acordo com o Sistema Binário11 e como displasias leves conforme preconizado pela OMS4.
Os grupos PROP2 (Figura 1g) e PROP3 (Figura 1h) exibiram comportamentos semelhantes, apresentando números baixos de alterações tanto morfo-arquiteturais (2,66 ±1,03 e 2,0 ±0,63, respectivamente) quanto citológicas (0.33±0.51 e 0.50±0.22). Estrangulamento de papilas (projeções em gota), hiperplasia basilar e aumento do número de mitoses foram as alterações morfo-estruturais observadas, enquanto que, quando presentes, as alterações citológicas estavam representadas por discreto aumento no tamanho dos núcleos basais e parabasais. As poucas alterações observadas estavam sempre limitadas ao estrato basal/parabasal, e dispostas apenas em áreas bastante focais. Estas foram, portanto, classificadas como de baixo risco de acordo com o Sistema Binário e como displasias leves conforme preconizado pela OMS4.
Após análise estatística, foi observado que os grupos TUM1, TUM2 e PROP1 exibiram número médio de alterações morfo-arquiteturais estatisticamente semelhantes (
p>0,05), mas todos significativamente maiores que aquele evidenciado em CTR1 e CTR2 (
p<0,01), e em PROP2 e PROP3 (
p<0,05). Além disso, estes últimos grupos também não foram diferentes entre si (
p>0,05). Quanto às alterações citológicas, os grupos TUM1 e TUM2, apesar de semelhantes entre si (
p>0,05), apresentaram valores significativamente mais elevados que os demais (
p<0,01).
DISCUSSÃOPesquisas têm sido realizadas no sentido de testar o efeito quimioterápico de produtos naturais, especialmente nos estágios iniciais de desenvolvimento das neoplasias malignas, utilizando metodologias
in vitro7 e modelos experimentais de indução de carcinogênese química em roedores10.
Neste estudo, para a indução das lesões utilizou-se um carcinógeno químico, denominado 9,10-dimetil-1,2- benzatraceno (DMBA), que vem sendo amplamente utilizado em estudos de indução de carcinogênese química, conforme trabalhos de Lima, Taveira
et al.12; Chen
et al.13; Barros
et al.14 e Wang
et al.15. A escolha da língua como sítio anatômico para o desenvolvimento das lesões, fundamenta-se na elevada incidência do CEO nesta região, bem como no comportamento biológico agressivo deste tipo específico de carcinoma epidermóide, devido à extensa vascularização da língua, em consonância com Neville
et al.3, Bsoul
et al.16 e INCA1.
A utilização da própolis em associação ao DMBA no grupo experimental, justifica-se pelo amplo espectro de propriedades biológicas deste fitoterápico, que possui efeitos antimicrobiano, antimicótico, imunomodulador, cicatrizante, antioxidante e antitumoral, todos atribuídos à presença de flavonóides em sua composição17. Os flavonóides são compostos fenólicos, que contêm um radical hidroxila ligado diretamente a um anel aromático, podendo apresentar ação antibacteriana, pois têm capacidade de inibir a RNA-polimerase bacteriana; ou atuarem como imunomoduladores, antioxidantes e cicatrizantes, devido à capacidade de sequestrar ou inibir a formação de radicais livres9,18. Neste estudo, a amostra utilizada da própolis verde apresentou bom teor de flavonóides (0,95 ± 0,44 %), já que, conforme preconizado pela Legislação de Compostos Flavonóides19, o teor mínimo é de 0,25% (m/m). Além disso, o rendimento do extrato seco (41,43%) foi acima do valor mínimo especificado pelo Ministério da Agricultura19 (11% m/v), sendo, portanto, considerado plenamente satisfatório. No entanto, deve ser ressaltado que outros compostos ativos são encontrados na própolis, como o ácido caféico e seus derivados, pois possuem atividade imunomodulatória e hepatoprotetora18,20.
Neste trabalho observou-se nos grupos de controle negativo, CTR1 e CTR2 a presença de mucosa oral com aspecto de normalidade, com escassas alterações morfoestruturais, expressas por áreas focais de duplicação da camada basal e formação de papilas irregulares. Segundo Neville et al.3 e Regezi et al.21, é comum observar alterações arquiteturais e citológicas em áreas da cavidade oral submetidas a atrito constante, como é o caso do dorso da língua, que constitui área de mucosa mastigatória. Estas seriam, portanto, interpretadas como distúrbios de natureza reacional trauma induzidos, e não devem ser confundidas com alterações de caráter displásico.
Nos grupos controle positivos, TUM1 e TUM2, verificou-se grande quantidade de alterações morfológicas arquiteturais e citológicas, que se estendiam até o terço médio epitelial. Estes achados são favoráveis ao potencial carcinogênico atribuído ao DMBA, conforme os trabalhos de Lima & Taveira et al.12, Chen et al13, Barros et al.14 e Wang et al.15. É importante destacar, que fatores endógenos, como a localização do tumor a ser induzido, a espécie ou linhagem do animal e a condição de saúde do mesmo, bem como fatores exógenos, como tipo de alimentação e condicionamento dos animais, e, sobretudo, a concentração, o veículo de diluição e a forma de administração do DMBA, podem provocar variações no período de tempo necessário para a indução de tumores malignos, através da carcinogênese química.
Nos grupos experimentais, PROP1, PROP2 e PROP3, observaram-se áreas de atipia morfológica limitadas aos terços epiteliais mais inferiores. Esta atipia teve distribuição difusa na mucosa oral do grupo PROP1, embora nos grupos PROP2 e PROP3, tenha sido evidenciada distribuição focal no epitélio de revestimento lingual. Estes dados parecem sugerir que a administração dos extratos hidroalcoólicos da própolis promoveu melhoria no quadro epitelial displásico induzido por carcinogênese química, e que esta atividade quimioprotetora poderia estar relacionada à dose do extrato de própolis utilizado. Tais achados parecem confirmar a propriedade antitumoral deste apicoterápico, estando em conformidade com relatos prévios de Luo et al.7, Orsolic et al.6 e Khalil5.
Segundo Veronez22, um dos principais responsáveis pela atividade antitumoral da própolis é o Éster fenetil do Ácido Caféico (CAPE), que tem demonstrado ação citotóxica sobre células tumorais, além de inibição dos processos oxidativos essenciais para a geração de tumores, supressão da destruição oxidativa de leucócitos polimorfonucleares e inibição da síntese de DNA, RNA e proteínas em células tumorais. É importante destacar que, nos grupos PROP2 e PROP3, não se observaram mitoses atípicas ou mitose em estratos epiteliais parabasais e espinhosos, achados histológicos que corroboram a ação mitodepressora deste apicoterápico22
Com relação aos sistemas de gradação histológica das displasias epiteliais da mucosa oral, chama-se a atenção que no grupo PROP1 houve divergência entre a classificação da OMS4 e o Sistema Binário11, já que algumas das lesões foram classificadas como displasia leve e lesão displásica de alto risco, respectivamente. Adicionalmente, a análise estatística mostrou que, de acordo com a classificação proposta pelo Sistema Binário proposto por Kujan et al.11, não houve diferença significativa entre os grupos controles positivos (TUM1 e TUM2) e o grupo tratado com a menor concentração de própolis (PROP1). Este fato parece sugerir maior confiabilidade para a classificação OMS4, pois considera a ocorrência das alterações arquiteturais e citológicas ao longo de toda a extensão da mucosa oral, enquanto que o Sistema Binário11, por considerar apenas a quantidade de alterações arquiteturais e citológicas presentes durante a análise histopatológica, desprezando o nível de comprometimento da mucosa oral pelas alterações displásicas, parece tender a superestimar a gradação das alterações citomorfológicas. Estes dados também parecem sugerir que quando as alterações morfológicas e estruturais são abundantes, ambos os sistemas de gradação apontam resultados similares; contudo, quando são escassas ou focais, mais uma vez o Sistema Binário11 tende a superestimar a gravidade da atipia citológica observada e conduzir a diagnósticos equivocados. Além disso, é relevante destacar a praticidade da classificação proposta pela OMS4 quando comparada ao Sistema Binário11, que pressupõe uma análise mais detalhada e de utilidade duvidosa em rotinas laboratoriais.
Diante do exposto, os resultados desta pesquisa sugerem uma possível atividade quimiopreventiva e antitumoral da própolis verde. No entanto, estudos posteriores são demandados a fim de elucidar os possíveis mecanismos de ação deste apicoterápico sobre a carcinogênese bucal quimicamente induzida.
CONCLUSÕESNo presente estudo, o DMBA mostrou-se efetivo, na promoção da carcinogênese química, ao induzir alterações displásicas na mucosa oral. Sugere-se, ainda, que a própolis verde desempenha algum papel protetor durante o processo de carcinogênese quimicamente induzida em língua e que esta guardou relação direta com o aumento da sua concentração nos extratos hidroalcoólicos administrados por gavagem. Quanto aos sistemas de gradação histológica das displasias epiteliais da mucosa oral, observou-se que o proposto pela OMS mensurou de forma mais prática e confiável a gravidade das displasias epiteliais, quando comparado ao Sistema Binário.
AGRADECIMENTOSOs autores agradecem a Fundação de Apoio a Pesquisa e Inovação Tecnológica do Estado de Sergipe (FAPITEC) pelo apoio financeiro a esta pesquisa.
REFERÊNCIAS BIBLIOGRÁFICAS1. Inca - Instituto Nacional do Câncer. Estimativa 2009: Incidência do câncer oral no Brasil. Rio de Janeiro.
2. Coletta RD, Graner E, Lopes MA, Vargas PA, Jorge JJR, Almeida OP. Os avanços da biologia molecular e o câncer bucal. Rev APCD. 2002;56:62-6.
3. Neville BW, Damm DD, Allen CM, Bouquot JE. Patologia oral e maxilofacial. Rio de Janeiro: Guanabara Koogan;2008.
4. Barnes L, Evenson JW, Reichart P, Sindransky D. World Health Organization Classification of Tumours. Pathology and genetics of head and neck tumours. IARC Press: Lyon; 2005.
5. Khalil ML. Biological activity of bee propolis in health and disease. Asian Pac J Cancer Prev. 2006;7(1):22-31.
6. Orsolic N, Knezevic AH, Sver L, Terzic S, Basic, I. Imunomodulatory and antimetastatic action of propolis and related polyphenolic compounds. J Ethnopharmacol. 2004;94:307-15.
7. Luo J, Soh JW, Xing WQ, Mao Y, Matsuno T, Weinstein IB. PM-3 a benzo-gamma-pyran derivative isolated from propolis, inhibits grow of MCF-7 human breast cancer cells. Anticancer Res.2001;21(3B):1665-71.
8. Park YK, Ikegakl M, Abreu JAS, Alcici NMF. Estudo da preparação dos extratos de Própolis e suas aplicações. Ciênc Tecnol Aliment. 1998;18:313-8.
9. Adelmann J. Própolis: variabilidade composicional, correlação com a flora e bioatividade antimicrobiana/antioxidante. 2005, 186p, Dissertação (Mestrado em Ciências Farmacêuticas)-Universidade Federal do Paraná, Curitiba, PR.
10. Kavitha K, Manoharan S. Anticarcinogenic and antilipidperoxidative effects of tephrosia purpurea (linn.) Pers. In 7,12-dimethylbenz(a) anthracene (dmba) induced hamsters buccal pouch carcinoma. Indian J Pharmacol. 2006;38(3):185-9.
11. Kujan O, Oliver RJ, Khattab A, Roberts SA, Thakker N, Sloan P. Evaluation of a new binary system of grading oral epithelial dysplasia for prediction of malignant transformation. Oral Oncol. 2006;42(10):987-93.
12. Lima N L, Taveira LAA. Estudo das alterações morfológicas causadas pela indução concomitante de DMBA e bebidas alcoólicas de alto teor na carcinogênese química bucal. Rev FOB. 1999;7:61-6.
13. Chen YK, Hsue SS, Lin LM. Correlation between inducible nitric oxide synthase and p53 expression for DMBA-induced hamster bucal-pouch carcinomas. Oral Dis. 2003;9:227-34.
14. Barros ACSD, Muranaka ENK, Mori LP, Pelizon CHT, Iriya K, Giocondo G, et al. Indução da carcinogênese mamária experimental em ratas com 7,12 - dimetil-benz(a)antraceno. Rev Hosp Clín Fac Med S Paulo. 2004;59(5):257-61.
15. Wang WC, Liang SL, Chen YK, Lin LM. The therapeutic effect of fractionated radiation on DMBA-induced hamster buccal pouch squamous cell carcinomas. Oral Oncol. 2008;44:1160-6.
16. Bsoul SA, Huber AM, Terezhaimy GT. Squamaus Cell Carcinoma of the oral tissues: A comprehensive review for oral healthcare providers. J Contemp Dent Pract. 2005;6:1-18.
17. Daugsh A, Moraes CS, Fort P, Park YK, Brazilian red própolis-chemical composition and botanical origin. ECAM.2007;1-7.
18. Bosio K , Avanzin C, D´Avolio A, Ozino O, Savoia D et al. In vitro activity of própolis against Streptococcus pyogenes. Microbiology. 2000;(31):174-7.
19. Brasil. Ministério da Agricultura, Pecuária e do Abastecimento. Instrução Normativa nº 3, de 19 de janeiro de 2001. Aprova os regulamentos Técnicos de Identidade e Qualidade de Apitoxina, Cera de Abelha, Geléia Real, Geléia Real Liofilizada, Pólen Apícola, Própolis e Extrato de Própolis, conforme consta dos Anexos desta Instrução Normativa. Publicado no Diário Oficial da União de 23/01/2001, Seção 1, Página 18.
20. Castaldo S, Capasso F. Própolis, an old remedy used in modern medicine. Fitoterapia. 2002;73(1):1-6.
21. Regezi JA, Sciuba JJ, Jordan RCK. Patologia bucal: correlações clinicopatológicas. Rio de Janeiro: Guanabara Koogan;2008.
22. Veronez R. 2000. Revisão de literatura: própolis na clínica médica internacional.
1. Mestranda em Saúde e Ambiente da Universidade Tiradentes, Aracaju/SE, Brasil.
2. Graduação Ciências Biológicas Licenciatura pela Universidade Tiradentes, Aracaju/SE, Brasil. Professora.
3. Graduação Ciências Biológicas Licenciatura pela Universidade Tiradentes, Aracaju/SE, Brasil. Professor.
4. Doutora em Patologia Oral/UFRN, Professora Adjunta da Universidade Federal de Sergipe, Aracaju/SE, Brasil.
5. Doutora em Ciências Farmacêuticas/USP. Professora Titular do Programa de Pós-Graduação em Saúde e Ambiente da Universidade Tiradentes, em Aracaju/SE, Brasil.
6. Doutora em Ciência de Alimentos/UNICAMP. Professora Titular do Programa de Pós-Graduação em Saúde e Ambiente da Universidade Tiradentes, em Aracaju/SE, Brasil.
7. Doutor em Patologia Oral/UFRN., Professor Titular do Programa de Pós-Graduação em Saúde e Ambiente da Universidade Tiradentes, em Aracaju/SE, Brasil.
Universidade Tiradentes - UNIT, Aracaju/SE, Brasil.
Endereço para correspondência:
Ricardo Luiz Cavalcanti de Albuquerque Júnior
Programa de Pós-Graduação em Saúde e Ambiente da Universidade Tiradentes - UNIT
Avenida: Murilo Dantas 300 Bairro Farolândia
Aracaju SE 49032-490.
Tel. (0xx79) 3218-2115 - 3218-2190 Ramal 2615
E-mail: ricardo_luiz@unit.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 17 de agosto de 2010. cod. 7271
Artigo aceito em 9 de novembro de 2010.
Fundação de Apoio a Pesquisa e Inovação Tecnológica do Estado de Sergipe (FAPITEC).


